Chinin
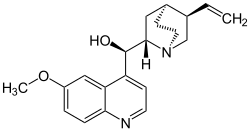
Chinin () ist eine in Chinarinde vorkommende natürliche chemische Verbindung aus der Gruppe der Chinolin-Alkaloide. Es ist ein weißes, sehr schwer wasserlösliches, kristallines Pulver mit bitterem Geschmack, das als Bitter- und Arzneistoff eingesetzt wird. Ein Diastereomer von Chinin ist Chinidin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Chinin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C20H24N2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser kristalliner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Muskelrelaxans, Malariamittel | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 324,42 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
| |||||||||||||||||||||
| Löslichkeit |
sehr schwer löslich in Wasser (0,5 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Chinin kommt in der Rinde des Chinarindenbaums (Familie Rubiaceae, Subfamilie Cinchonoideae), häufig im Roten Chinarindenbaum Cinchona pubescens aber auch Cinchona officinalis und Cinchona spp vor[10] und kann daraus gewonnen werden.

Der Ursprungsort ist der Hochwald (1500–2700 m ü. M.) der Anden (Venezuela bis Bolivien). Der Name der Pflanze stammt von den Ureinwohnern (Quechua quina-quina ‚Rinde der Rinden‘), die bereits von den fiebersenkenden Eigenschaften wussten.
Den lateinischen Namen Cinchona, nach dem später das Chinin benannt wurde, erhielt die Pflanze vermutlich nach der Gräfin von Chinchón, Gattin des Vizekönigs Luis Jerónimo de Cabrera der spanischen Kolonien, die 1638 angeblich durch den Arzt de Vega mit einem Sud aus Rindenpulver von der Malaria geheilt werden konnte.[12] Jesuiten sorgten für die Verbreitung des Mittels in Europa, daher die Namen Jesuitenrinde und Kardinalspulver.
Chinin wird in Mengen von ca. 300 bis 500 Tonnen pro Jahr durch Rindenextraktion von kultivierten Pflanzen hauptsächlich in Indonesien, Malaysia und der Demokratischen Republik Kongo gewonnen;[3] manche Arten enthalten 11 bis 15 Prozent Chinin in der Rinde.
Geschichte
Um 1630 verwendeten südamerikanische Indianer Pflanzen der Cinchona-Gattung aus dem Bereich der Anden innerhalb Kolumbiens und Boliviens erstmals gegen Kälte-Zittern. Außerdem wendeten sie es erfolgreich gegen durch Malariafieber bedingtes Zittern an.
Die Legende besagt, dass es im 17. Jahrhundert dem Leibarzt des damaligen spanischen Vizekönigs von Peru gelang, dessen an Malaria erkrankte Frau, Condesa de Chinchon (1599–1640), zu heilen. Dadurch soll der Chinarindenbaum zu seinem Namen gekommen sein. Wenige Jahre später brachte der Jesuit Barnabas Cobo (1582–1657) die Chinarinde nach Madrid. Dort erreichte sie den jesuitischen Kardinal Juan de Lugo (1583–1660), der das Chinarindenpulver in Rom einführte. Er gilt als der eigentliche Propagandist der Chinarinde. Aus diesem Grund waren die Jesuiten allein zuständig für den Vertrieb. Dadurch kam es zu einem religiös geprägten Streit, denn viele Ärzte protestierten gegen die Monopolstellung der Jesuiten beim Handel der Chinarinde.[13]
Die Wirkung der Chinarinde war umstritten. Es gab Zweifler wie zum Beispiel den französischen Arzt Jean-Jacques Chifflet oder den Pariser Dekan Guy Patin.[13] Krankengeschichten von zwei berühmten Patienten der Frühzeit bestätigen die Kontroversen zur Wirkung des Chinins:
- Zum einen starb der Vizekönig der Niederlande Ferdinand von Habsburg 1641 an Tertianfieber (Malaria). Dadurch kam es zu Streitereien, nachdem 1645 die Chinarinde in den Niederlanden eingeführt wurde.
- Zum anderen erhielt der Erzherzog Leopold Wilhelm von Österreich, der 1652 ebenfalls an dem Fieber erkrankte, von seinem Leibarzt Chifflet Auszüge aus der Chinarinde und erholte sich darauf. Chifflet verfasste nach der Genesung des Erzherzogs ein Buch über die Wirkung von Chinin (Jean-Jacques Chifflet: Pulvis febrifugus orbis Americani Iussu Serenissimi Principis Leopoldi Guilielmi, Archiducis Austriae, Belgii ac Burgundiae proregis, ventilatus ratione, experienta, auctoritate, a Ioanne Iacobo Chifletio... MDCIII). Leopold Wilhelm starb erst 1662 in Wien, nicht am Fieber.[14]
Obwohl sich die protestantischen Länder nicht von der Wirkung der Chinarinde überzeugen ließen, braute der englische Arzt Robert Talbor einen Chinarindenwein und verkaufte diesen 1679 teuer an Ludwig XIV. 1663 hatte sich das Arzneimittel in Deutschland durchgesetzt, obgleich Georg Ernst Stahl die Verwendung der Chinarinde ablehnte. Erst 1709 untersuchte Francesco Torti verstärkt die Wirkung der Chinarinde gegen Malaria und konnte diese belegen. Im späten 18. Jahrhundert manifestierte sich die Chinarinde als Therapeutikum gegen Malaria. Ein Faktor hierfür war insbesondere die Kolonisation Indiens, Amerikas und Südostasiens. Das Problem zu dieser Zeit allerdings war, dass die Rinde weiterhin aus Südamerika importiert werden musste, was zum einen sehr teuer und zum anderen sehr umständlich war. Außerdem lösten sich die Andenrepubliken allmählich von der spanischen Herrschaft. Dies hatte zur Folge, dass man neue Anbaugebiete erschließen musste.[13][15]
Anfang des 19. Jahrhunderts fand man kurz nach der Entdeckung des Morphins das Chinin als wirksamkeitsbestimmenden Inhaltsstoff der Chinarinde und machte daraus einen Eckpfeiler der entstehenden Pflanzenchemie.[15] Es wurde bereits im Jahre 1792 von Antoine François de Fourcroy in unreinem Zustand hergestellt[16] und 1820 von Pierre Joseph Pelletier und Joseph Bienaimé Caventou durch Extraktion mit Alkohol aus der Chinarinde isoliert.[17][18] Der Extrakt wurde mit Kalilauge verdünnt, worauf ein gelblicher amorpher, sehr bitter schmeckender Niederschlag entstand.[19] Pelletier und Caventou nannten die getrocknete Substanz Chinin. 1823 wurde es vom Apotheker Friedrich Koch in Oppenheim erstmals im industriellen Maßstab aus der Rinde von Cinchona-Arten gewonnen. Das Chinin stimulierte anschließend die pflanzenchemische Forschung. Ab Mitte des 19. Jahrhunderts versuchte man, das teure Chinin durch billigere und/oder wirksamere Derivate zu ersetzen. Dadurch erhielt man 1856 das giftige Abbauprodukt Chinolin, das man wiederum zur Erforschung weiterer Fiebermittel verwendete. Über Kairin 1882, Antipyrin 1883 und weitere Substanzen gelangte man 1896 zum Pyramidon, einem der ersten weltweit erfolgreichen Präparate der pharmazeutischen Industrie, lange bevor man die Konstitution von Chinin kannte, die 1911 von Pictet aufgeklärt wurde.[15][20]
1944 wurde Chinin von Robert B. Woodward formal totalsynthetisiert,[21][22] die tatsächliche Totalsynthese gelang Milan R. Uskokovic erst 1970.[23][24]
Der Franzose François Magendie analysierte um 1840 erstmals die physiologische Wirkung von Chinin.
Mit Chinin wurden 1916 zum ersten Mal experimentell ausgelöste neuromuskuläre Krämpfe gehemmt. Anhand weiterer Forschungsergebnisse um 1930 kristallisierten sich zwei Haupteffekte des Chinins heraus: eine neurotrope (nervenbezogene) und eine myotrope (muskelbezogene) Wirkung.[25][26][27]
Größere wirtschaftskriminelle Ausmaße erreichte im 20. Jahrhundert das Chininkartell.
Der Weg zur Totalsynthese
Chinin war ein sehr wichtiger Wirkstoff. Daher war die Aufklärung seiner Struktur und später die Totalsynthese ein interessantes Forschungsprojekt, das mit großer Anerkennung verbunden war. Vor allem im Zweiten Weltkrieg wurde die Forschung an der Synthese stark vorangetrieben, da viele Seewege blockiert wurden, sodass nicht genug Lieferungen mit dem Medikament die Truppen der Alliierten erreichen konnten.
Als 1944 Woodward und Doering die Totalsynthese gelang, wurden sie deshalb auch in der Bevölkerung gefeiert[28]. Obwohl die Synthese nie Anwendung fand, trug sie maßgeblich zur Weiterentwicklung der Naturstoff-Synthese bei. Woodward erkannte den Nutzen der Spektroskopie als Mittel zur Aufklärung von Strukturen an Stelle von chemischen Reaktionen. Dieser deutlich elegantere Weg war die Grundlage für die Synthesen von beispielsweise Cholesterin, Chlorophyll oder Vitamin B12. 1965 erhielt Woodward für seine Arbeiten an den Synthesen von Naturstoffen den Nobelpreis in Chemie[29].
Strukturaufklärung
Schon die Strukturaufklärung war ein langer Prozess. Es dauerte 147 Jahre, bis nach der ersten Isolierung die Struktur komplett geklärt werden konnte. Dabei wurde die Summenformel, die Konstitution sowie relative und absolute Konfiguration untersucht. Die große Herausforderung bestand darin, das richtige der 16 Stereoisomeren des Chinins zu identifizieren.
Den Anfang machte 1879 Kraupt, der die Summenformel (C20H24N2O2) herausfand. 1907 bestimmte Rabe die Konstitution des Chinin-Moleküls. Auf Basis der Verknüpfung der Moleküle (ohne räumliche Orientierung) bestimmten 1950 Prelog und Häflinger die relative Konfiguration. Dies gelang ihnen durch chemische Abbaureaktionen. Dadurch bestimmten sie schrittweise jede Konfiguration an den stereogenen Zentren. Die absolute Konfiguration (es handelt sich um ein (−)-Isomer) konnte schließlich von Carter 1967 festgelegt werden.[29]
Totalsynthese
Nachdem die Struktur des Chinins geklärt war, begann die Forschung an der Totalsynthese von Chinin. Bis diese erstmals 1944 Robert B. Woodward und William von Eggers Doering gelang, vergingen fast 100 Jahre. Woodward und Doering brauchten 14 Monate, bis ihnen die Synthese gelang.
Bei den Syntheseversuchen entstand unter anderem der Phenazinium-Farbstoff Mauvein (von William Perkin, der ausgehend von der Summenformel N-Allyltoluidin zu Chinin oxidieren wollte), der am Anfang der Teerfarben-Synthese steht, welche als die Wurzel der chemischen Industrie gilt.[29]
Die Totalsynthese, die Woodward 1944 präsentierte, bestand aus der Synthese von 7-Hydroxyisochinolin zu racemischem Chinotoxin und der Synthese von Rabe und Kindler, die bereits 1918 Chinin aus (+)-Chinotoxin gewonnen hatten.[28]
Den Beginn der Totalsynthese machte Louis Pasteur bereits 1853, indem er Chinin durch Erwärmen in verdünnter Säure in das isomere Chinotoxin umlagerte, und das, obwohl damals noch nichts über den Aufbau des Moleküls bekannt war. Darauf aufbauend gelang es Kindler und Rabe 65 Jahre später, 1918, Chinotoxin in einer dreistufigen Synthese in Chinin zurückzuwandeln. 1943 gelang M. Proštenik und V. Prelog die Synthese von Chinotoxin. Dafür bauten sie Cinchonin zu (+)-Homomerochinen ab. Dieses setzten sie mit Chininsäure zu (+)-Chinotoxin um.
Die Synthese des Homomerochinens gelang schließlich Woodward und Doering 1944. Dieses stellten sie racemisch aus 7-Hydroxyisochinolin her. Das Racemat setzten sie auf dem Weg von Proštenik und Prelog zu racemischem Chinotoxin um. Mithilfe von einem D-Weinsäurederivat trennten sie die beiden Enantiomere. Den letzten Schritt, die Synthese von (+)-Chinotoxin zu Chinin, führten sie nicht mehr durch, sondern beriefen sich auf die Arbeiten von Kindler und Rabe.[28]
Dies führte im Nachhinein zu einigen Diskussionen. So argumentierte Gilber Stork über 50 Jahre später, dass Woodward und Doering die Arbeit von Kindler und Rabe überprüfen hätten müssen und es sich somit nicht um die erste Totalsynthese handeln könne. Gilbert Stork war auch derjenige, dem die erste stereokontrollierte Synthese von Chinin gelang, nachdem sie zuvor bereits immer weiter verfeinert wurde. Er schaffte es, in knapp 20 eleganten Reaktionsschritten die Konfiguration des chiralen Bausteins zu erhalten, weshalb nur stereoselektive Reaktionen angewandt werden konnten.[28]
Extraktionsverfahren
Heute können mit einem industriellen Verfahren aus einer Tonne Rinde 30–40 kg Chinin gewonnen werden. Davon werden ca. 75 % in die Pharmaindustrie, 20 % in die Getränkeindustrie und der Rest an die chemische Industrie verkauft.[29]
Das erste industrielle Verfahren zur Gewinnung von Chinin aus Chinarinde wurde 1823 von Friedrich Koch vorgestellt. Dieses wurde stetig weiterentwickelt, bis zum heutigen Extraktionsverfahren. Dieses wird am Beispiel des Verfahrens der Firma Buchler & Co. aus Braunschweig gezeigt. Sie sind einer von 7 Chinin-Produzenten, der einzige in Europa und mit einem Anteil von 20–30 % Weltmarktführer.[28]
Im ersten Schritt wird die Rinde fein zermahlen. Das Mahlgut wird dann mit gebranntem Kalk und verdünnter Natronlauge aufgeschlossen. Das Rindenpulver ist nun aufgequollen und wird dann für mehrere Stunden mit Toluol extrahiert. Toluol als organisches Lösungsmittel löst sich nicht in Wasser, sodass die Chinaalkaloide, die Fette und Harze sich in die organische Phase extrahieren. Dieses Gemisch wird im Anschluss filtriert. Um das restliche Toluol zu entfernen, wird der Filterrückstand (Chinarinde) mit Wasserdampf behandelt. Die Toluol-Phase wird währenddessen in Flüssig-Flüssig-Extraktoren mit verdünnter Schwefelsäure versetzt. Da die Chinaalkaloide als basische Amine mit der Säure Salze bilden, gehen sie aus der organischen in die wässrige Phase über. Die Fette und Harze verbleiben in der organischen Phase. Diese wird im Anschluss abgetrennt und das Toluol über Destillation zurückgewonnen. In der wässrigen Phase (die die gesamten Chinaalkaloide enthält) wird der pH-Wert exakt eingestellt, sodass durch Kristallisation bereits 70 % des Chinins ausfällt. In der restlichen Lösung befinden sich neben dem restlichen Chinin Chinidin, Chinchoin, Chinchonidin und Chininsäure. Diese können in weiteren Kristallisationsschritten gewonnen werden. Die Kristallisationsprodukte werden auf Reinheit und Lösemittelrestgehalt untersucht und dann weiterverarbeitet.[28]
Eigenschaften

Chinin schmeckt bitter. Es fluoresziert in saurer Lösung bei Bestrahlung mit Ultraviolettstrahlung (315–380 nm) intensiv hellblau. Dieser Effekt liegt an der auxochromen Wirkung der Methoxy-Gruppe am 10 π-Elektronensystem des Chinolins. Die Fluoreszenz verschwindet bei Zugabe von Salzsäure,[30] da die darin enthaltenen Chloridionen die Fluoreszenz löschen.
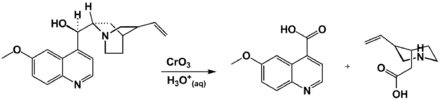
Mit Chrom(VI)-oxid (CrO3) kann Chinin in saurer wässriger Lösung zu Chininsäure und Merochinen oxidiert werden:[31]
Wirkung und Verwendung
Als Anti-Malaria-Mittel
Chinin gehört zu den ältesten Malariamitteln der Welt und ist auch als fiebersenkendes Heilmittel bekannt. Bis 1940 war Chinin das einzige wirksame Medikament gegen Malaria. Heute gibt es deutlich mehr und auch wirksamere Mittel zur Behandlung,[32] aber eine Schutzimpfung ist bis heute nicht verfügbar.
Ist der Mensch durch den Stich einer weiblichen Anopheles-Mücke infiziert worden, entwickelt sich der Erreger im Körper weiter. Er gelangt über das Blut in die Leberzellen, wo er sich fortpflanzt und eine Überdauerungsform hervorbringt, die Monate oder sogar Jahre schlummern und danach wieder aktiv werden kann. Nach wenigen Tagen strömen viele Einzeller in die Blutbahn und befallen die roten Blutkörperchen. Ein Teil der Erreger geht in die Geschlechtsform der Gametozyten über, sodass eine Mücke, die den infizierten Menschen sticht, die Gametozyten aufnimmt und diese sich in ihr vermehren können. Sticht diese Mücke wiederum einen Menschen, wird dieser infiziert und der Infektionskreislauf schließt sich.[28][33]
In den infizierten roten Blutkörperchen zerlegt der Einzeller das Hämoglobin, um an die Aminosäuren des Komplexes zu kommen. Dabei bleibt als Spaltprodukt der eisenhaltige Farbstoff des Blutes, das Häm (Ferriprotoporphyrin IX), zurück. Dieses ist in freier Form für den Erreger giftig, weswegen er es in einem einmaligen Schutzmechanismus in Schichten übereinanderstapelt und so über Wasserstoffbrücken verknüpfte Häm-Dimere erhält, die in dieser gebundenen Form als nicht toxische Hämazoin-Kristalle (β-Hämatin) ausfallen.[28][34] Die Kristallisation von β-Hämatin verläuft entgegen früheren Annahmen nicht enzymatisch.[35]
Chinin setzt an der Stelle gegen den Malariaerreger an, wo dieser die roten Blutkörperchen befällt und das Protein Globin des Hämoglobins abbaut, das für ihn giftige Häm jedoch über Biomineralisierung unschädlich macht. Hier liegt auch die Lebensbedrohung für den infizierten Menschen, da auf diese Weise bis zu 80 % der roten Blutkörperchen zerstört werden können, was zu einer Anämie führt. Außerdem verändert sich die Oberfläche von befallenen Blutkörperchen, sodass sie dazu neigen, die Kapillaren, besonders im Gehirn, zu verstopfen.[28][34]
Die pharmakologische Wirkung des Chinins besteht darin, die Biomineralisierung des Häms in das kristalline Hämozoin zu verhindern. Der exakte Mechanismus ist noch unbekannt. Es wurde noch nicht geklärt, ob Chinin beispielsweise die dimeren Häm-Komplexe bindet und eine weitere Zusammenlagerung aufhält oder ob es an den Kristallflächen eine Schutzschicht bildet. Klar ist jedoch, dass der Erreger sich durch den weiteren Abbau des Hämoglobins selbst tötet.[28][34]
Chinin wird heute kaum noch als Malariamedikament eingesetzt (meist zur Behandlung der komplizierten Malaria tropica), weil sich mittlerweile bei den Erregern Resistenzen entwickelt haben. Meist werden heutzutage Kombinationspräparate zur Prophylaxe und Therapie verwendet. Helfen diese bei schweren Krankheitsverläufen allerdings nicht, wird auch heute noch Chinin, manchmal in Kombination mit anderen Wirkstoffen gegeben.[28], [34]
Die Malariabehandlung erfolgt über eineinhalb bis zwei Wochen mit oralen Gaben von Chininsalzen in Dosierungen, die mindestens 0,8 bis 1,0 Gramm freier Chininbase pro Tag entsprechen (z. B. Tagesgabe von 1,95 Gramm Chininsulfatdihydrat).[36]
Chinin wirkt außerdem schmerzstillend, in unmittelbarer Umgebung betäubend und fiebersenkend.[37] In China wird es aufgrund der fiebersenkenden und schmerzstillenden Wirkung in geringen Dosen Mitteln zur Behandlung von grippalen Infekten beigemischt.
Als Mittel gegen Muskelkrämpfe
In der pharmazeutischen Zubereitung als Chininsulfat wirkt Chinin krampflösend und wird deshalb zur Vorbeugung und Behandlung bei Muskelkrämpfen (z. B. nächtlichen Wadenkrämpfen) eingesetzt.[38] Hierbei wird jedoch eine weitaus geringere Dosis als bei der Malariabehandlung verwendet. Man geht von einer Tagesdosis von 200 bis 400 Milligramm aus. Das Chininsulfat wirkt an der motorischen Endplatte an den Verbindungsstellen zwischen Nerven und Muskelfasern.[25] Die Funktion des Muskels wird dadurch nicht beeinträchtigt. Die Eliminationshalbwertszeit von Chininsulfat beträgt 4–18 Stunden.[39][40]
In den USA ist Chininsulfat wegen schwerwiegender Nebenwirkungen, wie Blutbildveränderungen (Thrombozytopenie) bis hin zu Todesfällen, nur zur Behandlung der Malaria tropica zugelassen.[41] In Deutschland hingegen ist die Anwendung von Chinin zur Verhütung und Behandlung nächtlicher Wadenkrämpfe zugelassen. In Studien ist die Reduzierung von Krampfhäufigkeit, Krampfintensität und Krampfdauer durch Chinin dokumentiert worden.[42]
Unter anderem wegen der schweren Nebenwirkungen forderte das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) jedoch schon länger eine Verschreibungspflicht für Limptar (Wirkstoff Chininsulfat).[43] Dem ist der Gesetzgeber mittlerweile nachgekommen: Seit 1. April 2015 unterliegt Chinin der Verschreibungspflicht, ist also nicht mehr freiverkäuflich zu erhalten.[44]
Als wehenförderndes Mittel
Chinin wirkt anregend auf die Gebärmuttermuskulatur und wurde früher als wehenförderndes Mittel eingesetzt. In diesem Zusammenhang wurde Chinin als Abortivum (Abtreibungsmittel) missbraucht, was auf Grund der Aufnahme sehr hoher Dosen oftmals zum Tod der Mutter führte. Das Bundesinstitut für Risikobewertung (BfR) warnt wegen der Wirkung auf die Gebärmuttermuskulatur in einer Publikation Schwangere vor dem Verzehr.[45]
Gegenanzeigen
Chinin kann bei empfindlichen Personen allergische Reaktionen auslösen.[46] Zudem sollte das Medikament bei Personen mit Überempfindlichkeiten gegen China-Alkaloide oder Xanthine vorsichtig eingesetzt werden. Personen mit Glukose-6-Phosphat-Dehydrogenase-Mangel, Tinnitus, Optikusneuritis, Myasthenia gravis, peptischem Ulcus oder Gastritis sollten auf das Präparat verzichten. Kinder, ältere Patienten oder Patienten mit ernsthaften Herzkrankheiten, Leberkrankheiten und Nierenkrankheiten sollten kein Chininsulfat einnehmen. Da Chinin fruchtschädigend wirkt, darf es nicht von Schwangeren eingenommen werden. In der Stillzeit ist es kein geeignetes Medikament, da Chinin über die Muttermilch an den Säugling abgegeben wird.[47]
Nebenwirkungen
Eine mögliche Oxidation des Hämoglobins durch aufgenommenes Chinin kann eine Methämoglobinämie verursachen.[48]
Bei Chininsulfat können vor allem bei längerer Einnahme und hohen Dosen Tinnitus, Übelkeit und Sehstörungen auftreten. Weitere Nebenwirkungen betreffen den Gastrointestinaltrakt, das Nervensystem, das kardiovaskuläre System und die Haut. Überempfindlichkeiten manifestieren sich meist durch Hautrötungen, Juckreiz, Fieber, Hautausschlag, Magenbeschwerden, Ohrensausen oder Sehstörungen. Seltene Nebenwirkungen sind Hämoglobinurie, Asthma und thrombopenische Purpura.
Chinin ist wie jedes Präparat in Abhängigkeit von der Dosierung giftig. Eine Überdosis führt unter anderem zu Schwindelgefühl, Kopfschmerz, Tinnitus, Taubheit, vorübergehender Erblindung und Herzlähmung. Die Nebenwirkungen beruhen auf einer Hemmung von Enzymen der Gewebsatmung sowie einer Blockierung der Synthese der Desoxyribonukleinsäure. Die tödliche Dosis liegt für einen erwachsenen Menschen bei etwa fünf bis zehn Gramm Chinin.[20] Der Tod tritt durch zentrale Atemlähmung ein.[49]
Wechselwirkungen
Da Chinin das QT-Intervall im EKG verlängert, muss darauf geachtet werden, es nicht mit anderen Medikamenten einzunehmen, die ebenfalls eine verlängernde Wirkung auf die QT-Zeit haben. Dies könnte zu Torsade de pointes und zum Herzstillstand führen.[50]
In der Leber hemmt Chinin den Abbau anderer Wirkstoffe und erhöht so den Wirkstoffspiegel. Vor allem bei Präparaten wie Digitalis, Muskelrelaxantien und Antikoagulantien müssen Wechselwirkungen berücksichtigt werden.
Nichtmedizinische Verwendung
Das bitter schmeckende Chinin wird in geringen Mengen Getränken wie Bitter Lemon oder Tonic Water zugesetzt. Als Höchstmenge ist in Deutschland 85 mg/kg in alkoholfreien Getränken, 300 mg/kg in Spirituosen zugelassen.[51] Generell ist es ein beliebter Bittermacher der Lebensmittelindustrie und beispielsweise in Magenbitter zu finden.
Da es sich jedoch um eine pharmakologisch wirksame Substanz handelt, muss die Verwendung in Deutschland in alkoholfreien Getränken stets kenntlich gemacht werden.[52]
Gelegentlich wird Chinin als Streckmittel für Heroin benutzt.[53]
In der chemischen Reaktionsführung kann Chinin bzw. dessen Derivate in asymmetrischen Synthesen eingesetzt werden. Aufgrund der Tatsache, dass Chinin enantiomerenrein aus der Natur gewonnen werden kann, wird es besonders dazu genutzt, mit Enantiomeren diastereomere Paare zu bilden, welche sich in chemischen und physikalischen Eigenschaften unterscheiden. Damit ist eine Trennung der zuvor chemisch und physikalisch identischen Enantiomere möglich. Chinin dient zudem oft als Katalysatorbestandteil für die Induktion einer spezifischen stereochemischen Information, damit bei einer Synthese ein höherer Anteil eines Enantiomers erhalten wird (hoher ee-Wert). Beispiele sind Epoxidierungen, Dihydroxylierungen und Aminohydroxylierungen an Doppelbindungen.
Handelsnamen
Monopräparate
Limptar N (D, Chininsulfat)
Literatur
- Henry Hobhouse: Sechs Pflanzen verändern die Welt. Chinarinde, Zuckerrohr, Tee, Baumwolle, Kartoffel, Kokastrauch. Klett-Cotta (2001), ISBN 3-608-91024-7.
- T. S. Kaufman, E. A. Rúveda: Die Jagd auf Chinin: Etappenerfolge und Gesamtsiege. In: Angewandte Chemie, 2005, 117, S. 876–907; doi:10.1002/ange.200400663.
- Christian Mähr: Von Alkohol bis Zucker – Zwölf Substanzen, die die Welt veränderten. Köln 2010, ISBN 978-3-8321-9549-6.
Weblinks
- Chinin. (Memento vom 11. Oktober 2011 im Internet Archive) Deutsche Gesellschaft für Ernährung, 1. September 2005
- Gesundheitliche Bewertung des Bundesinstituts für Risikobewertung (PDF; 124 kB)
- Umstrittene Chinin-Totalsynthese von Woodward und Doering bestätigt.
Anmerkungen
- In der Literatur sind eine Reihe von zum Teil stark abweichenden Werten genannt, da pKs-Werte stark abhängig von Temperatur und Ionenstärke sind. Die als Referenz angegebene Quelle listet eine umfangreiche Anzahl von Werten für Chinin mit Quelle und Messbedingungen auf.
Einzelnachweise
- Eintrag zu QUININE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Chinin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu China-Alkaloide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2011.
- Harry G. Brittain: Profiles of Drug Substances, Excipients and Related Methodology: Critical … Academic Press, 2007, ISBN 0-12-260833-X, S. 354–356 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Quinine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- American Journal of Ophthalmology. Vol. 90, S. 403, 1980.
- J.M. Arena, I.L. Springfield, C.C. Thomas: Poisoning; Toxicology, Symptoms, Treatments, 2. Auflage, 1970, S. 73.
- Journal of Pharmacology and Experimental Therapeutics. Vol. 100, S. 408, 1950.
- Japanese Journal of Toxicology. Vol. 4, S. 105, 1991.
- QUININE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 978-3-906390-29-1, S. 495.
- Meilensteine. Hrsg. Bayer AG, Leverkusen 1988, ISBN 3-921349-48-6.
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges., Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 62 ff.
- Renate Schreiber: „ein galeria nach meinem hiumor“ Erzherzog Leopold Wilhelm. In: Schriften des Kunsthistorischen Museums, Band 8, S. 1666
- Erika Hickel: Die Arzneimittel in der Geschichte: Trost und Täuschung – Heil und Handelsware (= Edition Lewicki-Büttner. Nr. 4). Bautz, Nordhausen 2008, ISBN 978-3-88309-419-9, S. 180 ff.
- Alfons Metzner: Weltproblem Gesundheit. Imhausen International Company, Lahr (Schwarzwald) 1961, S. 112.
- C. Gerhardt: Lehrbuch der Organischen Chemie. Band 4. Otto Eiland Verlag, Leipzig 1853, S. 113.
- J. J. Berzelius: Lehrbuch der Organischen Chemie. Band 5, Friedrich Vieweg und Sohn, Braunschweig 1856, S. 86.
- V. Gulliermond: Ueber die gelbe Chinarinde. In: Pharmaceutisches Centralblatt, 1957, S. 508–510.
- Eintrag zu Chinin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- Robert B. Woodward, Wilhelm E. von Doering: Total Synthesis of Quinine. In: Journal of the American Chemical Society, 1944, 66, S. 849–849; doi:10.1021/ja01233a516.
- Robert B. Woodward, Wilhelm E. von Doering: Total Synthesis of Quinine. In: Journal of the American Chemical Society, 1945, 67, S. 860.
- Milan R. Uskokovic, Juerg Gutzwiller, Thomas Henderson: Total Synthesis of Quinine and Quinidine I. In: Journal of the American Chemical Society, 1970, 92, S. 203–204; doi:10.1021/ja00704a036.
- Juerg Gutzwiller, Milan R. Uskokovic: Cinchona alkaloids. 2. Stereoselective total syntheses of quinine and quinidine. In: Journal of the American Chemical Society, 1978, 100, S. 576–581; doi:10.1021/ja00470a036.
- A. M. Harvey: The actions of quinine on skeletal muscle. In: The Journal of physiology. Band 95, Nummer 1, Februar 1939, S. 45–67, PMID 16995079, PMC 1393954 (freier Volltext).
- Berg A. et al. In: Med.Welt 1985, 16, S. 414–418.
- K. Löffelholz, I. Wessler. In: H. Mörl (Hrsg.): Muskelkrämpfe. Springer Verlag, 1987, S. 35–44.
- Prof. Dr. S. Streller, Prof. Dr. K. Roth: Von der Apotheke an die Bar Eine Rinde erobert die Welt. In: Chem. Unserer Zeit. 46. Auflage. 2012, S. 228 – 24.
- A. Rudo, K.-P. Zeller, H.-U. Siehl, S. Berger, D. Sicker: Chinin, ein legendäres Alkaloid. Bittere Medizin und bitteres Vergnügen, Chemie in unserer Zeit. In: Chem. Unserer Zeit. 52. Auflage. 2018, S. 238–248.
- F. von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis: Drogen A–K. 5. Auflage. Springer Verlag, Berlin 1998, ISBN 3-540-61618-7, S. 101.
- C. Vernon, H. Resch: The Oxidation of Optochin, in: J. Am. Chem. Soc., 1932, 54, S. 3455–3456, doi:10.1021/ja01347a072.
- S. Agnello, M. Brand, M. Chellat, S. Gazzola, R. Riedl: Eine strukturelle Evaluierung medizinalchemischer Strategien gegen Wirkstoffresistenzen. In: Angewandte Chemie. 131. Auflage. 2018, S. 3336–3383.
- B. Nocht, M. Mayer: Die Malaria. Eine Einführung in ihre Klinik, Parasitologie und Bekämpfung. 2. Auflage. Springer-Verlag, 1936, S. 1–17.
- M. Schlitzer: Wirk- und Resistenzmechanismen. Medizinische Chemie der Wirkstoffe gegen Malaria. In: Pharmazie Unserer Zeit. 38. Auflage. 2009, S. 512.
- Steinhilber, Schubert-Zsilavecz, Roth: Medizinische Chemie. 2. Auflage. Deutscher Apotheker Verlag, Stuttgart 2010, Kapitel 13.4 Antiprotozoische Wirkstoffe, S. 588.
- Chininhaltige Getränke können gesundheitlich problematisch sein. Bundesinstitut für Risikobewertung (BfR), Aktualisierte Gesundheitliche Bewertung Nr. 020/2008, 9. Mai 2008.
- Chinin. (Memento vom 11. Oktober 2011 im Internet Archive) dge.de
- Limptar® N Produkte. (Memento des Originals vom 7. Februar 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. klosterfrau.de
- Limptar-Tabletten (PDF; 17 kB) Pharmazie.com
- Eintrag zu Quinine in der DrugBank der University of Alberta, abgerufen am 18. November 2019.
- New risk management plan and patient Medication Guide for Qualaquin (quinine sulfate). FDA Drug Safety Communication, 8. Juli 2010.
- S. El-Tawil et al.: Quinine for muscle cramps (Review). The Cochrane Collaboration, 2010:12.
- Chinin (Limptar N): Anhörung im Stufenplanverfahren Stufe II BfArM vom 20. Dezember 2013.
- Verordnung zur Änderung der Arzneimittelverschreibungsverordnung, der Apothekenbetriebsverordnung, der Verordnung über apothekenpflichtige und freiverkäufliche Arzneimittel und der Medizinprodukte-Abgabeverordnung vom 19. Dezember 2014 (BGBl. I S. 2371).
- Publikationen zu Chinin. Bundesinstitut für Risikobewertung (BfR)
- alles-zur-allergologie.de.
- Fachinformation Limptar-Tabletten (PDF)
- Methämoglobinämie (Memento vom 3. September 2007 im Internet Archive) im Roche Lexikon Medizin, 4. Auflage, Urban & Fischer Verlag, München 1984/1987/1993/1999.
- Virchow: Über die Wirkung des Chinins auf den respiratorischen Stoffwechsel des Menschen In: Naunyn-Schmiedeberg's Archives of Pharmacology, Heidelberg 1927 doi:10.1007/BF01863946
- Medikamentenbedingte QT-Verlängerung und Torsade de pointes. (PDF; 142 kB)
- Anlage 4 (zu § 2 Abs. 3) Höchstmengen an bestimmten Stoffen in verzehrfertigen aromatisierten Lebensmitteln AromV
- § 5 Verkehrsverbot AromV
- Dimethyltryptamine and Ecstasy Mimic Tablets (Actually containing 5-Methoxy-Methylisopropyltryptamine) in Oregon. (PDF; 2,4 MB) In: Microgram Bulletin, Band 42, Nr. 10, Oktober 2009, S. 79. Stand 22. September 2012.