Porphyrine
Porphyrine (nach altgriechisch πορφυρά porphyrá, dem Purpurfarbstoff) sind organisch-chemische Farbstoffe, die aus vier Pyrrol-Ringen (Tetrapyrrol) bestehen, die durch vier Methingruppen zyklisch miteinander verbunden sind. Der einfachste Vertreter ist Porphin. Porphyrine bzw. porphyrinverwandte Verbindungen kommen z. B. auch als Chlorophyll und als Häm in den Häm-basierten Proteinen Hämoglobin und den verschiedenen Cytochromen vor. Häm ist eine Komplexverbindung mit Protoporphyrin IX und einem Eisen-Ion als Zentralatom anstelle der beiden Wasserstoff-Atome. Ein eisenfreies Häm ist z. B. Hämatoporphyrin.

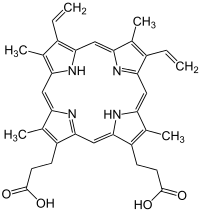
Bedeutung der Porphyrine
Porphyrine, deren Aufbau erstmals von dem Chemiker Hans Fischer[1] ausführlich beschrieben wurde, spielen im menschlichen Stoffwechsel eine zentrale Rolle. Neben dem Transport des Blutsauerstoffs durch die im roten Blutfarbstoff gebundene Häm-Gruppe kommen sie in vielen Enzymen vor, z. B. der Katalase (Wasserstoffperoxid-Entgiftung) und den Enzymen der Atmungskette im Mitochondrium. Auch das bakteriell hergestellte Vitamin B12 enthält einen porphyrinähnlichen-Anteil, nämlich Corrin. Offenkettige Abbauprodukte des roten Blutfarbstoffs im Körper sind für die Färbung von Urin, Stuhl und Galle verantwortlich. Krankheiten in Zusammenhang mit Porphyrinen sind z. B. eine Hepatitis, bei der der gestörte Abbau des Häms zur Gelbfärbung der Haut führt (Ikterus), oder aber die vererbten Häm-Aufbaustörungen (Porphyrien), bei denen Vorläuferstoffe akkumulieren und zu starker Lichtunverträglichkeit, Bauchschmerzen und Nervenschäden führen.
Einige Porphyrine können die Bestimmung von Drogen im Blut, z. B. mittels FPIA (Fluorescence Polarization Immunoassay), undurchführbar machen oder verfälschen.
| Protein | Stoffgruppe | zentrales Metall | Funktion |
|---|---|---|---|
| Hämoglobin | Häme (Stoffgruppe) | Sauerstofftransport | |
| Photosystem | Chlorophylle | Lichtabsorption | |
| Cytochrom c | Häme (Stoffgruppe) | Elektronentransport | |
| Cytochrom P450 | Häme (Stoffgruppe) | Oxygenasen |
Biosynthese
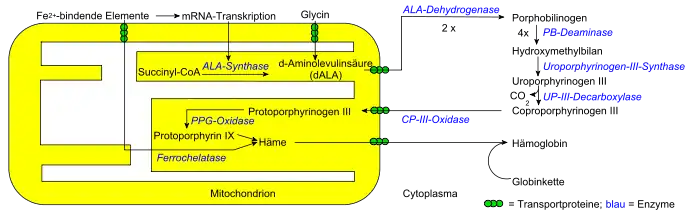
Im menschlichen Körper geht die Biosynthese aller Porphyrine von Succinyl-CoA und der Aminosäure Glycin aus. Sie findet teilweise im Zytosol und teilweise im mitochondriellen Intermembranraum statt. Die Reaktionssubstrate und -produkte müssen daher mehrmals die Mitochondrienmembran passieren; die dafür zuständigen Transportproteine sind noch völlig unbekannt.
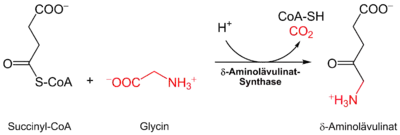
Die δ-Aminolävulinat-Synthase[2] katalysiert die Verbindung von Glycin und Succinyl-CoA zu α-Amino-β-ketoadipat, welches spontan zu δ-Aminolävulinat decarboxyliert:
Pflanzen, Algen, Bakterien (mit Ausnahme der Alphaproteobacterien) sowie Archaebakterien können δ-Aminolävulinat auch ausgehend von Glutaminsäure herstellen, was als C5- bzw. Beale-Weg bezeichnet wird. Dabei wird die an eine tRNA gebundene Aminosäure durch die Glutamyl-tRNA-Reduktase[3] in Glutamat-1-semialdehyd unter NADPH-Verbrauch reduziert. Dieses wird schließlich in δ-Aminolävulinat umgewandelt, was durch die Glutamat-1-semialdehyd-aminotransferase katalysiert wird. Es wurde indes noch nicht nachgewiesen, dass Bakterien sowohl den C5-Weg wie auch den oben beschriebenen Syntheseweg über die δ-Aminolävulinat-Synthase besitzen.[4][5]
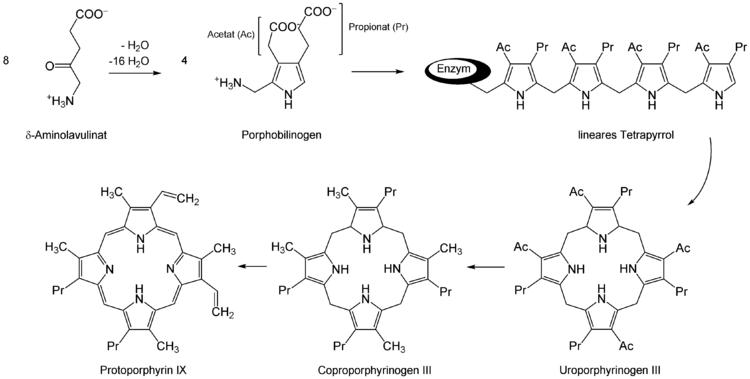
Vier dieser Moleküle werden von der Porphobilinogen-Deaminase unter Abspaltung von vier Ammoniak-Molekülen zu Hydroxymethylbilan umgesetzt. Weitere Umwandlungen erfolgen schrittweise über Uroporphyrinogen III (Uroporphyrinogen-III-Synthase) und Coproporphyrinogen III (Uroporphyrinogen-Decarboxylase) zu Protoporphyrinogen IX (Coproporphyrinogen-Oxidase) und Protoporphyrin IX (Protoporphyrinogen-Oxidase).
Abbau und Ausscheidung
Die Hämooxygenase wandelt das rote Häm unter Öffnung des Porphyrinrings sowie unter Eisen- und Kohlenmonoxidabspaltung zum grünen Biliverdin um. Die Biliverdin-Reduktase reduziert es zum orange-roten Bilirubin. Bilirubin wird über die Galle in den Darm sezerniert und 75 bis 80 Prozent des sezernierten Bilirubins werden mit dem Kot ausgeschieden, der Rest unterliegt dem Enterohepatischen Kreislauf.

Weitere Abbauprodukte des Bilirubins wie das farblose Sterkobilinogen (das durch Darmbakterien zu den braunen Dipyrrolen Mesobilifuchsin und Bilifuchsin umgesetzt wird) und das orange-gelbe Sterkobilin tragen zur normalen Stuhlfarbe bei. Teilweise werden Bilirubinabbauprodukte wieder resorbiert und tragen als Urobilinogen und Urobilin zur gelben Farbe des Urins bei.
Porphyrinverwandte Moleküle
 Porphyrin Derivate |
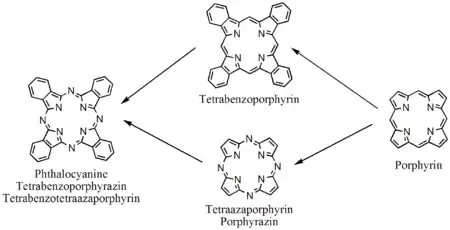 Tetraazoporphyrine, Phthalocyanine |
Weblinks
Einzelnachweise
- Otto Warburg: The Enzyme Problem and Biological Oxidations. In: Bulletin of the Johns Hopkins Hospital. Band 46, 1930, S. 341–358; auch in: Albert Faulconer, Thomas Edward Keys: Otto Heinrich Warburg. In: Foundations of Anesthesiology. Charles C Thomas, Springfield IL 1965, S. 1288–1302, hier: S. 1301 (The Chemical Constitution of the Enzyme).
- EC 2.3.1.37 (δ-Aminolävulinatsynthase).
- EC 1.2.1.70 (Glutamyl-tRNA-Reduktase).
- H. Panek, M.R. O’Brian: A whole genome view of prokaryotic haem biosynthesis. In: Microbiology, 2002, 148, S. 2273–2282. PMID 12177321.
- S.I. Beale: Biosynthesis of the tetrapyrrole pigment precursor, d-aminolevulinic acid, from glutamate. In: Plant Physiology, 1990, 93(4), S. 1273–1279. PMID 16667613; PMC 1062668 (freier Volltext).