Enantiomerenüberschuss
Der Enantiomerenüberschuss ee (englisch: enantiomeric excess, Begriff geprägt 1971 von Morrison und Mosher[1]) gibt in der Stereochemie den Überschuss eines Enantiomers in einem Enantiomerengemisch an.[2]
Definition
mit
- : Masse des Enantiomers 1
- : Masse des Enantiomers 2.
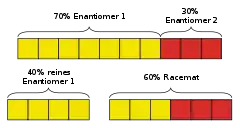
Im Beispiel aus der Abbildung können bei Massenanteilen der Enantiomere von 70 % zu 30 % je 30 Prozentpunkte der Enantiomere als racemisches Gemisch und der Rest des überschüssigen Enantiomers rein vorliegen, was einen 40 %igen Enantiomerenüberschuss für das Enantiomerengemisch bedeutet
Die Grenzfälle für den Enantiomerenüberschuss sind:
- bei einem Racemat (1:1-Gemisch der Enantiomere 1 und 2)
- bei einer enantiomeren-reinen Verbindung.
Enantiomerenüberschuss und Drehwert
In der Praxis bedeutet ein bestimmter Enantiomerenüberschuss oft, dass bei einer Messung des Drehwertes einer optisch aktiven Lösung nur der entsprechende Prozentsatz des theoretischen Drehwertes der enantiomerenreinen Lösung gemessen wird.
Genaugenommen wird über den Drehwert aber nur die optische Reinheit gemessen (englisch optical purity). Verunreinigungen der untersuchten Probe mit Nebenprodukten (egal ob achiral oder enantiomerenrein) können dazu führen, dass die optische Reinheit nicht mit dem Enantiomerenüberschuss übereinstimmt:
sowohl ein höherer als auch ein niedrigerer Enantiomerenüberschuss als tatsächlich vorhanden kann vorgetäuscht werden.
Enantiomerenüberschuss und Enantiomerenverhältnis
Nach Vorschlag der IUPAC soll daher der Enantiomerenüberschuss zunehmend durch das Enantiomerenverhältnis ersetzt werden, das aus dem Enantiomerenüberschuss berechnet werden kann:
Im Beispiel aus der Abbildung ist das Enantiomerenverhältnis daher
Obige Formel kann umgestellt werden zu:
Das Enantiomerenverhältnis kann auch direkt gemessen werden, vorwiegend mit
- chromatographischen Methoden[3] (Dünnschicht-,[4][5] Gas-[6] oder Hochdruckflüssigkeitschromatographie unter Verwendung chiraler stationärer Phasen)
- speziellen NMR-Techniken.[7]
Einzelnachweise
- James D. Morrison, Harry S. Mosher: Asymmetric Organic Reactions. Prentice-Hall, Englewood Cliff, New Jersey, 1971 (ISBN 0-13-049551-4).
- Reinhard Brückner: Reaktionsmechanismen, Spektrum Akademischer Verlag, 3. Auflage, 2004, ISBN 978-3-8274-1579-0, S. 110.
- Volker Schurig: Contributions to the theory and practice of the chromatographic separation of enantiomers. In: Chirality 17 (2005) 205–226, doi: 10.1002/chir.20133.
- K. Günther, J. Martens, M. Schickedanz: Dünnschichtchromatographische Enantiomerentrennung mittels Ligandenaustausch. In: Angew. Chem. 1984, 96, S. 514–515, doi: 10.1002/ange.19840960724.
- Teresa Kowalska, Joseph Sherma (Herausgeber): Thin Layer Chromatography in Chiral Separations and Analysis (= Chromatographic Science Series. Band 98). CRC Press Taylor & Francis Group, 2007, ISBN 978-0-8493-4369-8.
- Kurt Günther, Jürgen Martens, Maren Messerschmidt: Gas Chromatographic Separation of Enantiomers: Determination of the Optical Purity of the Chiral Auxiliaries (R)- and (S)-1-Amino-2-methoxymethylpyrrolidine. In: Journal of Chromatography A. 1984, 288, S. 203–205, doi:10.1016/S0021-9673(01)93696-9.
- Ernest L. Eliel, Samuel H. Wilen: Stereochemistry of Organic Compounds, John Wiley & Sons, 1994, ISBN 0-471-05446-1, S. 221–240.