Borane
Borane (auch Borwasserstoffe oder Borhydride) sind die Wasserstoffverbindungen des Elements Bor und ihre Derivate. Die einfachsten Verbindungen dieser Stoffklasse sind Diboran(6) B2H6 und Salze des Tetrahydridoborats BH4−. Ausgehend vom einfachsten denkbaren Boran, der Verbindung Monoboran BH3, welche in dieser Form instabil ist, handelt es sich bei B2H6 um das Dimere von BH3 und bei BH4− um das Hydrid-Addukt von BH3.
-from-xtal-view-1-tilt-3D-bs-17.png.webp)
B10H14
Die Strukturen der höheren Borane beruhen auf polyedrischen Geometrien, in denen die Boratome alle oder alle bis auf eine, zwei bzw. drei Polyederecken besetzen. Die höheren Borane besitzen somit räumliche Käfigstrukturen, die z. T. hoch-symmetrisch sind und die sich von den Strukturen anderer Element-Wasserstoffverbindungen, z. B. von denen der Kohlenwasserstoffe oder Silane deutlich unterscheiden.
Überblick über die Substanzklassen
Im engeren Sinne handelt es sich bei den Boranen um
- Salze des Tetrahydridoborats BH4−
- neutrale, niedermolekulare Verbindungen BnHn+m, die nur aus Bor und Wasserstoff bestehen
- Anionen, die durch ein- oder zweifache Deprotonierung dieser neutralen Borane BnHn+m entstehen
- Addukte von Lewis-Basen an Monoboran BH3 oder an höhere, neutralen Borane BnHn+m
- einfache Derivate die durch Substitution eines Wasserstoffrests entstehen.
Geschichte
Über die erste gasförmige Substanz, die als Hydrid des Bors beschrieben wurde und mit grüner Flamme verbrannte, berichteten 1881 F. Jones und R. L. Taylor. Dieses Gas entstand durch Einwirken von Salzsäure auf Magnesiumborid. Im weiteren Verlauf der Untersuchungen wurden verschiedene Formeln für diese Verbindung vorgeschlagen, so BH3.[1] Das bei der Umsetzung von Magnesiumborid mit Salzsäure entstehende Gas wurde in den folgenden Jahren zudem von P. Sabatier sowie von W. R. Ramsay und H. S. Hartfield untersucht. Auch diese Untersuchungen ergaben, dass es sich bei dem borhaltigen Produkt dieser Reaktion um BH3 handelt. Wie sich aber später herausstellte, beruhten die Folgerungen der obigen Untersuchungen auf experimentellen Fehlern und waren somit hinfällig.[2]
Alfred Stock, der die Borane ab Anfang der 1910er Jahre eingehend untersuchte, isolierte mit B4H10 das erste Boran als Produkt der Reaktion von Magnesiumborid mit Salzsäure. Dabei ging er davon aus, dass bei der Zersetzung von Magnesiumborid mit Säuren neben B4H10 als weiteres Boran B6H12 entsteht.[2] Später konnte er selber zeigen, dass es sich bei dem von ihm zuvor angenommenen B6H12 um ein Gemisch bestehend aus B4H10, B5H9, B6H10 und Siliciumhydriden handelte.[3] Die Verbindung B6H12 wurde erst 1964 von D.F. Gaines und R. Schaeffer synthetisiert.[4] Neben B4H10 hat Alfred Stock bereits 1913 das einfachste Boran B2H6 als Zersetzungsprodukt von B4H10 und in den darauf folgenden Jahren weitere Borane wie B10H14 erstmals isoliert, charakterisiert und bzgl. ihrer Eigenschaften untersucht.[5][3][6]
Alfred Stock hat die von ihm gefundene Formel B4H10 für das erste isolierte Boran als "höchst überraschend" beschrieben. So war für ihn und in seinen Worten auf Grund der Stellung des Elements Bor im Periodensystem, auf Grund der Dreiwertigkeit des Elements in der großen Mehrzahl seiner Verbindungen und in Anbetracht der Formeln der bekannten Verbindungen B(Me)3 und B(Et)3 fast sicher zu erwarten, dass das Hauptprodukt der Reaktion von Magnesiumborid mit Salzsäure BH3 oder eine sich hiervon ableitende "höhermolekulare" Verbindung wie B2H4, B3H5 oder B5H6 ist. Die gefundene Formel B4H10 war mit der Dreiwertigkeit des Bors nicht in Einklang zu bringen.[2]
Während des Zweiten Weltkrieges wurden die Forschungen, insbesondere die Möglichkeiten zur Herstellung von Tetrahydridoborten MBH4 , von Hermann Irving Schlesinger und Herbert Charles Brown verstärkt betrieben, weil die Borane im Zusammenhang mit der Urananreicherung (als U(BH4)4) und als Raketentreibstoff auf Interesse stießen. Auf diese Untersuchungen geht u. a. die Herstellung vom Natriumborhydrid durch Umsetzung von Natriumhydrid mit Borsäuretrimethylester zurück.[7]

B2H6
Lange Zeit wurde am Strukturproblem des Diborans(6) B2H6 gearbeitet und Vorschläge für mögliche Strukturformeln über die klassische Valenztheorie gemacht. Endgültige Klärung der Struktur von Diboran(6) mit zwei die beiden Boratome verbrückenden Wasserstoffatomen brachten 1948 veröffentlichte Untersuchungen mit einem hochauflösenden Infrarotspektrometer, welche zeigten, dass Diboran(6) D2h-Symmetrie wie Ethylen und nicht D3d-Symmetrie wie Ethan besitzt.[8] Später wurden diese Ergebnisse mit Hilfe von Röntgenstrukturanalysen an Einkristallen bei tiefen Temperaturen (Schmelzpunkt von Diboran(6): −164,85 °C) bestätigt.[9]
Die erste eindeutige Bestimmung der Struktur eines höheren Borans gelang 1948 mit der Einkristall-Röntgenstrukturanalyse von Decaboran(14), welche die auf einem Polyeder basierende Struktur aufzeigte.[10][11] Welche Probleme die Strukturaufklärung der Borane bereitete, zeigt sich zum Beispiel daran, dass noch im gleichen Jahr, der auf Röntgenstrukturanalyse-Daten basierenden Veröffentlichung der Struktur von Decaboran(14), auf der Basis von Elektronenbeugungs-Daten vermutet wurde, das Decaboran(14) aus zwei symmetrischen Fünfringen besteht, die über eine BB-Bindung miteinander verbunden sind.[12]
Diese Untersuchungen führten zum Bruch mit dem klassischen Valenzstrich-Konzept und unter Einbeziehung der Molekülorbitaltheorie zu der Formulierung als BHB-Dreizentrenbindung neben den terminalen BH-Zweizentrenbindungen.
William Lipscomb erhielt für seine Arbeiten über Borane und Carbaborane 1976 den Nobelpreis für Chemie.
Molekulare Eigenschaften
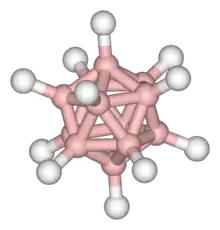
closo-dodecaborat
B12H122−
Borane sind Elektronenmangelverbindungen, da mehr Atome kovalent miteinander verknüpft sind, als Elektronenpaare vorhanden sind. Dies führt zu ungewöhnlich hohen Bindungsordnungen und Koordinationszahlen. Maßgeblich sind hierfür Mehrzentrenbindungen, zumeist Dreizentrenbindungen.
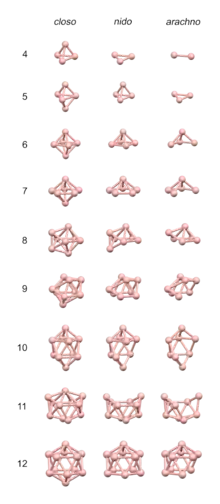
Borane, die aus einem einzelnen, d. h. einem nicht mehrteiligen Grundgerüst, wie bei den conjuncto-Boranen, bestehen, werden in die Gruppen der closo-, nido-, arachno- und hypho-Borane eingeteilt. Die Gruppen besitzen jeweils eine allgemeine Summenformel, wobei der Wasserstoffanteil von den closo- zu den hypho-Boranen steigt. Die folgende Tabelle zeigt eine Übersicht für diese Borane mit einfachem Grundgerüst und hiervon abgeleitete Mono- und Dianionen (bis n = 12):
| Cluster-Typ | allgem. Summenformel | bisher isolierte Borane (nicht vollständig) | Beispiele |
|---|---|---|---|
| closo- | BnHn+2 BnHn+1– BnHn2− | unbekannt n = 6–11 n = 6–12 | B6H62− , B12H122− |
| nido- | BnHn+4 BnHn+3− BnHn+22− | n = 2, 5–6, 8, 10–11 n = 5, 10 n = 10 | B10H14 , B5H9 B10H13– , B5H8– B10H122− |
| arachno- | BnHn+6 BnHn+5– BnHn+42− | n = 4–6, 8–9 n = 3 n = 5 | B4H10 , B5H11 B3H8− B5H92− |
| hypho- | BnHn+8 BnHn+7– BnHn+62− | n = 5 n = 5 | B5H12− B5H112− |
closo-Borane
Die closo-Borane sind in Form ihrer Dianionen mit der Summenformel BnHn2− für n = 6-12 bekannt, nicht aber in Form der entsprechenden neutralen Verbindungen mit der Summenformel BnHn+2.
Die closo-Borane besitzen geschlossene polyedrische Strukturen, wobei die Boratome alle Ecken sogenannter Trigonpolyeder besetzen, welche ausschließlich von Dreiecksflächen begrenzt sind. Dabei handelt es sich bei diesen Polyedern mit Ausnahme des Oktadekaeders (n = 11) um Deltaeder, d. h. um Polyeder, die ausschließlich durch zueinander kongruente gleichseitige Dreiecke begrenzt sind. So besitzt hinsichtlich des zugrunde liegenden Grundkörpers beispielsweise B6H62− die Struktur des Oktaeders, B8H82− die Struktur des Trigondodekaeders und B12H122− die Struktur des Ikosaeders. Die Struktur des B12-Ikosaeders, bildet zudem eine Struktureinheit verschiedener Modifikationen des elementaren Bors.
Jedes Boratom der closo-Borane ist zudem mit einem terminalen Wasserstoffatom verbunden, welches jeweils nach außen vom Polyeder wegweist.
In der folgenden Tabelle sind die Trigonpolyeder, die den Strukturen der dianionischen closo-Hydridoborate zugrunde liegen, aufgelistet:[13]
| BnHn2− | Trigonpolyeder | Punktgruppe | Anzahl der jeweils gleichen Ecken |
|---|---|---|---|
| nicht bekannt | Tetraeder | Td | 4 |
| nicht bekannt | Trigonale Bipyramide | D3h | 2 + 3 |
| B6H62− | Oktaeder | Oh | 6 |
| B7H72− | Pentagonale Bipyramide | D5h | 2 + 5 |
| B8H82− | Trigondodekaeder | D2d | 4 + 4 |
| B9H92− | Dreifach überkapptes trigonales Prisma | D3h | 3 + 6 |
| B10H102− | Zweifach überkapptes quadratisches Antiprisma | D4d | 2 + 8 |
| B11H112− | Octadekaeder | C2v | 1 + 2 + 4 + 2 + 2 |
| B12H122− | Ikosaeder | Ih | 12 |
Wie die Tabelle oben zeigt, sind die den Boranen zugrunde liegenden Polyeder zum Teil hoch-symmetrisch. So sind die Ecken des Oktaeders und des Ikosaeders, die zur Gruppe der platonischen Körper gehören, gleich, was zur Folge hat, dass die B6- und B12-closo-Hydridoborate im 11B-NMR-Spektrum jeweils nur ein Signal zeigen und als Monoderivate dieser Borane durch Ersatz eines exo-Wasserstoffatoms oder einer BH-Einheit jeweils nur ein mögliches Derivat gebildet werden kann. Die übrigen Borane besitzen niedrigere Symmetrien und zeigen in ihren 11B-NMR-Spektren entsprechend ihrer Symmetrie mehrere Signale und bilden zumindest potenziell mehrere Mono-Derivate.
nido- und arachno-Borane
Die Strukturen der nido- und arachno-Borane leiten sich ebenfalls von den geschlossenen polyedrischen Strukturen, die den closo-Boranen zugrunde liegen, durch Wegnahme von einer Polyederecke bei den nido-Boranen und von zwei Polyederecken bei den arachno-Boranen ab. Hierbei entstehen zunehmend offenere Strukturen, wobei die zusätzlichen Wasserstoffatome, der nido- und arachno-Borane in Form verbrückender B-H-B Wasserstoffatome oder weiterer endständiger Wasserstoffatome vorhanden sind.
In diesem Sinne leitet sich beispielsweise die Struktur des nido-Borans Pentaboran(9) vom Oktaeder durch Wegnahme einer Ecke ab. Pentaboran(9) besitzt somit die Struktur einer tetragonalen Pyramide, wobei die Boratome an den Ecken der tetragonalen Pyramide stehen. Jedes der fünf Boratom besitzt ein terminales Wasserstoffatom, welches nach außen von der Pyramide wegweist und an der offenen quadratischen Fläche stehen zusätzlich vier Wasserstoffatome, welche jeweils zwei benachbarte Boratome der offenen quadratischen Fläche verbrücken. Die Struktur des arachno-Borans Tetraboran(10) leitet sich ebenfalls vom Oktaeder durch Wegnahme von zwei Polyederecken ab.
-dianion-from-xtal-3D-bs-17.png.webp) Hexahydrido-
Hexahydrido-
closo-hexaborat
B6H62−-from-xtal-view-1-Mercury-3D-bs.png.webp) nido-Pentaboran(9)
nido-Pentaboran(9)
B5H9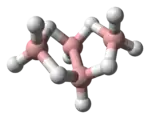 arachno-Tetraboran(10)
arachno-Tetraboran(10)
B4H10
Einfluss der Anzahl der Gerüstelektronen auf die Gerüststruktur
Die Gerüststruktur eines Borans, dessen Struktur auf einem einzelnen Polyeder basiert, wird durch die Zahl der vorhandenen Gerüstelektronen bestimmt. Zur Anzahl der Gerüstelektronen tragen alle Valenzelektronen des Boran-Gerüsts bei, die nicht an den Bindungen zu jeweils einem endständigen Wasserstoffatom pro BH-Einheit beteiligt sind.
Mit Hilfe der Wade-Regel kann man anhand der durch Abzählen ermittelten Zahl der Gerüstelektronen eines Borans qualitativ erklären bzw. ableiten, welche Struktur dieses Boran besitzt. Nach dieser Regel besitzen Borane mit n Boratomen bei 2n+2 Gerüstelektronen eine closo-, bei 2n+4 Geüstelektronen eine nido-, bei 2n+6 Gerüstelektronen eine arachno- und bei 2n+8 Gerüstelektronen eine hypho-Struktur. Dabei besetzen die Boratome bei closo-Boranen alle Ecken eines Polyeders mit n Ecken, bei nido-Boranen alle bis auf eine Ecke eines Polyeders mit n + 1 Ecken, bei archno-Boranen alle bis auf zwei Ecken eines Polyeders mit n + 2 Ecken und bei hypho-Boranen alle bis auf drei Ecken eines Polyeders mit n + 3 Ecken.[14][15] Welche Polyedergeometrie in einem konkreten Fall zugrunde liegt, kann man aus der Tabelle oben ablesen.
Bei Boranen tragen die folgenden Elemente zur Zahl der Gerüstelektronen bei und werden zu ihrer Berechnung entsprechend ihrer Anzahl addiert:
- jede BH-Einheit: 2 Elektronen (das dritte Außenelektron des Bors wird zur Bindung des Wasserstoffatoms benötigt)
- jedes weitere Wasserstoffatom: 1 Elektron
- jede negative Ladung des Gesamtmoleküls: 1 Elektron
- jede addierte Lewis-Base: 2 Elektronen
Beispiele:
B6H62−
6 BH-Einheiten + 2 negative Ladungen: 6*2 + 2*1 = 14 Gerüstelektronen:
6*2 + 2 = 14 Gerüstelektronen (Formel 2n+2) → closo-Struktur entsprechend dem Polyeder mit 6 Ecken
B10H14
10 BH-Einheiten + 4 weiter Wasserstoffatome: 10*2 + 4*1 = 24 Gerüstelektronen:
10*2 + 4 = 24 Gerüstelektronen (Formel 2n+4) → nido-Struktur abgeleitet vom Polyeder mit 11 Ecken
B4H10
4 BH-Einheiten + 6 weiter Wasserstoffatome: 4*2 + 6*1 = 14 Gerüstelektronen:
4*2 + 6 = 14 Gerüstelektronen (Formel 2n+6) → arachno-Struktur abgeleitet vom Polyeder mit 6 Ecken
B5H9(PMe3)2
5 BH-Einheiten + 4 weiter Wasserstoffatome + 2 Lewis-Basen: 5*2 + 4*1 + 2*2 = 18 Gerüstelektronen:
5*2 + 8 = 18 Gerüstelektronen (Formel 2n+8) → hypho-Struktur abgeleitet vom Polyeder mit 8 Ecken
Auch die Strukturen der Carborane, anderer Heteroborane oder Metallaborane, in denen ein oder mehrere Boratome eines Borans durch Kohlenstoff, ein anderes Hauptgruppenelement oder ein Übergangsmetall ersetzt sind, lassen sich mit Hilfe der Wade-Regel erklären. Da z. B. Kohlenstoff vier und nicht drei Valenzelektronen wie Bor besitzt, ist eine BH−-Einheit isoelektronisch mit einer CH-Einheit, so dass verständlich ist, dass das Dicarbadodecaboran C2B10H12 Ikosaederstruktur wie das isoelektronische B12H122− besitzt.
conjuncto-Borane
Neben den oben beschriebenen Boranen, denen die Struktur eines einzelnen Trigonpolyeders zugrunde liegt, gibt es Borane, die aus zwei oder mehreren solcher Grundborane bestehen. Die Grundborane sind dabei über gemeinsame BB-Bindungen oder über gemeinsame Boratome miteinander verknüpft. Hierbei können Wasserstoff-freie Boratome vorhanden sein. Beispielsweise bestehen die isomeren conjuncto-Borane anti- und syn-B18H22 jeweils aus zwei B10H14 Grundboran-Einheiten, die über zwei gemeinsame, Wasserstoff-freie Boratome miteinander verknüpft sind.[16][17][18] Das conjuncto-Boran B20H16 besteht aus zwei B12-Ikosaedern die über vier gemeinsame, Wasserstoff-freie Boratome miteinander fusioniert sind.[19]
Die Strukturen der conjuncto-Borane lassen sich mit der mno-Regel nach Jemmis erklären bzw. vorhersagen.[20]
Nomenklatur
Nomenklatur bei neutralen Boranen
Die Bezeichnung der neutralen Borane erfolgt so, dass man vor dem Wortstamm boran die Anzahl der Boratome durch einen griechischen Zahlenwert angibt. Nach dem Wortstamm boran wird die Anzahl der Wasserstoffatome in runden Klammern als arabische Ziffer angegeben. Weiter kann optional durch die Vorsilben closo, nido, arachno, hypho und conjuncto angegeben werden, welche Art von Gerüststruktur vorliegt.[21]
Beispiele zur Veranschaulichung:
- Pentaboran(9) bzw. nido-Pentaboran(9) für B5H9
- Pentaboran(11) bzw. arachno-Pentaboran(11) für B5H11
Wie die Beispiele zeigen, ist die einfachere Bezeichnung Pentaboran ohne Angabe der Wasserstoffzahl (9) bzw. (11) nicht ausreichend, da zwei unterschiedliche Pentaborane bekannt sind. Die zusätzliche Voranstellung von nido bzw. arachno ist aber zumindest im Fall der Pentaborane in gewisser Weise überflüssig, da von Pentaboran keine conjuncto-Borane bekannt sind und sich die Gerüststruktur somit bereits aus der Summenformel ergibt.
Nomenklatur bei anionischen Boranen
Die anionischen Borane werden heute als Hydridoborate benannt. Dabei wird bei Borananionen mit mehr als einem Boratom die Anzahl der Boratome vor dem Wortteil borat durch einen griechischen Zahlenwert angegeben. Die Anzahl der Wasserstoffatome wird ebenfalls durch einen griechischen Zahlenwert angegeben und dem Wortteil hydrido vorangestellt. Optional kann man die Ladung in Klammern in der Form (1-) oder (2-) anfügen und ebenfalls optional kann durch die eingeschobenen Silben closo, nido, arachno, hypho und conjuncto angegeben werden, welche Art von Gerüststruktur vorliegt. Bei der Benennung der Salze wird die Art und Anzahl der kationischen Gegenionen dem Namen insgesamt vorangestellt.[21]
Die Hydridoborate wurden früher als Boranate benannt.
Beispiel zur Veranschaulichung der Benennung von anionischen Boranen:
- Tetrahydridoborat für BH4−
- Octahydridotriborat bzw. Octahydridotriborat(1-) bzw. Octahydrido-arachno-triborat für B3H8−
- Decahydridodecaborat bzw. Decahydridodecaborat(2-) bzw. Decahydrido-closo-decaborat für B10H102−
Chemische Eigenschaften und Reaktionen
Gegenüber Wärme, Sauerstoff und Wasser besitzen die einzelnen Borane jeweils sehr unterschiedliche Stabilitäten.
Insbesondere die closo-Borane wie B6H62−, B9H92−, B10H102−, B12H122−, B21H18− und B20H16 sind im Vergleich mit simpleren Boranen wie B2H6 oder B10H14 sehr stabil. Diese Stabilität beruht hauptsächlich auf sterischen Effekten, hoher Symmetrie und darauf, dass die geschlossenen Käfigstrukturen der closo-Borane ohne verbrückende Wasserstoffatome aufgebaut sind.
Thermische Stabilität
Monoboran BH3 ist eine bei Standardbedingungen instabile Verbindung und liegt in dimerer Form als Diboran B2H6 vor. Diboran(6) selbst ist bei Standardbedingungen metastabil, zersetzt sich aber bereits oberhalb einer Temperatur von 50 °C unter Bildung von Wasserstoff und höheren Boranen. Dabei bilden sich hauptsächlich Tetraboran(10), Pentaboran(9), Pentaboran(11) und Decaboran(14).
Stabilität gegenüber Sauerstoff
Die Borane sind gegenüber Sauerstoff nicht stabil und verbrennen in seiner Gegenwart unter Bildung von Bortrioxid (B2O3) und Wasser unter starker Wärmeentwicklung. Die Reaktivität gegenüber Sauerstoff ist teilweise so hoch, dass z. B. Pentaboran(9) an der Luft selbstentzündlich ist und Diboran(6) eine niedrige Zündtemperatur besitzt. Andere Borane wie z. B. Decaboran(14) sind deutlich weniger reaktiv und lassen sich an der Luft handhaben.
Stabilität gegenüber Wasser und Alkoholen
Von Wasser werden Borane zu Borsäure und Wasserstoff zersetzt. Die Borane besitzen gegenüber dieser Zersetzung aber unterschiedliche Stabilitäten. Diboran(6) ist hydrolyse-empfindlich. Im Gegensatz dazu sind die closo-Hydridoborate(2–) gegenüber Wasser kinetisch ziemlich stabil.
In Gegenwart von Alkoholen erfolgt die analoge Reaktion zu Borsäureestern und Wasserstoff, hier am Beispiel der Zersetzung von Diboran durch Methanol und Bildung des Borsäuremethylesters:
Reaktion mit Lewis-Basen
Mit Lewis-Basen bilden Borane Addukte. Addukte von Lewis-Basen an Monoboran sind z. B. das Tetrahydrofuran-Addukt BH3·THF (vgl. Abschnitt Herstellung), das Ammoniak-Addukt BH3·NH3 (vgl. Abschnitt Verwendung) oder das Tetrahydridoborat-Anion, welches in der Verbindung Natriumborhydrid vorliegt und u. a. durch Umsetzung von Diboran(6) mit Natriumhydrid entsteht:
Auch höhere Borane sind gegenüber Lewis-Basen reaktiv, wobei es bei der Anlagerung von Lewis-Basen zu einer Öffnung des Borangerüsts kommt. Beispielsweise reagiert nido-Decaboran(14) u. a. mit zwei Äquivalenten der Lewis-Base Acetonitril unter Adduktbildung und Eliminierung von Wasserstoff zum entsprechenden arachno-Boran.[22]
Nido-Pentaboran(9) reagiert mit zwei Äquivalenten Trimethylphosphin unter Adduktbildung und ohne Eliminierung von Wasserstoff zum entsprechenden hypho-Boran:
Brønsted-Acidität
Einige höhere Borane, insbesondere solche mit verbrückenden Wasserstoffatomen, können mit geeigneten Basen deprotoniert werden. Dabei nimmt die Acidität mit der Clustergröße zu und arachno-Borane sind acider als nido-Borane. So lässt sich beispielsweise nido-Pentaboran(9) mit Alkyllithium-Verbindungen oder Alkalimetallhydriden zum entsprechenden Mono-Anion deprotonieren.
Das gegenüber nido-Pentaboran(9) acidere nido-Decaboran(14) mit einem pKs-Wert von 2,70 lässt sich bereits mit Hydroxid-Ionen zum Mono-Anion B10H13− deprotonieren. Ein weiteres Proton lässt sich mit stärkeren Basen wie Natriumhydrid unter Bildung des Dianions B10H122− abspalten.[23][24]
Reaktion mit Reduktionsmitteln
Nido-Borane wie Decaboran(14) oder Pentaboran(9) werden von starken Reduktionsmitteln unter Aufnahme von zwei Elektronen zu den entsprechenden dianionischen arachno-Hydridoboraten reduziert.
Im Falle des Reduktionsprodukts von nido-Pentaboran(9) konnte gezeigt werden, dass durch die zweifache Protonierung des Dianions B5H92− das arachno-Pentaboran(11) erhalten werden kann.[25]
Öffnung des Borangerüsts
Das Borangerüst kann durch Reduktion oder durch die Addition von Lewis-Basen geöffnet werden. Eine Öffnung des Borangerüsts meint hierbei einen Schritt in der Richtung closo → nido → arachno → hypho. Dabei wird das Borangerüst durch die Aufnahme von zwei Elektronen bzw. durch die Addition einer Lewis-Base jeweils um eine Stufe geöffnet. Bzgl. Beispielen für Clusteröffnungen siehe die Abschnitte "Reaktion mit Lewis-Basen" und "Reaktion mit Reduktionsmitteln" weiter oben.
Verengung des Borangerüsts
Unter Abspaltung von Wasserstoff erfolgt die Überführung des Borangerüsts in eine geschlossenere Form unter Beibehaltung der Anzahl der Boratome. Eine Überführung des Borangerüsts in eine geschlossenere Form meint hierbei einen Schritt in der Richtung hypho → arachno → nido → closo. Das folgende Beispiel zeigt die Herstellung eines closo-Borans aus einem nido-Boran durch Eliminierung von Wasserstoff:
Erhöhung der Zahl der Gerüstatome
Durch Umsetzung von neutralen Boranen mit Tetrahydridoborat BH4− bzw. durch Umsetzung von neutralen Boranen oder anionischen Boranen mit Diboran(6) kann die Zahl der Boratome des Borangerüsts erhöht werden:
Erniedrigung der Zahl der Gerüstatome
Durch Umsetzung mit Basen lassen sich Borangerüste verkleinern:
Elektrophile Substitution
Durch Umsetzung von nido-Pentaboran(9) mit Cl2/AlCl3 entsteht 1-Chloro-nido-pentaboran(9) unter Substitution des endständigen Wasserstoffatoms an der Pyramidenspitze. Analoge halogenierte Derivate von Pentaboran(9) werden auch durch die Umsetzung mit Br2 oder I2 bzw. alkylierte Derivate durch Umsetzung mit Alkylchloriden (RCl) in Kombination mit Aluminiumchlorid (RCl/AlCl3) erhalten.
In gleicher Weise werden die Wasserstoffatome an den Boratomen 1–4 von nido-Decaboran(14) unter Bildung von B10H14-nXn (X = Cl, Br, I) substituiert. Die Alkylierung dieser Boratomen von nido-Decaboran(14) ist ebenfalls wie bei nido-Pentaboran(9) möglich.
Herstellung
Herstellung von Tetrahydridoboraten
Natriumborhydrid wird nach dem Schlesinger-Verfahren aus Borsäuretrimethylester und Natriumhydrid hergestellt.[7]
Herstellung von Lewis-Base Addukten an Monoboran
Der Tetrahydrofuran-Komplex von Monobran BH3·THF kann leicht aus Natriumtertrahydridoborat NaBH4 und elementarem Iod hergestellt werden.[26]
Herstellung von Diboran(6)
Diboran(6) entsteht in nahezu quantitativer Ausbeute bei der Umsetzung von Bortrichlorid mit einer Lösung von Lithiumtetrahydroaluminat in Diethylether:
Technisch wird Diboran(6) durch Umsetzung von gasförmigem Bortrifluorid mit Natriumhydrid bei einer Temperatur von 180 °C gewonnen:
Bzgl. weiterer Herstellungsverfahren für Diboran(6):
Herstellung von neutralen nido- und arachno-Boranen aus Diboran(6)
Die Bildung von Tetraboran(10), Pentaboran(9), Pentaboran(11) und Decaboran(14), welche die Hauptprodukte der Thermolyse von Diboran B2H6 darstellen, lässt sich jeweils hinsichtlich der hauptsächlichen Bildung eines dieser Borane optimieren. Beispielsweise kann man Decaboran(14) in guter Ausbeute durch Pyrolyse von Dioran(6) bei einer Temperatur von 160–200 °C in Gegenwart katalytischer Mengen einer Lewis-Base wie Dimethylether herstellen.
Herstellung von Salzen der closo-Hydridoborate
B12H122− lässt sich aus Bortrioxid, Natrium und Wasserstoff bei 600–850 °C im Autoklaven herstellen:
Am besten wird Dodecahydrido-closo-dodecaborat B12H122− durch Umsetzung von Diboran(6) nit Natriumtertrahydridoborat NaBH4 bei einer Temperatur von 180 °C gewonnen:
Verwendung
Herstellung von Carboranen
Ausgehend von Boranen lassen sich Carborane mit zwei Kohlenstoffatomen im Clustergerüst durch deren Umsetzung mit Alkinen herstellen. So entstehen beispielsweise closo-Dicarbadodecaborane (RR'C2B10H10) durch Umsetzung von Alkinen der Formel RR'C2 mit nido-Decaboran(14) (B10H14).[22]
Hydroborierung, Herstellung von Alkylboranen
Bei Hydroborierungen wird formal Monoboran, welches u. a. in der Form von Diboran oder in der Form des THF-Addukts von Monoboran eingesetzt wird, an Alkene addiert. Hiermit lassen sich durch die Umsetzung von Monoboran mit Alkenen im Verhältnis 1:1 – 1:3 Mono-, Di- und Trialkylborane (RBH2, R2BH und R3B) herstellen. Bekannte Produkte dieser Reaktion sind Triethylboran, welches durch Umsetzung von Diboran oder des THF-Addukts von Monoboran mit Ethylen entsteht und das bicyclische 9-BBN, welches durch Umsetzung von Monoboran mit dem cyclischen Diolefin 1,5-Cyclooctadien entsteht.
In der organischen Synthese stellen die durch Hydroborierung hergestellten Alkylborane Zwischenprodukte bei der Herstellung von funktionalisierten Alkanen dar. Bei der Umsetzung von Monoboran mit unsymmetrischen Alkenen bilden sich Alkylborane, bei denen die Borylgruppe an das weniger stark verzweigte Kohlenstoffatom der Kohlenstoff-Kohlenstoff-Doppelbindung gebunden wird. Die gebildeten Alkylborane lassen sich in einer Folgereaktion in substituierte Alkane umwandeln, z. B. in Alkohole. Im Fall der Herstellung eines Alkohols bilden sich Alkohole, bei denen Wasser formal in einer Anti-Markownikow-Addition an ein Alken addiert wurde, das heißt die Hydroxylgruppe ist an das andere C-Atom der C=C-Doppelbindung als bei einer direkten Addition von Wasser gebunden.[27]
Reduktionsmittel
In der Form von u. a. Diboran oder Tetrahydroboraten wie Natriumborhydrid, Lithiumborhydrid werden Borane in der organischen Synthese als Reduktionsmittel eingesetzt. Ein Beispiel ist die Herstellung von Alkoholen ausgehend von Carbonsäureestern, Aldehyden oder Ketonen.[28]
Wasserstoffspeicher
Amminboran BH3·NH3, das Addukt von Ammoniak an Monoboran, wird als mögliche Quelle für Wasserstoffgas für Fahrzeuge diskutiert. Dabei wird der Wasserstoff durch Erhitzung aus dem Amminboran freigesetzt
Additive für Treibstoffe in Triebwerken
Borane besitzen eine höhere Energiedichte als konventionelle Treibstoffe auf der Basis von Kohlenwasserstoffen. In den 1950er Jahren entwickelte die US Air Force Treibstoffe für Strahl- und Raketentriebwerke zur Erhöhung der Reichweite unter dem Namen High-Energy-Fuels (abk: HEF), die alkylierte Borane als Additive enthielten. Die entwickelten Borane waren Ethyldiboran, Propylpentaboran, Ethyldecaboran, Methyldecaboran und Ethylacetylenedecaboran. Die Entwicklungsarbeiten auf diesem Gebiet wurden aber 1959, wegen unterschiedlicher Probleme eingestellt. Die Borane sind, geruchsintensiv, giftig, teuer und die festen Verbrennungsprodukte führten zu Problemen an den Triebwerken, da diese klebrig, korrosiv und im Falle des gebildeten Borcarbids abrasiv sind.
Literatur
- Nils Wiberg: Hollemann – Wiberg, Lehrbuch der Anorganischen Chemie, Walter de Gruyter Berlin, New York 2007, 102. Auflage, S. 1042–1096, ISBN 978-3-11-017770-1
- N. N. Greenwood, A. Earnshaw, Chemie der Elemente, VCH 1990, S. 191–225, ISBN 3-527-26169-9
- Peter Paetzold: Neues vom Bor und seinen Verbindungen, In: Chemie in unserer Zeit, 9. Jahrg. 1975, Nr. 2, S. 73, ISSN 0009-2851
- Georg Süss-Fink: Vom Enfant Terrible zum Musterknaben: Die Borane, In: Chemie in unserer Zeit, 20. Jahrg. 1986, Nr. 3, S. 90–100, ISSN 0009-2851
Weblinks
- Seminar Universität Siegen (PDF; 93 kB)
Einzelnachweise
- JONES, Francis; TAYLOR, R. L., XXXII.—On boron hydride Journal of the Chemical Society, Transactions, 1881, 39, S. 213-219; doi:10.1039/CT8813900213
- STOCK, Alfred; MASSENEZ, Carl Borwasserstoffe, Berichte der deutschen chemischen Gesellschaft, 1912, 45(3), S. 3539-3568; doi:10.1002/cber.191204503113
- STOCK, Alfred; KUSS, Ernst Borwasserstoffe, VI.: Die einfachsten Borhydride, Berichte der deutschen chemischen Gesellschaft (A and B Series), 1923, 56(4), S. 789-808; doi:10.1002/cber.19230560404
- Gaines, Donald F., and Riley Schaeffer: Studies of Boranes. XI. The Preparation and Properties of Hexaborane-12, B6H12 Inorganic Chemistry, 1964 3(3), S. 438-440.
- STOCK, Alfred; FRIEDERICI, Kurt: Borwasserstoffe. II. Ein neuer Borwasserstoff, B2H6.—Schwefelkohlenstoff‐Kühlbad zur Konstanthaltung einer Temperatur von− 112.°, Berichte der deutschen chemischen Gesellschaft, 1913, 46(2), S. 1959-1971; doi:10.1002/cber.191304602110
- STOCK, Alfred; POHLAND, Erich: Borwasserstoffe, XII.: Zur Kenntnis des B10H14, Berichte der deutschen chemischen Gesellschaft (A and B Series), 1929, 62(1), S. 90-99; doi:10.1002/cber.19290620111
- H. I. Schlesinger, H. C. Brown et al.: New developments in the chemistry of diborane and the borohydrides. General summary, J. Am. Chem. Soc., 1953, 75, S 186–190; doi:10.1021/ja01097a049
- Price, W. C.: The absorption spectrum of diborane, The Journal of Chemical Physics, 1948, 16(9), S. 894-902.
- Smith, H. Warren, and William N. Lipscomb: Single‐Crystal X‐Ray Diffraction Study of β‐Diborane The Journal of Chemical Physics 1965, 43(3) 1060-1064.
- Kasper, John S., C. M. Lucht, and David Harker, The structure of the decaborane molecule Journal of the American Chemical Society, 1948, 70(2), S. 881.
- Kasper, J. S., C. M. Lucht, and D. Harker: The crystal structure of decaborane, B10H14, Acta Crystallographica, 1950, 3(6), S. 436-455.
- Silbiger, Gloria, and S. H. Bauer: The Structures of the Hydrides of Boron. VIII. Decaborane Journal of the American Chemical Society, 1948, 70(1), S. 115-119.
- István Hargittai, Magdolna Hargittai: Symmetry through the Eyes of a Chemist, VCH Verlagsgesellschaft Weinheim 1986, S. 101–103, ISBN 3-527-26409-4
- Wade, K. The structural significance of the number of skeletal bonding electron-pairs in carboranes, the higher boranes and borane anions, and various transition-metal carbonyl cluster compounds, Journal of the Chemical Society D: Chemical Communications, 1971, 15, S. 792–793; https://doi.org/10.1039/C29710000792
- RUDOLPH, Ralph W.: Boranes and heteroboranes: a paradigm for the electron requirements of clusters?, Accounts of Chemical Research, 1976, 9(12), S. 446-452; doi:10.1021/ar50108a004
- OLSEN, Frederic P.; VASAVADA, Ravindra C.; HAWTHORNE, M. Frederick.: The chemistry of n-B18H22 and i-B18H22, Journal of the American Chemical Society, 1968, 90(15) S. 3946-3951; doi:10.1021/ja01017a007
- SIMPSON, Paul G.; LIPSCOMB, William N.: Molecular, crystal, and valence structures of B18H22, The Journal of Chemical Physics, 1963, 39(1), S. 26-34; doi:10.1063/1.1734029
- SIMPSON, Paul G., et al.: Molecular, Crystal, and Valence Structures of Iso‐B18H22, The Journal of Chemical Physics, 1963, 39(9), S. 2339-2348; doi:10.1063/1.1701439
- DOBROTT, Robert D.; FRIEDMAN, Lawrence B.; LIPSCOMB, William N.: Molecular and crystal structure of B20H16, The Journal of Chemical Physics, 1964, 40(3), S. 866-872; doi:10.1063/1.1725218
- E. D. Jemmis, M. M. Balakrishnarajan, P. D. Pancharatna: Electronic requirements for macropolyhedral boranes, Chemical reviews, 2002, 102(1), S. 93-144; https://doi.org/10.1021/cr990356x
- Nils Wiberg: Hollemann - Wiberg, Lehrbuch der Anorganischen Chemie, Walter de Gruyter Berlin, New York 2007, 102. Auflage, S. 1054–1055 (Fußnote 10), und als Beispiele u. a. S. 1071, 1085, ISBN 978-3-11-017770-1
- T. L. Heying et al.: New Series of Organoboranes I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds, Inorganic Chemistry, 1963, Vol. 2, No. 6, S. 1089–1092; https://doi.org/10.1021/ic50010a002
- N. N. Greenwood, A. Earnshaw, Chemie der Elemente, VCH 1990, S. 216–217, 220–221, ISBN 3-527-26169-9
- BRIDGES, Adam N.; GAINES, Donald F: The Dianion of nido-Decaborane (14), nido-Dodecahydrodecaborate (2-),[B10H122-], and Its Solution Behavior, Inorganic Chemistry, 1995, 34(18), S. 4523-4524; https://doi.org/10.1021/ic00122a004
- WERMER, Joseph R.; SHORE, Sheldon G.: Reduction of nonahydropentaborane by alkali metals. Preparation of the dianion (B5H9) 2-and a new route to undecahydropentaborane Inorganic Chemistry, 1987, 26(11) S. 1644-1645; doi:10.1021/ic00258a003
- A.S.B. Prasad, J.V.B. Kanth, M. Periasamy, Tetrahedron 1992, 48, 4623–4628.
- Herbert C. Brown: Hydroboration - a powerful synthetic tool, Tetrahedron Letters, 1961, Vol. 12, S. 117–138.
- E. R. H. Walker: The functional group selectivity of complex hydride reducing agents, Chemical Society Reviews, 1976, S. 23–50.