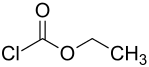
Chlorameisensäureethylester
Chlorameisensäureethylester ist eine organisch-chemische Verbindung aus der Stoffgruppe der Chlorameisensäureester (eigentlich korrekterweise Chlorkohlensäureester), die als Zwischenprodukt zur Herstellung verschiedener Kohlensäure-Derivate dient.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylchlorformiat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit beißendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,53 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
95 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[3] | ||||||||||||||||||
| Brechungsindex |
1,3974 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−505,3 kJ/mol[7] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Chlorameisensäureethylester wird technisch in einem kontinuierlichen Prozess aus Phosgen und wasserfreiem Ethanol bei Temperaturen bis 20 °C hergestellt.[8]
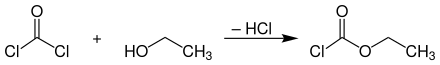
Die Umsetzung kann im Gleich- oder Gegenstrom erfolgen. Beim Gleichstromverfahren wird in Rührkesselreaktoren, Reaktoren mit eingebauter Zerstäuberdüse oder Umlaufreaktoren gearbeitet, wohingegen man für die Gegenstromanordnung in der Regel eine Füllkörperkolonne verwendet, bei der überschüssiges Phosgen zusammen mit gasförmigem Chlorwasserstoff am Kopf der Kolonne austritt und der Chlorameisensäureester im Sumpf angereichert wird.[8]
Chemische Eigenschaften
Chlorameisensäureethylester gehört zur Gruppe der Chlorameisensäureester, wie auch Chlorameisensäuremethylester, Chlorameisensäure-n-butylester, Chlorameisensäurephenylester und Chlorameisensäurebenzylester. Die Verbindung ist thermisch instabil. Eine DSC-Messung zeigt ab 136 °C eine exotherme Zersetzungsreaktion mit einer Wärmetönung von −344 kJ·kg−1 bzw. −37,3 kJ·mol−1.[9]
Verwendung
Chlorameisensäureethylester dient als weit verbreitetes Zwischenprodukt bei der Herstellung von Carbonaten und Carbamaten,[10] die in der pharmazeutischen Industrie als Ausgangsstoffe für Synthesen dienen.
Nomenklatur
Der gebräuchliche Name „Chlorameisensäureethylester“ ist nicht korrekt, da die Verbindung kein Derivat der Ameisensäure, sondern der Kohlensäure (Kohlensäuremonochlorid und Kohlensäuremonoester) ist.[11]
Sicherheitshinweise
Die Dämpfe von Chlorameisensäureethylester bilden bei Konzentrationen zwischen 3,2 und 27,5 Volumenprozent mit Luft ein explosionsfähiges Gemisch (Flammpunkt 16 °C, Zündtemperatur 450 °C).[3] In Hitze zersetzt sich die Verbindung, wobei Chlorwasserstoff, Phosgen, Chlor und andere giftige Stoffe frei werden können.
Einzelnachweise
- Datenblatt Ethylchlorformiat (PDF) bei Merck, abgerufen am 4. Februar 2018.
- Eintrag zu Chlorameisensäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. August 2012.
- Datenblatt Ethyl chloroformate bei AlfaAesar, abgerufen am 4. Februar 2018 (PDF) (JavaScript erforderlich).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-240.
- Eintrag zu Ethyl chloroformate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Ethylchlorformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Siegfried Böhm, Maren Beth-Hübner: Chloroformic Esters. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. April 2006, doi:10.1002/14356007.a06_559.pub2.
- Sperry, J.B.; Minteer, C.J.; Tao, J.; Johnson, R.; Duzguner, R.; Hawksworth, M.; Oke, S.; Richardson, P.F.; Barnhart, R.; Bill, D.R.; Giusto, R.A.; Weaver, J.D.: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing in Org. Process Res. Dev. 22 (2018) 1262–1275, doi:10.1021/acs.oprd.8b00193.
- chemicalland21.com: Produktinformation.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 430 (eingeschränkte Vorschau in der Google-Buchsuche).


