Kaliummethanolat
Kaliummethanolat ist das Alkoholat des Methanols mit dem Gegenion Kalium und findet Verwendung als starke Base und als Katalysator für Umesterungen, insbesondere bei der Herstellung von Biodiesel.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
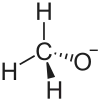 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliummethanolat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3KO | |||||||||||||||
| Kurzbeschreibung |
weißes bis gelbliches geruchloses kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 70,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
15,5[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Die Synthese von Kaliummethanolat im Labormaßstab erfolgt durch die stark exotherme Reaktion von metallischem Kalium mit Methanol unter Freisetzung äquimolarer Mengen von Wasserstoff.[5]
Von nachgeordneter Bedeutung für die Herstellung von Kaliummethanolat ist die Reaktion von Metallhydriden, wie z. B. Kaliumhydrid mit Methanol.
Die exotherme Reaktion von Kaliumhydroxid mit Methanol führt – unter Vermeidung der Entstehung von leicht entzündlichem Wasserstoffgas – in einer Gleichgewichtsreaktion zu Kaliummethanolat und Wasser, das in einem kontinuierlichen Prozess fortwährend dem Gleichgewicht entzogen werden muss.[6]
Auch wegen der ausgeprägten Hygroskopie von Kaliumhydroxid, das ca. 10 % Wasser enthält, ist die vollständige Entfernung des Wassers für den Reaktionsumsatz kritisch.[7] Vorteilhaft ist die signifikant höhere Auflösungsgeschwindigkeit von Kaliumhydroxid in Methanol im Vergleich zu Natriumhydroxid. Großtechnisch wird Kaliummethanolat durch Zersetzung des bei der Chloralkali-Elektrolyse von Kaliumchlorid nach dem Amalgam-Verfahren entstehenden Kaliumamalgams mit Methanol. Verunreinigungen des anfallenden Kaliummethanolats in Methanol mit metallischem Quecksilber können durch Ultrafiltration beseitigt werden.[8] Durch Abdestillieren des Methanols wird festes Kaliummethanolat erhalten.
Wegen ihrer einfacheren Darstellung und besseren Handhabbarkeit werden bevorzugt die kontinuierlich dem Amalgam-Prozess entzogenen Lösungen von Kaliummethanolat in Konzentrationen von 25 bis 32 Gewichtsprozent für chemische Zwecke eingesetzt.
Evonik Industries als einer der größeren Hersteller von Alkalimetallalkoxiden verfügt über Kapazitäten von mehreren tausend Jahrestonnen Kaliummethanolat-Lösungen am Standort Lülsdorf/Niederkassel. BASF betreibt eine Anlage zur Herstellung von Kaliummethanolat in Ludwigshafen.
Die Verdrängung des Amalgam-Verfahrens durch das ökologisch und ökonomisch überlegene Membranverfahren zur Herstellung der Massechemikalien Natronlauge und Kalilauge stellt zukünftig dieses Standardherstellverfahren für die Herstellung von Alkalimetallalkoholaten in Frage.[9]
Eigenschaften
Kaliummethanolat ist ein weißes bis gelbliches, hygroskopisches, geruchloses kristallines Pulver, das mit Wasser heftig zu Kaliumhydroxid und Methanol reagiert. Die erhaltenen wässrigen Lösungen sind stark basisch und wirken korrosiv und ätzend. Die Substanz ist als entzündlicher Feststoff klassifiziert mit einer Selbstentzündungstemperatur von 70 °C.[2]
Die Angaben zur Human- und Ökotoxizität von Kaliummethanolat beruhen auf den Eigenschaften der Zersetzungsprodukte Kalilauge und Methanol bei der Hydrolyse im wässrigen Medium.[3]
Verwendung
Die Carbonylierung von Methanol mit Kohlenmonoxid zum Methylformiat wird von starken Basen, wie z. B. Kaliummethanolat katalysiert.[10][11]
Das wesentliche Einsatzgebiet von Kaliummethanolat in Form seiner 25-32%igen methanolischen Lösungen ist als basischer Umesterungskatalysator in der Biodieselsynthese. Dabei werden Triglyceride pflanzlichen und tierischen Ursprungs mit Methanol in Gegenwart von Alkalimetallmethanolaten zu den entsprechenden Fettsäuremethylestern (englisch fatty acid methyl esters, FAME) umgesetzt.[12][7] Obwohl Kaliummethanolat die Bildung von Fettseifen – hier Kaliumsalze der Fettsäuren aus den Triglyceriden – stärker fördert als das (preisgünstigere) Natriummethanolat, werden mit Kaliummethanolat höhere Ausbeuten erzielt. Als optimale Bedingungen für die Biodieselproduktion aus Canolaöl wird eine Konzentration von 1,59 Gew.% Kaliummethanolat, eine Reaktionstemperatur von 50 °C und ein Methanol-Öl-Verhältnis von 4,5:1 angegeben. Die Biodieselausbeute beträgt dabei 95,8 % bei einem Fettsäurengehalt von 0,75 Gew.%.[13]
Literatur
- N.Y. Turova, E.P. Turevskaya, V.G. Kessler, M.I. Yanovskaya (Hrsg.): The Chemistry of Metal Alkoxides. Springer US, 2002, ISBN 978-0-7923-7521-0, doi:10.1007/b113856.
Einzelnachweise
- Eintrag zu Kaliummethanolat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Evonik Industries, GPS Safety Summary, Potassium Methylate, abgerufen am 12. August 2015.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Potassium methanolate, abgerufen am 12. August 2015.
- Eintrag zu Potassium methanolate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- A.R. Ronzio, W.B. Cook: 4-Amino-2,6-dimethylpyrimidine In: Organic Syntheses. 24, 1944, S. 6, doi:10.15227/orgsyn.024.0006; Coll. Vol. 3, 1955, S. 71 (PDF).
- Chimtek Engineering: Potassium Methylate Production Technology, abgerufen am 12. August 2015.
- J. Ruwwe: Metal alkoxides as catalysts for the biodiesel production. In: Chim. Oggi Chem. Today. Band 26, Nr. 1, 2008, S. 26–28 (Online [PDF]).
- Patent EP2656905: Entquickung von Lösungen durch Ultrafiltration. Angemeldet am 10. April 2013, veröffentlicht am 30. Oktober 2013, Anmelder: Evonik Degussa GmbH, Erfinder: M. Horn, B. Helpap, M. Thiel, M. Neumann.
- ICF International: Study on EU Implementation of the Minamata Convention on Mercury, abgerufen am 12. August 2015.
- B.N. Pattanaik: The advances in processes and catalysts for the production of methyl formate by methanol carbonylation – a review. In: IJCPT. Band 3, Nr. 2, 2013, ISSN 2277-4807, S. 55–70.
- Patent US20140148614: Process for preparing methyl formate by reaction of methanol with carbon monoxide in the presence of a catalyst system comprising alkali metal formate and alkali metal alkoxide. Angemeldet am 25. November 2013, veröffentlicht am 29. Mai 2014, Anmelder: BASF SE, Erfinder: D. Schneider, K.-D. Mohl, M. Schäfer, J. Paschold, J.H. Teles, S. Rittinger.
- G. Knothe, J. Krahl, J. Van Gerpen (Hrsg.): The Biodiesel Handbook, 2nd Edition. AOCS Press, 2010, ISBN 978-1-893997-62-2.
- A. Singh, B. He, J. Thompson, J. Van Gerpen: Process optimization of biodiesel production using alkaline catalysts. In: Appl.Eng.Agric. Band 22, Nr. 4, 2006, S. 597–600, doi:10.13031/2013.21213 (PDF (Memento vom 23. November 2015 im Internet Archive)).

