Magenkarzinom
Ein Magenkarzinom (Magenkrebs) ist eine Krebserkrankung des Magens. Im Gegensatz zu den meisten anderen Krebsarten hat die Anzahl an Neuerkrankungen pro Jahr in den westlichen Ländern seit Jahren kontinuierlich abgenommen. Hauptrisikofaktoren für die Entstehung eines Magenkarzinoms sind eine nitrosaminreiche Ernährung sowie eine chronische Infektion mit Helicobacter pylori. Zentrale Bedeutung in der Diagnostik des Magenkrebses hat die Magenspiegelung (Gastroskopie). Mittels kleiner Gewebeproben, die im Rahmen einer solchen Untersuchung gewonnen werden, kann die Diagnose genau vom Pathologen gestellt werden. Beim Fehlen von Metastasen (Tochtergeschwulsten) ist die Therapie der Wahl die operative Entfernung des Magens (Gastrektomie), verknüpft mit einer Entfernung der lokalen Lymphknoten (Lymphadenektomie). In Abhängigkeit vom Tumorstadium erfolgt bei lokalem Tumorstadium eventuell zusätzlich eine Chemotherapie vor der Operation, eine sogenannte neoadjuvante Chemotherapie, oder im Anschluss an die Operation (adjuvante Chemotherapie). Bei Vorliegen von Fernmetastasen ist keine heilende Therapie mehr möglich. In diesem Stadium wird bei Hinweis auf Behinderung der Magenpassage eine Umgehungsoperation (palliative Gastrektomie) durchgeführt. Fehlt diese Symptomatik, so wird in Abhängigkeit vom Allgemeinzustand des Patienten eine palliative Chemotherapie durchgeführt.
| Klassifikation nach ICD-10 | |
|---|---|
| C16.- | Magenkarzinom |
| ICD-10 online (WHO-Version 2019) | |
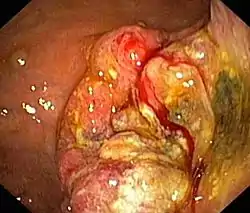
Epidemiologie
Weltweit stellt das Magenkarzinom den zweithäufigsten Tumor des Menschen dar.[1] In Deutschland macht Magenkrebs nur rund 5 % aller malignen Erkrankungen aus.[2] Das Auftreten variiert regional erheblich. Länder mit hohem Auftreten sind Japan, Chile, Costa Rica, Kolumbien, China, Portugal, Russland und Bulgarien. In diesen Staaten ist das Auftreten rund vier- bis sechsfach im Vergleich zu Ländern mit niedrigem Risiko erhöht. In der westlichen Welt geht die Krebsart mittlerweile im Vergleich zu anderen Krebsarten zurück. So war sie 1930 die häufigste Krebstodesursache in den USA, heute ist Magenkrebs nur noch für rund 2,5 % der Krebstoten verantwortlich. Dies lässt sich durch ein besseres Langzeitüberleben der Patienten erklären, ist aber vor allem der Abnahme der Neuerkrankungsrate zu verdanken. Diese fiel von 38:100.000 in den 1930er-Jahren auf rund 5:100.000 im 21. Jahrhundert. In den meisten Staaten sind Männer gegenüber Frauen doppelt so oft von der Krankheit betroffen.[1]
Im Jahr 2002 wurden in Deutschland knapp 20.000 Fälle diagnostiziert. Dort erkranken seither jedes Jahr über 15.000 Menschen neu an Magenkrebs, davon über 9.000 Männer.[3] Männer sind etwas häufiger als Frauen betroffen (Verhältnis etwa 3:2). Der Häufigkeitsgipfel liegt jenseits des 50. Lebensjahres.
Risikofaktoren
Zu den umweltbedingten Risikofaktoren zählen die Infektion mit Helicobacter pylori, bestimmte Ernährungsweisen und gesellschaftliche Faktoren. Eine chronische Infektion mit Helicobacter pylori, einem Bakterium, das in der Magensäure überleben kann und auch Magengeschwüre begünstigt, steigert das Risiko von Magenkrebs um den Faktor fünf bis sechs. Zwar führt nicht jede Infektion zum Krebs, aber in fast allen Karzinomen vom intestinalen Typ kann eine Infektion nachgewiesen werden. Eisenmangel erhöht das Risiko, dass aus einer Helicobacter-Infektion ein Karzinom entsteht.[4]
Eine Ernährung mit hohem Gehalt an Nitrat und Nitrit, das in schlecht aufbereitetem Trinkwasser oder Konservennahrung vorkommen kann, fördert auch die Krebsentstehung. Ebenso kann mit der Nahrung aufgenommenes Benzo[a]pyren zur Entartung beitragen. Auch Rauchen erhöht über einen bisher unbekannten Mechanismus das Risiko, an einem Magenkarzinom zu erkranken. Da diese Risikofaktoren vor allem bei Personen mit geringem sozio-ökonomischen Status vorhanden sind, tritt Magenkrebs in dieser Bevölkerungsgruppe gehäuft auf.[1]
Außerdem gibt es zahlreiche patientenbezogene Risikofaktoren, die Magenkrebs begünstigen. Eine chronische Magenschleimhautentzündung senkt auf die Dauer den Säurespiegel und macht so den Magen verwundbar für die Besiedlung mit Helicobacter. Ebenso führt sie durch die andauernde Entzündungsreaktion zu einer Umwandlung der Schleimhaut, bei der Magenschleimhaut durch Schleimhaut, die der des Darms ähnelt, ersetzt wird. Diese Läsionen gelten als Vorläufer eines Karzinoms vom intestinalen Typ. Patienten, bei denen eine teilweise Magenentfernung durchgeführt wurde, haben auch ein erhöhtes Risiko zu erkranken. Dies wird auf den Fluss basischer Gallenflüssigkeit und Dünndarmsekret zurückgeführt. Adenome des Magens sind auch als Vorläufer von Magenkrebs anzusehen. Bei 40 % der entfernten Adenome findet sich ein Karzinom. Außerdem hat rund ein Drittel der Patienten mit Adenomen ein Karzinom an einer anderen Stelle des Magens.[1] Das Ménétrier-Syndrom, bei dem Schleimhaut des Magens generell verdickt ist, wird als Krebsvorstufe des Magens angesehen.[5]
Auch genetische Risikofaktoren fördern die Entstehung von Magenkrebs. So haben Patienten mit Blutgruppe A ein erhöhtes Risiko zu erkranken. Ebenso kommt es im Rahmen des autosomal-dominant erblichen Tumorsyndroms HNPCC gehäuft zu Magenkrebsfällen.[6] Fälle von Magenkrebs in der Familie erhöhen generell das individuelle Risiko des Patienten, selbst an Magenkrebs zu erkranken. Außerdem gibt es ein familiäres Magenkarzinomsyndrom, das auf einer Mutation von Cadherin beruht.[1]
Chronische Magengeschwüre entarten nur selten maligne (in bis zu 3 % der Fälle), hinter einem chronischen, nicht abheilenden Magengeschwür kann sich allerdings auch ein unerkannter Magenkrebs verbergen.
Ein hoher Obst- und Gemüseverzehr könnte vor Lungenkrebs und Krebs des oberen Verdauungstraktes (u. a. Magen) schützen. Vor allem Männer mit ursprünglich geringerem Konsum profitierten in der EPIC-EURGAST-Studie (2006) von einer Erhöhung auf 300 g Obst und Gemüse am Tag. Ein Zusammenhang mit anderen Krebsentitäten ist nicht belegt. Je höher der Vitamin-C-Spiegel im Blut war, desto geringer das Magenkrebsrisiko. Dies galt vor allem bei hohem Fleisch- und Wurstkonsum.[7]
Symptome
Die Diagnose des Magenkarzinoms wird dadurch erschwert, dass Karzinome, die noch klein sind und operativ vollkommen entfernt werden könnten, in der Regel keinerlei Symptome verursachen. Erst spät zeigen sich für den Patienten Symptome wie ein Völlegefühl im Oberbauch, das bei weiterem Wachstum in dauerhafte Schmerzen übergehen kann. Appetitlosigkeit, oft zusammen mit Übelkeit und Brechreiz, ist ein häufiges Spätsymptom, führt aber selten zur Vorstellung beim Arzt. Schluckstörungen sind ein Symptom fortgeschrittener Tumoren am Mageneingang. Brechreiz und Übelkeit werden eher bei Tumoren des Magenausgangs beobachtet.[5]
Seltene mit einem Magenkarzinom vergesellschaftete Symptome sind Thrombosen oberflächlicher Venen, hämolytische Anämien mit Mikroangiopathie und Acanthosis nigricans.[5]
Teilweise werden Metastasen im Eierstock, auch Krukenberg-Tumor genannt, vor dem eigentlichen Magentumor entdeckt.
Diagnostik
_H%2526E_magn_400x.jpg.webp)
Bei der körperlichen Untersuchung des Patienten ist insbesondere auf vergrößerte Lymphknoten oberhalb des linken Schlüsselbeins zu achten (Virchow-Lymphknoten). Seltenere Orte einer lymphogenen Metastasierung sind die Region um den Bauchnabel und die linke Achselhöhle. Ebenso ist auf Zeichen von Aszites zu achten; - dies ist ein Zeichen von Tumoraussaat in das Bauchfell. Außerdem sollte eine Tastuntersuchung der Leber durchgeführt werden, da dies den häufigsten Absiedlungsweg von Magenkarzinomen darstellt. Eine Vergrößerung kann einen Hinweis darauf geben.[8]
Die gebräuchlichste Methode zur Diagnose eines Magenkarzinoms ist die Magenspiegelung. Im Rahmen dieser Untersuchung sind Gewebeproben zu entnehmen, da nur eine histologische Untersuchung Art und Dignität des Tumors sicher feststellen kann. Um diese Methode zu verbessern, wurden mehrere Farbstoffe entwickelt, die auf die Magenschleimhaut aufgetragen werden können. Der Farbstoff Methylenblau wird von Oberflächenzellen des Darmes aufgenommen. Der Nachweis von Darmschleimhaut im Magen oder der Speiseröhre ist ein Hinweis auf einen bösartigen Prozess oder eine Vorstufe dessen. Die Farbstoffe Indigokarmin und Kresylviolett verstärken den Kontrast des Schleimhautreliefs und lassen so Unregelmäßigkeiten leichter erkennen. Des Weiteren ist mittlerweile die Zoomendoskopie verfügbar, bei der die Schleimhaut unter 15 bis 150-facher Vergrößerung beurteilt werden kann. Eine weitere Technik ist das Narrow-Band-Imaging. Dabei wird durch einen Filter der Blauanteil des Lichts erhöht, so dass auch Unregelmäßigkeiten in der Schleimhaut besser gesehen werden können.[8]
Bei vorhandenem Tumor muss dessen Ausbreitung festgestellt werden (Staging). Ein Mittel des Stagings ist die Endosonographie. Hierbei wird wie bei einer Magenspiegelung ein Endoskop in den Magen eingeführt. Aus dem Magen heraus wird mit Hilfe eines Ultraschallkopfs das umliegende Gewebe beurteilt. Eine weitere Untersuchung zur Suche von Tumorabsiedlungen ist eine Ultraschalluntersuchung des Bauch- und Beckenraumes. Die Computertomographie bietet eine weitere Möglichkeit, nach Metastasen zu suchen; - allerdings erfasst sie keine Absiedlungen, die kleiner als fünf Millimeter sind. In 20 bis 30 % der CT-Untersuchungen zeigt sich ein unauffälliges Bild, obwohl Absiedlungen ins Bauchfell vorliegen. Zur Diagnose dieser Metastasen ist die Laparoskopie die sensitivste Methode. Allerdings birgt sie als operativer Eingriff Risiken für den Patienten. In 3–5 % treten Komplikationen auf. In rund 0,1 % der Untersuchungen verstirbt der Patient an den Folgen des Eingriffs.[8]
Tumormarker weisen bei der Diagnostik des Magenkarzinoms eine Sensitivität von 9 bis 30 % auf und stellen somit keine sinnvolle Maßnahme zur Entdeckung des Tumors dar.[8]
Histopathologie
Die Mehrheit der Karzinome zeigt unter dem Mikroskop Siegelringzellen. In den Zellen ist der Zellkern an den Rand gedrängt, und sie reagieren stark mit der PAS-Färbung. Seltener treten Karzinome auf, die den Drüsen des Darmes ähneln. Es sind auch Gallertkarzinome beschrieben, bei denen außerhalb der Krebszellen Massen von PAS-positivem Schleim liegen, sowie entdifferenzierte Karzinome, deren Herkunft sich nur durch immunhistochemische Methoden klären lässt. Neben diesen Tumoren, die vom Epithel des Magens ausgehen, sind auch neuroendokrine Tumoren beschrieben.[9]
Typen
Man unterscheidet je nach der Form des Tumorwachstums vier Typen von Adenokarzinomen des Magens. Das polypoide Adenokarzinom wächst wie ein Polyp von der Mageninnenseite in das Magenlumen ein. Das ulzerierende Adenokarzinom zeichnet sich durch die Bildung einer Schleimhautschädigung im Sinne eines Geschwürs aus. Gegenüber gutartigen Magengeschwüren zeigt das Karzinom unregelmäßigere Ränder. Beide Typen machen je ein Drittel der Magenkarzinome aus. Rund ein Zehntel aller Magenkarzinome sind vom diffusen Typ. Diese Tumoren wachsen nicht in das Lumen ein, sondern infiltrieren das Gewebe des Magens. Die Tumorzellen induzieren eine Fibrose in der Schleimhaut- und der Muskelschicht des Magens, was zu einer Wandverdickung führt. Der diffuse Typ ist mit einer besonders schlechten Prognose assoziiert. Als Frühkarzinom des Magens bezeichnet man einen Tumor, der auf die Schleimhaut oder die Submukosa beschränkt bleibt. Obwohl rund 20 % der Frühkarzinome bei Diagnosestellung bereits metastasiert haben, besitzen sie im Vergleich zu den anderen Arten eine relativ gute Prognose.[10]
Viel seltener als Adenokarzinome sind adenosquamöse Karzinome, Plattenepithelkarzinome und undifferenzierte Karzinome.
Molekularbiologie
Molekularbiologische Befunde werden für die Einschätzung der Prognose und für die Wahl der Therapie immer wichtiger. 2014 wurde auf Basis genetischer Untersuchungen eine Klassifikation in vier Typen vorgeschlagen:
Aus dem TCGA-Projekt (The Cancer Genome Atlas) standen genetische und molekularbiologische Analysen von 295 Adenokarzinomen des Magens zur Verfügung. Die Gewebeproben der Tumoren wurden mit 6 verschiedenen molekularen Plattformen untersucht:
- array-based somatic copy number analysis: Verfahren zur Bestimmung der Anzahl somatischer DNA – Kopien
- whole-exome sequencing: Sequenzierung der DNA
- array-based DNA methylation profiling: Analyse der DNA-Hypermethylierung
- messenger RNA sequencing: Sequenzierung der mRNA
- microRNA (miRNA) sequencing: Sequenzierung der microRNA
- reverse-phase protein array (RPPA): Analyse der gebildeten Proteine
Epstein-Barr-Virus-positive Tumoren
Das Epstein-Barr-Virus konnte in 9 % der Fälle aufgespürt werden. EBV-positive Tumoren hatten häufig eine extrem starke DNA-Hypermethylierung. Sie wiesen oft eine PIK3CA-Mutation auf und amplifizierten JAK2, PD-L1 und PD-L2, d. h. diese Proteine wurden über-normal stark gebildet. Diese Tumoren wären potentielle Kandidaten für eine Immuntherapie mit PD-L1-Inhibitoren. Bisher sind sie für das Magenkarzinom allerdings noch nicht zugelassen. Klinische Studien brachten bisher keinen Erfolg.[12]
MSI-Tumoren
64 Tumoren wiesen eine sehr starke Mutationsrate auf. Es kommt zur Mikrosatelliten-Bildung. Die Abkürzung MSI steht für "MikroSatellit Instabil". Das Mismatch-Reparatur-Protein MLH1 wird häufig nicht exprimiert, wodurch bestimmte DNA-Schäden nicht erfolgreich repariert werden können. Das führt zur Ausbildung zahlreicher Mutationen, die eventuell Ziel für eine Target-Therapie werden könnten. Durch eine Hypermethylierung des MLH1-Promotors wird die Produktion dieses DNA-Reparaturmoleküls abgeschaltet.
Genomisch-stabile Tumoren
Die verbliebenen Tumoren wurden nach dem Vorhandensein oder Fehlen extensiver somatischer Aberrationen der Kopienzahl(engl. somatic copy-number aberrations = SCNA), d. h. der Veränderung der Genaktivität in genomisch-stabile und chromosomeninstabile unterteilt. 58 Tumoren zeigten ein stabiles Genomen mit wenig Mutationen. Histologisch waren es häufig diffus wachsenden Magenkarzinome. Gene von Proteinen für die Zellmigration waren häufig aktiviert. Besonders häufig waren Mutationen von CDH1 und RHOA. Ferner wurde eine Fusion von CLDN18- und ARHGAP-Genen nachgewiesen.
Chromosomeninstabile Tumoren
Die übrigen 147 Tumoren gehörten der verbleibenden chromosomeninstabilen Gruppe (CIN) mit vielen Mutationen an. Histologisch waren sie meistens intestinal differenziert. Besonders häufig war eine Mutation von TP53 anzutreffen, welches das Protein p53 kodiert. Ferner fand sich eine Aktivierung von RTK-RAS.
TNM-Klassifikation
Die TNM-Klassifikation dient der Stadieneinteilung der Tumorausbreitung (sogenanntes Staging). TNM ist eine Abkürzung für
- T = Tumor: Ausdehnung des Primärtumors
- N = Nodus: Lymphknoten, Fehlen oder Vorhandensein von regionären Lymphknotenmetastasen
- M = Metastasen: Fehlen oder Vorhandensein von Fernmetastasen
Derzeit gültig ist die 7. Auflage der Kriterien nach AJCC staging system (American Joint Committee on Cancer).[13]
| TX | Primärtumor kann nicht bestimmt werden. |
| T0 | Keine Evidenz für einen Primärtumor |
| Tis | Carcinoma in situ: Intraepithelialer Tumor ohne Invasion der Lamina propria |
| T1 | Infiltration der Lamina propria oder der Tela submucosa (Synonym: Frühkarzinom) |
| T1a | Infiltration der Lamina propria oder Lamina muscularis mucosae |
| T1b | Infiltration der Tela submucosa |
| T2 | Infiltration der Tunica muscularis |
| T3 | Infiltration des subserösen Bindegewebes ohne Invasion des visceralen Peritoneums oder benachbarter Strukturen. T3 schließt auch Tumoren ein, welche sich entlang des gastrocolischen oder gastrohepatischen Ligaments ausbreiten, sowie das Omentum majus oder minus erreichen, ohne Durchdringung des visceralen Peritonuems, welche diese Strukturen umgibt. |
| T4 | Infiltration von Nachbarorganen (Milz, Colon transversum, Leber, Zwerchfell, Pancreas, Bauchwand, Nebenniere, Niere, Dünndarm oder Retroperitoneum) |
| T4a | Infiltration der Serosa (viszerales Peritoneum) |
| T4b | Infiltration von Nachbarorganen (Milz, Colon transversum, Leber, Zwerchfell, Pancreas, Bauchwand, Nebenniere, Niere, Dünndarm oder Retroperitoneum) |
| NX | Befall lokaler Lymphknoten nicht beurteilbar |
| N0 | Keine lokalen Lymphknoten befallen |
| N1 | Metastasen in ein bis zwei lokalen Lymphknoten |
| N2 | Metastasen in drei bis sechs lokalen Lymphknoten |
| N3 | Metastasen in sieben oder mehr lokalen Lymphknoten |
| M0 | Keine Fernmetastasen nachgewiesen |
| M1 | Fernmetastasen |
Therapie
| TNM-Stadium | Therapie |
|---|---|
| uT1aN0M0* (Mucosakarzinom, Magenfrühkarzinom) | Endoskopische Resektion (EMR, ESD) |
| alle Stadien ≥ uT1b* (operabel) | Operation (komplette oder Teil-Gastrektomie mit D2-Lymphadenektomie) |
| Stadien uT3 und uT4* (operabel) | zusätzlich vorgeschaltet zur o. g. Operation: Neoadjuvante Chemotherapie mit Cisplatin und Fluorouracil (bzw. Oxaliplatin, Capecitabin); Stellenwert der adjuvanten (Radio-)Chemotherapie ist umstritten, wird bisher nicht empfohlen |
| lokal inoperabel oder metastasiert (M1) | Palliative Chemotherapie auf Basis der o. g. Substanzen, bei HER2-Positivität möglichst mit Trastuzumab |
| * der Buchstabe 'u' bei der TNM-Formel steht für durch Ultraschall, d. h. endosonografisch gewonnene Befunde | |
Die wichtigste Behandlungsmaßnahme ist die operative Entfernung des Tumors, möglichst vollständig, mit einem Sicherheitsabstand von 5 cm beim intestinalen Typ bzw. 8 cm beim diffusen Typ. Daraus ergibt sich je nach Lokalisation eine teilweise (4/5) oder vollständige Magenentfernung, evtl. unter Mitnahme von Teilen der Speiseröhre oder des Zwölffingerdarmes. Eine 4/5 Resektion nach Billroth ist ausschließlich beim intestinalen Typ in Verbindung mit einer Lokalisation im untersten Teil des Magens, dem Antrum, möglich. In allen anderen Fällen muss bei Aussicht auf Heilung eine Gastrektomie mit einer nach Y-Roux ausgeschalteten Jejunalschlinge erfolgen. Die umgebenden Lymphknoten werden mitentfernt, bei Infiltration auch die Milz oder Teile der Leber. Anschließend wird das verbleibende Magen- oder Speiseröhrenende wieder mit dem Zwölffingerdarm verbunden (Operationstechnik nach Billroth I oder II).
Lokale Abtragung bzw. endoskopische Resektion
Falls ein Magenkarzinom nur auf die Schleimhaut begrenzt ist („Mukosakarzinom“ im Stadium T1aN0M0, dies lässt sich mit hoher Sicherheit durch die endosonografische Untersuchung feststellen) besteht die Therapie aus einer lokalen endoskopischen Abtragung. Zwei verschiedene Techniken finden hier Anwendung: die endoskopische Mukosaresektion (EMR), bei der die Läsion zunächst mit steriler Kochsalzlösung unterspritzt und anschließend mit einer Schlinge abgetragen wird, oder die endoskopische submukosale Dissektion (ESD), bei der die Läsion mikrochirurgisch abgetragen wird. Letztere hat den Vorteil, dass die Läsion en bloc abgetragen werden kann, was die spätere histopathologische Beurteilung erleichtert. Allerdings ist die ESD wohl auch mit etwas höheren Komplikationsraten verbunden.[14]
Neoadjuvante Chemotherapie
In den operablen Stadien T1b, T2, T3, T4 ist eine endoskopische Abtragung nicht mehr möglich oder sinnvoll. Stattdessen soll eine Operation (komplette oder partielle Gastrektomie) mit sogenannter Lymphknotendissektion (Mitentfernung der ableitenden Lymphwege mit Lymphstationen) erfolgen.
Bei den operablen Magenkarzinomen im Stadium T3 oder T4 empfehlen die deutschen Leitlinien grundsätzlich die Durchführung einer neoadjuvanten Chemotherapie, d. h. einer Chemotherapie vor der Operation um den Tumor zu verkleinern und damit das Operationsergebnis zu verbessern. Zwei große Therapiestudien haben einen Überlebensvorteil für derartig behandelten im Vergleich zu chemotherapeutisch unbehandelten Patienten gezeigt, zum einen die britische MAGIC-Studie, bei der Patienten mit einer Kombination aus Epirubicin, Cisplatin und Fluorouracil („ECF“) behandelt wurden,[15] zum anderen die französische FNCLCC/FFCD-Studie, bei der die Patienten Cisplatin und Fluorouracil erhielten.[16] Statt Fluorouracil und Cisplatin werden wegen besserer Verträglichkeit heute vielfach Capecitabin und Oxaliplatin genommen. Eine weitere vielversprechende Kombination ist Docetaxel – Oxaliplatin – Fluorouracil.[14]
Adjuvante Chemotherapie oder Radiochemotherapie
Der Stellenwert einer adjuvanten Chemotherapie oder Radiochemotherapie (d. h. Chemotherapie evtl. kombiniert mit Strahlentherapie nach der erfolgten Operation) wird zurzeit noch unterschiedlich beurteilt. Nach deutschen Leitlinien (Stand 15. Dezember 2012)[17] wird im Allgemeinen keine adjuvante Therapie empfohlen. Einzige Ausnahme bildet die Situation, wenn der Tumor nicht komplett operativ entfernt werden konnte. In asiatischen Ländern wird das anders beurteilt und gehandhabt und eine adjuvante Therapie vielfach durchgeführt, z. B. mit Capecitabin und Oxaliplatin.[14]
Palliative Therapie
Falls der Tumor primär inoperabel ist (z. B. weil er in der Nähe großer Blutgefäße liegt, „lokal fortgeschrittenes Karzinom“) oder mehrere Fernmetastasen zeigt, ist in der Regel keine Heilung mehr möglich. Die Therapie erfolgt dann nicht mehr mit kurativer („heilender“), sondern mit palliativer („lindernder“) Zielsetzung. Mit den o. g. Chemotherapeutika lässt sich in den meisten Fällen eine Beschwerdelinderung und Verlängerung der Überlebenszeit erreichen. Falls der Tumor histopathologisch HER2-positiv ist, sollte wenn möglich Trastuzumab (Herceptin®) zum Einsatz kommen.[18]
Rehabilitation
Nach einer Voll- oder Teilentfernung des Magens kann es bei den Patienten zu verschiedenen Störungen kommen, welche eigene Maßnahmen zur Erhöhung der Lebensqualität des Patienten nach der Operation benötigen. So führt das totale oder teilweise Entfernen des Magens zu einer schnelleren Passage der Nahrung in den Dünndarm. Dadurch kann ein Dumping-Syndrom entstehen, welches beim Patienten zu einer osmotischen Schwellung des Dünndarms und vasomotorischen Störungen mit Blutdruckabfall bis zur Synkope direkt nach der Nahrungsaufnahme führen kann. Dies wird als Frühdumping bezeichnet. Die andere Seite des Krankheitsbilds, das sogenannte Spätdumping, beruht darauf, dass leicht verdauliche kohlenhydratreiche Nahrung zu schnell resorbiert wird. Dies führt zu einem zu hohen Blutzucker, den der Körper durch eine überschießende Ausschüttung von Insulin zu beherrschen versucht. Da aber meist zu viel Insulin ausgeschüttet wird, kommt es einige Stunden nach der Nahrung zur Unterzuckerung, was für den Patienten sehr belastend ist. Das Dumpingsyndrom kann durch diätetische Maßnahmen wie kleinere, aber häufigere Mahlzeiten, das Vermeiden von Flüssigkeitsaufnahme mit dem Essen oder Liegen nach den Mahlzeiten gebessert werden.[19]
Nach einer teilweisen Magenentfernung kann sich eine Refluxösophagitis ausbilden, wenn proximale Teile des Magens entfernt wurden. Ebenso kann basisches Duodenalsekret in den Restmagen oder die Speiseröhre gelangen und dort Schmerzen, Übelkeit oder eine chronische Entzündung auslösen. Diese Probleme können durch Hochlagern des Bettkopfendes oder auch durch medikamentöse Behandlung behoben werden.[19] Auch die Fettverdauung kann den Patienten Probleme bereiten, da die Nahrung nicht mehr im Magen gespeichert werden kann und somit die Zeit sinkt, welche die Bauchspeicheldrüse für die Sekretion von Fett verdauenden Enzymen hat. Als Therapie kann der Fettanteil der Nahrung reduziert werden; auch können die Enzyme exogen zugeführt werden. Bei vielen Patienten treten Malassimilationssyndrome auf, bei denen Nahrungsmittelbestandteile nicht in ausreichendem Umfang verdaut oder resorbiert werden können. Deshalb ist der Patient auf eine ausreichende Kalorienzufuhr und eine ausreichende Zufuhr von Vitaminen und Mineralstoffen hinzuweisen und entsprechend zu schulen. Ebenso entwickeln fast alle Patienten mit einer vollständigen Magenentfernung einen Mangel an Vitamin B12. Dieser verursacht mit einer Latenz von drei bis fünf Jahren eine Anämie. Infolgedessen ist bei jedem Patienten eine Substitution des Vitamins indiziert. Ebenso treten bei Patienten nach der Operation Störungen des Knochenstoffwechsels auf, die Osteoporose sehr stark begünstigen. Einerseits wird dies auf verminderte Kalziumaufnahme zurückgeführt, da die meisten Patienten nach der Operation keine Milchprodukte mehr vertragen. Andererseits findet sich häufig ein Vitamin-D-Mangel. Kalzium und Vitamin D können exogen zugeführt werden. Darüber hinaus stellen die Krebserkrankung und der operative Eingriff für die Patienten in der Regel eine starke psychische Belastung dar. Die Fähigkeit des Patienten, mit seiner Erkrankung umzugehen, sollte infolgedessen wenn nötig durch psychologische Betreuung unterstützt werden.[19]
Nachsorge
Es konnte bisher nicht gezeigt werden, dass Nachsorgeuntersuchungen zu einer Früherkennung von Rezidiven und damit zu einem besseren Überleben führen. Deswegen sind die Empfehlungen zur spezifischen Nachsorge in den aktuellen Leitlinien zurückhaltend.[17] Es werden dort keine routinemäßigen diagnostischen Untersuchungen wie z. B. Magenspiegelung, Sonografie, Thorax-Röntgen oder gar Computer-Tomografie empfohlen. Etwas anderes ist es natürlich, wenn der in Nachsorge befindliche Patient spezifische Beschwerden hat, die durch ein Rezidiv verursacht sein könnten. Hier muss dann natürlich entsprechende Diagnostik durchgeführt werden, wobei allerdings die Prognose von Patienten mit einem symptomatischen (= Beschwerden verursachenden) Rezidiv als generell schlecht gilt.[14]
Vorbeugung
Da das Ernährungsprofil viele Risikofaktoren abdeckt, andererseits auch die protektive Wirkung von Obst und Gemüse bekannt ist, sollten ungesunde Essgewohnheiten grundsätzlich umgestellt werden. Vor allem häufiger Verzehr von Fleisch und gepökelter Nahrung sollte reduziert werden. Raucherentwöhnung ist der Gesundheit prinzipiell zuträglich.
Bei nachgewiesenem Befall mit Helicobacter pylori ist deren Eradikation (medikamentöse Beseitigung) anzustreben. Sollte Magenkrebs in der Familie verbreitet sein oder eine chronische Gastritis vorliegen, empfiehlt sich eine regelmäßige Magenspiegelung.
Beim Deutschen Krebsforschungszentrum geht man davon aus, dass der registrierte Rückgang (zwischen 1977 und 1997 um rund ein Viertel) der Magenkrebserkrankungen auf die massenhafte Verbreitung von Kühlschränken und die ganzjährige Bereitstellung von frischem Obst und Gemüse und einem damit verbundenen Rückgang der Konservierung mittels Pökeln und Räuchern zurückzuführen ist.
Je früher der Magentumor erkannt wird, desto erfolgreicher kann er behandelt werden.
Prognose
Da Magenkrebs in der Regel erst in weit fortgeschrittenen Stadien diagnostiziert wird (70 % aller Fälle werden in Tumorstadien III und IV erkannt), ist die Sterberate insgesamt relativ hoch. Bei frühzeitiger Erkennung (Stadium I) beträgt die 5-Jahresüberlebensrate 65 bis 80 %, bei fortgeschrittenen Krebsstadien sinkt sie dramatisch. Für den westeuropäischen Raum betragen die 5-Jahresüberlebensraten nach Sammelstatistiken 65 % im Stadium I, 22 % im Stadium II und 5 % im Stadium III. Im Tumorstadium IV ist eine 5-Jahres-Überlebenszeit nicht zu erwarten.[20] Sollte man die ersten fünf Jahre überleben, besteht eine 50- bis 90-prozentige Chance auf dauerhafte Heilung.
Literatur
- Die Blauen Ratgeber. Nr. 7: Magenkrebs, Deutsche Krebshilfe und Deutsche Krebsgesellschaft, Januar 2014.
- M. Moehler, S.-E. Al-Batran u. a.: S3-Leitlinie Magenkarzinom In: Zeitschrift für Gastroenterologie. 49, 2011, S. 461–531, doi:10.1055/s-0031-1273201.
- S3-Leitlinie Magenkarzinom – Diagnostik und Therapie der Adenokarzinome des Magens und ösophagogastralen Übergangs der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Krebsgesellschaft (DKG). In: AWMF online
- Hans-Joachim Meyer, Hansjochen Wilke: Behandlungsstrategien beim Magenkarzinom. In: Dtsch Arztebl Int. Nr. 108(41), 2011, S. 698–706 (Übersichtsarbeit).
Weblinks
- Magenkrebs: Symptome, Untersuchungsverfahren, Therapie und Nachsorge – Informationen für Patienten, Angehörige und Interessierte. Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 20. September 2013; abgerufen am 4. September 2014.
- Magenkarzinom-Bildergalerie
- Zentrum für Krebsregisterdaten im Robert Koch-Institut
Einzelnachweise
- Chen Liu, James Crawford: The Gastrointestinal Tract. In: Vinag Kumar, Abul Abbas, Nelson Fausto (Hrsg.): Pathologic Basis of Disease. 7. Auflage. Philadelphia 2005, S. 823–826.
- C. Thomas: Histopathologie. Stuttgart, 2006, S. 139.
- Deutsche Krebshilfe, aktuelle Statistik 2013.
- J. M. Noto, J. A. Gaddy u. a.: Iron deficiency accelerates Helicobacter pylori-induced carcinogenesis in rodents and humans. In: The Journal of clinical investigation. Band 123, Nummer 1, Januar 2013, S. 479–492, ISSN 1558-8238. doi:10.1172/JCI64373. PMID 23257361. PMC 3533289 (freier Volltext).
- Robert Mayer: Gastrointestinal Tract Cancer. In: Anthony Fauci u. a. (Hrsg.): Harrison’s Principles of Internal Medicine. Band 1, New York 2008, S. 571–573.
- Frank Mitros, Emanuel Rubin: The Gastrointestinal Tract. In: Raphael Rubin, David Strayer u. a. (Hrsg.): Rubin’s Pathology. 5. Auflage. Philadelphia 2008, S. 569.
- Abgewandelt zitiert nach: Was schützt vor Krebs und Diabetes? In: MMW-Fortschr. Med. Nr. 24 / 2007 (149. Jg.), S. 16, dort zitiert nach EPIC-Symposium, Berlin, 25. April 2007.
- Ch. Englisch-Fritz u. a.: Diagnostik beim Magenkarzinom. In: Der Onkologe. 14, 2008, S. 332–338.
- C. Thomas: Histopathologie. Stuttgart 2006, S. 139.
- Frank Mitros, Emanuel Rubin: The Gastrointestinal Tract. In: Raphael Rubin, David Strayer u. a. (Hrsg.): Rubin’s Pathology. 5. Auflage. Philadelphia 2008, S. 571.
- The Cancer Genome Atlas Research Group: Comprehensive molecular characterization of gastric adenocarcinoma. In: Nature 2014; Band 513: S. 202–209 doi:10.1038/nature13480
- Julia Borsch: Hoffnungsträger Avelumab erreicht Endpunkt nicht. In: deutsche-apotheker-zeitung.de. 29. November 2017, abgerufen am 26. Juni 2019.
- K. Washington: 7th edition of the AJCC cancer staging manual: stomach. In: Ann Surg Oncol. 17, 2010, S. 3077–3079.
- G. Woeste, Salah-Eddin Al-Batran, J. Albert, J. Trojan: Diagnostik und Therapie des Magenkarzinoms. In: Onkologe. 2014; 20, S. 1139–1152. doi:10.1007/s00761-014-2792-1
- D. Cunningham, W. H. Allum, S. P. Stenning, J. N. Thompson, C. J. Van de Velde, M. Nicolson, J. H. Scarffe, F. J. Lofts, S. J. Falk, T. J. Iveson, D. B. Smith, R. E. Langley, M. Verma, S. Weeden, Y. J. Chua, MAGIC Trial Participants: Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. In: N Engl J Med. 2006;355(1), S. 11–20. PMID 16822992. doi:10.1056/NEJMoa055531
- M. Ychou, V. Boige, J. P. Pignon, T. Conroy, O. Bouché, G. Lebreton, M. Ducourtieux, L. Bedenne, J. M. Fabre, B. Saint-Aubert, J. Genève, P. Lasser, P. Rougier: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. In: J Clin Oncol. 2011;29(13), S. 1715–1721. PMID 21444866. doi:10.1200/JCO.2010.33.0597
- Magenkarzinom - Diagnostik und Therapie der Adenokarzinome des Magens und ösophagogastralen Übergangs. AWMF online, abgerufen am 8. Dezember 2014 (Stand der Leitlinie:15. Dezember 2012, zum Zeitpunkt des Abrufs Gültigkeit bis zum 31. Dezember 2015).
- Y. J. Bang, E. Van-Cutsem, A. Feyereislova, H. C. Chung, L. Shen, A. Sawaki, F. Lordick, A. Ohtsu, Y. Omuro, T. Satoh, G. Aprile, E. Kulikov, J. Hill, M. Lehle, J. Rüschoff, Y. K. Kang; ToGA Trial Investigators: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. In: Lancet. 2010;376(9742), S. 687–697. PMID 20728210. doi:10.1016/S0140-6736(10)61121-X.
- H. Delbrück, H. Wilke: Rehabilitation von Patienten mit Magenkarzinomen. In: Der Onkologe. 6, 2000, S. 6–13.
- Leitlinie Magenkarzinom (Memento vom 13. Juli 2015 im Internet Archive) (PDF)