Blasenkrebs
Als Blasenkrebs (Blasenkarzinom) werden allgemein von der Harnblase ausgehende bösartige Geschwülste (bösartige Tumoren) bezeichnet. Als ursächlich für die Entstehung von Blasenkrebs gelten chronische Entzündungen (einschließlich Parasiteninfektionen), Tabakkonsum, die Aufnahme bestimmter chemischer Substanzen (beispielsweise aromatische Amine wie 2-Naphthylamin), Strahlenexposition und abwehrunterdrückende Medikamente. Behandelt wird der Harnblasenkrebs je nach Ausdehnung mit einer transurethralen Resektion der Harnblase (TUR-B), der kompletten Entfernung der Blase, einer lokalen Chemotherapie oder auch einer Strahlentherapie in Kombination mit einer systemischen Chemotherapie. Die Heilungsaussichten sind bei früh entdecktem Krebsleiden gut, bei bereits ausgedehnter Erkrankung mit Metastasen jedoch gering.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| C67 | Bösartige Neubildung der Harnblase |
| D09.0 | Carcinoma in situ der Harnblase |
| ICD-10 online (WHO-Version 2019) | |
Häufigkeit (Epidemiologie)
Das Blasenkarzinom gilt (Stand vor 2006) insgesamt als die fünfthäufigste bösartige Tumorerkrankung des Menschen. Das Risiko für Männer, an Blasenkrebs zu erkranken, ist rund dreimal so hoch wie das Risiko von Frauen. Blasenkarzinome sind der fünfhäufigste Tumor bei Männern und der zehnthäufigste bei Frauen. In der Bundesrepublik Deutschland treten pro Jahr rund 30.000 neue Fälle von Blasenkrebs auf.[2][3]
| Inzidenz | Männer | Frauen |
| Neuerkrankungen nur invasive Tumoren | 12.220 | 4.250 |
| mit Vorstufen auch nichtinvasiven papillären Karzinomen und in situ Tumoren | 22.760 | 7.220 |
| rohe Erkrankungsrate | 30,1 | 10,2 |
| standardisierte Erkrankungsrate | 18,4 | 5,0 |
| medianes Erkrankungsalter | 74 | 77 |
Anmerkungen: die rohe Erkrankungsrate gibt die jährliche Anzahl neuer Erkrankungen pro 100.000 Einwohner an. Die standardisierte Erkrankungsrate berücksichtigt das Alter der Erkrankten und setzt sie im Verhältnis zu einer europäischen Altersverteilung der Bevölkerung. Die Tabelle zeigt, dass ein großer Anteil der Vorstufen nie in ein invasives Karzinom übergeht. Das liegt an der langsamen Entwicklung der Krebsvorstufen und dem hohen medianen Erkrankungsalter der Patienten, die vor dem Übergang in ein invasives Karzinom an anderen Erkrankungen sterben.
Das Durchschnittsalter des Auftretens variiert je nach Quelle,[4] in Deutschland für Frauen bei 77 Jahren, für Männer bei 74 Jahren (Stand 2016).[2] Erkrankungen bei Patienten jünger als 50 Jahre sind selten.[5] In Industrieländern ist Harnblasenkrebs rund sechsmal häufiger als in Entwicklungsländern,[6] die Häufigkeit der Erkrankung stieg während des 20. Jahrhunderts insgesamt an. Bei der Erstdiagnose wird zu rund 75 % ein oberflächliches Karzinom gefunden. In 20 % der Fälle ist es bereits invasiv und in 5 % liegen schon Metastasen vor.[4] Harnblasenkrebs tritt dabei oft gleichzeitig an verschiedenen Stellen innerhalb der Blase auf. Nach erfolgreicher Heilung tritt der Tumor häufig wieder auf (Rezidiv).[5]
Ursachen
Aromatische Amine
Der Kontakt zu aromatischen Aminen (2-Naphthylamin, Benzidin) ist der am längsten bekannte Risikofaktor. In zahlreichen Berufen ist der Kontakt zu solchen krebsverursachenden Stoffen möglich und Blasenkrebs als Berufskrankheit anerkannt. Dazu zählen Arbeiter in der Chemie-, Stahl- und Lederindustrie, Automechaniker sowie Zahntechniker und Friseure. Die aromatischen Amine werden in der Leber durch Kopplung mit Hydroxygruppen und Glucuronsäure wasserlöslich gemacht, damit der Körper sie im Urin ausscheiden kann. Dabei entwickeln sie allerdings eine krebserregende Potenz. Aromatische Amine können durch das Enzym N-Acetyltransferase inaktiviert werden. Dabei haben einige Menschen, bei denen aufgrund eines genetischen Polymorphismus eine höhere Aktivität des Enzyms entsteht, ein geringeres Risiko, an Harnblasenkrebs zu erkranken.[4] Laut einer spanischen Studie sind diese Polymorphismen so weit verbreitet, dass sie bei rund 31 % der Blasenkrebserkrankungen eine Rolle spielen könnten.[7]
Tabakrauchen
Tabakrauchen ist der wichtigste Risikofaktor für Blasenkrebs, was in der Öffentlichkeit nicht allgemein bekannt ist. In einer Befragung urologischer Patienten gaben zwar fast alle einen Zusammenhang zwischen Rauchen und Lungenkrebs an, aber nur 34 % wussten, dass Blasenkrebs durch Rauchen verursacht werden kann.[5][8] Die Menge der insgesamt konsumierten Tabakprodukte korreliert dabei linear mit dem Risiko, an einem Harnblasenkarzinom zu erkranken. Es erhöht sich je nach Konsumverhalten und -dauer um das Zwei- bis Sechsfache. Als Ursache wird das Vorkommen aromatischer Amine wie des 2-Naphthylamin im Rauch angesehen.[4] Ob das Beenden eines Nikotinmissbrauchs nach dem Auftreten des Krebses die Prognose der Erkrankung verbessern oder ein Wiederauftreten verhindern kann, ist bisher (2002) noch nicht abschließend geklärt.[9]
Laut einer Studie aus dem Jahr 2011 ist Tabakrauchen bei Männern für 50 Prozent und bei Frauen für 52 Prozent aller Blasenkrebserkrankungen verantwortlich. Für aktive Raucher wurde ein 4-fach erhöhtes, für ehemalige Raucher ein 2,2-fach erhöhtes Risiko einer Erkrankung errechnet.[10]
Chronische Entzündungen
Chronische Entzündungen im Bereich der Blase erhöhen ebenso das Risiko für eine bösartige Neubildung. Dazu zählen langjährige Blasensteinleiden und chronische Harnwegsinfekte. In Afrika und Teilen der arabischen Welt ist die durch Parasiten ausgelöste Schistosomiasis ein wichtiger Risikofaktor für das Entstehen von Blasenkrebs. Durch Entzündungen ausgelöste Karzinome sind in der Regel Plattenepithelkarzinome. Als Ursache wird eine Bildung von Nitrosaminen im Rahmen der Entzündungsreaktion angenommen.[4]
Bestrahlung
Ebenso ist eine Strahlentherapie im Beckenbereich ein Risikofaktor für ein Blasenkarzinom.[4][11]
Medikamente
Weitere iatrogene Risikofaktoren stellen einige Medikamente dar. Chlornaphazin, ein Mittel zur Behandlung der Polycythaemia vera, und Phenacetin, ein Schmerzmedikament, fördern die Bildung von Harnblasenkrebs. Der erstgenannte Wirkstoff ist seit 1963 nicht mehr im Handel,[4] der zweitgenannte wurde 1983 vom Markt genommen. Als weiteres Medikament kann das Immunsuppressivum Cyclophosphamid eine hämorrhagische Zystitis auslösen und dadurch Blasenkrebs begünstigen. Bei korrekter Anwendung zusammen mit dem Wirkstoff Mesna ist das Krebsrisiko allerdings vernachlässigbar gering.[4] Das Zytostatikum Chlornaphazin, welches bis 1963 bei der Behandlung der Polycythaemia vera eingesetzt wurde, löste bei rund einem Drittel der behandelten Patienten Harnblasenkarzinome aus.[12]
Auch das orale Antidiabetikum Pioglitazon steht im Verdacht, Blasenkrebs auslösen zu können. Die US-amerikanische Food and Drug Administration veröffentlichte 2011 und 2016 aktualisierte Sicherheitsinformationen, die auf das potentielle Risiko hinweisen.[13][14][15][16]
Süßungsmittel
Künstliche Süßungsmittel wie Saccharin und Cyclamat haben in Tierversuchen nachweislich das Auftreten von Harnblasenkrebs erhöht. Die Wirkung beim Menschen ist umstritten, da die Mehrheit der Studien am Menschen diesen Effekt nicht nachgewiesen hat. Zudem sind die Studien im Tierversuch insoweit nicht relevant, als die Substanzen mit einer Kanüle direkt in die Blase injiziert wurden. Die beobachteten Tumoren sind eher mit der Penetration der Nadeln zu assoziieren als mit dem Süßungsmittel.[17] Auch zum Konsum von Kaffee ist die Forschungslage bisher nicht eindeutig.[4]
Wasser
Eine spanische Fallkontrollstudie kam zu dem Ergebnis, dass chloriertes Wasser das Risiko für Blasenkrebs erhöhe. Demnach haben Menschen, die chloriertes Wasser tranken, ein um 35 Prozent erhöhtes Risiko auf Blasenkrebs. Schwimmen im Chlorwasser steigere die Gefahr sogar um 57 Prozent.[18] Studien mit großer Fallzahl aus der Volksrepublik China und der Republik China (Taiwan) kamen zu dem Ergebnis, dass Arsenkontaminationen im Trinkwasser das Risiko für Blasenkrebs steigerten.[6]
Ernährung
Statistisch hat ein hoher Gesamtverzehr von Obst einen leicht schützenden Effekt gegen Blasenkrebs. Der genaue Mechanismus, über den diese Schutzwirkung erfolgt, ist bisher aber noch nicht aufgeklärt. Ein schützender Effekt von Vitamin E wird in der Literatur debattiert, ist allerdings nicht belegt.[19]
Symptome
Das klassische Symptom des Blasenkrebses ist die Beimengung von Blut im Urin, ohne dass dabei Schmerzen auftreten. Dies kann mit dem bloßen Auge erkennbar sein (Makrohämaturie) oder auch nur im Labor bei einer Untersuchung des Urins auffällig werden (Mikrohämaturie). Der Tumor kann in seltenen Fällen auch Schmerzen verursachen, wenn durch geronnenes Blut die Harnröhre verstopft wird. Im Spätstadium kann es durch einen großen Tumor zu einem Harnstau oder einer Nierenstauung kommen (wenn der Tumor den Blasenaus- oder -eingang verlegt) und damit verbunden zu Schmerzen im Bereich der Harnblase oder den Flanken führen. Falls Knochenmetastasen vorliegen, machen sich diese häufig durch Schmerzen der betroffenen Skelettanteile bemerkbar.[6]
Diagnostik
Erster Schritt in der Diagnostik ist ein Urinstatus. Hier kann auch eine mit dem bloßen Auge nicht sichtbare Blutbeimengung im Urin nachgewiesen werden. Die zytologische Untersuchung des Urins kann einen weiteren Hinweis auf Blasenkrebs liefern, insofern sich unter dem Mikroskop sichtbare entartete Zellen zeigen. Die Urinzytologie liefert vor allem bei fortgeschrittenen und schwer entarteten Tumoren einen positiven Befund. Bei gut differenzierten Tumoren ist oft eine Unterscheidung zu entzündlichen Veränderungen schwierig. Eine negative Zytologie schließt einen Blasenkrebs nicht aus. Es befinden sich verschiedene Markersysteme in Entwicklung, welche über den Nachweis von tumorspezifischen Molekülen im Urin eine Diagnose ermöglichen sollen.[20] Aufgrund der Unsicherheit dieser Tests sollten diese weder in der Früherkennung noch in der Erfolgskontrolle der Behandlung eingesetzt werden.[21]
Eine Ultraschalluntersuchung kann Raumforderungen der Harnblase nachweisen und somit einen Hinweis auf Blasenkrebs liefern. Ebenso können dadurch von einem eventuellen Tumor ausgelöste Veränderungen der Nieren oder der ableitenden Harnwege sichtbar gemacht werden. Die Ultraschalluntersuchung kann jedoch keine endgültige Diagnose liefern.[20]
Der Goldstandard zur Diagnostik des Blasenkrebses ist die Blasenspiegelung. Dabei wird über die Harnröhre die Blase mittels eines Endoskops untersucht. Auffällige Bereiche können biopsiert werden. Die feingewebliche Untersuchung liefert die endgültige Diagnose. Bei auffälligen Befunden kann auch direkt eine Behandlung im Sinne einer Entfernung durch die Harnröhre durchgeführt werden. Konventionell erfolgt die Untersuchung mit Weißlicht. Durch die photodynamische Diagnostik können auffällige Gewebsareale besser dargestellt werden. Dabei wird Aminolävulinsäure oder Hypericin in die Blase instilliert und die Schleimhaut mit Blaulicht untersucht. Diese Stoffe färben die Schleimhaut und machen zusätzlich auffällige Areal sichtbar. Dabei werden aber auch oft entzündliche Areale als auffällig angefärbt.[20] Die photodynamische Diagnostik sollte bei positiver Urinzytologie aber fehlendem Nachweis eines Tumors in der konventionellen Untersuchung durchgeführt werden.[22]
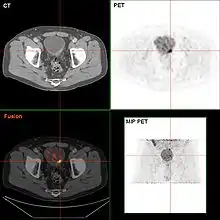
Bei Vorhandensein eines Tumors können eine Computertomographie oder eine Magnetresonanztomographie über die Ausdehnung des Tumors in Nachbarorgane oder das der Blase anliegende Fettgewebe sowie Aussagen über Lungen-, Lymphknoten- und Knochenmetastasen liefern. In speziellen Fragestellungen kann die Bildgebung auch durch den Nachweis von Stoffwechselaktivität mittels Positronen-Emissions-Tomographie ergänzt werden.[20]
Klassifikation
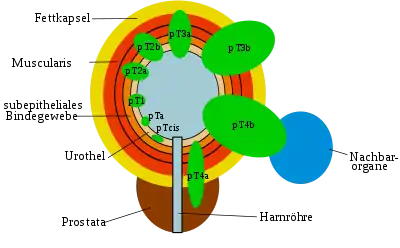
Die Einordnung von Schleimhauttumoren folgt nach der TNM-Klassifikation. Das Blasenkarzinom stellt hierbei keine Ausnahme dar. Die Klassifikation ist in der folgenden Tabelle grob umrissen:
| T | Ta | Nicht invasives papilläres Carcinoma in situ des Urothels |
| Tcis | Nicht invasives Carcinoma in situ | |
| T1 | Einwachsen unter die Schleimhaut in das submuköse Bindegewebe (Unterformen: T1a: oberhalb der Schleimhautmuskelschicht; T1b: unterhalb der Schleimhautmuskelschicht) | |
| T2 | Einwachsen in die Muskelschicht der Harnblase (Unterformen: T2a: innere Hälfte, T2b: bis in die äußere Hälfte) | |
| T3 | Hinauswachsen über die Muskelschicht der Harnblase (Unterformen: T3a: nur mikroskopisch erkennbar, T3b: mit dem bloßen Auge sichtbar) | |
| T4 | Einwachsen in Nachbarorgane (Unterformen: T4a: Prostata, Gebärmutter, Scheide, T4b: Becken- oder Bauchwand) | |
| N | N0 | Keine lokalen Lymphknoten befallen |
| N1 | Einzelner befallener Lymphknoten kleiner als 2 cm | |
| N2 | einzelner Lymphknoten von 2 bis 5 cm Durchmesser oder mehrere befallene Lymphknoten < 5 cm | |
| N3 | Lymphknoten über 5 cm | |
| M | M0 | Keine Fernmetastasen nachgewiesen |
| M1 | Fernmetastasen nachgewiesen (Unterformen: M1a: Metastasen in nichtregionalen Lymphknoten; M1b: sonstige Fernmetastasen) |
| Stadium 0a | Ta | N0 | M0 |
| Stadium 0is | Tis | N0 | M0 |
| Stadium I | T1 | N0 | M0 |
| Stadium II | T2a oder T2b | N0 | M0 |
| Stadium IIIA | T3a oder T3b oder T4a | N0 | M0 |
| T1-T4a | N1 | M0 | |
| Stadium IIIB | T1-T4a | N2 oder N3 | M0 |
| Stadium IVA | T4b | beliebiges N | M0 |
| beliebiges T | beliebiges N | M1a | |
| Stadium IVB | beliebiges T | beliebiges N | M1b |
Neben der Klassifikation der Ausdehnung des Tumors wird im Rahmen einer feingeweblichen Untersuchung auch ein Grading durchgeführt. Seit 2004 umfasst das Grading laut den Kriterien der WHO nur noch zwei Möglichkeiten, entweder High- oder Low-grade. Low-grade-Karzinome sind dabei besser differenziert und haben eine bessere Prognose als High-grade Karzinome mit vielen Atypien. Es zählt beim Grading jeweils der am schlechtesten differenzierte Anteil des Tumors unabhängig von seinem Anteil am Gesamttumor.[23] Daneben ist im deutschsprachigen Raum eine Einteilung verbreitet, welche die Tumoren von G1 bis G3 nach dem Differenzierungsgrad einteilt. Dabei stellt G1 einen relativ wenig atypischen Tumor und G3 einen sehr schlecht differenzierten Tumor dar. G2 liegt zwischen diesen beiden Extremen.[4]
Pathologie
_at_trigone.jpg.webp)
Der häufigste in der Harnblase vorkommende bösartige Tumor ist das vom Urothel der Harnblase ausgehende urotheliale Karzinom. Es können auch Plattenepithelkarzinome vorkommen. Diese entstehen auf der Basis einer Metaplasie des normalen Urothels zu Plattenepithel. Dieser Prozess wird durch die chronische Entzündung durch eine Schistosomiasis ausgelöst, die in Teilen Afrikas und der arabischen Welt endemisch ist. Sehr selten sind drüsige Adenokarzinome und neuroendokrine Karzinome. Ebenso sehr selten können sich auch von der Muskelschicht der Harnblase ausgehend Sarkome bilden.[5]
Makroskopie
Mit bloßem Auge lassen sich Harnblasentumoren makroskopisch in zwei Arten einteilen. Einerseits gibt es Tumoren, die sich flach über die Oberfläche des Organs (solide Tumoren) ausdehnen, andererseits solche, die warzenartig (papillär) in das Lumen der Harnblase einwachsen. Der Augenschein gibt dabei keinen Hinweis auf die Invasivität des Tumors.[25]
Histologie
Histologisch zeigt der häufigste Typ ein Urothelgewebe mit „krebstypischen“ Atypien. Die Zellkerne sind verändert, verstärkt angefärbt, sehen nicht gleich aus und sind in ihrer Polarität voneinander verschieden. In seiner Gesamtheit zeigt das Epithel eine Aufhebung der Schichtung und ein Fehlen der am Gesunden zu beobachteten Ausreifung von der unteren zur oberflächennahen Schicht. Die restlichen Typen zeichnen sich durch beim Gesunden nicht vorhandene Typen von Oberflächengewebe in der Harnblase aus, welches auch atypisch verändert ist.[5]
Das Eindringen des Tumors in tiefere Schichten der Harnblase findet meist in kleinen Zellgruppen statt. Diese sind häufig von einer Entzündungsreaktion aus Lymphozyten und Plasmazellen umgeben.[6]
Eine Sonderform des Urothelkarzinoms ist die „Nested-Variante“. Diese zeigt nur geringe Zellatypien und auch immunhistologisch keine besonderen Auffälligkeiten, wächst aber oft bösartig in das umgebende Gewebe ein. Erkennbar ist sie an der nestartigen Anordnung von Tumorzellen. Durch das vergleichsweise harmlose morphologische Erscheinungsbild kann die Diagnose erschwert werden, wenn die Invasion in tiefere Schichten nicht durch das Biopsatmaterial erfasst wird.[26]
Immunhistochemie
Die Deckzellen des Urothels bilden auch beim Gesunden Zytokeratin aus. Wie bei anderen Karzinomen ist auch bei Harnblasentumoren immunhistochemisch eine Expression von Zytokeratin nachweisbar.[23] Mit einem gegen das Protein Uroplakin gerichteten Antikörper kann der urotheliale Charakter des Tumors belegt werden.[27] Der Differenzierungsgrad und die eventuelle Malignität der Tumorzellen kann unter anderem durch eine Färbung mit dem Proliferationsmarker Ki-67 abgeschätzt werden, der in Teilung befindliche Zellen markiert. Je mehr Zellen sich in Teilung befinden, desto aggressiver verhält sich im Allgemeinen der Tumor.[28] Auch eine vermehrte Ansammlung von p53-Protein im Zellkern hat eine ungünstige prognostische Bedeutung.[29]
Molekularpathologie
Die bereits mit bloßem Auge getroffene Einteilung zwischen soliden und papillären Tumoren spiegelt sich auf genetischer Ebene wider. Die papillären Tumoren zeigen Veränderungen auf beiden Armen des Chromosoms 9. Die soliden Tumoren zeigen als genetische Hauptveränderung eine Mutation des Tumorsuppressorgens p53 auf Chromosom 17.[25]
Therapie
Behandlung des Tumors
Die Therapie erfolgt in Stadienabhängigkeit unter Berücksichtigung der Lebensumstände des Patienten (biologisches Alter, Komorbiditäten, Lebenserwartung) mit verschiedenen Methoden.
Das Carcinoma in situ kann durch die Instillation von Bacillus Calmette-Guérin (BCG) in die Blase behandelt werden. Dabei handelt es sich um attenuierte Tuberkuloseerreger. Diese lösen eine Entzündungsreaktion in der Harnblase aus, durch welche die Tumorzellen vernichtet werden können. Die Behandlung umfasst einen bis zwei Zyklen. Dabei stellt sich bei rund zwei Dritteln der Patienten ein langfristiger Erfolg ein. Mit drei und mehr Zyklen waren 2008 sogar 90,8 % nach 3 Jahren rückfallfrei.[30] Der Therapieerfolg sollte langfristig über die mikroskopische Untersuchung abgelöster Blasenzellen aus dem Urin erfolgen. Bei einem Rezidiv oder Therapieversagen ist eine operative Entfernung der Blase angezeigt.[4][31]
Oberflächliche Tumoren (pTaG1 bis pT1G2) werden durch eine TUR-B entfernt. Im Rahmen der Behandlung oberflächlicher Tumoren ist die Instillation von Chemotherapeutika, wie beispielsweise Mitomycin C, empfohlen. Diese sollte direkt nach der Operation erfolgen. Patienten mit einem schlechten Grading und Nachweis von atypischen Zellen in den initialen Zufallsbiopsien haben ein höheres Rezidivrisiko. Deshalb ist bei ihnen eine intensive Instillationstherapie durchzuführen, die sich je nach Therapieschema über mehrere Monate erstrecken kann.[4] Lebenslange Nachsorge mit endoskopischen und cytologischen Kontrollen ist obligat.
Einen Sonderfall stellt der pT1G3-Tumor dar. Der Tumor ist noch nicht muskelinvasiv, hat aber wegen seiner schlechten Differenzierung ein hohes Risiko der Metastasierung. Insbesondere bei Vorliegen eines Rezidivs ist die radikale Blasenentfernung die Methode der Wahl.[32]
Muskelinvasive Blasenkarzinome werden durch eine radikale Blasenentfernung behandelt. Ebenso werden nach Lokalbehandlung wiederaufgetretene Blasenkarzinomen ohne Einwachsen in den Muskel mit schwerer Entartung und endoskopisch nicht abtragbare Karzinome mit dieser Operation behandelt. Dabei müssen zahlreiche umliegende Organe oder Organteile mit entnommen werden, bei einer Frau zusätzlich die Gebärmutter, die Eierstöcke sowie Eileiter, bei Männern die Prostata und die Samenblase. Ebenso werden die Lymphknoten des Beckens mit entfernt. Ist die Harnröhre auch vom Tumor befallen, muss sie bei beiden Geschlechtern entfernt werden. Die Sterberate während des Eingriffs selbst bei optimaler Durchführung bei unter 3 %. Komplikationen treten bei der Operation häufig auf. So erleiden rund 60 % der Patienten eine oder mehrere Komplikationen. Häufige Komplikationen sind ein postoperativer Darmverschluss, Wund- und Harnwegsinfektionen bis zur Nierenbeckenentzündung, Lungenentzündungen, Tiefe Beinvenenthrombosen oder auch Komplikationen am Herzen.[33]
Bei Patienten bei denen der Blasenkrebs mit dem bloßen Auge sichtbar über die Muskelschicht hinaus fortschreitet oder bei Patienten mit gesicherten Lymphknotenmetastasen kann durch eine Chemotherapie vor der Operation ein Überlebensvorteil erzielt werden. Bei der gleichen Patientengruppe kann auch eine Chemotherapie nach der Operation erfolgen wenn diese vor der Operation nicht geboten erscheint. Eine Bestrahlung vor der Operation kann die Tumormasse reduzieren, zeigt aber keinen Überlebensvorteil. Bestrahlungen nach kurativer Operation werden nicht empfohlen.[33]
Als Alternative zur Radikaloperation kommt eine Strahlentherapie oder Radiochemotherapie in Betracht. Urothelkarzinome gehören zu den strahlenempfindlichen Tumoren und können mit gutem Erfolg mit Bestrahlung vernichtet werden. Die Strahlentherapie, evtl. in Kombination mit strahlenverstärkender Chemotherapie, erreicht gleiche Überlebensraten wie eine Radikaloperation, aber etwa 70 % aller Patienten können dadurch ihre Blase mit guter Blasenfunktion erhalten. Dies kann insbesondere bei Patienten, bei denen aufgrund Alter oder Vorerkrankungen eine Operation kritisch eingeschätzt werden muss, eine Alternative zu einem operativen Vorgehen darstellen.[34]
Metastasierte Harnblasenkarzinome werden standardmäßig mit einer Chemotherapie behandelt. Dabei gibt es unterschiedliche Therapieschemata, bei denen jeweils eine Kombination mehrerer Wirkstoffe verabreicht wird. Die verschiedenen Kombinationen unterscheiden sich dabei in ihrer Wirksamkeit wie in der Häufigkeit und dem Auftreten von Nebenwirkungen. Generell sind Cisplatinhaltige Therapieschemata zu bevorzugen, wenn keine Gegenanzeigen von Patientenseite vorliegen. Die Substanz sollte bei schlechtem Allgemeinzustand, einer eingeschränkten Nierenfunktion, einer peripheren Nervenschwäche, einer Schwerhörigkeit oder einer schwerergradigen Herzschwäche nicht eingesetzt werden. Für diese Patienten kommen alternative Chemotherapieschemata ohne Cisplatin in Betracht. Alternativ kommen für diese Patienten die Immuncheckpoint-Inhibitoren Atezolizumab oder Pembrolizumab in Betracht sofern der Tumor hierfür sensibel ist. Die Sensibilität des Tumors wird vom Vorhandensein des Oberflächenmoleküls PD-L1 bestimmt. In der Zweitlinientherapie kann auch der Immuncheckpoint-Inhibitor Nivolumab zum Einsatz kommen.[35]
In Einzelfällen kann auch die operative Entfernung einer Metastase sinnvoll sein.[36] Bei Patienten, bei denen aufgrund hohen Alters oder schlechten allgemeinen Gesundheitszustandes eine Blasenentfernung zu riskant erscheint, kann auch eine Chemotherapie durchgeführt werden. Die Überlebensrate und -zeit sind dabei geringer als bei operierten Patienten.[4]
Harnableitung nach Entfernung der Blase
Bei Patienten, deren Harnblase entfernt wurde (Zystektomie), gibt es mehrere Möglichkeiten, den Harn abzuleiten. Man unterscheidet kontinente und sogenannte nasse Ableitungen.
Eine Möglichkeit ist die Anlage einer Neoblase als Harnblasenersatz. Dazu wird ein ausgeschaltetes Dünndarmsegment (Ileum) zu einer Kugel vernäht und an die Harnleiter sowie an die Harnröhre angeschlossen. Da der Blasenschließmuskel bei der Blasenentfernung erhalten bleibt, sind die Patienten zu einem hohen Prozentsatz kontinent und scheiden den Urin wie gewohnt über die Harnröhre aus.[4]
Eine weitere Methode ist das Einpflanzen der Harnleiter in den unteren Abschnitt des Dickdarms (Colon sigmoideum) nach Coffey. Der Urin wird dann zusammen mit dem Stuhl über die Darmaustrittsöffnung (Kloake) ausgeschieden. Diese Methode ist weitgehend verlassen worden zugunsten der Mainz-Pouches. An der Verbindungsstelle zwischen Harnleiter und Darm kann nach rund einem Jahrzehnt eine Bildung von Karzinomen beobachtet werden.
Der Urin kann auch über einen künstlich geschaffenen Ausgang (Urostoma) in der Bauchwand abgeleitet werden. Dazu wird etwa ein sogenannter Ileum-Conduit angelegt: aus dem Dünndarm (Ileum) wird ein Segment entnommen, an die Harnleiter angeschlossen und mit dem Stoma verbunden. Auch eine Ersatzblase aus Darmanteilen kann über ein Stoma abgeleitet werden, sie wird dann als Pouch bezeichnet. Diese Methoden stellen eine Option für Patienten dar, denen im Rahmen der Operation auch die Harnröhre entfernt werden musste.[4]
Bei allen Ableitungen mit Darmsegmenten ist die Kontrolle des Säure-Base-Haushalts erforderlich, da durch Rückresorption von Urin eine Übersäuerung (Azidose) entstehen kann; gegebenenfalls ist eine Therapie der Azidose mit Bikarbonat angezeigt.
Die einfachste Form der Harnableitung ist die Harnleiter-Hautfistel. Hierbei werden die Harnleiter direkt in die Haut eingenäht. Der Vorteil besteht in einer geringeren Belastung durch die Blasenentfernung, da das Bauchfell nicht grundsätzlich eröffnet werden muss. Nachteilig ist die dauerhafte Schienung der Harnleiter mit regelmäßigen Schienenwechseln.
Prognose
Die Aussicht auf Heilung hängt sehr ab von der Ausdehnung des Tumors bei Behandlungsbeginn. Patienten im Stadium T1 haben eine 5-Jahres-Überlebensrate von rund 80 %. Im Stadium T2 fällt diese bereits auf circa 60 %, im Stadium T3 beträgt sie 30–50 %. Von den Patienten, bei denen ein T4-Tumor festgestellt wird, leben nach 5 Jahren trotz optimaler Therapie nur noch 20 %.[5] Weitere Faktoren für eine schlechte Prognose sind Lymphknotenmetastasen, Infiltration der Harnröhre, mehrere Tumorenorte innerhalb der Blase sowie eine Tumorgröße über drei Zentimeter.[6]
Berufskrankheit
1895 stellte der deutsche Chirurg Ludwig Rehn den Zusammenhang zwischen Tätigkeiten in der anilinverarbeitenden Industrie und der Entstehung von Blasenkrebs fest. Blasenkrebs gehört bei entsprechender Konstellation zu den anerkannten Berufskrankheiten. Das Hessische Landessozialgericht Darmstadt hat 2019 entschieden, dass bei einem Kfz-Mechaniker – als er 38 Jahre alt war, wurde bei ihm ein Blasentumor nach BK Nr. 1301 festgestellt – eine Berufskrankheit vorliegt, die die Berufsgenossenschaft finanziell zu entschädigen hat. Grundlegend für seine Erkrankung war der langjährige Kontakt mit giftigen Bleiverbindungen in Ottokraftstoffen. Zudem war der Mann Nichtraucher; üblicherweise hat Tabakkonsum bei Blasentumoren eine schädigende Wirkung. (Az. L 3 U 48/13) Eine Revision ließ das Gericht nicht zu.[37]
Medizingeschichte
Zunächst wurde als kurative Operation die einfache Blasenentfernung durchgeführt bei der die Nachbarorgane und die Beckenlymphknoten belassen wurde. Ab den 1950er Jahren etablierte sich die radikale Blasenentfernung da sie eine deutliche Steigerung des Überlebens der Patienten mit sich brachte. In den 1980er-Jahren entwickelte der US-amerikanische Chirurg D.G. Skinner diese durch eine noch genauere Technik der Lymphknotenentfernung weiter.[38]
In den 1950er Jahren entwickelten US-amerikanische Chirurgen die Ableitung des Urins über den Darm und erarbeiteten die Methode der Bildung einer Neoblase aus Darmanteilen.[39][40]
Literatur
- Maurice Stephan Michel, Joachim W. Thüroff, Günter Janetschek, Manfred Wirth (Hrsg.): Die Urologie – Retroperitoneum, Niere, Harnblase, Harnröhre, Tumortherapie. Heidelberg, 2016
- R. Rubin, D. Strayer u. a.: Rubin’s Pathology. 5. Auflage. Kluwer, Philadelphia 2008, ISBN 978-0-7817-9516-6. (englisch)
- J. A. Efstathiou u. a.: Bladder sparing approaches to invasive disease. In: World J Urol. Band 24, 2006, S. 517–529.
- C. Weiss u. a.: Radiochemotherapy with cisplatin and 5-fluorouracil after transurethral surgery in patients with bladder cancer. In: Int J radiat Oncol Biol Phys. Band 68, 2007, S. 1072–1080.
- Blasenkrebs Antworten. Hilfen. Perspektiven, Die blauen Ratgeber Nr. 18, Stiftung Deutsche Krebshilfe, Bonn 2016, ISSN 0946-4816.(Digitalisat)
Weblinks
- Kapitel über das Harnblasenkarzinom aus dem Online-Lehrbuch der Urologie für Ärzte und medizinisches Fachpersonal
- K. Golka u. a.: Ätiologie und Prävention des Harnblasenkarzinoms. Teil 1 der Serie zum Harnblasenkarzinom In: Deutsches Ärzteblatt. 104, Ausgabe 11 vom 16. März 2007, S. A-719.
- Behandlungsempfehlung Harnblasenkarzinom. Universitätsklinikum Essen, abgerufen am 1. Februar 2016.
- S3 -Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms der Deutsche Gesellschaft für Urologie e.V. (DGU) und der Deutsche Krebsgesellschaft (DKG) -> AWMF-Registernummer: 032-038OL – Version 2.0 vom März 2020. In: AWMF online
- Maike de Wit et al.: Blasenkarzinom (Urothelkarzinom). In: Onkopedia. März 2019, abgerufen am 29. Oktober 2020.
Einzelnachweise
- Dieter Jocham, Andreas Böhle: Systematische Chemotherapie beim Urothelkarzinom. Deutsches Ärzteblatt, 1996, abgerufen am 16. Oktober 2017.
- Krebs – Krebs in Deutschland 2015/2016 – Häufigkeiten und Trends. (PDF) Eine gemeinsame Veröffentlichung des Robert Koch-Instituts und der Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V., 2019, abgerufen am 29. Oktober 2020.
- Charité-Universitätsmedizin Berlin: Pressemitteilung. Abgerufen am 19. Januar 2021.
- Hartwig Huland, M. G. Friedrich: Harnblasenkarzinom. In: Richard Hautmann, Hartwig Huland: Urologie. 3. Auflage. Heidelberg 2006, S. 202–212.
- Ivan Damyanov: The Lower Urinary Tract and Male Reproductive System. In: R. Rubin, D. Strayer u. a.: Rubin’s Pathology. 5. Auflage. Philadelphia 2008, S. 752–758.
- J. N. Eble, G. Sauter, J. I. Epstein, I. A. Sesterkenn (Hrsg.): World Health Organization Classification of Tumours – Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. Lyon 2004, S. 90–108.
- Montserrat García-Closas et al.: NAT2 slow acetylation, GSTM1 null genotype, and risk of bladder cancer: results from the Spanish Bladder Cancer Study and meta-analyses. In: Lancet (London, England). Band 366, Nr. 9486, August 2005, S. 649–659, doi:10.1016/S0140-6736(05)67137-1, PMID 16112301, PMC 1459966 (freier Volltext).
- A. M. Nieder, S. John, C. R. Messina, I. A. Granek, H. L. Adler: Are patients aware of the association between smoking and bladder cancer? In: J Urol. Band 176, 2006, S. 2405–2408. PMID 17085114.
- P. Aveyard et al.: Does smoking status influence the prognosis of bladder cancer? A systematic review. In: BJU international. Band 90, Nr. 3, August 2002, S. 228–239, doi:10.1046/j.1464-410x.2002.02880.x, PMID 12133057.
- rme/aerzteblatt.de: Rauchen erklärt die Hälfte aller Blasenkrebserkrankungen. (Nicht mehr online verfügbar.) In: aerzteblatt.de. 17. August 2011, archiviert vom Original am 24. April 2015; abgerufen am 2. Februar 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Klaus Golka et al.: Ätiologie und Prävention des Harnblasenkarzinoms. In: Deutsches Ärzteblatt. 16. März 2007, abgerufen am 4. April 2020.
- D. Schmähl: Iatrogenic carcinogenesis. In: Journal of Cancer Research and Clinical Oncology. Band 99, Nr. 1-2, 1981, S. 71–75, doi:10.1007/bf00412444, PMID 7251640.
- FDA Safety Alerts: FDA Drug Safety Communication: Update to ongoing safety review of Actos (pioglitazone) and increased risk of bladder cancer.
- FDA Drug Safety Communication: Updated FDA review concludes that use of type 2 diabetes medicine pioglitazone may be linked to an increased risk of bladder cancer. FDA, 12. Dezember 2016, abgerufen am 17. Oktober 2017 (englisch).
- Deutsches Ärzteblatt: Pioglitazon: FDA prüft mögliches Blasenkrebsrisiko. (Memento des Originals vom 3. Dezember 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. 20. September 2010.
- Pioglitazon: Studie bestätigt Blasenkrebsrisiko. In: Deutsches Ärzteblatt. 14. August 2012, abgerufen am 17. Oktober 2017.
- M. R. Weihrauch und V. Diehl: Artificial sweeteners--do they bear a carcinogenic risk? In: Annals of Oncology: Official Journal of the European Society for Medical Oncology. Band 15, Nr. 10, Oktober 2004, S. 1460–1465, doi:10.1093/annonc/mdh256, PMID 15367404.
- Cristina M. Villanueva et al.: Bladder cancer and exposure to water disinfection by-products through ingestion, bathing, showering, and swimming in pools. In: American Journal of Epidemiology. Band 165, Nr. 2, 15. Januar 2007, S. 148–156, doi:10.1093/aje/kwj364, PMID 17079692.
- Maurice P. A. Zeegers et al.: The association between smoking, beverage consumption, diet and bladder cancer: a systematic literature review. In: World Journal of Urology. Band 21, Nr. 6, Februar 2004, S. 392–401, doi:10.1007/s00345-003-0382-8, PMID 14685762.
- Thomas Martini: Urothelkarzinom der Harnblase : Diagnostik. in Maurice Stephan Michel, Joachim W. Thüroff, Günter Janetschek, Manfred Wirth (Hrsg.) : Die Urologie – Retroperitoneum, Niere, Harnblase, Harnröhre, Tumortherapie. Heidelberg, 2016, S. 711–719.
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms, Langversion 2.0 – März 2020, AWMF-Registernummer : 032/038OL, S. 78, S. 311.
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms, Langversion 2.0 – März 2020, AWMF-Registernummer : 032/038OL, S. 124.
- K. Lindemann-Docter, R. Knüchel-Clarke: Histopathologie des Harnblasenkarzinoms. In: Der Urologe. Band 47, 2008, S. 627–638.
- Bladder Cancer Staging | Bladder Cancer Stages. Abgerufen am 10. Oktober 2018 (englisch).
- W. Böcker, H. Denk, Ph. U. Heitz, H. Moch: Pathologie. 4. Auflage. München 2008, S. 893–896.
- K. Lindemann-Docter et al.: Die Nested-Variante des Urothelkarzinoms. In: Der Pathologe. Band 29, Nr. 5, 1. September 2008, ISSN 1432-1963, S. 383–387, doi:10.1007/s00292-008-1018-y.
- R. Moll et al.: Uroplakins, specific membrane proteins of urothelial umbrella cells, as histological markers of metastatic transitional cell carcinomas. In: The American Journal of Pathology. Band 147, Nr. 5, November 1995, S. 1383–1397, PMID 7485401, PMC 1869506 (freier Volltext).
- K. Mellon et al.: Cell cycling in bladder carcinoma determined by monoclonal antibody Ki67. In: British Journal of Urology. Band 66, Nr. 3, September 1990, S. 281–285, doi:10.1111/j.1464-410x.1990.tb14927.x, PMID 2207543.
- A. S. Sarkis et al.: Nuclear overexpression of p53 protein in transitional cell bladder carcinoma: a marker for disease progression. In: Journal of the National Cancer Institute. Band 85, Nr. 1, 6. Januar 1993, S. 53–59, doi:10.1093/jnci/85.1.53, PMID 7677935.
- Marc Decobert et al.: Maintenance bacillus Calmette-Guérin in high-risk nonmuscle-invasive bladder cancer: how much is enough? In: Cancer. Band 113, Nr. 4, 15. August 2008, S. 710–716, doi:10.1002/cncr.23627, PMID 18543328.
- Alexandre R. Zlotta et al.: The management of BCG failure in non-muscle-invasive bladder cancer: an update. In: Canadian Urological Association Journal. Band 3, 6 Suppl 4, Dezember 2009, S. S199–S205, PMID 20019985, PMC 2792453 (freier Volltext).
- M. Babjuk (chair), A. Böhle, M. Burger, E. Compérat, E. Kaasinen, J. Palou, B. W. G. van Rhijn, M. Rouprêt, S. Shariat, R. Sylvester, R. Zigeuner: EAU Guidelines on Non-muscle-invasive Bladder Cancer (Ta, T1 and CIS) (Memento vom 18. Juli 2014 im Internet Archive) 2014.
- Christian Bolenz: Urothelkarzinom der Harnblase: Chirurgische Therapie. in Maurice Stephan Michel, Joachim W. Thüroff, Günter Janetschek, Manfred Wirth (Hrsg.) : Die Urologie – Retroperitoneum, Niere, Harnblase, Harnröhre, Tumortherapie. Heidelberg, 2016, S. 735–741.
- Raymond H. Mak et al.: Long-term outcomes in patients with muscle-invasive bladder cancer after selective bladder-preserving combined-modality therapy: a pooled analysis of Radiation Therapy Oncology Group protocols 8802, 8903, 9506, 9706, 9906, and 0233. In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 32, Nr. 34, 1. Dezember 2014, S. 3801–3809, doi:10.1200/JCO.2014.57.5548, PMID 25366678, PMC 4239302 (freier Volltext).
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms, Langversion 2.0 – März 2020, AWMF-Registernummer : 032/038OL, S. 78, S. 230–248, S. 272.
- G. Jakse, M. Stöckle, J. Lehmann, T. Otto, S. Krege, H. Rübben: Metastasiertes Harnblasenkarzinom. In: Deutsches Ärzteblatt. Jg. 104, Heft 15, 13. April 2007, S. 1024–1028.
- sozialgerichtsbarkeit.hessen.de
- Christian Bolenz: Urothelkarzinom der Harnblase: Chirurgische Therapie. in Maurice Stephan Michel, Joachim W. Thüroff, Günter Janetschek, Manfred Wirth (Hrsg.) : Die Urologie – Retroperitoneum, Niere, Harnblase, Harnröhre, Tumortherapie. Heidelberg, 2016, S. 735.
- F. W. Klinge und E. M. Bricker: The evacuation of urine by ileal segments in man. In: Annals of Surgery. Band 137, Nr. 1, Januar 1953, S. 36–40, doi:10.1097/00000658-195301000-00005, PMID 12996965, PMC 1802393 (freier Volltext).
- E. M. Bricker: Substitution for the urinary bladder by the use of isolated ileal segments. In: The Surgical Clinics of North America. August 1956, S. 1117–1130, doi:10.1016/s0039-6109(16)34949-0, PMID 13371525.