Bauchspeicheldrüsenkrebs
Bauchspeicheldrüsenkrebs, fachsprachlich Pankreaskarzinom, sind bösartige (maligne) Tumoren der Bauchspeicheldrüse (altgriechisch πάγκρεας pánkreas). Die Mehrheit der Tumoren befällt den die Verdauungsenzyme bildenden Teil der Bauchspeicheldrüse und hier vorwiegend die Gänge innerhalb des Organs. Diese „duktalen Adenokarzinome“ gehören zu den häufigen Krebserkrankungen. Die wichtigsten Risikofaktoren sind Bauchspeicheldrüsenentzündungen, Alkoholabusus sowie Tabakrauchen und einige Erbkrankheiten. Häufigste Symptome sind eine stetig zunehmende Gelbsucht, in den Rücken ausstrahlende und nachts an Stärke zunehmende Bauchschmerzen sowie Verdauungsstörungen und Gewichtsverlust.
| Klassifikation nach ICD-10 | |
|---|---|
| C25.- | Bösartige Neubildung des Pankreas |
| C25.0 | Pankreaskopf |
| C25.1 | Pankreaskörper |
| C25.2 | Pankreasschwanz |
| C25.3 | Ductus pancreaticus |
| C25.4 | Endokriner Drüsenanteil des Pankreas, Inkl.: Langerhans-Inseln |
| C25.7 | Sonstige Teile des Pankreas, Inkl.: Pankreashals |
| C25.8 | Pankreas, mehrere Teilbereiche überlappend |
| C25.9 | Pankreas, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Pankreaskarzinome wachsen aggressiv und bilden früh Tochtergeschwülste (Metastasen). Sie können bisher nur durch operative Entfernung behandelt werden, allerdings werden vier von fünf bösartigen Pankreastumoren erst in einem so weit fortgeschrittenen Stadium erkannt, dass keine Heilung mehr möglich ist. Chemo- und Strahlentherapie haben in der Behandlung von Bauchspeicheldrüsenkrebs eine unterstützende Funktion. Bei der Operation wird die Bauchspeicheldrüse teilweise oder vollständig entfernt (Pankreatektomie) und die unterbrochenen Gallen- und Bauchspeicheldrüsenausgänge werden wieder mit dem Darmtrakt verbunden. Die Heilungsrate ist in den letzten Jahrzehnten besser geworden; gleichwohl nehmen Palliation (Linderung) und bestmöglich unterstützende Behandlungsmaßnahmen (Best Supportive Care) in den Pankreaszentren immer noch breiten Raum ein.
Neben den bösartigen Tumoren der Bauchspeicheldrüse gibt es auch gutartige (benigne), wie beispielsweise das seröse Zystadenom.
Geschichte
Der griechische Arzt Rufus von Ephesos soll die Bauchspeicheldrüse erstmals als Organ beschrieben haben. Galenos bemerkte, dass sie ein Sekret absondert, hielt das Organ aber für ein Polster des Magens – eine Vorstellung, die sich bis Mitte des 17. Jahrhunderts hielt.[1] Die Verdauungsfunktion des Sekrets wurde erst Mitte des 19. Jahrhunderts von Claude Bernard endgültig bewiesen.[2]
Operationen der Bauchspeicheldrüse, vor allem mit Entfernung (Resektion) größerer Anteile der Drüse, galten lange als unmöglich. Erst gegen Ende des 19. Jahrhunderts gelangen einzelne derartige Eingriffe, und bis 1898 waren erst neun Entfernungen veröffentlicht worden. Bekannt ist eine erfolgreiche Linksresektion (s. u.) durch Friedrich Trendelenburg 1882. 1890 entdeckten Oskar Minkowski und Josef von Mering, dass die Entfernung der Bauchspeicheldrüse die Zuckerkrankheit verursacht, und damit entdeckten sie indirekt das Insulin,[3] welches dann 1921 von Frederick Banting und Charles Best erstmals isoliert wurde.[4] Im Jahr 1940 standardisierte Allen Oldfather Whipple die von Walther Kausch und vermutlich auch etwa gleichzeitig von Alessandro Codivilla entwickelte[5] Operationstechnik, bei der Bauchspeicheldrüse und Zwölffingerdarm gemeinsam entfernt werden. Diese Vorgehensweise zählt bis heute zu den gebräuchlichen Standardverfahren. Das schwierigste Problem der Resektionen bestand stets darin, den Abfluss des Bauchspeicheldrüsensekrets in den Darm sicherzustellen. Ab etwa 1950 erarbeiteten Chirurgen dafür verbesserte Methoden und Instrumente, beginnend mit der Idee von Charles Frey, den Rest der Bauchspeicheldrüse mit einer eröffneten Darmschlinge zu vernähen.
Todesfälle von Prominenten wie die des Schauspielers Patrick Swayze im Herbst 2009 oder des Tenorsängers Luciano Pavarotti im Februar 2007 sowie das jahrelange Ringen des Apple-Gründers Steve Jobs mit dieser Krankheit – er litt unter einer seltenen, aber gut behandelbaren Unterform (neuroendokriner Pankreastumor) und verstarb im Oktober 2011 – trugen dazu bei, den Bauchspeicheldrüsenkrebs einer breiteren Öffentlichkeit bekannter zu machen.[6]
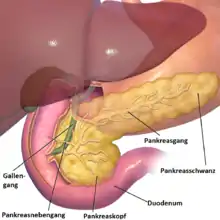
Anatomie
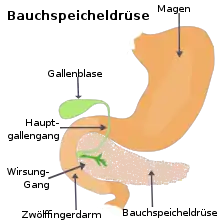
Die Bauchspeicheldrüse ist eine 40 bis 120 g schwere Drüse im Retroperitoneum, hinter dem Magen, links vom Zwölffingerdarm und wird in einen Kopf, einen Körper und einen Schwanz untergliedert. Der Schwanz berührt links Milz und Niere. Der Hauptgallengang durchquert rechts den Kopf der Bauchspeicheldrüse. Die Aorta und mehrere große Eingeweidearterien (Truncus coeliacus, obere Gekrösearterie, Milzarterie) haben engen Kontakt zur Bauchspeicheldrüse, ebenso die untere Hohlvene und die Pfortader.[7] Alle diese Strukturen können von Bauchspeicheldrüsenkrebs erfasst werden. Die Ausführungsgänge für das Bauchspeicheldrüsensekret (Wirsung- und der beim Menschen nur selten vorkommende Santorini-Gang) verlaufen durch das ganze Organ und können vom Tumor verstopft werden. Ihre Blutversorgung erhält die Bauchspeicheldrüse aus dem Truncus coeliacus und der oberen Gekrösearterie, manchmal auch aus einer abweichenden Leberarterie, was Operationen erheblich erschweren kann. Das verbrauchte Blut fließt in die obere Gekrösevene und in die Milzvene ab. Die Lymphe strömt in alle Richtungen zu den nächstgelegenen Lymphknotengruppen (Bauchspeicheldrüsen-, obere und untere Bauchspeicheldrüsen-Zwölffingerdarm-, Leber-, Zölikial-, obere Mesenterial-, Milz- und obere paraaortale Lymphknoten), die alle von einer Metastasierung betroffen sein können.[8]
Die Bauchspeicheldrüse ist überwiegend exokrin („nach außen ausscheidend“): Ihr Verdauungssekret wird über die beiden Ausführungsgänge in den Zwölffingerdarm abgegeben. Sie enthält aber auch endokrine („nach innen ausscheidende“) Zellgruppen in den sogenannten Langerhans-Inseln, die die Hormone (unter anderen Insulin und Glucagon) produzieren und an das Blut abgeben. Beide Gewebe können prinzipiell Tumoren entwickeln. Über 95 % der Pankreastumoren entstehen aus dem exokrinen Organ, genauer gesagt aus dem Gangepithel und den Azinuszellen.[9] Neben den gutartigen Zystadenomen und muzinösen Zystomen sind es vor allem Karzinome. Tumoren des endokrinen Pankreasgewebes kommen dagegen fast nur bei erblichen Syndromen vor. Sie werden zu den neuroendokrinen Tumoren gerechnet.
Drei Viertel der Tumoren entstehen im Pankreaskopf, dem am weitesten rechts, am Zwölffingerdarm gelegenen Anteil. 20 % der Tumoren treten im mittleren Anteil (Corpus) und fünf Prozent im linksseitigen Pankreasschwanz auf.
Häufigkeit und Ursachen
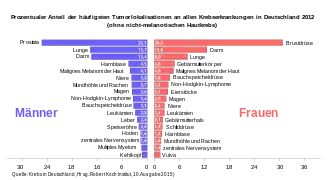
Das Pankreaskarzinom, der mit Abstand häufigste Pankreastumor, verursacht in Deutschland etwa 14.000 Neuerkrankungen jährlich – die Neuerkrankungsrate liegt bei rund 18 pro 100.000 Einwohner und Jahr.[10] In der deutschen Krebsstatistik steht es bei Männern an der zehnten, bei Frauen an der neunten Stelle (Stand: 2006). Bei den Krebstodesfällen belegt es den vierten Platz.[11] Die Erkrankten sind meist älter als 60 Jahre. Männer sind häufiger betroffen als Frauen (1,6:1). In der Schweiz erkrankten von 2010 bis 2014 durchschnittlich 1292 Menschen pro Jahr (51,5 % Frauen; 48,5 % Männer) und starben 1177 Menschen pro Jahr.[12] Seit einigen Jahren werden in Expertengremien Signale für eine zunehmende Inzidenz diskutiert, es liegen jedoch häufig nur fragmentierte epidemiologische Daten und Auswertungen vor. Unter Zugrundelegung der Datenbank “Surveillance, Epidemiology, and End Results” (SEER), die 37 % der US-Bevölkerung erfasst, wurde nun die Veränderung der Inzidenz seit Beginn des Jahrtausends als durchschnittliche jährliche prozentuale Veränderung beschrieben. Hierbei wurden zwischen 2000 und 2018 insgesamt 283.817 Pankreaskarzinome erfasst. Es zeigt sich sowohl bei Frauen als auch bei Männern ein Anstieg der Inzidenz. Auffällig war, dass besonders bei jüngeren Frauen (<55 Jahre) die Erkrankungshäufigkeit anstieg. Trotz erwartungsgemäß sehr niedriger Gesamtinzidenz ist diese Zunahme bei 15–34-Jährigen besonders ausgeprägt.[13]
Wichtigster Risikofaktor neben dem Lebensalter ist die chronische Pankreatitis (Bauchspeicheldrüsenentzündung): Etwa einer von 50 davon Betroffenen entwickelt innerhalb von zehn Jahren ein Karzinom. Diabetes verdoppelt das Karzinomrisiko aus bislang unbekanntem Grund. Lebensstilbezogene Gefahren sind Zigarettenrauchen (Raucherentwöhnung reduziert das Risiko nach zwei Jahren auf die Hälfte), Vitamin-D-Mangel, starkes Übergewicht (BMI > 30) und fettreiche Ernährung.[14] Angeborene Risiken sind Syndrome mit allgemein gesteigerter Krebserkrankungsrate wie das Peutz-Jeghers-Syndrom, die erbliche Pankreatitis und die zystische Fibrose. Zwei oder mehr Pankreaskarzinomfälle in der nahen Verwandtschaft erhöhen das Risiko um ein Vielfaches. Screeninguntersuchungen werden gegenwärtig nur für Familien mit erblicher Pankreatitis oder mehreren Pankreaskarzinomfällen empfohlen; üblich ist dann eine jährliche Endosonografie ab dem 50. Lebensjahr.[15] Ungefähr 5 % der Patienten weisen eine ererbte Mutation in einem der beiden Gene BRCA1 oder BRCA2 auf. Diese Mutation bringt ein erhöhtes Risiko mit sich, an bestimmten Krebsarten zu erkranken (bei Frauen am häufigsten Brustkrebs, aber auch Bauchspeicheldrüsenkrebs). Falls diese Krebsformen in der Familie auffällig häufig aufgetreten sind, sollte der an Bauchspeicheldrüsenkrebs erkrankte Patient auch darauf genetisch getestet werden, weil sich hier unter Umständen die Möglichkeit einer gezielteren Behandlung ergibt (s. u.).[16]
Chemische Karzinogene (Naphthylamin, Benzidin oder Nitrosamine) können das Erkrankungsrisiko erhöhen. Auch chlororganische Verbindungen und polycyclische aromatische Kohlenwasserstoffe werden verdächtigt.[17]
Für die Karzinome sind ein aggressives Wachstum, eine schnelle Metastasierung und ein schlechtes Ansprechen auf die verfügbaren Behandlungen kennzeichnend. Das liegt auch an dem besonders hohen Entartungsgrad: Wachstumsregulierende oder tumorunterdrückende Gene wie jene für HER2/neu, KRAS, p16, p53 und DPC4 sind in den Tumorzellen sehr häufig durch Mutationen inaktiviert.[18]
Pathologie
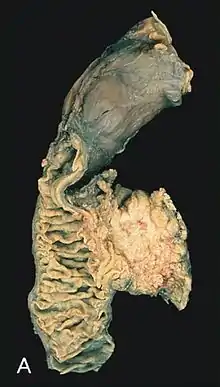
_Case_01.jpg.webp)
Pankreastumorzellen können Ähnlichkeit mit Zellen der Gänge (duktal), der Azini und Langerhans-Inseln aufweisen, aber auch gemischten Charakter haben.[19] In der Regel richten sich die Pathologen nach der WHO-Klassifikation bösartiger Tumoren, derzeit in der Ausgabe von 2010.[20] Die meisten bösartigen Tumoren (Malignome) werden danach als Varianten des duktalen Adenokarzinoms bezeichnet, eingestuft von hochdifferenziert bis undifferenziert. Dazu kommen Azinuszellkarzinome, muzinöse Zystadenokarzinome und intraduktale Neoplasien (s. u.). Endokrine Langerhanszell-Karzinome, nichtepitheliale Malignome (Lymphome und Sarkome) sind selten, ebenso die Pankreasmetastasen von anderen Organtumoren. Der häufigste gutartige Tumor ist das seröse Zystadenom.
Adenokarzinom
Adenokarzinome des Gangsystems können sich direkt bilden oder aus sogenannten Präkanzerosen entwickeln. Dies sind oberflächliche Wucherungen des Epithels, wobei vor allem papilläre Hyperplasien – nach neuer Nomenklatur pankreatische epitheliale Neoplasien 3 (PanIN 3) – als gefährlich gelten. Gutartige Tumoren wie das Zystadenom und die intraduktalen papillären Neoplasien weisen mit zunehmender Größe ebenfalls ein zunehmendes Entartungsrisiko auf.
Bei den Adenokarzinomen kann man im Mikroskop je nach ihrem Entartungsgrad noch schleimgefüllte Drüsenschläuche mit Zylinderepithel erkennen („duktaler Typ“). Die Nervenscheiden sind fast immer tumorinfiltriert. Charakteristisch ist außerdem eine Verdichtung des umgebenden Bindegewebes („desmoplastische Reaktion“), die in den bildgebenden Verfahren schlecht vom eigentlichen Tumor zu unterscheiden ist. Die wichtigsten histologischen Varianten des duktalen Adenokarzinoms sind das adenosquamöse Karzinom, das muzinöse nichtzystische Karzinom und das anaplastische (undifferenzierte) Karzinom. Nach dem Grad der Entdifferenzierung vergibt der Pathologe das Grading G1 bis G4.
Karzinome sind bei Diagnosestellung meist 2 bis 5 cm groß (bildgebend nachweisbar ab etwa 1 cm Größe). Sie sind unscharf begrenzt, von fester Konsistenz und grau-gelblicher Farbe, oft zentral nekrotisch. Es kommt häufig zu einer Verengung (Stenose) der durch die Bauchspeicheldrüse verlaufenden Strecke des Gallengangs, häufig auch zu einer Stenose des Pankreas-Ausführungsgangs. Der Tumor kann in die Wand des Zwölffingerdarmes einwachsen, weiterhin auch wichtige Gefäßstrukturen wie die obere Gekrösearterie, die Milzvene, die Pfortader und/oder die untere Hohlvene infiltrieren. Die Feststellung dieser Beteiligungen ist für die Stadienbestimmung (Staging) und damit für das weitere therapeutische Vorgehen von großer Bedeutung.
Die meisten duktalen Adenokarzinome exprimieren die Mucine 1 (Ca 15-3), 3, 5/6, und 16 (Ca 125) sowie das Glykoprotein CA 19-9 auf den Zellmembranen.
Die ersten Metastasen finden sich in den benachbarten Lymphknoten und – über den Blutstrom der Pfortader – in der Leber. Tumoren im Pankreaskörper und Pankreasschwanz sind bei Diagnosestellung zumeist größer als Pankreaskopftumoren und haben meistens schon zu Lebermetastasen oder einer Infiltration des Bauchfells (Peritonealkarzinose) geführt.
Tumoren der Papilla Vateri
Die Tumoren im Bereich der gemeinsamen Mündung des Gallen- und Pankreasgangs (Papilla Vateri) sind meist Adenokarzinome; sie sollen manchmal aus tubulovillösen Adenomen hervorgehen. Die Prognose des Papillenkarzinoms ist relativ gut, da die rasch auftretende Gelbsucht zu einer frühzeitigen Erkennung führt. Ausbreitung und Metastasierung verlaufen wie beim Pankreaskarzinom.
Intraduktaler papillär-muzinöser Tumor (IPMT)
Der IPMT wird auch als Intraduktales papillär-muzinöses Karzinom bezeichnet. Dieser Tumor breitet sich innerhalb des Gangsystems aus, beginnend meist im Kopfteil der Bauchspeicheldrüse. Man unterscheidet einen Hauptgangtyp (schlechtere Prognose), einen Seitenasttyp und einen kombinierten Typ. Das normale Gangepithel wird durch hochzylindrische neoplastische Zellen in kleinknotig-warzenförmigen (papillären) Wucherungen ersetzt, die viskösen Schleim bilden, der nur schwer abfließt und den Gangabschnitt unregelmäßig bis auf drei oder vier Zentimeter erweitert. Die Tumorzellen können die gesamte Bauchspeicheldrüse erfassen. Bei etwa 30 % der Patienten bestehen schon Gefäßeinbrüche und damit ein invasives Karzinom, wegen der Schleimseen im mikroskopischen Bild wird es oft als muzinöses nichtzystisches Karzinom oder Kolloidkarzinom bezeichnet. Dennoch ist die Prognose dieser Tumorart vergleichsweise sehr gut mit mehr als 90 % Langzeitüberleben.
Muzinös-zystischer Tumor
Der Muzinös-zystische Tumor wird auch muzinöses Zystadenom oder Zystadenokarzinom genannt. Dieser Tumor kann gut- oder bösartig sein. Computertomographie- oder Magnetresonanztomographie-Bilder können diese nicht unterscheiden, deshalb werden gut- und bösartige Varianten unter diesem Begriff zusammengefasst und unabhängig von den Symptomen immer operiert. 40- bis 60-jährige Frauen sind bevorzugt betroffen. Die 2 bis 12 cm großen Tumoren weisen eine breite Bindegewebskapsel auf. Sie bestehen meist aus weniger als sechs großen Zysten, die mit muzinproduzierendem Zylinderepithel ausgekleidet sind. Gelingt die operative Entfernung, ist die Prognose dieses Tumors gut; selbst die bösartige Variante erreicht Fünf-Jahres-Überlebensraten um 75 %.
Azinuszellkarzinom
Dieser seltene Tumor der Azinuszellen kommt doppelt so häufig bei Männern wie bei Frauen vor (Altersgipfel: 55–65 Jahre). Obwohl die Tumoren gewöhnlich relativ groß sind (4–6 cm), werden sie oft erst entdeckt, wenn sie bereits in die Leber metastasiert sind. Gelegentlich kommt es, durch eine massive Sekretion von Lipasen bedingt, zu Fettgewebsnekrosen unter der Haut sowie zu Gelenkschmerzen.
Seröses Zystadenom
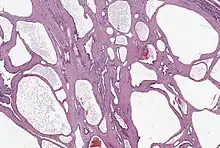
Das seröse Zystadenom, auch als mikrozystisches (Zyst-)Adenom bezeichnet, ist ein gutartiger Tumor, der vorwiegend bei Frauen im höheren Lebensalter beobachtet wird. Er liegt häufiger im Pankreaskopf, jedoch kann jede Region betroffen sein. Zystadenome können 6 bis 10 cm groß werden. Sie bestehen im Unterschied zum muzinös-zystischen Tumor (s. o.) aus kleinen Zysten mit serösem Inhalt, die durch zarte Septen getrennt sind. Im Zentrum findet man eine narbenartige Verdichtung und oft auch Verkalkungen. Diese Zysten sind mit kubischem Epithel ausgekleidet, histologisch finden sich keine Atypien oder Mitosefiguren. Eine Assoziation mit dem Von-Hippel-Lindau-Syndrom wurde beschrieben, der Tumor kann dabei große Abschnitte der Bauchspeicheldrüse einnehmen. Das seröse Zystadenom weist keine Entartungstendenz auf und sollte nur entfernt werden, wenn es durch seine Größe Symptome verursacht.
Endokrine Tumoren
Endokrine Pankreastumoren (Synonym pankreatische neuroendokrine Neoplasien PaNEN, veraltet: Karzinoide) entstehen aus den endokrinen Drüsenzellen der Bauchspeicheldrüse und bilden nur etwa 1–2 % der Pankreastumoren. Höchstens 50 % sind funktionell, d. h. sie bilden vermehrt Hormone und verursachen dadurch Krankheitserscheinungen.[21] Dazu zählen:
- Insulinom
- Gastrinom (Zollinger-Ellison-Syndrom)
- Somatostatinom
- Glucagonom
- VIPom (Verner-Morrison-Syndrom)
Ein gehäuftes Auftreten findet man beim Syndrom der multiplen endokrinen Neoplasie (MEN1-Syndrom). Davon abgesehen gibt es neuroendokrine Pankreastumoren im Kindesalter praktisch gar nicht; später treten sie in allen Altersklassen sowie bei Männern und Frauen etwa gleich selten auf. Die Prävalenz liegt unter 1/100.000.
Endokrine Tumoren sind begrenzte, einzeln auftretende, runde Tumoren mit einem Durchmesser von 1 bis 4 cm und können in allen Teilen des Pankreas auftreten. Histologisch handelt es sich um einheitlich aussehende Tumorzellen mit einem feinkörnigen Zytoplasma. Die Zellen sind solide, trabekulär und pseudoglandulär angeordnet. Immunhistologisch sind endokrine Tumoren positiv für die Marker NSE, Synaptophysin und Chromogranin A (CgA), letzterer ist auch im Blutserum bei vielen Erkrankten erhöht.[22] Im Elektronenmikroskop sieht man in den Tumorzellen neurosekretorische Hormongranula.
Nach der WHO-Klassifikation von 2010 sind alle PaNEN potentiell bösartig. Die histologisch gut differenzierten Tumoren (neuroendokrine Tumoren NET) werden nach dem Ki67/MIB1-Index in hoch- und mitteldifferenziert (< 2 % = G1, 2–20 % = G2) unterteilt. Die hochproliferierenden (Ki67-Index > 20 %) sogenannten neuroendokrinen Karzinome NEC werden als G3 eingestuft und nochmals in klein- und großzellige Subtypen unterteilt.
Kriterien zur prognostischen Einschätzung von neuroendokrinen Pankreastumoren (WHO 2010) sind neben diesem Differenzierungsgrad und der TNM-Klassifikation noch das Vorliegen von mikroskopischen Gefäßeinbrüchen und die hormonelle Aktivität:
| Metastasierungsrisiko | Histologie | Differenzierung | TNM |
|---|---|---|---|
| minimal (benignes Verhalten) | NET, keine Angioinvasion | G1 | T1 N0 M0 |
| gering | NET | G2 | T1-2 N0 M0 |
| erheblich | NET | G1-2 | T2>4 cm oder T3, N0-1, M0-1 |
| hochmalignes Verhalten | NEC | G3, funktionell inaktiv | jedes T, N, M |
Insulinproduzierende Tumoren sind in über 90 % der Fälle gutartig, dagegen sind Gastrinome, Glukagonome, VIPome und ACTH-produzierende sowie die nichtfunktionellen PanNEN meistens bösartig. Sie wachsen und metastasieren vergleichsweise langsam, sodass auch Patienten mit Metastasen noch eine mittlere Überlebensdauer von über vier Jahren erreichen.
Symptome und Diagnostik
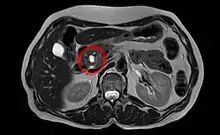
Unspezifische Symptome wie Missempfindungen/Druck im Oberbauch, Appetitlosigkeit, Übelkeit, Verdauungsprobleme und depressive Verstimmungen können erste Anzeichen des Pankreaskopfkarzinoms sein. Später zeigt sich häufig das Leitsymptom des Pankreaskopfkarzinoms, eine zunehmende, nicht von Koliken begleitete Gelbsucht (Ikterus),[23] die durch die Verengung des Gallengangs verursacht wird. Diese Gelbsucht ist nur bei Papillentumoren ein Frühsymptom, ansonsten Zeichen eines fortgeschrittenen Befundes. In den Rücken ausstrahlende Bauchschmerzen (u. a. gürtelförmig ausstrahlende Schmerzen im mittleren Rückenbereich) sind ebenfalls häufig, aber uncharakteristisch. Allerdings sind die quälenden, über Monate langsam zunehmenden dumpfen, nachts verschlimmerten Schmerzen, die durch Infiltration des Sonnengeflechtes entstehen, oft der erste Anlass, einen Arzt aufzusuchen. Ein Courvoisier-Zeichen (prall tastbare Gallenblase) ist möglich. Verengungen des Pankreasgangs beeinträchtigen die Drüsenfunktion und verursachen Verdauungsbeschwerden, Gewichtsverlust um mehr als 10 % und Diabetes (u. a. plötzlich auftretend). Weitere Anzeichen können Durchfall und Fettstühle (lehmartig, hell) sein. Thrombosen (u. a. Beinvenenthrombose) und neue Pigmentierungen der Haut sind Warnhinweise auf einen Tumor im Bauchraum. Im späten Erkrankungsstadium können Metastasen zur Lebervergrößerung, Leberfunktionsstörung, Bauchwassersucht und hochgradiger Abmagerung führen.
Im Serum findet man unspezifische Entzündungsparameter wie CRP erhöht, außerdem die Pankreasenzyme Trypsin, Lipase und Amylase. Als Tumormarker werden CA 19-9 und mit Einschränkung auch CEA genannt, die jedoch nicht spezifisch (CA 19-9: Sensitivität und Spezifität circa 70 %) und als Screeningparameter deshalb ungeeignet sind. Bessere diagnostische Parameter werden noch gesucht; die Forschung konzentriert sich gegenwärtig auf Proteomik (Eiweißprofile), microRNAs und auf KRAS-Mutationen in Serum und Gallenflüssigkeit, wobei letzterer Parameter in Vorstudien über 90 % Sensitivität und Spezifität erreichte.[24]
Beim Adenokarzinom der Bauchspeicheldrüse (PDAC) kann durch die Untersuchung von DNA-basierten Biomarkern in exosomaler Speichel-DNA (exoDNA) mittels Liquid Biopsy die Früherkennung, Tumorstratifizierung, Therapiestratifizierung und das Monitoring bei Patienten mit PDAC durchgeführt werden.[25]
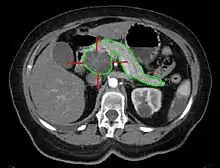
Sonografie, Computertomographie und Kernspintomographie sind die Diagnoseverfahren der Wahl. Aufgabe dieser Methoden ist, Krebserkrankungen von gutartigen Tumoren zu unterscheiden. Weiterhin ist zu erkennen, ob ein Tumor operabel ist. Dies entscheidet sich daran, ob Metastasen vorliegen und ob die dem Pankreas anliegenden Arterien (Arteria mesenterica superior, Truncus coeliacus, Arteria hepatica) von dem Tumor betroffen sind. Die Darstellung der Blutgefäße wird dabei in der Regel durch Gabe von Kontrastmitteln verbessert. Die ERCP (eine Kombination aus Endoskopie und Röntgenkontrastdarstellung) kann den Verschluss des Gallen- oder Pankreasganges nachweisen und bei günstiger Lage eine Biopsie des Tumors ermöglichen. Die Endosonografie funktioniert ähnlich, mit einer hohen Genauigkeit in der Beurteilung des Tumors und möglicher Metastasen in dessen Umgebung. Die Punktion des Tumors ist hier endosonografisch leichter durchzuführen als mit der ERCP. Spezialkliniken halten gelegentlich auch die neu entwickelte Pankreatikoskopie vor, eine Endoskopie bis in das Pankreasgangsystem hinein, die noch in der Erprobung steht und die auf das Gangsystem beschränkte Neubildungen möglicherweise am besten darstellen kann.
Wenn die genannten Diagnosemethoden nicht ausreichen, um eine schwere chronische Pankreatitis sicher von einem Tumor unterscheiden zu können, oder um eine Peritonealkarzinose nachzuweisen, bleibt zuletzt noch die Bauchspiegelung (Laparoskopie). Dieser Eingriff wird heute meist mit einer laparoskopischen Ultraschallsonde und einer Bauchspülung kombiniert, was als „erweiterte diagnostische Laparoskopie“ (EDL) bezeichnet wird.
Die klinischen und apparativen Untersuchungen liefern die Tumordiagnose und das Tumorstadium (Grad der Ausbreitung). Die TNM-Klassifikation dient zur international einheitlichen Klassifikation der Ausbreitung bösartiger Tumoren. Beim Pankreaskarzinom wird sie wie folgt vorgenommen:
| T | Primärtumor |
|---|---|
| TX | Primärtumor kann nicht beurteilt werden. |
| T0 | kein Primärtumor nachweisbar |
| Tis | Carcinoma in situ (= frühestes, noch nicht invasives Tumorstadium) |
| T1 | größter Durchmesser des Primärtumors ≤ 2 cm |
| T1a | größter Durchmesser des Primärtumors ≤ 0,5 cm |
| T1b | größter Durchmesser des Primärtumors > 0,5 cm und ≤ 1 cm |
| T1c | größter Durchmesser des Primärtumors > 1 cm und ≤ 2 cm |
| T2 | größter Durchmesser des Primärtumors > 2 cm und ≤ 4 cm |
| T3 | größter Durchmesser des Primärtumors > 4 cm |
| T4 | Angrenzende große Arterien sind infiltriert (Truncus coeliacus, A. mesenterica superior und/oder Arteria hepatica communis). |
| N | regionäre Lymphknoten |
| NX | Die regionären Lymphknoten können nicht beurteilt werden. |
| N0 | keine regionären Lymphknotenmetastasen |
| N1 | Metastasen in 1 – 3 regionären Lymphknoten |
| N2 | Metastasen in > 3 regionären Lymphknoten |
| M | Fernmetastasen |
| MX | Fernmetastasen können nicht beurteilt werden. |
| M0 | keine Fernmetastasen |
| M1 | Fernmetastasen |
Aus der Ausbreitung ergibt sich das Tumorstadium, nach dem sich die Behandlung richten wird.
| Stadium | |
|---|---|
| IA | T1 N0 M0 (Tumor bis 2 cm, keine Metastasen) |
| IB | T2 N0 M0 (Tumor innerhalb des Pankreas, keine Metastasen) |
| IIA | T3 N0 M0 (Tumor noch operabel, keine Metastasen) |
| IIB | T1-3 N1 M0 (Tumor noch operabel, mit regionären Lymphknotenmetastasen) |
| III | T1-4 N2 M0 (lokal fortgeschritten, ohne Fernmetastasen) |
| IV | T1-4 N0-2 M1 (Fernmetastasen) |
Anmerkungen: Diese Klassifikation gilt nur für Karzinome des exokrinen Pankreas. Eine gesonderte Klassifikation gilt für Tumoren der Ampulla Vateri und für gut differenzierte neuroendokrine Tumoren des Pankreas
Die Stadien T1 bis T3 gelten auch, wenn eine Invasion des peripankreatischen Weichgewebes vorliegt.
Regionäre Lymphknoten von Pankreaskopfkarzinomen liegen
- am Ductus choledochus
- an der Arteria hepatica communis
- an der Vena portae, ferner
- pylorische Lymphknoten
- subpylorische Lymphknoten
- proximale mesenteriale Lymphknoten
- zöliakale Lymphknoten
- posteriore und anteriore pankreaticoduodenale Lymphknoten
- Lymphknoten entlang der Vena mesenterica superior
- Lymphknoten rechts der A. mesenterica superior
Regionäre Lymphknoten von Pankreaskarzinomen des Körpers und des Schwanzes liegen
- an der Arteria hepatica communis
- an der Milzarterie und am Milzhilus
- zöliakale Lymphknoten
- laterale aortale Lymphknoten
Jeglicher Befall nicht regionärer Lymphknoten erfordert die Klassifikation M1.
Behandlung
Gestaute Gallenwege können zunächst mit einem endoskopisch platzierten Stent (Röhrchen) freigemacht werden, um den Allgemeinzustand des Patienten zu verbessern. Es gibt auch Verfahren, bei denen die Galle aus der Leber durch einen Katheter nach außen abgeleitet wird. Ist beides unmöglich, kann ein begrenzter chirurgischer Eingriff Entlastung verschaffen. Bei operablen Tumoren wird wegen der Gefahr von aufsteigenden Infektionen und Wundheilungsstörungen in der Regel auf die vorherige Entlastung verzichtet, mit Ausnahme von schwersten Stauungen (z. B. Bilirubin-Spiegel > 10 mg/dl). Weitere Erstmaßnahmen richten sich gegen die oft (25 %) bestehende Mangelernährung, die das Operationsrisiko deutlich erhöht, gegen Eiweiß- und Vitaminmangel (insbesondere fettlösliche Vitamine) und gegen diabetische Stoffwechselstörungen.
Um die Versorgung zu verbessern und aktuellen Erkenntnissen gerecht zu werden, hat die Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen (DGVS) im Dezember 2013 eine aktualisierte S3-Leitlinie „Exokrines Pankreaskarzinom“ herausgegeben.[27]
Operative Behandlung
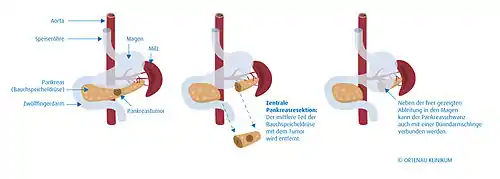
Etwa vier von fünf Pankreaskarzinomen sind, wenn sie erkannt werden, schon zu weit fortgeschritten und können nicht mehr mit dem Ziel der Heilung (kurativ) operiert werden. Auch wenn nur einzelne Lebermetastasen vorliegen, kann man – im Unterschied zum Darmkrebs – mit deren Entfernung keine Heilung erreichen. Tumoren, die weder große Arterien infiltriert noch Fernmetastasen verursacht haben (UICC-Stadien I und II), können prinzipiell noch komplett entfernt werden. Infiltrierte Venen machen den Eingriff nicht unmöglich; befallene Lymphknoten werden mit entfernt. Ob auch nicht befallene Lymphknoten sicherheitshalber entfernt werden sollten, ist umstritten.
Es ist sinnvoll, möglichst einen Teil des Organs zu erhalten und wieder mit dem Darm zu verbinden. Je nach Ort des Tumors wird deshalb die rechtsseitige Teilresektion (Duodenopankreatektomie, mehrere Varianten), eine mittlere Teilresektion, eine linksseitige Teilresektion (Pankreasschwanzresektion, meist mit Entfernung der Milz) oder eine Totalresektion (vollständige Entfernung) der Bauchspeicheldrüse durchgeführt, meist einschließlich aller regionären Lymphknoten. Der Magen und der Gallengang müssen wieder mit dem Darm verbunden werden. Man verwendet dafür entweder eine oder mehrere hochgezogene Dünndarmschlingen, die spannungsfrei angeschlossen werden. Bei der Verwendung mehrerer Dünndarmschlingen werden diese rekonstruiert nach der klassischen von César Roux erdachten Methode. Nach Teilresektion kann der Ausführungsgang des belassenen Rests der Bauchspeicheldrüse sowohl mit dem Dünndarm als auch mit dem Magen verbunden werden.
Alle genannten Eingriffe sind schwerwiegend und aufwändig. Frühe Komplikationen wie Pankreatitis, Sepsis, Anastomoseninsuffizienz (Lecks in den Darmnähten), Wundheilungsstörungen und Fisteln (abnorme Gangsysteme) sind sehr häufig. Werden Lymphgänge erheblich verletzt, kann ein Chylaskos (Lymphaustritt in die Bauchhöhle) die Folge sein. Die bedrohlichste Komplikation ist die Nachblutung aus großen Blutgefäßen, die vor allem bei mehrfachen perioperativen Manipulationen (ERCP) oder bei Entzündungen im Operationsgebiet droht. Diabetes bekommen etwa zehn Prozent der Patienten nach Teilresektionen und ausnahmslos alle nach Totalresektionen des Pankreas. Bei einer exokrinen Pankreasinsuffizienz als häufige Folge des operativen Eingriffs müssen körpereigene Verdauungsenzyme des Pankreas in der Regel lebenslang in Kapsel- oder Tablettenform (Pankreatin, Rizoenzyme) ersetzt werden.
- Operationsvarianten
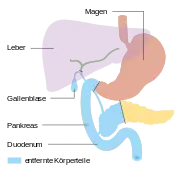 Pylorus-erhaltende Teilresektion
Pylorus-erhaltende Teilresektion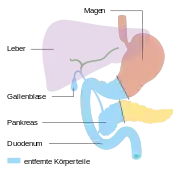 Duodenopankreatektomie nach Whipple
Duodenopankreatektomie nach Whipple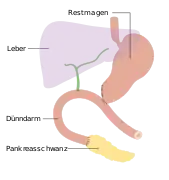 Endzustand nach Whipple-Operation
Endzustand nach Whipple-Operation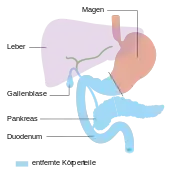 Totale Pankreasresektion
Totale Pankreasresektion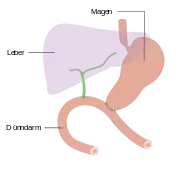 Endzustand nach Totalresektion
Endzustand nach Totalresektion
Die Enukleation (Ausschälung) ist eine sehr gewebesparende Technik, bei der nur der Tumor entfernt wird. Sie ist für gutartige Befunde und oberflächlich gelegene neuroendokrine Tumoren geeignet. Der Tumor muss Abstand vom Gangsystem haben.
Mit einer Segmentresektion werden definierte Teile der Bauchspeicheldrüse entfernt: entweder der Kopf einschließlich Zwölffingerdarm, der mittlere (zentrale) Abschnitt oder der linksseitige Teil. Die Milz kann mit entfernt oder bei geeigneten Fällen belassen werden. Vom Ausführungsgang abgeschnittenes Gewebe muss entweder in eine nach Roux Y-förmig (d. h. end-zu-seit-) angenähte Dünndarmschlinge oder in den Magen drainiert werden.
Die den pyloruserhaltende Duodenopankreatektomie nach den kalifornischen Chirurgen Longmire und Traverso[28] erhält im Gegensatz zu der Kausch-Whipple-Operation den gesamten Magen bis zum Pförtnermuskel (Pylorus).
Die subtotale oder totale Pankreasentfernung bringt als Maximaleingriff die höchste Letalität mit sich. In etwa 6 % der Operationen kommt sie zum Einsatz. Gefürchtete Komplikation ist der schwer einstellbare Brittle-Diabetes.
Inwieweit die benachbarten Lymphknoten vorbeugend ebenfalls zu entfernen sind, ist noch nicht abschließend geklärt. Jeder zweite Patient hat bei der Krankenhausaufnahme schon Lymphknotenmetastasen entwickelt. Die Standard-Lymphonodektomie umfasst die um die Bauchspeicheldrüse und am Zwölffingerdarm liegenden Lymphknoten sowie jene rechts der oberen Gekrösearterie und teilweise der aus dem Leber-Zwölffingerdarm-Band. Das radikale Konzept skelettiert komplett den Truncus coeliacus, das Leber-Zwölffingerdarm-Band und die Aorta auf Höhe der Bauchspeicheldrüse. Ein noch weitergehendes japanisches Vorgehen[29] schließt sämtliche Lymphknoten an der Bauchaorta vom Zwerchfell bis zur Endaufzweigung ein. Bisher ist eine Erhöhung der Heilungsrate dieser Varianten nicht nachgewiesen.
Palliativoperationen dienen zur Symptomlinderung. Beispielsweise wird mit der Choledochojejunostomie eine Verbindung zwischen dem gestauten Gallengang und dem Darm geschaffen, um die Galle aus der Leber abzuleiten. Bei einem drohenden Verschluss des Zwölffingerdarmes kann das Herstellen einer Verbindung zwischen Magen und Darm (Gastrojejunostomie) sinnvoll sein.
Chemo- und Strahlentherapie
Eine vor der Operation durchgeführte („neoadjuvante“) Chemotherapie kann nach der gegenwärtigen Phase-II-Studienlage einige fortgeschrittene Tumoren so weit verkleinern, dass sie operabel werden, die Daten sind aber noch zu schwach für eine allgemeine Empfehlung.[30] Gleiches gilt für die neoadjuvante Kombination aus Chemo- und Strahlentherapie (Radiochemotherapie), die in kleineren Studien erprobt wird. Nur wenn die Standardchemotherapie nicht mehr wirkt, nutzt man als second line eine Kombination aus Oxaliplatin, 5-Fluoruracil (5-FU) und Folinsäure (OFF-Schema). Als Erstlinientherapie gegen neuroendokrine Tumoren empfiehlt die ENETS in Abhängigkeit von der Wachstumstendenz die Gabe von Somatostatinrezeptoranaloga oder Everolimus. Des Weiteren verwendet man eine Kombinationschemotherapie von Streptozocin mit Doxorubicin oder 5-FU, bei hochgradig bösartigen neuroendokrinen Tumoren Cisplatin und Etoposid. Alternativ werden Temozolomid und Capecitabin erprobt. Eine weitere für neuroendokrine Tumoren spezifische Behandlung ist die Peptid-vermittelte Radiorezeptortherapie.
Dagegen ist eine nach der Operation durchgeführte (adjuvante) Chemotherapie anerkannter Standard, weil die Rezidivrate (s. u.) extrem hoch ist.[31] Jede Woche 1× 1000 mg/(m² KOF) Gemcitabin drei Wochen lang, dann eine Woche Pause, dann der nächste Zyklus, ist das in Europa gebräuchlichste Schema. In den USA wird eher 5-Fluoruracil eingesetzt. Kombinationen mehrerer Zytostatika verbessern die Wirkung bei Karzinomen bisher nicht, sind allerdings der Standard bei NET. Radiochemotherapien erhöhen nachweislich die örtliche Tumorkontrolle, allerdings wird dabei weder Metastasierung noch Sterblichkeit verringert, sodass darauf meist verzichtet wird.
| Chemotherapie | Therapienutzen/medianes Überleben |
|---|---|
| Gemcitabin- Monotherapie 3-wöchentlich | Gesamtüberleben bei 5,9 Monaten |
| Gemcitabin +Erlotinib | Erlotinib brachte nur bei den Patienten, die einen Hautausschlag entwickelten, einen Nutzen; Gesamtüberleben bei diesen Patienten 10,5 Monaten |
| FOLFIRINOX | nur bei Patienten mit ECOG 0 bis 1, Alter < 75 Jahre, normalem Bilirubin, nebenwirkungsreich! Gesamtüberleben 11,1 Monate |
| Gemcitabin +nab-Paclitaxel | Gesamtüberleben im Vergleich zur Gemcitabin-Monotherapie von 6,6 auf 8,7 Monate verlängert |
| nal-Irinotecan +5FU/FA | Zugelassen für Patienten nach Gemcitabin-haltiger Therapie; Gesamtüberleben im Vergleich zur 5FU/FA-Monotherapie mit 6,1 versus 4,2 Monate signifikant besser |
| Olaparib-Erhaltungstherapie | Bei metastasierten Patienten, die eine BRCA1/2-Mutation aufweisen und die zuvor eine platin-haltige Therapie erhalten haben, unter der sie nicht progredient waren (progressionsfreies, aber nicht Gesamtüberleben verbessert). Bisher (08/2019) nicht zugelassen! |
Unheilbare (d. h. primär inoperable oder metastasierte) Tumoren können mit einer Chemotherapie palliativ behandelt werden, z. B. mit Gemcitabin.[33] Auch eine vorsichtig dosierte Radiochemotherapie kann zur Schmerzlinderung beitragen. Ein anderer Ansatz ist es, das Zytostatikum über einen von der Leistenarterie eingebrachten Katheter in eine tumorversorgende Arterie zu spritzen, z. B. in die Arteria pancreatica magna (lokoregionäre Chemotherapie). Damit kann die Dosis am Tumor ohne zusätzliche Nebenwirkungen gesteigert werden. Es gibt aber bisher nur Phase-I-Studien (kleine Fallserien) zu dieser teuren und technisch sehr aufwändigen Methode.
Wie bei vielen anderen Krebserkrankungen setzt die Medizin auch beim Pankreaskarzinom zunehmend auf die Gezielte Krebstherapie (targeted therapy), d. h. auf monoklonale Antikörper, andere Biologika und small molecules. Außerhalb von Studien ist der Tyrosinkinase-Inhibitor Erlotinib gegen Pankreaskarzinome zugelassen; außerdem der Tyrosinkinase-Inhibitor Sunitinib und der mTOR-Inhibitor Everolimus gegen endokrine Tumoren.
Erlotinib wird in der Regel in Kombination mit Gemcitabin (3-wöchentlich) gegeben. Hier zeigte sich in einer Therapiestudie, dass die Hinzunahme von Erlotinib zu Gemcitabin zu einer geringen, aber statistisch signifikanten Verlängerung des medianen Gesamtüberlebens führte (6,24 versus 5,91 Monate). Allerdings war dieser Vorteil nur auf die Subgruppe von Patienten beschränkt, die während der Therapie einen deutlichen Hautausschlag entwickelten. Diese Patientengruppe hatte ein medianes Gesamtüberleben von 10,5 Monaten.[34] Es wird daher empfohlen, die Behandlung mit Erlotinib nur dann fortzuführen, wenn nach spätestens acht Wochen ein Hautausschlag aufgetreten ist.
Bei metastasierten oder primär inoperablen Patienten, die in einem sehr guten Allgemeinzustand (ECOG-Score 0-1) sind, können auch intensivere Therapien durchgeführt werden. Ein solches Therapieregime ist FOLFIRINOX (5-Fluorouracil, Leukovorin, Oxaliplatin, Irinotecan). Mit FOLFIRINOX zeigte sich bei diesen Patienten ein signifikant besseres Gesamtüberleben als mit Gemcitabin-Monotherapie (11,1 versus 6,8 Monate).[35] Dieser Vorteil muss allerdings auch mit deutlich höheren Nebenwirkungen erkauft werden. Ähnlich ist es bei der Kombination Gemcitabin/nab-Paclitaxel (Albumin-Nanopartikel-gebundenem Paclitaxel), die in einer Phase III-Studie das mediane Gesamtüberleben von metastasierten Patienten auf 8,7 Monate verbesserte.[36] Paclitaxel ist in Deutschland in Kombination mit Gemcitabin für die Therapie des Adenokarzinoms des Pankreas zugelassen.[37]
Im Februar 2016 wurden in der Fachzeitschrift The Lancet die Ergebnisse einer dreiarmigen internationalen Phase III-Studie veröffentlicht. In dieser sogenannten NAPOLI-1-Studie wurden Patienten mit metastasiertem Pankreaskarzinom behandelt, die zuvor eine Gemcitabin-haltige Therapie erhalten hatten. Ein Studienarm bestand aus einer Behandlung mit 5-Fluorouracil und Folinsäure (5FU/FA), ein zweiter aus einer Behandlung mit nanoliposomalem Irinotecan („nal-Irinotecan“, „nalIRI“) und ein dritter, später hinzugenommener Studienarm enthielt eine Kombination aller drei Medikamente. Das mediane Überleben der Patienten im dritten Studienarm war mit 6,1 Monaten signifikant besser als das der Patienten im ersten Studienarm (5FU/FA, 4,2 Monate). Die nalIRI-Monotherapie war dagegen nicht signifikant besser als die 5FU/FA-Therapie.[38] Als Konsequenz dieser Studie wurde die Kombinationsbehandlung nalIRI+5FU/FA für Patienten mit metastasiertem Pankreaskarzinom und vorheriger Gemcitabin-haltiger Therapie im Oktober 2016 zugelassen.[39]
Gegen die durch hormonproduzierende (funktionell aktive) Tumoren verursachten Symptome können Somastostatinanaloga wie Octreotid und Interferon-alpha eingesetzt werden, die Krankheit wird damit jedoch nicht aufgehalten. Beim Versagen der Erstlinien-Chemotherapie kann die Peptid-Rezeptor-Radionuklidtherapie (PRRT) versucht werden, bei der ein wirksames Radionuklid chemisch an einen geeigneten Liganden gekoppelt in die Blutbahn injiziert wird.
Eine im Juli 2019 publizierte Studie fand, dass sich das krankheitsfreie Überleben (nicht aber das Gesamtüberleben) bei Patienten mit metastasiertem Bauchspeicheldrüsenkrebs, die eine BRCA1- oder BRCA2-Mutation aufwiesen und zuvor eine platin-haltige Therapie (z. B. FOLFIRINOX) erhalten hatten, deutlich verbessern ließ, wenn diese anschließend eine Erhaltungstherapie aus Olaparib (2 × 300 mg täglich) erhielten. Es wurden nur Patienten in die Studie eingeschlossen, die unter der vorangegangenen platinhaltigen Therapie keine Krankheitsprogression gezeigt hatten.[16]
Experimentelle Ansätze
Forscher der LMU München verfolgen Ansätze, die Immuntherapie weiter zu treiben. Konkret geht es darum, dass Abwehrzellen das Tumorgebiet erreichen und es schaffen, zu den eigentlichen Krebszellen vorzudringen. Die Tumorzellen des Pankreas sind einerseits umgeben von einem schwer zu durchdringenden Stroma-Gewebe. Andererseits senden die Tumorzellen einen Botenstoff namens CXCL16 aus. Dieses CXCL16 lockt eine Gruppe von Immunzellen, die einen Angriff gegen den Tumor verhindern statt ihn loszutreten. Der Gruppe der T-Zellen, die den Tumor theoretisch bekämpfen können, fehlt der Rezeptor, der auf das CXCL16 Signal mit einem Angriff reagieren könnte. Deshalb setzen die Forscher CAR-T-Zellen ein. CAR-T steht für „chimärer Antigenrezeptor in T-Zellen“. Der Name beschreibt die gentechnischen Veränderungen, die aus T-Zellen aggressive Tumorkiller machen. Damit die Immunzellen die Krebszellen identifizieren, basteln Wissenschaftler mit gentechnischen Verfahren eine Art Antenne auf die Oberfläche der T-Zellen, die nach dem Schlüssel-Schloss-Prinzip ein ganz spezielles Molekül auf der Oberfläche der Tumorzellen erkennen. Mit Hilfe der Antenne spüren die T-Zellen die Krebszellen auf, docken an sie an und zerstören sie letztendlich. Um speziell die Zellen von Bauchspeicheldrüsentumoren anzusteuern, haben die Münchner Forscher zusätzlich das Gen für den fehlenden Rezeptor in die CAR-T-Zellen eingebaut. In allen Laborversuchen fanden die so ausgestatteten CAR-T-Zellen ihr Ziel und attackierten die Krebszellen von Pankreastumoren. Aktuell laufen die Vorbereitungen für klinische Versuche am Menschen.[40]
Prognose

Mit den verbesserten Operationstechniken und der Chemotherapie sind die Heilungsraten etwas besser geworden. Die Prognose der Pankreaskarzinome ist jedoch immer noch eine der schlechtesten aller Karzinome: Neueren Untersuchungen zufolge liegt die Fünf-Jahres-Überlebensrate nach einem in kurativer Absicht durchgeführten Eingriff mit anschließender Chemotherapie bei 20 %,[41] höchstens 30 %.[42] Nur 10 bis 20 % der Tumoren sind zum Zeitpunkt der Diagnose noch operabel. Bei vier von fünf operierten Patienten kehrt der Tumor innerhalb von zwei Jahren zurück und nur in vereinzelten Fällen kann er ein zweites Mal entfernt werden. Inoperable Tumoren sprechen nur begrenzt auf eine Chemotherapie an; diese Patienten haben nur eine mittlere Überlebensdauer von vier bis sieben Monaten, die sich auch mit palliativer Chemotherapie nicht wesentlich verlängern lässt.[31]
In dieser Situation liegt es in der Verantwortung der Onkologen, ihre therapeutischen Entscheidungen unter das Primat der subjektiven Lebensqualität des Patienten zu stellen. Dieser hermeneutische Endpunkt muss neben den mechanistischen Endpunkten wie Überlebensrate, Überlebenszeit, progressionsfreies Überleben etc. mindestens gleichwertig berücksichtigt werden. Das ärztliche Handeln sollte sich nach standardisierten Behandlungspfaden (clinical pathways) richten und sowohl die wissenschaftliche Evidenz als auch die Wirtschaftlichkeit berücksichtigen.
Für die Lebensqualität wichtige Faktoren sind eine adäquate, ausreichend hoch dosierte Schmerztherapie nach dem WHO-Stufenschema und fachkundige Hilfen zur psychologischen Krankheitsbewältigung. Best Supportive Care bedeutet, sich von unheilbaren Patienten nicht zurückzuziehen, sondern ihnen im Gegenteil jederzeit und dauerhaft medizinische Hilfe anzubieten. Beispielsweise ist es für Krebspatienten wichtig, sich möglichst lange normal ernähren zu können; dafür sind geeignete Diätprodukte zu verordnen und mechanische Hindernisse soweit möglich, auch mit palliativen Eingriffen, zu beheben. In der Endphase können zumindest für Brei- und Flüssignahrung passierbare Stents in den Darmtrakt eingesetzt werden oder es kann auf Sondenkost über eine PEG umgestellt werden. Neben dem Tumorschmerz ist Juckreiz ein weiteres sehr belastendes Symptom des fortgeschrittenen Pankreaskarzinoms, das in einem sorgfältigen Palliativkonzept durchaus gezielt und wirksam behandelt werden kann.
Darüber hinaus benötigen auch geheilte Patienten Betreuung. Wesentliche Ziele ihrer Rehabilitation sind Kostaufbau und Ernährungsberatung, Enzymsubstitution mit Verdauungsenzymen (Pankreatine, Pilzenzyme), Diabeteskontrolle und psychotherapeutische Stützungsmaßnahmen wie Gruppen- und Einzelgespräche. Sozialmedizinische Hilfen durch entsprechendes Fachpersonal sind Beratungen nach dem Schwerbehindertenrecht, Leistungen der beruflichen Rehabilitation, Häusliche Krankenpflege, Haushaltshilfe, Essensversorgung usw. Sie müssen noch im Krankenhaus im Rahmen eines geplanten Entlassungsmanagements eingeleitet werden.
Literatur
- H. U. Baer, M. Wagner, M. W. Büchler: Onkologische Standardchirurgie des Pankreaskarzinoms. In: Chir Gastroenterol. Band 14, 1998, S. 42–48.
- Hans G. Beger, Markus W. Büchler, Henning Dralle, Markus M. Lerch, Peter Malfertheiner, Joachim Mössner, Jürgen F. Riemann: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2.
- M. Birth, Thomas Heinz Ittel, Philippe L. Pereira: Hepatobiliäre und Pankreastumoren. Springer-Verlag, 2010, ISBN 978-3-642-04935-4.
- F. T. Bosman, F. Carneiro, R. H. Hruban, N. D. Theise: WHO Classification of Tumours of the Digestive System. (= WHO Classification of Tumours. Band 3). 4. Auflage. WHO/IARC, 2010, ISBN 978-92-832-2432-7.
- R. Grützmann u. a.: Intraduktale papillär-muzinöse Neoplasie des Pankreas: Aktueller Stand von Diagnostik, Therapie und Prognose. In: Dtsch Arztebl Int. Nr. 108 (46), 2011, S. 788–794 (Übersichtsarbeit).
- T. Seufferlein, J. B. Bachet u. a.: Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. In: Annals of Oncology. Band 23, Suppl. 7, Oktober 2012, ISSN 1569-8041, S. vii33–vii40, doi:10.1093/annonc/mds224. PMID 22997452.
- Peter Bailey u. a.: Genomic analysis identify molecular subtypes of pancreatic cancer. In: Nature. Band 531, 3. März 2016, S. 47–52.
Weblinks
- S3-Leitlinie Exokrines Pankreaskarzinom, AWMF-Registernummer 032/010, Stand 10/2013
- Informationsseite und „blauer Ratgeber“ (PDF; 1017 kB) Patientenbroschüre, aktualisiert Stand 12/2017, Stiftung Deutsche Krebshilfe und der Deutschen Krebsgesellschaft, abgerufen am 8. Dezember 2018.
- Kampagne „Aus der Mitte – Diagnose Bauchspeicheldrüsenkrebs“ von Hoffmann-La Roche
- Selbsthilfeverein Tumore und Erkrankungen der Bauchspeicheldrüse e. V.
- Pancreatic Cancer. NCCN Guidelines for patients. (PDF) National Comprehensive Cancer Network, Januar 2014 (englisch)
- Pancreatica:Confronting pancreatic cancer. Cancer Patients Alliance, US-amerikanische Stiftung (englisch)
- Liste der DGAV-zertifizierten Zentren für Pankreaschirurgie in Deutschland
- Häufige Krankheiten – modern behandelt: Bauchspeicheldrüsenkrebs. In: nzz.ch. 21. Februar 2013, abgerufen am 17. Januar 2015.
- Sonografisches Bild eines Pankreaskarzinoms
Einzelnachweise
- John Malone Howard, Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 0-306-46742-9, S. 6.
- John Malone Howard, Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 0-306-46742-9, S. 83.
- John Malone Howard, Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 0-306-46742-9, S. 107.
- John Malone Howard, Walter Hess: History of the Pancreas: Mysteries of a Hidden Organ. Springer, 2002, ISBN 0-306-46742-9, S. 117.
- Christos G. Dervenis, Claudio Bassi: Pancreatic Tumors: Achievements and Perspectives. Thieme, 2000, ISBN 1-58890-002-9, S. 4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dagny Lüdemann: Der vergessene Tumor. Zeit Online, 2009.
- Detlev Drenckhahn (Hrsg.): Anatomie. 17. Auflage. Band 1. Urban & Fischer, München 2008, ISBN 978-3-437-42342-0, S. 723.
- Nicolas T. Schwarz, Karl-Heinz Reutter: Allgemein- und Viszeralchirurgie essentials: Intensivkurs zur Weiterbildung. 7. Auflage. Georg Thieme, 2012, ISBN 978-3-13-159057-2, S. 256.
- F. G. Bader u. a.: Histopathologie, Tumorklassifikation und Prognosefaktoren. In: M. Birth, T. H. Ittel, P. L. Pereira: Hepatobiliäre und Pankreastumoren. Springer-Verlag, 2010, ISBN 978-3-642-04935-4, S. 91.
- Krebs – Bauchspeicheldrüsenkrebs. In: krebsdaten.de. 13. Dezember 2014, abgerufen am 16. Januar 2015. Informationen zum Pankreastumor vom Zentrum für Krebsregisterdaten am Robert Koch-Institut
- Krebs – Krebs in Deutschland. In: krebsdaten.de. Zentrum für Krebsregisterdaten am Robert Koch-Institut und Gesellschaft der epidemiologischen Krebsregister in Deutschland, 13. Dezember 2013, abgerufen am 16. Januar 2015.
- Krebs in der Schweiz: wichtige Zahlen. (PDF) Krebsliga Schweiz, Oktober 2017, S. 8, abgerufen am 3. Februar 2018.
- Srinivas Gaddam, Yazan Abboud, Janice Oh, Jamil S. Samaan, Nicholas N. Nissen: Incidence of Pancreatic Cancer by Age and Sex in the US, 2000-2018. In: JAMA. 24. Oktober 2021, doi:10.1001/jama.2021.18859 (jamanetwork.com [abgerufen am 30. Oktober 2021]).
- N. Schulte: Epidemiologie und Karzinogenese des Pankreaskarzinoms. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 334. doi:10.1007/978-3-642-37964-2_62
- P. Langer, D. K. Bartsch: Familiäres Pankreaskarzinom. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 342–343. doi:10.1007/978-3-642-37964-2_63
- T. Golan, P. Hammel, M. Reni, E. Van Cutsem, T. Macarulla, M. J. Hall, J. O. Park, D. Hochhauser, D. Arnold, D. Y. Oh, A. Reinacher-Schick, G. Tortora, H. Algül, E. M. O'Reilly, D. McGuinness, K. Y. Cui, K. Schlienger, G. Y. Locker, H. L. Kindler: Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. In: N Engl J Med. Band 381, Nr. 4, 25. Juli 2019, S. 317–327, doi:10.1056/NEJMoa1903387, PMID 31157963 (englisch).
- G. Andreotti, D. T. Silverman: Occupational risk factors and pancreatic cancer: a review of recent findings. In: Molecular Carcinogenesis. Band 51, Nummer 1, Januar 2012, S. 98–108, ISSN 1098-2744. doi:10.1002/mc.20779. PMID 22162234. (Review).
- A. F. Hezel, A. C. Kimmelman, B. Z. Stanger, N. Bardeesy, R. A. Depinho: Genetics and biology of pancreatic ductal adenocarcinoma. In: Genes Dev. Band 20, Nr. 10, Mai 2006, S. 1218–1249, doi:10.1101/gad.1415606, PMID 16702400 (cshlp.org).
- C. Wittekind: Pathohistologische Klassifikation, Tumorstaging und R-Klassifikation des Pankreaskarzinoms. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 327. doi:10.1007/978-3-642-37964-2_61
- R. H. Hruban, G. Klöppel, P. Bofetta u. a.: Tumours of the pancreas. In: F. T. Bosman u. a.: WHO Classification of Tumours of the Digestive System. (= WHO Classification of Tumours. Band 3). 4. Auflage. WHO/IARC, 2010, ISBN 978-92-832-2432-7, S. 279–337.
- G. Klöppel: Klassifikation und Pathologie endokriner Tumoren des Pankreas. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 204–209. doi:10.1007/978-3-642-37964-2_39
- K. Streetz, W. Karges: Laborchemische und genetische Diagnostik endokriner Tumoren des Pankreas. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 216–217. doi:10.1007/978-3-642-37964-2_41
- John L. Cameron: Pancreatic Cancer. PMPH-USA, 2001, ISBN 1-55009-131-X, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. M. Winter, C. J. Yeo, J. R. Brody: Diagnostic, prognostic, and predictive biomarkers in pancreatic cancer. In: Journal of Surgical Oncology. Band 107, Nummer 1, Januar 2013, S. 15–22, ISSN 1096-9098. doi:10.1002/jso.23192. PMID 22729569. (Review).
- Bedeutung exosomaler DNA aus Speichel beim duktalen Pankreaskarzinom, Deutsche Forschungsgemeinschaft. Abgerufen am 23. Februar 2019.
- Christian Wittekind, Union for International Cancer Control.: TNM – Klassifikation maligner Tumoren. Achte Auflage. [Weinheim, Germany], ISBN 978-3-527-80758-1.
- DGVS: Leitlinie Exokrines Pankreaskarzinom
- W. P. Longmire, L. W. Traverso: The Whipple procedure and other standard operative approaches to pancreatic cancer. In: Cancer. Band 47, Nummer 6 Suppl, März 1981, ISSN 0008-543X, S. 1706–1711. PMID 6791804.
- O. Ishikawa, H. Ohhigashi u. a.: Practical usefulness of lymphatic and connective tissue clearance for the carcinoma of the pancreas head. In: Annals of Surgery. Band 208, Nummer 2, August 1988, S. 215–220, ISSN 0003-4932. PMID 2840866. PMC 1493620 (freier Volltext).
- H. Oettle, M. Sinn: Chemotherapie beim Pankreaskarzinom. In: M. Birth, T. H. Ittel, P. L. Pereira: Hepatobiliäre und Pankreastumoren. Springer-Verlag, 2010, ISBN 978-3-642-04935-4, S. 381.
- V. Heinemann: Evidenz der Chemotherapie beim fortgeschrittenen Pankreaskarzinom. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 377–382. doi:10.1007/978-3-642-37964-2_71
- T. J. Ettrich, H. Oettle, T. Seufferlein: Therapie des metastasierten Pankreaskarzinoms. In: Der Onkologe. Band 21, Nr. 11, 2015, S. 1044–1053. doi:10.1007/s00761-015-2930-4
- H. A. Burris, M. J. Moore u. a.: Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. In: Journal of clinical oncology: official journal of the American Society of Clinical Oncology. Band 15, Nummer 6, Juni 1997, ISSN 0732-183X, S. 2403–2413. PMID 9196156.
- M. J. Moore, D. Goldstein, J. Hamm, A. Figer, J. R. Hecht, S. Gallinger, H. J. Au, P. Murawa, D. Walde, R. A. Wolff, D. Campos, R. Lim, K. Ding, G. Clark, T. Voskoglou-Nomikos, M. Ptasynski, W. Parulekar; National Cancer Institute of Canada Clinical Trials Group: Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. In: J Clin Oncol. Band 25, Nummer 15, 2007, S. 1960–1966. PMID 17452677.
- T. Conroy, F. Desseigne, M. Ychou, O. Bouché, R. Guimbaud, Y. Bécouarn, A. Adenis, J. L. Raoul, S. Gourgou-Bourgade, C. de la Fouchardière, J. Bennouna, J. B. Bachet, F. Khemissa-Akouz, D. Péré-Vergé, C. Delbaldo, E. Assenat, B. Chauffert, P. Michel, C. Montoto-Grillot, M. Ducreux: Groupe Tumeurs Digestives of Unicancer. PRODIGE Intergroup: FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. In: N Engl J Med. Band 364, Nr. 19, 2011, S. 1817–1825. doi:10.1056/NEJMoa1011923.
- D. Goldstein, R. H. El-Maraghi, P. Hammel, V. Heinemann, V. Kunzmann, J. Sastre, W. Scheithauer, S. Siena, J. Tabernero, L. Teixeira, G. Tortora, J. L. van Laethem, R. Young, D. N. Penenberg, B. Lu, A. Romano, D. D. von Hoff: nab-Paclitaxel plus gemcitabine for metastatic pancreatic cancer. long-term survival from a phase III trial. In: J Natl Cancer Inst. Band 107, Nr. 2, 2015, dju413. doi:10.1093/jnci/dju413.
- Fachinformation Abraxane. Juli 2015.
- A. Wang-Gillam, C. P. Li, G. Bodoky, A. Dean, Y. S. Shan, G. Jameson, T. Macarulla, K. H. Lee, D. Cunningham, J. F. Blanc, R. A. Hubner, C. F. Chiu, G. Schwartsmann, J. T. Siveke, F. Braiteh, V. Moyo, B. Belanger, N. Dhindsa, E. Bayever, D. D. Von Hoff, L. T. Chen: NAPOLI-1 Study Group. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. In: Lancet. Band 6, Nr. 387(10018), Februar 2016, S. 545–557, doi:10.1016/S0140-6736(15)00986-1 (englisch).
- G. Prager, H. Oettle, A. Vogel: Liposomales Irinotecan. In: Thieme Drug Report. Band 11, Nr. 8, 2017, S. 1–1 (thieme.de [PDF]).
- Stefanie Lesch, Viktoria Blumenberg, Stefan Stoiber, Adrian Gottschlich, Justyna Ogonek: T cells armed with C-X-C chemokine receptor type 6 enhance adoptive cell therapy for pancreatic tumours. In: Nature Biomedical Engineering. 3. Juni 2021, ISSN 2157-846X, S. 1–15, doi:10.1038/s41551-021-00737-6 (nature.com [abgerufen am 4. Juni 2021]).
- O. Strobel, J. Werner: Langzeitverlauf nach operativer Tumorentfernung und Chemotherapie des duktalen Pankreaskarzinoms. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 415–418. doi:10.1007/978-3-642-37964-2_79
- Wagner 2004 und Schmidt 2012, zitiert nach: T. Hackert, W. Hartwig: Indikation zur Resektion beim Pankreaskarzinom. In: H. G. Beger u. a.: Erkrankungen des Pankreas: Evidenz in Diagnostik, Therapie und Langzeitverlauf. Springer-Verlag, 2013, ISBN 978-3-642-37964-2, S. 365. doi:10.1007/978-3-642-37964-2_68