Capecitabin
Capecitabin (Handelsname Xeloda®, Hersteller: Roche, sowie viele Generikaanbieter) ist ein zytostatisch wirkender Arzneistoff. Capecitabin ist eine Vorstufe (Prodrug) von 5-Fluoruracil und wird im Tumor in die aktive Substanz umgewandelt. Die Substanz ist oral wirksam und wird zur Therapie von metastasiertem Dickdarmkrebs, metastasiertem oder lokal fortgeschrittenem Mammakarzinom und zur palliativen Therapie des Magenkarzinoms eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
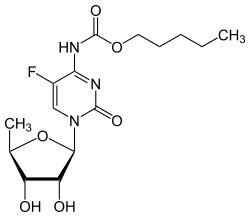 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Capecitabin | |||||||||||||||||||||
| Andere Namen |
N4-Pentyloxycarbonyl-5′-desoxy-5-fluorcytidin | |||||||||||||||||||||
| Summenformel | C15H22FN3O6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01BC06 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 359,35 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakokinetik
Capecitabin ist ein Prodrug, das rasch vom Magen-Darm-Trakt aufgenommen wird, mit einer maximalen Plasmakonzentration nach 90 Minuten. Die Plasmaproteinbindung beträgt weniger als 60 %. Capecitabin wird in der Leber hydrolysiert zu 5'-Desoxy-5-fluorcytidin, das in Zellen zu 5'-Desoxy-5-fluoruridin (Doxifluridin) und weiter zum Wirkstoff 5-Fluoruracil (5-FU) konvertiert wird.
Die Wirksamkeit von Capecitabin ist deshalb mit 5-FU vergleichbar. Die Umwandlung zu 5-FU erfolgt durch das Enzym Thymidinphosphorylase, das in besonders hoher Konzentration im Tumorgewebe auftritt. Durch die gezielte Ausrichtung des Wirkmechanismus auf die Tumorzellen vertragen die Patienten Capecitabin eher besser und müssen deutlich seltener wegen schwerer Nebenwirkungen behandelt werden.
Der Abbau von Capecitabin und 5-FU geschieht über das Enzym Dihydropyrimidindehydrogenase.[3]
Nebenwirkungen
Wie die meisten Zytostatika kann auch Capecitabin eine Vielzahl von leichten, schweren, und selbst tödlichen Nebenwirkungen haben. Besonders häufig sind Muskel- oder Gliederschmerzen, Abgeschlagenheit, Blutbildveränderungen, Infektionen, Störungen des Nervensystems, Halsschmerzen, Symptome des Magen-/Darmtrakts, Leber- und Nierenschäden, und Durchblutungsstörungen am Herz bis hin zum Herzinfarkt.[4] Seltener als bei 5-FU sind insbesondere Übelkeit, Erbrechen und vor allem Stomatitis. Auch Haarausfall wird deutlich seltener beobachtet. Dennoch kann es auch unter Capecitabin zu schwerem Durchfall kommen. Deutlich häufiger kommt es bei der peroralen Medikation zum Hand-Fuß-Syndrom. Die Symptome reichen von Taubheitsgefühl, Kribbeln und Missempfindungen bis zu starken Schmerzen in Handflächen und Fußsohlen. Es kann auch zu Geschwür- und Blasenbildung an Händen oder Füßen kommen. Betroffenen helfen regelmäßige kalte Wasserbäder für Hände und Füße oder 10%ige uridinhaltige Cremes.[5] Auch der Verlust der Fingerabdrücke ist nicht auszuschließen.[6][7]
Unter der Therapie mit Capecitabin kann es sehr selten zu schweren Hautreaktionen wie dem Stevens-Johnson-Syndrom (SJS) und der toxischen epidermalen Nekrolyse (TEN) kommen. Bei Anzeichen muss die Behandlung sofort und dauerhaft abgebrochen werden. Der Hersteller informierte über dieses Risiko am 17. Dezember 2013 in einem Rote-Hand-Brief.[8]
Für die Metabolisierung, d. h. den Abbau des Capecitabins ist wesentlich das Enzym Dihydropyrimidin-Dehydrogenase (DPD) verantwortlich. Da manche Individuen eine verminderte DPD-Enzymaktivität aufweisen, wurde im Jahr 2020 durch die Europäische Arzneimittel-Agentur (EMA) und verschiedene Fachgesellschaften die Empfehlung ausgesprochen, dass Patienten, die eine Therapie mit diesem Medikament erhalten sollten, zuvor auf einen DPD-Mangel getestet werden sollen.[9] Im Falle eines DPD-Enzymmangels muss eine niedrigere Medikamentendosierung gewählt werden.[10]
Anwendung
Capecitabin wird zweimal täglich, morgens und abends, innerhalb von 30 Minuten nach einer Mahlzeit eingenommen. Je nach Dosierung muss der Patient jeweils drei bis neun Tabletten schlucken. Bei schweren Nebenwirkungen muss die Therapie unterbrochen oder die Dosis reduziert werden.
Weblinks
- Xeloda auf der Seite der Europäischen Arzneimittelagentur
- Pharmazeutische Zeitung: Neue Arzneistoffe: Capecitabin
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Capecitabin
Einzelnachweise
- Eintrag zu Capecitabin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. Maurer, J. Thödtmann: Das Mammakarzinom: Diagnostik und Therapie. Govi-Verlag, Eschborn, 2003, ISBN 978-3-7741-0996-4.
- Roche AG: Fachinformation Xeloda, Stand 14. September 2016
- Hendrik-Tobias Arkenau: Therapiemanagement: Capecitabin und das Hand-Fuß-Syndrom. 2006. Abgerufen am 13. April 2009.
- Unerwartete Nebenwirkung: Einreiseverbot. Abgerufen am 8. September 2019.
- Wong M, Choo SP, Tan EH: Travel warning with capecitabine. In: Ann. Oncol.. 20, Nr. 7, Juli 2009, S. 1281. doi:10.1093/annonc/mdp278. PMID 19470576.
- Arzneimittelkommission der deutschen Ärzteschaft: Drug Safety Mail 2013-68 – Rote-Hand-Brief zu Xeloda® (Capecitabin): Risiko für schwere Hautreaktionen. 17. Dezember 2013.
- Fluorouracil, Capecitabin, Tegafur und Flucytosin: Empfehlung zur Testung und Behandlung. Bundesinstitut für Arzneimittel und Medizinprodukte, 4. August 2020, abgerufen am 27. März 2021.
- L. M. Henricks, C. A. T. C. Lunenburg, F. M. de Man, D. Meulendijks, G. W. J. Frederix, E. Kienhuis, G. J. Creemers, A. Baars, V. O. Dezentjé, A. L. T. Imholz, F. J. F. Jeurissen, J. E. A. Portielje, R. L. H. Jansen, P. Hamberg, A. J. Ten Tije, H. J. Droogendijk, M. Koopman, P. Nieboer, M. H. W van de Poel, C. M. P. W. Mandigers, H. Rosing, J. H. Beijnen, E. V. Werkhoven, A. B. P. van Kuilenburg, R. H. N. van Schaik, R. H. J. Mathijssen, J. J. Swen, H. Gelderblom, A. Cats, H. J. Guchelaar, J. H. M. Schellens: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. In: Lancet Oncol. Band 19, Nr. 11, November 2018, S. 1459–1467, doi:10.1016/S1470-2045(18)30686-7 (englisch).