Monoklonale Gammopathie
Bei der monoklonalen Gammopathie handelt es sich um einen Sammelbegriff verschiedener maligner aber auch nicht-maligner (Vor-)Erkrankungen, die mit einer monoklonalen Proliferation von Plasmazellen und einer vermehrten Produktion eines einzelnen Immunglobulins (Antikörper; IgG, IgA, IgM, IgD oder IgE) oder eines Fragmentes dessolchen (z. B. freie Leichtketten oder Schwerketten) einhergehen. In den meisten Fällen werden sowohl intakte Antikörper als auch freie Leichtketten produziert, es können aber auch ausschließlich intakte Antikörper oder ausschließlich freie Leichtketten vorkommen. Diese Produkte (monoklonale Antikörper) werden auch als M-Protein bezeichnet. In seltenen Fällen werden weder intakte Antikörper noch freie Leichtketten von den Plasmazellen produziert. Das M-Protein kann im Idealfall durch elektrophoretische Methoden (z. B. in einer Serumproteinelektrophorese) in der sogenannten γ-Fraktion nachgewiesen werden.[1][2]
| Klassifikation nach ICD-10 | |
|---|---|
| D47.2 | Monoklonale Gammopathie |
| ICD-10 online (WHO-Version 2019) | |
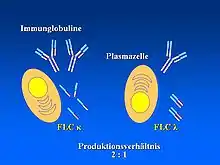
Neben den bekanntesten symptomatischen Formen, dem Multiplen Myelom (MM) und dem Plasmozytom sowie deren asymptomatische Vorstufen Schwelendes Multiples Myelom (SMM) oder Monoklonale Gammopathie unklarer Signifikanz (MGUS), sind der Morbus Waldenström, die AL-Amyloidose, die Monoklonale Gammopathie renaler Signifikanz (MGRS) sowie verschiedene seltenere Krankheitsbilder den monoklonalen Gammopathien zuzuordnen.[3][4] Übergeordnet zählen die monoklonalen Gammopathien zu den indolenten (niedrig-malignen) B-Zell-Non-Hodgkin-Lymphomen, wobei die symptomatischen Formen maligne Krebserkrankungen darstellen.
Verbreitung
| Häufigkeit verschiedener Formen monoklonaler Gammopathien | ||
|---|---|---|
| Typ | Häufigkeit[5] | |
| MGUS | 51 % | |
| SMM | 6 % | |
| Multiples Myelom | 18 % | |
| AL Amyloidose | 11 % | |
| Lymphoproliferative | 4 % | |
| Morbus Waldenström | 3 % | |
| Solitäres Plasmozytom | 1 % | |
| Andere | 6 % | |
Aufgrund der unterschiedlichen Ausprägungen der monoklonalen Gammopathien gibt es keine generelle Prävalenz oder Inzidenz. Beispielsweise liegt die Prävalenz einer MGUS bei Personen im Alter über 45 bis 75 Jahren bei 3,5 %.[6] In Deutschland liegt die Inzidenz für das Multiple Myelom bei 4–5 Neuerkrankungen je 100.000 Einwohner und Jahr.[7] Im Allgemeinen sind eine MGUS, eine AL Amyloidose und das Multiple Myelom die beiden häufigsten Formen der Monoklonalen Gammopathie.[5]
Ursache
Als mögliche Ursachen für die Entstehung Monoklonaler Gammopathien kommen insbesondere Veränderungen der Erbinformation in Frage. Mutationen verschiedener Gene sowie Translokationen sind hierbei in der Literatur beschrieben worden.[8] Diese Veränderungen werden von verschiedenen Faktoren begünstigt. Für die Entstehung einer monoklonalen Gammopathie unklarer Signifikanz ist ein Einfluss von Übergewicht, radioaktiver Strahlung, Autoimmunerkrankungen, entzündlicher Prozesse und Infektionen, Pestiziden sowie das Vorliegen bestimmter Einzelnukleotid-Polymorphismen beschrieben worden.[8]
Pathogenese
Typisch in der Entwicklung monoklonaler Gammopathien ist eine chromosomale Translokation von Genen, welche für die schweren Ketten von Immunglobulinen kodieren. Eine negative Prognose kann insbesondere für die Translokation t(4;14), t(14;16) und t(14;20) getroffen werden. Darüber hinaus sind auch Hyperdiploidien und Deletionen als Veränderungen beschrieben worden, die für die Pathogenese ursächlich sein können.[8][9][10] Ein Zusammenhang besteht hier für die Deletionen 1p, 13q und 17p. Ähnliche Daten gibt es für die Monosomie 13 und die Duplikation 1q.[11][12] Im weiteren Verlauf können Mutationen auftreten, die das Fortschreiten der monoklonalen Gammopathie und somit die Ausbildung einer symptomatischen Erkrankung bewirken können. Bekannt sind beispielsweise Mutationen der Gene N- und K-Ras, Myc und p53. Auch Veränderungen, welche den NF-κB-Signalweg aktivieren, können zur Weiterentwicklung der monoklonalen Gammopathie beitragen.[8][10][13] Speziell für die Entwicklung eines Morbus Waldenström konnten Mutationen unter anderem in den Genen MYD88, CXCR4 und ARID1 nachgewiesen werden.[8]
Klinische Erscheinungen
Monoklonale Gammopathien zeichnen sich generell durch eine typische wenn auch unspezifische Symptomatik aus. Prinzipiell unterscheidet man die nach klassischer Definition asymptomatischen Vorstufen MGUS und SMM sowie die verschiedenen symptomatischen Formen wie multiples Myelom, Morbus Waldenström und AL Amyloidose.[14] Patienten die an einer symptomatischen Form leiden, klagen zum Beispiel häufig über Knochenschmerzen, Müdigkeit und Schwäche. Durch eine adäquate Untersuchung kann eine Hyperkalzämie, eine Anämie, eine abnormale Anreicherung klonaler Plasmazellen im Knochenmark, Osteolysen, Ablagerungen monoklonaler Proteine in verschiedenen Geweben, eine eingeschränkte Nierenfunktion oder eine Proteinurie nachgewiesen werden. Es können, müssen aber nicht alle Symptome gleichzeitig auftreten. Zunehmend konnten neuere Studien das Auftreten von Symptomen auch bei den Vorstufen MGUS und SMM zeigen, die zum Teil auch mit schwerwiegenden Folgen verbunden sein können. So wird zwischenzeitlich z. B. eine rein asymptomatische MGUS von einer symptomatischen MGRS abgegrenzt, welche aber auch gleichzeitig nicht die Kriterien eines Multiplen Myeloms erfüllt.[4] Die klinische Erscheinung verschiedener monoklonaler Gammopathien kann recht unterschiedlich sein, weswegen insbesondere die Einteilung in asymptomatische und symptomatische Formen in Hinblick auf eine Therapie von besonderem Interesse ist.[8] Eine kurze Übersicht findet sich im Abschnitt Untersuchungsmethoden dieses Artikels.
Untersuchungsmethoden
Generelles
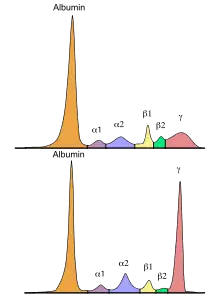
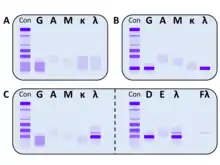
Eine monoklonale Gammopathie wird besonders im frühen Stadium oft nur zufällig diagnostiziert. Der Verdacht ergibt sich häufig aus einer auffälligen Serumproteinelektrophorese mit einer typischen Bande im Gel bzw. Spitze im Histogramm (sogenannter M-Gradient), welche in vielen (aber nicht allen) Fällen in der γ-Fraktion zu finden ist. Für eine eindeutige Bestimmung und Charakterisierung des M-Proteins ist zusätzlich eine Immunfixation und die Bestimmung der freien Leichtketten im Serum erforderlich.[15] Pathologische Konzentrationen freier Leichtketten lassen sich teilweise auch im Urin nachweisen. Man spricht dann von einer Bence-Jones-Proteinurie. In vielen Fällen kann auch die Symptomatik ein Hinweis auf das Vorliegen einer monoklonalen Gammopathie sein. Bestimmte Patientengruppen (z. B. Osteoporose- und Polyneuropathie-Patienten) weisen zudem eine erhöhte Prävalenz für das Vorliegen einer monoklonalen Gammopathie auf, was bei der Untersuchung berücksichtigt werden sollte.[8][16][17]
Ausschlussdiagnostik
Eine umfassende Ausschlussdiagnostik kann folgende Untersuchungsmethoden enthalten, die ggf. noch erweitert werden können:[8]
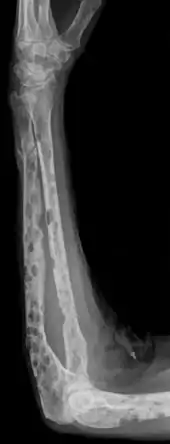
_MG_stain.jpg.webp)
| Überblick Ausschlussdiagnostik | ||
|---|---|---|
| Labordiagnostik | Histologie | Bildgebende Methoden |
|
||
Differenzierung
Nachfolgend sind die diagnostischen Kriterien und der typische klinische Verlauf verschiedener monoklonaler Gammopathien wiedergegeben. Einige dieser Formen können weiter unterteilt werden und zudem kombiniert auftreten. Beispielsweise können monoklonale Gammopathien, bei denen eine Beteiligung der Niere vorliegt, als MGRS eingestuft werden.[4] Typisch für die Einstufung einer symptomatischen Erkrankung, insbesondere dem multiplen Myelom, ist das Vorliegen eines CRAB- oder SLiM-Kriteriums (CRAB-Kriterien, aus dem Englischen für HyperCalcemia (Hyperkalzämie), Renal Insufficiency (Niereninsuffizienz), Anemia (Anämie) und Bone Lesions (Osteolysen); SLiM-Kriterien ebenfalls aus dem Englischen für Sixty percent bone marrow plasma cells (≥ 60 % klonale Plasmazellen im Knochenmark), Involved:uninvolved serum free Light chain ratio ≥100 (Ratio der involvierten zur nicht-involvierten freien Leichtkette im Serum ≥ 100; wobei die Konzentration ≥ 100 mg/l sein muss) und > 1 focal lesions on MRI studies (> 1 Knochenläsion, nachgewiesen durch MRT)).[14] Außerdem gibt es weitere spezifische Kriterien um eine genauere Differenzierung vorzunehmen. Nachfolgend die prominentesten Beispiele:
| Diagnostische Kriterien und klinischer Verlauf monoklonaler Plasmazell-Erkrankungen (Auswahl)[14][18][19][20][21] | |
|---|---|
| Erkrankung | Diagnostische Kriterien |
| MGUS |
|
| SMM |
|
| MM |
|
| Morbus Waldenström | |
| AL Amyloidose |
|
Behandlung
Bei symptomatischen Erkrankungen, bei denen eine Besserung nur durch die gezielte Unterdrückung des zugrundeliegenden Plasmazellklons möglich ist, stellt der Einsatz einer Chemotherapie, eine Stammzelltransplantation sowie die Verabreichung moderner Pharmazeutika wie monoklonaler therapeutischer Antikörper die Methode der Wahl dar. Seit einiger Zeit sind besonders effektive therapeutische monoklonale Antikörper verfügbar und konnten in klinischen Studien bereits vielversprechende Ergebnisse liefern. Neben diesen kurativen Therapiemethoden können palliative Therapeutika zur Verbesserung des Allgemeinzustands der Patienten beitragen. Eine Entscheidung der durchzuführenden Therapie muss anhand aller verfügbaren Befunde individuell und abhängig von der vorliegenden Form der monoklonalen Gammopathie gefällt werden.[8][22][23][24][25][26]
Vorbeugung
Verschiedene Risikofaktoren wie Übergewicht, Strahlung und schädliche Chemikalien wie Pestizide sollten vermieden werden, da diese als Auslöser der Erkrankung diskutiert werden.[8] Weitere vorbeugende Maßnahmen zur primären Entstehung einer monoklonalen Gammopathie können nach bisherigem Wissensstand nicht ergriffen werden. Eine regelmäßige Untersuchung bereits erkrankter Patienten kann allerdings einer Weiterentwicklung und Verschlechterung der Erkrankung, deren Symptome und auch vieler Begleiterscheinungen vorbeugen.
Heilungsaussicht
Die Heilungsaussichten sind abhängig von der zugrundeliegenden monoklonalen Gammopathie und können hier nicht verallgemeinert dargestellt werden. Bei malignen Erkrankungen ist heutzutage durch die fortschreitende Entwicklung hocheffizienter Therapeutika eine Heilung in erreichbare Nähe gerückt.[23] Wie bei allen Krebserkrankungen bleibt immer ein Restrisiko für ein Rezidiv bestehen. Durch eine regelmäßige Untersuchung des Patienten kann ein Rezidiv frühzeitig erkannt und umgehend eine Therapieentscheidung getroffen werden.
Weblinks
Einzelnachweise
- GP Mead et al.: Serum free light chains for monitoring multiple myeloma. In: Br J Hematol. 126, Nr. 3, 29. März 2004, S. 348–354. doi:10.1111/j.1365-2141.2004.05045.x. PMID 15257706.
- The International Myeloma Working Group: Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. In: Br J Hematol. 121, Nr. 5, 2. September 2002, S. 749–757. PMID 12780789.
- N. Leung, S. V. Rajkumar,: Renal Manifestations of Plasma Cell Disorders. In: American Journal of Kidney Diseases. Nr. 50, 2007, S. 155–165 (Abstract).
- N Leung et al.: Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. In: Blood. 120, Nr. 22, 9. Oktober 2012, S. 4292–4295. doi:10.1182/blood-2012-07-445304. PMID 23047823.
- RA. Kyle et al.: Monoclonal gammopathy of undetermined significance. In: Br J Haematol. 134, Nr. 6, 2006, S. 573–589. doi:10.1111/j.1365-2141. PMID 16938117.
- RA. Kyle et al.: Prevalence of monoclonal gammopathy of undetermined significance. In: N Engl J Med. 354, Nr. 13, 2006, S. 1362–1369. doi:10.1056/NEJMoa054494. PMID 16571879.
- Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (GEKID) Hochrechnung des Institut für Krebsepidemiologie e.V., Lübeck für icd10: C90 auf Basis der Daten der Krebsregister BY, BR, HB, HH, MV, NI, NW (Reg.Bez. Münster) SL, SN, SH (2005–2009), abgerufen am 27. Oktober 2017.
- N van de Donk et al.: The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. In: Haematologica. 99, Nr. 6, 21. März 2014, S. 984–96. doi:10.3324/haematol.2013.100552. PMID 23224402. PMC 4040895 (freier Volltext).
- GJ Morgan et al.: The genetic architecture of multiple myeloma. In: Nat Rev Cancer. 12, Nr. 5, Mai 2012, S. 335-48. doi:10.1038/nrc3257. PMID 22495321.
- M Chesi et al.: Advances in the pathogenesis and diagnosis of multiple myeloma. In: Int Jnl Lab Hem. 2015, S. 108–114. doi:10.1111/ijlh.12360. PMID 25976968.
- R Fonseca et al.: International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. In: Leukemia. 23, Nr. 12, Dezember 2009, S. 2210-21. doi:10.1038/leu.2009.174. PMID 19798094. PMC 2964268 (freier Volltext).
- NC Munshi et al.: Guidelines for risk stratification in multiple myeloma: report of the International Myeloma Workshop Consensus Panel 2. In: Blood. 117, Nr. 18, Mai 2011, S. 4696–4700. doi:10.1182/blood-2010-10-300970. PMID 21292777. PMC 3293763 (freier Volltext).
- A Zingone et al.: Pathogenesis of Monoclonal Gammopathy of Undetermined Significance (MGUS) and Progression to Multiple Myeloma. In: Semin Hematol. 48, Nr. 1, 1. Januar 2012, S. 4–12. doi:10.1053/j.seminhematol.2010.11.003. PMID 21232653. PMC 3040450 (freier Volltext).
- SV Rajkumar et al.: International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. In: Lancet. 15, Nr. 12, 15. November 2014, S. e538-48. doi:10.1016/s1470-2045(14)70442-5. PMID 25439696.
- A Dispenzieri et al.: International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. In: Leukemia. 23, Nr. 2, Februar 2009, S. 215–224. doi:10.1038/leu.2008.307. PMID 19020545.
- T Golombick et al.: Prevalence of monoclonal gammopathy of undetermined significance/myeloma in patients with acute osteoporotic vertebral fractures. In: Acta Haematol. 120, Nr. 2, 14. Oktober 2008, S. 87–90. doi:10.1159/000162282. PMID 18852483.
- N Steiner et al.: Are neurological complications of monoclonal gammopathy of undetermined significance underestimated?. In: Oncotarget. 8, Nr. 3, 10. Dezember 2016, S. 5081–5091. doi:10.18632/oncotarget.13861. PMID 27974705. PMC 5354894 (freier Volltext).
- SM Ansell et al.: Diagnosis and management of Waldenstrom macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. In: Mayo Clin Proc. 85, Nr. 9, September 2010, S. 824–833. doi:10.4065/mcp.2010.0304. PMID 20702770. PMC 2931618 (freier Volltext).
- RG Owen et al.: Guidelines on the diagnosis and management of Waldenstrom macroglobulinaemia. In: Br J Hematol. 165, Nr. 3, Mai 2014, S. 316–333. doi:10.1111/bjh.12760. PMID 24528152.
- J Gillmore et al.: Guidelines on the diagnosis and investigation of AL amyloidosis. In: Br J Hematol. 168, Nr. 2, 14. Oktober 2014, S. 207-18. doi:10.1111/bjh.13156. PMID 25312307.
- SH Nasr et al.: Renal monoclonal immunoglobulin deposition disease: a report of 64 patients from a single institution. In: Clin J Am Soc Nephrol. 7, Nr. 2, 14. Dezember 2011, S. 231-9. doi:10.2215/CJN.08640811. PMID 23047823.
- Mateos & González-Calle: Smoldering Multiple Myeloma: Who and When to Treat. In: Clin Lymphoma Myeloma Leuk. 17, Nr. 11, November 2017, S. 716–722. doi:10.1016/j.clml.2017.06.022. PMID 28709797.
- MA Bärtsch et al.: Aktuelle Aspekte bei der Diagnostik und Therapie des Plasmazellmyeloms. In: Dtsch Med Wochenschr. 142, Nr. 11, 2017, S. 800–804. doi:10.1055/s-0043-100295.
- JP Bridoux et al.: How I treat monoclonal gammopathy of renal significance (MGRS). In: Blood. 122, Nr. 22, 9. Oktober 2013, S. 3583–3590. doi:10.1182/blood-2013-05-495929. PMID 24108460.
- MA Dimopoulos et al.: Treatment recommendations for patients with Waldenstrom macroglobulinemia (WM) and related disorders: IWWM-7 consensus. In: Blood. 124, Nr. 9, 17. Juli 2014, S. 1404-11. doi:10.1182/blood-2014-03-565135. PMID 4148763.
- MA Gertz et al.: Immunoglobulin light chain amyloidosis: 2016 update on diagnosis, prognosis, and treatment. In: Am J Hematol. 91, Nr. 9, 17. August 2016, S. 947-56. doi:10.1002/ajh.24433. PMID 27527836.