Onkologie
Die Onkologie (von altgriechisch ὄγκος onkos ‚Anschwellung, Geschwulst‘, und -logie - Lehre, veraltet Cancerologie) oder Lehre von den Geschwulstkrankheiten ist eine medizinische Wissenschaft, die sich insbesondere mit der Erkrankung Krebs befasst. Sie widmet sich vor allem der Prävention, Diagnostik, Therapie und Nachsorge von malignen (bösartigen) Tumoren.
Die Onkologie ist von der interdisziplinären Zusammenarbeit medizinischer Fachrichtungen geprägt. Folgende Fachrichtungen können beispielhaft, etwa im Rahmen eines Tumorboards, beteiligt sein: alle chirurgischen Fachdisziplinen, Internistische Onkologie, Strahlentherapie, Nuklearmedizin, Pathologie, Pharmakologie, Psychoonkologie, Interventionelle Radiologie, Diagnostische Radiologische Endoskopie, Interventionelle Endoskopie.[1]
Geschichte

Bereits in der Antike beschäftigten sich Ärzte mit Tumoren. So wird ein Abschnitt im Papyrus Edwin Smith (ca. 2500 v. Chr.) zitiert, der einen Brusttumor beschreibt. Bekannt sind auch die lakonischen Beschreibungen im Corpus Hippocraticum über „versteckte Krebse“ (karkinoi kryptoi)[3] in der Brust und anderen Körperteilen. Diese „Schwellungen“ galten als unheilbar, auch wenn es Versuche gab, sie durch operative Eingriffe zu entfernen (Archigenes, 2. Jahrhundert). Auch während des Mittelalters konnten die überkommenen pathogenetischen Vorstellungen nicht zu einer erfolgreichen Therapie führen. Erst lange nach Beginn der Aufklärung konnten Forscher wie Henry François Le Dran (1685–1770) in Körpern Verstorbener die wesentlichen Entwicklungsschritte (wenn auch noch nicht die Ursache) von Krebserkrankungen nachvollziehen. Chirurgen wie John Hunter (1728–1793) erkannten, dass solide Tumoren vor ihrer tödlichen Ausbreitung noch eine gewisse Zeit lang örtlich begrenzt und damit heilbar sind.
Chirurgie war im 19. und frühen 20. Jahrhundert die erste Disziplin, die eine stadiengerechte, individuell angepasste Vorgehensweise gegenüber Krebserkrankungen entwickelte; dazu in die Lage versetzt durch Entwicklungen der Asepsis und der Anästhesie, verbunden mit Namen wie William Stewart Halsted, Theodor Billroth, Sampson Handley, und vielen weiteren. Eine wesentliche Aufgabe der Chirurgen war damals, und ist es noch heute, die örtlich begrenzten, operablen Tumoren auszuwählen und nutzlose Eingriffe zu vermeiden. War der Krebs einmal metastasiert, musste man sich auf palliative Behandlungen beschränken. Arbeiten wie die von Stephen Paget brachten subtilere Kenntnisse über die zu erwartende Ausbreitung. Entdeckte man sie dennoch erst während der Operation, so musste man diese unverrichteter Dinge beenden. Bis heute gibt es noch solche diagnostischen Eingriffe, etwa in der Bauchhöhle (explorative Laparotomie), allerdings werden sie mit der Verbesserung der radiologischen Bildgebung immer seltener.
Da zu Beginn nur operierte Patienten überhaupt eine Heilungschance hatten, kam es noch bis in das 20. Jahrhundert zu heroischen, nach heutigem Maßstab unmenschlichen Eingriffen, etwa Halsteds „radikale Mastektomie“, bei der auch Brustmuskeln und Rippenteile entfernt wurden.[4] Sie wurden erst verlassen, als die Strahlentherapie und später die Chemotherapie als weitere „Säulen“ der Krebsbehandlung neben der Chirurgie errichtet wurden.

Als erster Strahlentherapeut der Welt gilt der Wiener Leopold Freund, der 1897 zu veröffentlichen begann und 1908 eine Übersicht seiner Erfahrung mit Röntgenstrahlen gegen Karzinome publizierte. Den physikalischen Entdeckungen auf Schritt und Tritt folgend verbreitete sich zuerst die Behandlung mit Strahlung aus Röntgenröhren (die nur geringe Tiefen erreichte), dann mit natürlichen radioaktiven Proben meist aus dem von den Curies entdeckten Radium, dann mit künstlichen Radionukliden wie I-131, und zuletzt mit hochenergetischer Photonen- und Teilchenstrahlung aus Beschleunigern. Zunächst arbeiteten Radiologen mit allen diesen Verfahren. 1976 machte die zunehmende Differenzierung es notwendig, neue Facharztbezeichnungen für Strahlentherapie[5] und Nuklearmedizin in der Weiterbildungsordnung einzuführen, die in größeren Krankenhäusern nun gemeinsam die onkologischen Konferenzen besetzen müssen. Etwa jeder zweite Krebspatient wird heute auch, oder nur, mit Strahlentherapie behandelt.
Die Chemotherapie begann während des Zweiten Weltkriegs, als im Labor der Yale School of Medicine 1942 zufällig die Wirkung von Senfgas gegen Lymphome, eine Krebserkrankung der blutbildenden Zellen, entdeckt wurde. Nach Kriegsende wurde daraus das erste an Patienten angewendete Zytostatikum Stickstofflost weiterentwickelt. Etwa zur gleichen Zeit gelangen Sidney Farber in Boston die ersten Erfolge gegen Leukämie bei Kindern, mit einem Vorläufer des noch heute eingesetzten Methotrexat. Solche „diffusen“ Krebserkrankungen des Blutes und Knochenmarks waren viel besser durch die Chemotherapie erreichbar als die „soliden“ Tumoren (Brustkrebs, Lungenkrebs etc.), und einige davon sind heute sogar heilbar, sodass die herkömmliche Doktrin, jeder Tumor müsse örtlich radikal behandelt werden, nicht länger haltbar blieb. Die Chemotherapie ist heute die Methode der Wahl gegen Leukämien und Lymphome. Und auch bei soliden Tumoren zielt die in Kooperation der genannten Fachgebiete entwickelte Strategie heute darauf ab, die örtliche Begrenzung der Erkrankung, falls sie nicht mehr gegeben ist, durch Chemotherapie wiederherzustellen, und damit der örtlichen Strahlenbehandlung und Operation wieder einen Zugang zu geben. Die moderne Chemotherapie verwendet „herkömmliche“ Substanzen (Zytostatika), und eine schnell wachsende Zahl von sogenannten Biologicals, also Substanzen, die in die Signalwege der Krebszellen gezielt eingreifen. Die Komplexität dieses Gebietes erforderte 2009 eine eigene Schwerpunktbezeichnung, den Arzt für Hämatologie und Internistische Onkologie.
Risikofaktoren für Krebserkrankungen
- Tabak
- Tabak-Exposition ist die häufigste Ursache für Krebs.[6] Rauchtabak ist stark mit einem erhöhten Risiko für Krebserkrankungen von Lunge, Larynx, Mund, Speiseröhre, Hals, Gehirn, Blase, Niere, Leber, Magen, Pankreas, Kolon, Rektum und Zervix sowie für akute myeloische Leukämie verbunden, rauchloser Tabak (Schnupftabak oder Kautabak) mit einem erhöhten Risiko für Mundkrebs, Speiseröhrenkrebs und Bauchspeicheldrüsenkrebs.[7]
- Alkohol
- Alkoholkonsum erhöht das Risiko für Mund-, Rachen-, Speiseröhren-, Kehlkopf-, Leber- und Brustkrebs. Das Krebsrisiko ist viel höher für diejenigen, die Alkohol trinken und auch Tabak konsumieren.[8]
- Adipositas
- Adipöse Personen haben ein erhöhtes Risiko für Brust-, Dickdarm-, Mastdarm-, Endometrium-, Speiseröhren-, Nieren-, Bauchspeicheldrüsen- und Gallenblasen-Krebs.[9]
- Alter
- Fortgeschrittenes Alter ist ein Risikofaktor für viele Krebsarten. Das Durchschnittsalter der Krebsdiagnose beträgt 66 Jahre.[10]
- Krebsverursachende Substanzen
- Krebs wird durch Veränderungen bestimmter Gene verursacht, die die Funktionsweise unserer Zellen verändern. Einige von ihnen sind das Ergebnis von Umweltexpositionen, die DNA-Schäden verursachen. Diese Expositionen können Substanzen wie die Chemikalien im Tabakrauch oder Strahlung wie Ultraviolettstrahlung von der Sonne und andere Karzinogene umfassen.
- Infektionserreger
- Bestimmte Infektionserreger, einschließlich Onkoviren, Bakterien und Parasiten, können Krebs verursachen.
- Immunsuppression
- Die Immunantwort des Körpers spielt eine Rolle bei der Abwehr von Krebs. Bestimmte Krebsarten treten bei Menschen mit Immunsuppression häufiger auf.
Prävention
Unter Krebsprävention fallen Maßnahmen oder Verhaltensregeln, die die Entstehung von Krebserkrankungen verhindern oder zumindest die Wahrscheinlichkeit für eine solche Erkrankung herabsetzen sollen. Von zentraler Bedeutung ist es, Risikofaktoren zu erkennen. Wird ein Risikofaktor erkannt, versucht man diesen zu reduzieren. Beispiele sind Expositionsverhinderung durch TRK-Werte für krebsauslösende Substanzen oder Verhaltensinterventionen bei Raucherentwöhnung. Anhand von Risikofaktoren können auch besonders gefährdete Personengruppen identifiziert und Screening-Untersuchungen zugeführt werden. Ziel ist hier, malignes Zellwachstum zu erkennen und zu behandeln, möglichst bevor eine Krebserkrankung ausbricht oder sich ausbreitet (Früherkennung).
Diagnostik
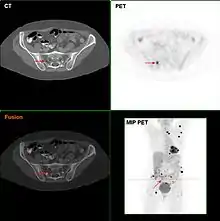
Aufgabe der onkologischen Diagnostik ist es, Tumorerkrankungen so früh wie möglich zu erkennen, und dann deren Ausbreitung im Körper genau zu beschreiben.
Die Krebsfrüherkennung ist noch keine Aufgabe der spezialisierten Onkologen; vielmehr sind daran alle Arztgruppen, insbesondere Haus- und Frauenärzte und Urologen beteiligt. Krebserkrankungen werden damit nicht verhindert, aber generell sind Tumoren in frühen Stadien viel erfolgversprechender und auch schonender zu behandeln. Da Krebs bei älteren Menschen häufiger auftritt, sind sie stärker zu solchen Untersuchungen aufgerufen. Es haben sich für die wichtigsten Krebsarten feste Untersuchungsrhythmen und -methoden herausgebildet, beispielsweise die Inspektion der Haut alle zwei Jahre, oder die Darmspiegelung alle 10 Jahre. Auch die Patienten selbst können beitragen, etwa mit der Brustselbstuntersuchung. Sogenannte "Tumormarker" im Blut sind zu unspezifisch, um die Vorsorge sinnvoll zu unterstützen; es gibt zu viele falsche Alarme. Nur das PSA hat in der Praxis Bedeutung erlangt. Auch bildgebende Verfahren wie Ultraschall, Computertomographie, oder Kernspintomographie eignen sich wenig zur Prävention in der gesunden Allgemeinbevölkerung. Der Einsatz von Röntgenstrahlen bei Vorsorgeuntersuchungen ist in den Ländern der Europäischen Union sogar verboten, mit Ausnahme des organisierten Brustkrebsscreenings.
Wurde eine Krebserkrankung entdeckt, dann muss ihre Ausbreitung genau festgestellt werden, bevor über die beste Therapie beraten werden kann. Die Erkrankungsfälle werden in Stadien mit ähnlicher Therapie und Prognose eingeordnet. Die Leitlinien enthalten genaue Vorgaben für diese Stadienbestimmung (englisch staging). Sie basieren auf Anamnese und körperlicher Untersuchung, Blutuntersuchungen, und fast immer auf Schnittbildverfahren wie Computer- und Kernspintomographie sowie der (allerdings teuren) PET. Jede Tumorart bevorzugt bestimmte Ausbreitungswege, etwa bestimmte Lymphknoten, Leber oder Skelett, die gezielt abgesucht werden. Blutmesswerte sind etwa bei Leukämien oder dem multiplen Myelom wesentlich.
Der Allgemeinzustand des Patienten ist eines der wichtigsten Kriterien für die Behandlungswahl; er wird nach standardisierten Skalen dokumentiert. Gleichzeitig muss der Tumor biopsiert und vom Pathologen histologisch (feingeweblich) beurteilt werden: von welchem Ursprungsgewebe stammt er? Wie stark ist seine Entartung, wie hoch seine Teilungsrate (Wachstumstendenz)? Auf welche Medikamente würde er voraussichtlich ansprechen? Zahlreiche Spezialfärbungen der Molekularpathologie sind hier mindestens gleichrangig neben die klassische Betrachtung der Präparate unter dem Mikroskop getreten, und die Befunde aus der Pathologie gehen weit über das herkömmliche Grading hinaus.
Alle diese Informationen müssen möglichst schnell gesammelt und aufbereitet werden. Meist übernehmen in dieser Phase die Fachärzte der "passenden" onkologischen Ausrichtung (beispielsweise Chirurgie beim Lungenkrebs) die Organisation und Patientenführung vom Hausarzt. In den Industrieländern gibt es überall spezialisierte Tumorzentren, die an den größeren Krankenhäusern angesiedelt sind und besonderen Qualitätsrichtlinien folgen. Dazu gehört, dass jeder neue Fall in einer standardisierten Beratung (Tumorboard) unter Klinikern, Radiologen und Pathologen besprochen und der Konsens dokumentiert wird.
Klassifikation
Neu diagnostizierte Tumoren werden in standardisierte Klassifikationen eingeordnet. Besonders umfassend ist die International Classification of Diseases for Oncology, eine Erweiterung der ICD-10 für die Onkologie, die jeden Tumor nach zwei Achsen klassifiziert: ein Code aus Buchstaben und Ziffern kennzeichnet den Ort (z. B. C50.3 L = „unterer innerer Quadrant der linken Brust“), und ein Zifferncode beschreibt die Gewebeart (z. B. 8230/2 = „solides duktales Carcinoma in situ“). Dazu kommen Angaben über die Ausbreitung, meist nach dem sogenannten TNM-Schema, die für jede Tumorart individuell definiert ist (beispielsweise beim Brustkrebs pT1a pN1 M0 L0 = „operativ gesicherte Tumorgröße unter 6 mm, 1-3 befallene Lymphknoten, keine Fernmetastasen, kein Lymphgefäßeinbruch“). Die sogenannte Tumorformel ist prominent in den Protokollen der Tumorboards und allen onkologischen Arztbriefen enthalten. Man kann die Patientin damit in Gruppen mit abnehmender Heilungswahrscheinlichkeit stratifizieren und eine standardisierte Aussage zur Operabilität machen. Oft wird auch nach den UICC-Stadien klassifiziert, die zur Unterscheidung mit römischen Ziffern bezeichnet sind, sonst aber ähnlich aufgebaut sind. Für viele Tumorarten, etwa Lymphome und Melanome, gibt es eigene Systeme. Die Therapieleitlinien stützen sich stark auf solche Klassifikationen.
Therapie
Behandlungsmethoden der Onkologie sind unter anderem:
- Chirurgische Tumorentfernung
- Strahlentherapie, in der das Tumorgewebe mit ionisierender Strahlung behandelt wird
- Chemotherapie mit Zytostatika
- Medikamentöse Therapie mit relativ neuen Wirkstoffen wie monoklonalen Antikörpern (Krebsimmuntherapie) oder Tyrosinkinase-Inhibitoren.
Die Therapien der Onkologie zielen entweder auf die Entfernung oder Zerstörung des gesamten Tumorgewebes (kurative Therapie) oder, wenn dies nicht mehr möglich ist, auf die Verkleinerung des Tumorgewebes mit dem Ziel, die Lebenszeit der Patienten zu verlängern und ihre tumorbedingten Beschwerden zu reduzieren (Palliation).
Für verschiedene Geschwulstarten haben sich spezielle Therapieschemata etabliert, die in großen internationalen Untersuchungen laufend optimiert werden (Therapieoptimierungsstudien). Ausgehend vom festgestellten Stadium werden mit dem Patienten mögliche Therapieoptionen erörtert. Hierbei spielen der körperliche Allgemeinzustand und die Begleiterkrankungen eine wesentliche Rolle. Die nach aktuellem Stand der Wissenschaft erfolgversprechende Therapieform wird dem Patienten vorgeschlagen. Möglichkeiten sind die einmalige oder mehrmalige Chemotherapie und/oder Bestrahlung und/oder eine Operation zur Entfernung des Tumorgewebes. Verschiedene Chemotherapeutika können kombiniert werden.
Weitere mögliche Therapiebestandteile mit Onkologiebezug:
- Psychoonkologie zur Mitbehandlung psychischer Komplikationen onkologischer Erkrankungen
- Patientenkompetenz zur Stärkung der mentalen und emotionalen Verfassung von Krebspatienten
- Chronoonkologie zur Verbesserung der Effizienz der Tumorbehandlung bei gleichzeitiger Verringerung unerwünschter Nebenwirkungen
Tumorchirurgie
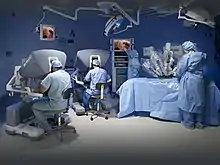
Tumorchirurgie ist kein eigenes Fachgebiet, sondern Bestandteil der Facharztweiterbildungen aller operativen Gebiete, vor allem der Kopf-Hals-Chirurgie, Thoraxchirurgie, Bauchchirurgie, sowie der urologischen und gynäkologischen Chirurgie. Obwohl die Herangehensweisen in all diesen Körperregionen unterschiedlich sind, gibt es einige gemeinsame Prinzipien. In fast allen Fällen muss die klinische und radiologische Diagnose zuerst durch eine Gewebeprobe gesichert werden. Oft (etwa in der weiblichen Brustdrüse) genügt dazu eine Stanzbiopsie in örtlicher Betäubung, manchmal (etwa aus der Lunge) muss das fragliche Gewebe in einer Operation gewonnen werden. Dazu gibt es herkömmliche (offene), und endoskopische Eingriffe. In einigen Gebieten, vor allem bei Gehirnoperationen, etablieren sich bildgestützte Navigationsverfahren, und viele Operationen der Prostata werden in Deutschland heute robotergestützt durchgeführt.
Wird ein aggressiver Tumor (z. B. ein Sarkom) vermutet, dann muss die Biopsie so geplant werden, dass der Zugangsweg gegebenenfalls später mitentfernt werden kann; es sollte beispielsweise an Extremitäten nicht durch mehrere Muskellogen hindurch biopsiert werden. Die eigentliche Tumorentfernung (Resektion) richtet sich ebenfalls nach onkologischen Erkenntnissen, d. h. es wird nicht nur mit bloßem Auge sichtbares Tumorgewebe entfernt, sondern auch der vermutete nächste Ausbreitungsweg, z. B. aus der Lunge das komplette befallene Segment, oder mit einem Enddarmtumor auch das ganze umliegende Fettgewebe bis zur mesorektalen Faszie. Inoperabilität kann bestehen, weil wichtige Nachbarstrukturen bereits infiltriert sind (vor allem große Blutgefäße), oder weil der Patient in zu schlechtem Allgemeinzustand ist („internistische Inoperabilität“). Manchmal kann in diesen Fällen noch ein begrenzter Eingriff zur Palliation (Symptomlinderung) wirken, etwa um die Blutung eines Speiseröhrentumors zu stoppen, oder den Hirndruck bei einem fortgeschrittenen Glioblastom zu mindern. Dabei ist sorgfältig abzuwägen, ob der Eingriff dem Patienten nicht mehr schaden als nützen würde. Als Alternative gibt es oft weniger invasive palliative Methoden, etwa Hochfrequenzablation von Leberherden, oder Embolisation von blutenden Arterien. Bei der Operation zurückgelassenes Tumorgewebe kann mit einer Strahlentherapie oder Radiochemotherapie nachbehandelt werden.
Strahlentherapie
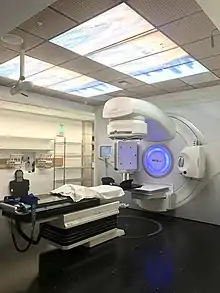
Die Strahlentherapie von Krebserkrankungen (Radioonkologie) kann kurativ (heilend), adjuvant bzw. additiv (zusätzlich zur Operation), oder palliativ eingesetzt werden. Nach dem Ziel richtet sich die Dosis. Beispielsweise sollte ein in kurativer Absicht bestrahlter Speiseröhrentumor mindestens 60 Gray erhalten; nach der Operation eines Darmtumors werden auf dessen vorherige Region 50 Gy angewendet, und für die palliative Behandlung von Gehirnmetastasen sind ungefähr 36 Gy üblich - immer die konventionelle Aufteilung auf 2 Gy täglich, 5 Termine pro Woche vorausgesetzt. Diese weitverbreitete Aufteilung ist relativ schonend. Andere Fraktionierungen sind möglich, um die Gesamtbehandlungszeit zu verkürzen oder die Wirkung zu erhöhen. Es gibt Bestrahlungen aus der Ferne (mit Linearbeschleunigern) und aus der Nähe (mit aufgelegten oder in den Körper eingeführten radioaktiven Quellen). Moderne Linearbeschleuniger können intensitätsmoduliert arbeiten und besitzen eingebaute Röntgenröhren oder CT zur täglichen Lagekontrolle. Viele Therapien vor allem bei jüngeren Patienten werden zur besseren Wirkung mit Chemotherapie kombiniert. Dafür gibt es definierte Schemata, bei denen beispielsweise während einer 6-wöchigen Strahlentherapie die Chemotherapie in der 1. und 5. Woche zugegeben wird. Nach Operationen sollte die Wundheilung abgewartet werden. Prinzipiell ist es aber sinnvoll, die Strahlentherapie, die mehrere Wochen dauert, so früh wie möglich einzuleiten.
Die Wirkung der Strahlentherapie ist bei einigen Tumoren ähnlich gut wie die der Operation (Speiseröhre, Prostata), bei anderen wird sie unterstützend oder für inoperable Patienten eingesetzt. Das Tumorgewebe spielt eine große Rolle. Lymphome sind zum Beispiel sehr strahlenempfindlich, Sarkome eher wenig. Strahlenempfindliche Körpergewebe wie die Lunge, die Nieren, das Rückenmark müssen peinlich geschont werden. Es gibt nur ein kleines therapeutisches Fenster zwischen der Dosis, die zur Zerstörung von Tumorgewebe notwendig ist, und der maximalen Dosis, die gesundes Körpergewebe ertragen kann. Die Dosisverteilung wird deshalb zu Beginn und oft auch später wiederholt auf Schnittbildern des Patienten individuell berechnet und simuliert. Dazu ist die verantwortliche Mitwirkung von fachkundigen Medizinphysikexperten erforderlich. Die konkrete Bedienung der Geräte obliegt medizinisch-technischen Radiologieassistenten. Diese Berufsgruppen müssen eng zusammenarbeiten. Die Patienten müssen millimetergenau positioniert werden. Eine standardisierte Qualitätssicherung des gesamten Ablaufes ist unabdingbar.
Typische Nebenwirkungen sind örtliche schmerzhafte Hautrötungen, Müdigkeit, und vorübergehende Entzündungen von Schleimhäuten innerhalb des Bestrahlungsgebietes. Schwerwiegende Nebenwirkungen treten bei <5 % auf. Strahlentherapeutische Patienten müssen über längere Zeit nachverfolgt werden, weil solche Nebenwirkungen auch nach Monaten und Jahren auftreten können. Gefürchtete Spätfolgen sind etwa Darmverschlüsse, chronische Harnblasenentzündungen, oder bei Bestrahlung im Brustbereich Herzinfarkte.
Chemotherapie

Klassische Chemotherapeutika sind Zytostatika, also Substanzen, die das Wachstum von Tumorzellen hemmen oder sie möglichst selektiv abtöten. Sie gelangen mit dem Blutstrom in den Tumor, weswegen sie gegen schlecht durchblutete große Tumoren wenig wirken. Zudem erreichen sie in der Regel nur maximal 4–5 Zehnerpotenzen Zellreduktion. Es ist daher oft sinnvoll, große Tumormassen vor der Chemotherapie operativ zu entfernen (debulking). Oft werden die Zytostatika in festen Kombinationen angewendet, etwa die seit Jahrzehnten bewährte CHOP-Therapie gegen Lymphome. Die meisten der etwa 50 verschiedenen Substanzen greifen in die DNA-Synthese ein (Alkylantien, Antimetabolite und weitere) oder stören wie die Mitosegifte die Zellteilung. Es gibt Stoffe in Tablettenform; die meisten werden aber intravenös gespritzt. Ihre Wirkung ist nicht auf Tumorzellen beschränkt, nutzt nur deren höhere Teilungsrate (Wachstumsfraktion). Alle Zytostatika sind deshalb mehr oder weniger toxisch, vor allem auf empfindliche Organe wie das Knochenmark, Keimdrüsen, und der Magen-Darm-Trakt. Oft müssen die Patienten für ihre Chemotherapie ins Krankenhaus, fast immer sind Begleittherapien gegen Übelkeit erforderlich, und schwerkranke Patienten tolerieren nicht immer die volle empfohlene Dosis. Besser verträglich sind antihormonelle Mittel, die gegen hormonabhängige Tumorarten wie Prostatakrebs zumindest verlangsamend wirken.
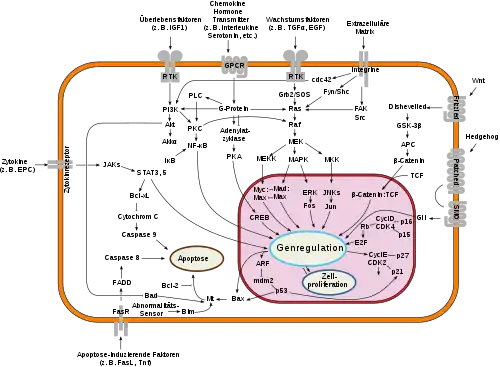
Beginnend mit Trastuzumab (EU-Zulassung im Jahr 2000) haben sich neue Wirkstoffe etabliert, die in die Signalwege der Zellen eingreifen und deren Teilung verhindern, sie zum Absterben veranlassen, oder gezielt Angriffe der Immunabwehr auf sie richten. Da Krebszellen durch Mutationen zahlreiche Störungen dieser Signalwege aufweisen, ist dieser Ansatz sehr spezifisch und die Nebenwirkungen auf gesunde Gewebe sind leichter. Derzeit (2021) handelt es sich bei diesen neuen Krebsmedikamenten entweder um speziell entwickelte Antikörper, oder um small molecules (engl. für "kleine Moleküle"). Mehr als 60 sind bereits zur Anwendung am Menschen zugelassen, jedes Jahr kommen 10–20 neue dazu. Die Medikamente werden gentechnisch hergestellt und im englischen Schrifttum oft als Biologicals zusammengefasst. Gegen manche Krebsarten wie das Melanom wirken sie besser als herkömmliche Zytostatika; bei anderen (Brust- und Lungenkrebs, Lymphome) haben sie bis jetzt nur unterstützende Bedeutung. Häufigste Nebenwirkung sind Allergien und Ekzeme.
Durch die neuen Medikamentengruppen sind die individuellen Therapieentscheidungen kompliziert geworden. Aktuelle Literatur greift über die nur alle paar Jahre erneuerten Lehrbücher hinaus. Die Änderungsfrequenz der Leitlinien nimmt zu. Molekularbiologische Eigenarten des individuellen Tumors müssen subtil geprüft und berücksichtigt werden. In Deutschland können sich Fachärzte für Innere Medizin oder Allgemeinmedizin gemäß der Musterweiterbildungsordnung über sechs Jahre weiterbilden, um die Schwerpunktbezeichnung „Hämatologie und Internistische Onkologie“ erlangen. Chemotherapien werden aber auch von anderen onkologisch tätigen Ärzten (Chirurgen, Strahlentherapeuten) eingesetzt. Alle Anwender sind verpflichtet, sich beständig weiterzubilden.
Rehabilitation und Nachsorge
Schon während der Akutbehandlung, aber vor allem in der späteren Erholungsphase profitieren die Patienten von unterstützenden Maßnahmen wie Schmerztherapie, Beratung durch fachkundige Sozialarbeiter, Ergotherapie, Physiotherapie, und Psychotherapie. Dies ist eine wichtige Aufgabe von spezialisierten Rehabilitationskliniken. Rehabilitative Maßnahmen stehen Arbeitnehmern und Rentnern offen und können auch nach palliativen Behandlungen unheilbarer Tumoren sinnvoll sein. Außer den Krankenversicherungen tragen in Deutschland auch Rentenversicherungen die Kosten solcher Maßnahmen, vor allem in der Form von 3-wöchigen Anschlussheilbehandlungen (AHB). Diese AHB müssen bereits während des Krankenhausaufenthaltes organisiert werden. Onkologische Kliniken haben dafür einen Sozialdienst, dessen Mitarbeiter die Patientin auf Ihren Stationen aufsuchen. Sie sind auch Ansprechpartner, wenn absehbar ist, dass Rückkehr in die eigene Wohnung häusliche Krankenpflege oder kurzzeitige Brückenpflege gebraucht wird. Bei Bedarf kann auch Haushaltshilfe beantragt werden, vor allem in Haushalten mit Kindern. Für Schwerkranke mit hohem Betreuungsbedarf gibt es in der GKV die Spezialisierte ambulante Palliativversorgung, in vielen Städten auch stationäre und ambulante Hospizleistungen.
Beginnend der Regel nach drei Monaten erhalten onkologische Patienten Nachsorgeuntersuchungen in regelmäßigen Abständen. Eine häufige Konvention sind vier Untersuchungen im ersten Jahr, zwei im zweiten Jahr, und dann jährliche Kontrollen bis zum 5. Jahr. Ihr Ziel ist es, Tumorrezidive, Metastasen, Therapienebenwirkungen, und andere neue Probleme möglichst frühzeitig zu erfassen. Dabei stehen das Gespräch und die klinische Untersuchung im Vordergrund. Je nach individueller Situation werden zusätzlich auch bildgebende Verfahren wie die Mammografie oder Blutuntersuchungen eingesetzt. Die Nachsorge kann in der operierenden Klinik erfolgen, wird aus praktischen Gründen aber oft an die heimischen Ärzte delegiert.
Alternativmedizin

Die Komplementäre und alternative Medizin (CAM) bietet diagnostische und therapeutische Methoden an, die keine wissenschaftliche Anerkennung erreichen konnten. Viele onkologisch tätige Ärzte wenden sie dennoch an mit dem Ziel, die normalen Verfahren zu unterstützen und deren Nebenwirkungen zu mindern. Völlig unstrittig sind die Empfehlungen für körperliche Bewegung und Ausgleichssport, ausgewogene Ernährung, und zum Verzicht auf Tabakrauchen. Bekannt ist außerdem, dass Fehl- und Mangelernährung Krebspatienten schwächen können, und darum spielen diätetische Maßnahmen eine Rolle.[11] Sogenannte Krebsdiäten, die den Krebs "aushungern" oder durch ein basisches Milieu bekämpfen wollen, liegen allerdings außerhalb des wissenschaftlichen Konsens. Für die Substitution von Vitaminen und Spurenelementen wie Selen gibt es zwar keine Belege, allerdings gilt sie als weitgehend ungefährlich. Ebenso die Akupunktur, TCM, und die im Bereich der gesetzlichen Krankenversicherung "besondere Therapierichtungen" genannten Homöopathie, Phytotherapie, und Anthroposophie, für die unter bestimmten Bedingungen die Kosten auch übernommen werden. Hyperthermie (Überwärmung der Tumorregion oder des ganzen Körpers) war zeitweise eine schulmedizinische Methode, die aber wegen ausbleibendem Erfolg verlassen wurde. In manchen Krankenhäusern wird sie noch benutzt. Angebote aus dem Wellnessbereich wie Aromatherapie, Shiatsu, Waldbaden etc. haben mit Sicherheit keine spezifische Wirkung gegen Krebs, können aber unter Umständen das allgemeine Wohlbefinden der Patienten bessern. Sie müssen vom Patienten selbst bezahlt werden.
Ein offener, patientenzentrierter Umgang mit der Thematik ist wichtig, um das Arzt-Patienten-Verhältnis nicht zu belasten. Umfragen[12][13] zufolge setzt ein großer Teil der Krebspatienten CAM-Methoden, meist Nahrungsergänzungsmittel, selbstständig ohne Rücksprache mit ihren Onkologen ein. Gelegentlich kommt es zu schweren Gesundheitsschäden und sogar Todesfällen, wenn Therapeuten und Patienten das Vertrauen in die schulmedizinische Behandlung verloren haben, sie abbrechen und durch gefährliche Methoden wie MMS[14][15][16][17][18] oder die GNM[19][20][21] zu ersetzen suchen.
Kinderonkologie
Die Kinderonkologie befasst sich mit Krebserkrankungen im Kindes- und Jugendalter.[22] Kinder erkranken seltener an Krebs als Erwachsene, und das Spektrum der pädiatrischen Krebserkrankungen ist ein anderes. Manche Tumoren wie das Retinoblastom im Auge, oder der Wilms-Tumor der Niere, kommen nur bei Kindern vor. Zwar gibt es prinzipiell dieselben Therapiesäulen Operation, Strahlentherapie, und Chemotherapie, jedoch mit spezifischen, abweichenden Methoden. Beispielsweise ist der kindliche Körper wesentlich empfindlicher gegenüber ionisierender Strahlung, auch gegenüber Chemotherapie. Ein krebskrankes Kind hat besondere Bedürfnisse der individuellen Hilfe und Förderung. Auch die Eltern und Geschwister brauchen psychosoziale Unterstützung. Daher ist es sinnvoll, die Therapie auf spezialisierte Zentren zu konzentrieren. Einige Vorgaben für deutsche Zentren sind in der verbindlichen Richtlinie zur Kinderonkologie[23] festgelegt. Die Einrichtungen sind in der Regel an den Universitätskrankenhäusern und Kliniken der Zentralversorgung angesiedelt. Es gibt auch auf Kinder und Jugendliche spezialisierte Rehabilitationseinrichtungen und Nachsorgekliniken. „Pädiatrische Hämatologie und Onkologie“ ist eine Schwerpunktbezeichnung, die Ärzte für Kinder und Jugendmedizin in 5-jähriger Weiterbildung erreichen. Viele dieser Ärzte sind in Deutschland in der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) organisiert. Das an der Universität Mainz angesiedelte deutsche Kinderkrebsregister sammelt Informationen über Erkrankungsverlauf und Behandlungsergebnisse. Bei rechtzeitiger Behandlung können drei Viertel der jährlich rund 2.000 erkrankten Kinder und Jugendlichen ein Leben ohne weitgehende Einschränkungen führen.[22]
Literatur
Geschichte
- Siddhartha Mukherjee: Der König aller Krankheiten. Krebs – eine Biografie. DuMont, 3. Auflage 2018, ISBN 978-3-8321-6232-0
- D. J. Th. Wagener: The history of oncology. (englisch) Bohn Stafleu van Loghum, 2009, ISBN 978-90-313-6143-4
Diagnostik
- Christian Wittekind, H. Asamura, Leslie H. Sobin: TNM Atlas. Wiley-Blackwell, 6. Auflage 2015, ISBN 978-3-527-33612-8
- M. A. Hayat: Cancer Imaging. (englisch) 2 Bände, Academic Press, 2007, ISBN 978-0-12-374183-7
- Otmar Schober, Fabian Kiessling, Jürgen Debus (Hrsg.): Molecular Imaging in Oncology. (englisch) Springer, 2. Ausgabe 2020, ISBN 978-3-03042617-0
- Gerald Höfler, Hans Kreipe, Holger Moch (Hrsg.): Pathologie – Das Lehrbuch. Urban & Fischer, 6. Ausgabe 2019, ISBN 978-3-437-42390-1
Chirurgie
- Michael Gnant, Peter M. Schlag (Hrsg.): Chirurgische Onkologie: Strategien und Standards für die Praxis. Springer, 2008, ISBN 978-3-211-48612-2
- Shane Y. Morita, Charles M. Balch, V. Suzanne Klimberg, Timothy M. Pawlik, Glenn David Posner, Kenneth K. Tanabe: Textbook of Complex General Surgical Oncology. (englisch) McGraw-Hill Education, 2017, ISBN 978-0-07-179331-5
Strahlentherapie
- Michael Wannenmacher, Frederik Wenz, Jürgen Debus (Hrsg.): Strahlentherapie. Springer, 2. Auflage 2013, ISBN 978-3-540-88304-3
- Frank Giordano, Frederik Wenz (Hrsg.): Strahlentherapie kompakt. Urban & Fischer, 3. Auflage 2019, ISBN 978-3-437-23292-3
- Edward C. Halperin, David E. Wazer, Carlos A. Perez, Luther W. Brady (Hrsg.): Perez & Brady’s Principles and Practice of Radiation Oncology. (englisch) Lippincott Williams and Wilkins, 7. Auflage 2018, ISBN 978-1-4963-8679-3
Chemotherapie
- Dietmar P. Berger, Roland Mertelsmann: Das Rote Buch: Hämatologie und Internistische Onkologie. ecomed, 6. Auflage 2017, ISBN 978-3-609-51221-1
- F. Honecker: Taschenbuch Onkologie: Interdisziplinäre Empfehlungen zur Therapie. Zuckschwerdt, 20. Auflage 2020; ISBN 978-3-86371-303-4
- Michael M. Boyiadzis, James N. Frame, David R. Kohler, Tito Fojo: Hematology - Oncology Therapy. (englisch) McGraw-Hill Education, 2. Auflage 2014, ISBN 978-0-07-163789-3
Alternative Krebstherapie
- Karsten Münstedt: Komplementäre und alternative Krebstherapien. ecomed, 2012, ISBN 978-3-609-16455-7
Ratgeber für Nichtfachleute
- Klaus Koch/Stiftung Warentest: Untersuchungen zur Früherkennung - Krebs: Nutzen und Risiken. Stiftung Warentest, 2005, ISBN 978-3-937880-07-5
- Isabell-Annett Beckmann / Stiftung Warentest: Diagnose Krebs: Zusammen stark bleiben (Ein Ratgeber für Angehörige und Freunde). Stiftung Warentest, 2020, ISBN 978-3-7471-0195-7
- Sarah Majorczyk: Das Handbuch gegen Krebs. ZS Verlag, 2014, ISBN 978-3-89883-448-3
Weblinks
- Krebsfrüherkennung beim Bundesgesundheitsministerium
- ICD-O-3: Internationale Klassifikation der Krankheiten für die Onkologie, 3. Revision (deutsch) beim DIMDI
- Krebsregisterdaten bei der GEKID
- Krebsregisterdaten beim Robert Koch-Institut (RKI)
- Deutsches Kinderkrebsregister
- Onkopedia: Leitlinien, Substanzen, Wissensdatenbank, und aktuelle Meldungen von der DGHO
- Deutsche Leitlinien in der Onkologie, zusammengestellt von der DKG
- Krebsinformationsdienst des DKFZ
- Kinderkrebsinfo.de – Informationen der DGPO zur pädiatrischen Onkologie für Betroffene und Fachkreise, auch Leitlinien und Listen geeigneter Krankenhäuser in Deutschland
- Onkologische Kliniken und Zentren in Deutschland (DKG)
- National Comprehensive Cancer Network der USA (englisch)
- Studienregister des NIH (englisch)
- Deutsches Register für Klinische Studien
Einzelnachweise
- Wolfgang Hiddemann, Claus R. Bartram, H. Huber: Die Onkologie. Teil 1: Epidemiologie – Pathogenese – Grundprinzipien der Therapie; Teil 2: Solide Tumoren – Lymphome – Leukämien. Springer-Verlag, 2013, ISBN 978-3-662-06671-3, S. 466 (E-Book).
- Spruch 874 des Papyrus Ebers, zitiert nach Lutz Popko: Papyrus Ebers. In: Science in Ancient Egypt. Abschnitt 857–877 „Erfahrungswissen zu Anschwellungen“, Online-Dokumentation der Sächsischen Akademie der Wissenschaften zu Leipzig
- Hippocrates: Aphorismen 6.38, zitiert nach L. Weiss: Early Concepts of Cancer. In: Cancer Metastasis Rev. Band 19, 2000, S. 205–217. doi:10.1023/A:1010698321682
- Catherine Offord: A Radical Intervention, 1894. In: The Scientist. 1. April 2018, abgerufen am 28. Februar 2021 (englisch).
- Eberhard Scherer: Vorwort zur ersten Auflage. In: Strahlentherapie. 2. Auflage. Springer, Berlin 1980, ISBN 978-3-540-09780-8, S. VIII.
- Cancers linked to tobacco use make up 40% of all cancers diagnosed in the United States. Centers for Disease Control and Prevention. Abgerufen am 2. Mai 2020.
- Tobacco. In: National Cancer Institute. 29. April 2015. Abgerufen am 18. Januar 2016.
- Alcohol. In: National Cancer Institute. 29. April 2015. Abgerufen am 18. Januar 2016.
- Obesity. In: National Cancer Institute. 29. April 2015. Abgerufen am 18. Januar 2016.
- Age. In: National Cancer Institute. 29. April 2015. Abgerufen am 18. Januar 2016.
- Josef Beuth, Joerg Michael Schierholz: Review. Evidence-based complementary oncology. Innovative approaches to optimize standard therapy strategies. In: In Vivo (Athens, Greece). Band 21, Nr. 2, März 2007, ISSN 0258-851X, S. 423–428, PMID 17436598.
- C.D.R. Colleen Lee, Farah Zia, Oluwadamilola Olaku, Joan Michie, Jeffrey D. White: Survey of Complementary and Alternative Medicine Practitioners Regarding Cancer Management and Research. In: Journal of the Society for Integrative Oncology. Band 7, Nr. 1, 2009, ISSN 1715-894X, S. 26–34, doi:10.2310/7200.2009.0003, PMID 19476732, PMC 2719964 (freier Volltext).
- Kerstin A. Kessel, Sabrina Lettner, Carmen Kessel, Henning Bier, Tilo Biedermann: Use of Complementary and Alternative Medicine (CAM) as Part of the Oncological Treatment: Survey about Patients’ Attitude towards CAM in a University-Based Oncology Center in Germany. In: PLoS ONE. Band 11, Nr. 11, 3. November 2016, ISSN 1932-6203, doi:10.1371/journal.pone.0165801, PMID 27812163, PMC 5094772 (freier Volltext).
- Anika Jonas: „Miracle Mineral Supplement“: Ein vermeintliches Wundermittel verätzt den Körper. In: FOCUS Online. 8. November 2018, abgerufen am 16. März 2021.
- Silvio Duwe: Alternativmedizin bei Krebs: Gefährliche Esoterik. In: Spiegel Online. 16. August 2015, abgerufen am 16. März 2021.
- Tom Porter: Taking toxic bleach MMS has killed 7 people in the US, Colombian prosecutors say – far more than previously known. In: businessinsider.com. 12. August 2020, abgerufen am 16. März 2021.
- Deborah Blum: Bleached to Death (Again). In: Wired. 19. September 2018, ISSN 1059-1028 (wired.com [abgerufen am 16. März 2021]).
- Hillel Aron: There’s Been an Uptick in the Use of the Crackpot Cure, Miracle Mineral Solution. In: fairwarning.org. 11. September 2019, abgerufen am 16. März 2021 (amerikanisches Englisch).
- Opfer der Germanischen Neuen Medizin – Psiram. Abgerufen am 16. März 2021.
- Dirk Ambrosch: „Wunderheiler“ versprach Hilfe - und Susanne starb doch. In: Augsburger Allgemeine. 20. Januar 2010, abgerufen am 16. März 2021.
- Falsche Versprechen – die tödliche Gefahr der „Germanischen Neuen Medizin“. In: ARD "Kontraste". 10. November 2005, abgerufen am 16. März 2021.
- Pädiatrische Onkologie und Hämatologie. Abgerufen am 17. Juni 2019.
- Richtlinie zur Kinderonkologie des GBA (2006, zuletzt geändert 2020)