Gallengangskarzinom
Das Gallengangskarzinom (medizinisch Cholangiokarzinom oder cholangiozelluläres Karzinom) ist ein bösartiger Tumor der Gallenwege. Es handelt sich um einen seltenen Tumor mit einer jährlichen Inzidenz von ein bis zwei Fällen auf 100.000 in der westlichen Welt,[1] wobei die Erkrankungsrate weltweit in den letzten Jahrzehnten angestiegen ist.[2] Risikofaktoren für das Gallengangskarzinom sind die primär sklerosierende Cholangitis (eine entzündliche Erkrankung der Gallenwege), angeborene Missbildungen der Leber, in Ostasien auch Infektionen mit den Leberparasiten Opisthorchis viverrini und dem Chinesischen Leberegel sowie die (heute verbotene) Verwendung von Thorotrast als Röntgenkontrastmittel. Die Symptome des Gallengangskarzinoms sind Gelbsucht, Gewichtsverlust und Juckreiz. Die Diagnose wird durch eine Kombination von Blutuntersuchungen, bildgebenden Verfahren, Endoskopie und durch Laparotomie gestellt.
| Klassifikation nach ICD-10 | |
|---|---|
| C22.1 | Intrahepatisches Gallengangskarzinom |
| C24.0 | Extrahepatischer Gallengang Ductus choledochus Ductus cysticus Ductus hepaticus Ductus hepaticus communis |
| C24.1 | Ampulla hepatopancreatica Vatersche Papille |
| C24.8 | Gallenwege, mehrere Teilbereiche überlappend |
| C24.8 | Bösartige Neubildung mit Beteiligung sowohl der intra- als auch der extrahepatischen Gallengänge |
| C24.9 | Gallenwege, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Eine operative Entfernung des Tumors ist die einzige Möglichkeit für eine Behandlung mit Heilungsaussicht. Allerdings wird der Tumor in den meisten Fällen erst dann entdeckt und richtig diagnostiziert, wenn die Patienten bereits in einem fortgeschrittenen Stadium der Erkrankung sind. Außer einer Operation können auch Chemotherapie und Bestrahlung die Behandlungsaussichten verbessern. Patienten in einem fortgeschrittenen Stadium der Erkrankung erhalten in der Regel eine Chemotherapie bzw. palliativmedizinische Versorgung. Forschungsziele zum Gallengangskarzinom sind die sogenannte Targeted Therapy mit Erlotinib und die photodynamische Therapie.
Epidemiologie
| Land | IH (Männer/Frauen) | EH (Männer/Frauen) |
|---|---|---|
| 0, 60 / 0, 43 | 0, 70 / 0, 87 | |
| 0, 23 / 0, 10 | 5, 87 / 5, 20 | |
| 0, 70 / 0, 53 | 0, 90 / 1, 23 | |
| 0, 83 / 0, 63 | 0, 43 / 0, 60 | |
| 1, 17 / 1, 00 | 0, 60 / 0, 73 | |
| 0, 27 / 0, 20 | 1, 20 / 1, 37 | |
| 0, 13 / 0, 13 | 2, 10 / 2, 60 |
Das Gallengangskarzinom ist ein eher seltener Tumor. Jedes Jahr erkranken in den USA etwa 2000 bis 3000 Menschen neu, was einer jährlichen Inzidenz von 1–2 auf 100.000 entspricht.[1] Die Auswertung von Autopsieserien ergab, dass die Prävalenz zwischen 0,01 und 0,46 % liegt.[4] In Asien ist die Prävalenz des Gallengangskarzinoms höher, wofür man die endemische Verbreitung chronischer Parasitenerkrankungen verantwortlich macht. Die Inzidenz des Gallengangskarzinoms steigt mit dem Alter. Männer erkranken etwas häufiger, vermutlich wegen der höheren Erkrankungsrate der primär sklerosierenden Cholangitis bei Männern.[5] Beim Vorliegen einer primär sklerosierenden Cholangitis steigt die Prävalenz um ein Vielfaches auf bis zu 30 %.[6] Zahlreiche Studien haben nachgewiesen, dass die Inzidenz des Gallengangskarzinoms während der letzten Jahrzehnte in weiten Teilen der Welt angestiegen ist.[7] Die Ursachen dafür sind unbekannt. Möglicherweise tragen verbesserte Diagnosemöglichkeiten und ein Anstieg von Risikofaktoren wie die HIV-Erkrankung zu dem Anstieg bei.[8]
Risikofaktoren
Verschiedene Risikofaktoren für die Entwicklung des Gallengangskarzinoms wurden beschrieben. In der westlichen Welt zählt dazu in erster Linie die primär sklerosierende Cholangitis, eine entzündliche Erkrankung der Gallenwege, die wiederum häufig gemeinsam mit der Colitis ulcerosa auftritt.[9] Aus epidemiologischen Untersuchungen wurde geschlossen, dass das Lebenszeitrisiko, ein Gallengangskarzinom zu bekommen, bei Personen mit einer primär sklerosierenden Cholangitis bei 10–15 % liegt,[10] obwohl in Autopsieserien Raten bis zu 30 % gefunden wurden.[6] Die Ursachen für den Zusammenhang zwischen Gallengangskarzinom und primär sklerosierender Cholangitis sind unklar.
Bestimmte Parasitenerkrankungen der Leber sind ebenfalls Risikofaktoren für das Gallengangskarzinom. Der in Thailand, Laos und Malaysia verbreitete Leberegel Opisthorchis viverrini und sein vor allem in Japan, Korea und Vietnam beheimateter Verwandter Clonorchis sinensis erhöhen das Erkrankungsrisiko für das Gallengangskarzinom.[11][12][13] Patienten mit chronischen Lebererkrankungen, wie die Virushepatitis B oder C,[14][15][16] alkoholische Lebererkrankung, oder Leberzirrhose anderer Ursache erhöhen ebenfalls das Risiko für ein Gallengangskarzinom.[8][17]
Auch HIV ist ein potentieller Risikofaktor für das Gallengangskarzinom. Allerdings ist unklar, ob HIV selbst oder mit HIV assoziierte Erkrankungen wie Hepatitis C für den Zusammenhang verantwortlich sind.[8] Angeborene Missbildungen der Leber, wie das Caroli-Syndrom oder Choledochuszysten, führen zu einem Lebenszeitrisiko von 15 % für die Entwicklung eines Gallengangskarzinoms.[18][19] Seltene Erbkrankheiten wie das hereditäre non-polypöse kolorektale Karzinom und die Papillomatose der Gallenwege treten in Verbindung mit dem Gallengangskarzinom auf.[20][21] Ein Zusammenhang mit dem Vorkommen von Gallensteinen ist nicht sicher belegt. Allerdings gibt es einen Zusammenhang zwischen der Häufigkeit von Gallensteinen und Gallengangskarzinom, wenn die Gallensteine innerhalb der Leber gelegen sind. Dies ist in den westlichen Ländern ungewöhnlich, kommt aber in Teilen Asiens häufiger vor.[22][23][24] Die Verwendung von Thorotrast, einer Form des Thoriumdioxid als Kontrastmittel, kann noch nach 30–40 Jahren zu einem Gallengangskarzinom führen. Die Verwendung von Thorotrast wurde wegen seiner Kanzerogenität verboten.[25][26]
Pathophysiologie
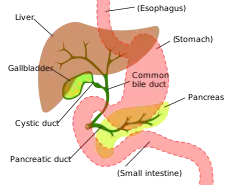
Das Gallengangskarzinom kann in jedem Abschnitt des Gallengangsystems auftreten. Tumoren, die in den innerhalb der Leber liegenden Gallengängen wachsen, heißen „intrahepatisch“, und Tumoren, die im Gallengangsystem außerhalb der Leber auftreten, werden „extrahepatisch“ genannt. Tumoren, die an der Ausgangsstelle des Gallengangsystems auftreten, heißen „perihilär“, und solche, die an der Vereinigungsstelle der beiden aus der Leber austretenden Gallengänge liegen, werden als Klatskintumoren[27] bezeichnet, wobei die Klatskintumoren heute den perihilären Tumoren zugerechnet werden. Obwohl das Gallengangskarzinom bekanntermaßen ein Tumor der epithelialen Zellen der Gallengänge ist, blieb bislang unbekannt, aus welchen Zellen sich der Tumor entwickelt. Man vermutet, dass er aus einer pluripotenten Stammzelle der Leber herrührt.[28][29][30]
Vermutlich durchläuft das Gallengangskarzinom – ähnlich wie der Dickdarmkrebs – eine Serie von Entwicklungsschritten von Hypoplasien über Metaplasien und Dysplasien hin zum Karzinom (Adenom-Karzinom-Sequenz).[31] Deshalb spielen Prozesse wie chronische Entzündungen und eine Verengung der Gallenwege, die mit einer Flussbehinderung der Gallenflüssigkeit einhergehen, bei der Entwicklung dieses Tumors eine Rolle.[31][32][33] Das histologische Bild des Gallengangskarzinoms kann von undifferenziertem bis hin zu gut differenziertem Gewebe variieren. Der Tumor ist oft von einem fibrotischen oder desmoplastischen Gewebe umgeben. Im Falle einer ausgeprägten Fibrose kann es schwierig sein, ein gut differenziertes Karzinom der Gallengänge von einem nur reaktiv veränderten Epithel zu unterscheiden. Es gibt keine völlig spezifische immunhistochemische Färbung, die bösartig verändertes von gutartigem Gallengangsgewebe unterscheidet. Markierungen für Cytokeratin, Carcinoembryonales Antigen und Mucine können bei der Diagnose hilfreich sein.[34] Die meisten Tumoren (über 90 %) sind Adenokarzinome.[35]
Symptome und Zeichen
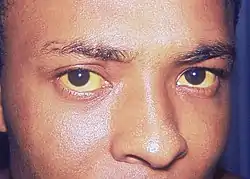
Die häufigsten körperlichen Anzeichen für das Vorliegen eines Gallengangskarzinom sind eine Gelbsucht, welche dann auftritt, wenn die Gallenwege durch den Tumor verengt werden, und typischerweise schmerzlos ist, ein generalisierter (also am ganzen Körper vorkommender) Juckreiz (66 %), Bauchschmerzen (30–50 %), Gewichtsverlust (30–50 %) und Fieber (20 %).[36] Bis zu einem gewissen Ausmaß hängen die Symptome von der Lokalisation des Tumors ab. Patienten mit einem Gallengangskarzinom der Gallenwege außerhalb der Leber haben eher eine Gelbsucht und Patienten mit einem Tumor innerhalb der Leber haben häufig Schmerzen ohne Gelbsucht.[37]
Blutuntersuchungen bei Patienten mit einem Gallengangskarzinom zeigen häufig Hinweise für einen Verschlussikterus mit erhöhtem Bilirubin, alkalischer Phosphatase (AP) und γ-Glutamyltransferase (GGT) bei normalen Transaminasewerten. Diese Konstellation der Leberwerte spricht eher für eine Verlegung der Gallenwege als für eine Entzündung oder Infektion der Leber, die die häufigsten Differentialdiagnosen der Gelbsucht darstellen.[38] Der Tumormarker CA 19-9 ist meist positiv.
Diagnostik
Das Gallengangskarzinom kann nur durch eine Gewebeuntersuchung eindeutig diagnostiziert werden. Üblicherweise gelingt die Entnahme von Gewebe, das für eine pathologische Untersuchung ausreichend gut geeignet ist, nur im Rahmen einer Operation. Ein Gallengangskarzinom kann vermutet werden, wenn ein Patient einen Verschlussikterus zeigt. Bei Patienten mit einer primären sklerosierenden Cholangitis kann die Abklärung der Verdachtsdiagnose eines Gallengangskarzinoms große Probleme bereiten. Solche Patienten haben ein hohes Risiko, ein Gallengangskarzinom zu bekommen, aber die Symptome sind nicht einfach von der primär sklerosierenden Cholangitis zu unterscheiden. Zudem kann bei den entsprechenden Patienten manchmal weder eine Raumforderung noch eine Aufweitung der Gallengänge nachgewiesen werden.
Laboruntersuchungen
Es gibt keine spezifischen Blutuntersuchungen, durch die ein Gallengangskarzinom nachgewiesen werden kann. Die Serumspiegel der Tumormarker Carcino-Embryonales Antigen (CEA) und CA 19-9 sind oft erhöht, aber sie sind nicht sensitiv und spezifisch genug, um als Screeningverfahren eingesetzt werden zu können. Allerdings können sie im Zusammenhang mit bildgebenden Verfahren die Verdachtsdiagnose untermauern.[39]
Sonographie und Computertomographie des Oberbauchs
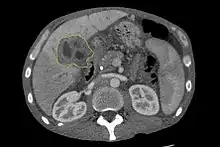
Bei Hinweisen auf einen Verschlussikterus wird häufig als erstes bildgebendes Verfahren zur Darstellung der Gallenwege die Oberbauchsonographie eingesetzt.[40][41] Mit dieser Methode kann die Verlegung und Aufweitung der Gallengänge untersucht werden und in Einzelfällen kann auf diese Weise schon die Diagnose eines Gallengangskarzinoms gestellt werden.[42] Auch die Computertomographie spielt eine große Rolle bei der Untersuchung dieser Patienten.[43][44][45]
Bildgebung der Gallenwege
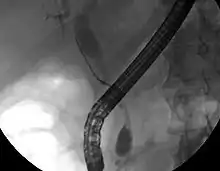
Wiewohl die Bildgebung der Oberbauchorgane für die Diagnose des Gallengangskarzinoma hilfreich sein kann, ist eine Darstellung der Gallenwege mit einem Kontrastmittel oft unumgänglich. Zu diesem Zweck wird die Endoskopisch retrograde Cholangiopankreatikographie (ERCP), ein endoskopisches Verfahren als Mittel der Wahl von Gastroenterologen oder Chirurgen eingesetzt. Obwohl die ERCP eine invasive Maßnahme mit allen damit verbundenen Risiken ist, bestehen ihre Vorteile doch darin, dass Gewebeproben zur Diagnose entnommen und ein röhrenförmiges Implantat in den Gallengang eingesetzt werden kann, um dadurch die Verlegung der Gallenwege zu beseitigen.[38]
Während der ERCP kann ein endoskopischer Ultraschall durchgeführt werden, um die Entnahme von Gewebeproben mittels Biopsie zu vereinfachen. Außerdem können so ein möglicher Lymphknotenbefall besser beurteilt und Informationen zur Frage der Operabilität des Tumors gewonnen werden.[46] Alternativ zur ERCP kann die Perkutane transhepatische Cholangiographie (PTC) eingesetzt werden. Die Magnetresonanz-Cholangiopankreatikographie (MRCP) ist eine nicht-invasive diagnostische Alternative zur ERCP.[47][48][49] Einige Autoren haben vorgeschlagen, in der Diagnostik bei biliären Tumoren die ERCP generell durch die MRCP zu ersetzen, da auch so der Tumor diagnostiziert werden kann und die Risiken der ERCP vermieden werden.[50][51][52]
Chirurgische Diagnostik
Eine Operation der Bauchhöhle kann notwendig sein, um ausreichend Gewebematerial zu gewinnen und um ein Tumorstaging zu machen. Gelegentlich kann dafür eine Bauchspiegelung ausreichend sein, vor allem wenn invasivere Maßnahmen vermieden werden sollen.[53][54] Eine Operation wird üblicherweise nur bei Patienten mit einer Erkrankung im frühen Stadium durchgeführt.
Pathologie
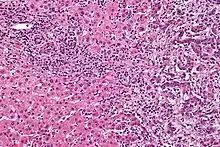
Gallengangskarzinome gehören zu den Adenokarzinomen und sind gewöhnlich histologisch gut bis mäßig differenziert. Eine Immunhistochemie ist bei der Diagnose hilfreich, wenn ein differenziertes Gallengangskarzinom von Metastasen anderer gastrointestinaler Tumoren unterschieden werden soll.[55] Gewebeabstriche sind selten diagnostisch aussagekräftig.[56]
Stadienbestimmung
Obwohl es mehr als drei aktuelle Stagingverfahren für das Gallengangskarzinom gibt (Bismuth, Blumgart, American Joint Committee on Cancer), ist keines geeignet, die Überlebensrate gut vorherzusagen.[57] Das wichtigste Stagingkriterium ist die Frage, ob ein Tumor operativ entfernt werden kann. Die Entscheidung darüber kann meist erst während einer Operation getroffen werden.[38]
Allgemeine Richtlinien für die Operierbarkeit sind:[58][59]
- Fehlen von Lymphknoten- oder Lebermetastasen
- Fehlen eines Tumorbefalls der Pfortader
- Fehlen einer Tumorinfiltration benachbarter Organe
- Fehlen von Fernmetastasen
Prognose
Wenn eine operative Entfernung des Tumors nicht möglich ist, weil Fernmetastasen vorliegen, beträgt die Fünfjahresüberlebensrate null Prozent,[60] und weniger als fünf Prozent für alle Patienten.[61] Die mediane Überlebenszeit beträgt weniger als sechs Monate für Patienten, die inoperabel, unbehandelt und ansonsten gesund sind, wenn der Tumor die Leber entweder über die Gallenwege oder die Pfortader befallen hat.[62]
Bei Patienten mit operablen Tumoren hängt die Heilungsaussicht von der Tumorlokalisation ab und von der Frage, ob er vollständig entfernt werden kann. Distale Gallengangskarzinome werden üblicherweise durch eine Operation nach Whipple behandelt. In diesen Fällen beträgt die Langzeitüberlebensrate etwa 15–25 %, obwohl eine Untersuchungsreihe eine Fünfjahresüberlebensrate von 54 % berichtet hat für Patienten, bei denen kein Lymphknotenbefall vorlag.[63]
Patienten mit einem intrahepatischen Gallengangskarzinom erhalten üblicherweise eine Leberteilresektion. In verschiedenen Studien war die berichtete Überlebensrate 22 % bis 66 % und hing davon ab, ob Lymphknoten befallen waren und ob eine vollständige Tumorentfernung gelang.[64]
Die perihilären Karzinome sind am häufigsten inoperabel. Wenn eine Operation möglich ist, dann wird häufig eine sogenannte aggressive Therapie gewählt, die aus einer Entfernung der Gallenblase und einer Teilresektion der Leber besteht. Von Patienten mit operablen perihilären Karzinomen wird eine Fünfjahresüberlebensrate von 20 % bis 50 % berichtet.[65]
Patienten mit einer primär sklerosierenden Cholangitis, die ein Gallengangskarzinom sekundär entwickeln, haben vermutlich deshalb die schlechteste Prognose, weil bei ihnen der Tumor meist erst festgestellt wird, wenn er schon fortgeschritten ist.[6][66] Es gibt Hinweise darauf, dass eine aggressive chirurgische Therapie zusammen mit adjuvanten Verfahren die Prognose verbessern kann.[67]
Behandlung
Das Gallengangskarzinom gilt als unheilbar und rasch zum Tode führend, wenn der Tumor nicht vollständig entfernt werden kann. Da die Operabilität des Tumors meist erst während einer Operation beurteilt werden kann,[68] ist bei den meisten Patienten eine Probelaparatomie (Eröffnung der Bauchhöhle zu Untersuchungszwecken) erforderlich, es sei denn, der Tumor ist ohnehin inoperabel.[38] Adjuvante Therapieverfahren nach einer Lebertransplantation spielen nur in einer geringen Anzahl von Fällen eine Rolle.[69]
Adjuvante Chemotherapie und Bestrahlung
Falls der Tumor operativ entfernt werden kann, können die Patienten eine adjuvante Chemotherapie oder Strahlentherapie erhalten, um die Heilungschancen zu erhöhen. Zur Frage des Nutzens der adjuvanten Therapieverfahren beim Gallengangskarzinom gibt es positive[70][71] und negative[37][72][73] Berichte. In keinem Fall wurden bisher (März 2007) prospektive und randomisierte Untersuchungen durchgeführt. In den Fällen, in denen der Tumor vollständig entfernt wurde (Gewebsrand negativ), ist eine adjuvante Chemotherapie ohne Nutzen.[74] Der Nutzen einer kombinierten Radiochemotherapie ist nicht klar. Wenn der Tumor nur unvollständig entfernt werden konnte (Gewebsrand positiv), wird allerdings aufgrund der gegenwärtigen Studienlage eine Radiochemotherapie empfohlen.[75]
Behandlung der fortgeschrittenen Erkrankung
In der Mehrzahl der Fälle präsentiert sich das Gallengangskarzinom als ein inoperabler Tumor.[76] In diesen Fällen werden die Patienten mit einer palliativen Chemotherapie mit oder ohne Bestrahlung behandelt. Dabei konnte in randomisierten Studien gezeigt werden, dass beim inoperablen Gallengangskarzinom die Chemotherapie die Lebensqualität verbessert und die Lebenserwartung verlängert.[77]
Es gibt kein allgemein verbindliches Chemotherapieverfahren für das Gallengangskarzinom und es wird empfohlen, dass die entsprechenden Patienten in Studien eingeschlossen werden sollten, wo immer das möglich ist.[75] Folgende Chemotherapeutika werden bei der Behandlung des Gallengangskarzinoms verwendet: Fluorouracil zusammen mit Folinsäure,[78] Gemcitabin als Einzelpräparat,[79] oder in Kombination mit Cisplatin,[80] Irinotecan[81] oder Capecitabin.[82] Als Therapiestandard gilt derzeit (2015) in der Erstlinientherapie eine Kombinationstherapie mit Gemcitabine und Cis-Platin (bei eingeschränkter Nierenfunktion auch Oxaliplatin, „GEMOX“).[83]
Experimentelle Verfahren
In einer kleinen Pilotstudie wurde ein begrenzter Nutzen für den Tyrosinkinaseinhibitor Erlotinib nachgewiesen.[84] Die Photodynamische Therapie ist ein experimentelles Verfahren, bei welchem den Patienten ein lichtempfindliches Medikament injiziert wird und dann der Tumor endoskopisch mit Licht bestrahlt wird. In einer kleinen randomisierten Studie konnten mit diesem Verfahren erste Ergebnisse erzielt werden. Insgesamt ist der Nutzen des Verfahrens allerdings noch nicht absehbar.[85][86]
Weblinks
Einzelnachweise
- S. Landis, T. Murray, S. Bolden, P. Wingo: Cancer statistics, 1998. In: Cancer J Clin, 48, 1, S. 6–29, PMID 9449931
- T. Patel: Worldwide trends in mortality from biliary tract malignancies. In: BMC Cancer, 2, 10, PMID 11991810
- S. Khan, S. Taylor-Robinson, M. Toledano, A. Beck, P. Elliott, H. Thomas: Changing international trends in mortality rates for liver, biliary and pancreatic tumours. In: J Hepatol, 37, 6, 2002, S. 806–813, PMID 12445422
- J. Vauthey, L. Blumgart: Recent advances in the management of cholangiocarcinomas. In: Semin Liver Dis, 14, 2, 1994, S. 109–114, PMID 8047893
- D. Henson, J. Albores-Saavedra, D. Corle: Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates. In: Cancer, 70, 6, 1991, S. 1498–1501, PMID 1516001
- C. Rosen, D. Nagorney, R. Wiesner, R. Coffey, N. la Russo: Cholangiocarcinoma complicating primary sclerosing cholangitis. In: Ann Surg, 213, 1, 1991, S. 21–25, PMID 1845927
- Mehrere unabhängige Untersuchungen haben auf einen weltweiten stetigen Anstieg der Inzidenz des Gallengangskarzinoms hingewiesen:
- T. Patel: Worldwide trends in mortality from biliary tract malignancies. In: BMC Cancer, 2, S. 10, PMID 11991810
- T. Patel: Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States Hepatology 33, 6, 2001, S. 1353–1357, PMID 11391522
- Y. Shaib, J. Davila, K. Mc Glynn, H. El-Serag (2004): Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase? In: J Hepatol, 40, 3, S. 472–477, PMID 15123362
- J. West, H. Wood, R. Logan, M. Quinn, G. Aithal: Trends in the incidence of primary liver and biliary tract cancers in England and Wales 1971–2001. In: Br J Cancer, 94, 11, 2006, S. 1751–1758, PMID 16736026
- S. Khan, S. Taylor-Robinson, M. Toledano, A. Beck, P. Elliott, H. Thomas: Changing international trends in mortality rates for liver, biliary and pancreatic tumours. In: J Hepatol, 37, 6, 2002, S. 806–813, PMID 12445422
- T. Welzel, K. Mc Glynn, A. Hsing, T. O’Brien, R. Pfeiffer: Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States. In: J Natl Cancer Inst, 98, 12, 2005, S. 873–875, PMID 16788161
- Y. Shaib, H. El-Serag, J. Davila, R. Morgan, K. Mc Glynn: Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study. In: Gastroenterology, 128, 3, 2005, S. 620–626, PMID 15765398
- R. Chapman: Risk factors for biliary tract carcinogenesis. Ann Oncol 10, 4, S. 308–311, PMID 10436847
- Epidemiologische Studien, welche die Inzidenz des Gallengangskarzinoms bei Patienten mit einer primär sklerosierenden Cholangitis untersuchten, sind folgende:
- A. Bergquist, A. Ekbom, R. Olsson, D. Kornfeldt, L. Lööf, A. Danielsson, R. Hultcrantz, S. Lindgren, H. Prytz, H. Sandberg-Gertzén, S. Almer, F. Granath, U. Broomé: Hepatic and extrahepatic malignancies in primary sclerosing cholangitis. In: J Hepatol, 36, 3, 2002, S. 321–327, PMID 11867174
- A. Bergquist, H. Glaumann, B. Persson, U. Broomé: Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study. In: Hepatology, 27, 2, 1998, S. 311–316, PMID 9462625
- K. Burak, P. Angulo, T. Pasha, K. Egan, J. Petz, K. Lindor: Incidence and risk factors for cholangiocarcinoma in primary sclerosing cholangitis. In: Am J Gastroenterol, 99, 3, 2004, S. 523–526, PMID 15056096
- P. Watanapa: Cholangiocarcinoma in patients with opisthorchiasis. In: Br J Surg, 83, 8, 1996, S. 1062– 1064, PMID 8869303
- P. Watanapa, W. Watanapa: Liver fluke-associated cholangiocarcinoma. In: Br J Surg, 89, 8, 2002, S. 962–970, PMID 12153620
- H. Shin, C. Lee, H. Park, S. Seol, J. Chung, H. Choi, Y. Ahn, T. Shigemastu (1996): Hepatitis B and C virus, Clonorchis sinensis for the risk of liver cancer: a case-control study in Pusan, Korea. In: Int J Epidemiol, 25, 5, S. 933–940, PMID 8921477
- M. Kobayashi, K. Ikeda, S. Saitoh, F. Suzuki, A. Tsubota, Y. Suzuki, Y. Arase, N. Murashima, K. Chayama, H. Kumada: Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis. In: Cancer, 88, 11, 2000, S. 2471–2477, PMID 10861422
- S. Yamamoto, S. Kubo, S. Hai, T. Uenishi, T. Yamamoto, T. Shuto, S. Takemura, H. Tanaka, O. Yamazaki, K. Hirohashi, T. Tanaka: Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma. In: Cancer Sci, 95, 7, 2004, S. 592–595, PMID 15245596
- H. Lu, M. Ye, S. Thung, S. Dash, M. Gerber: Detection of hepatitis C virus RNA sequences in cholangiocarcinomas in Chinese and American patients. In: Chinese Medical Journal, (englisch), 113, 12, 2000, S. 1138–1141, PMID 11776153
- H. Sorensen, S. Friis, J. Olsen, A. Thulstrup, L. Mellemkjaer, M. Linet, D. Trichopoulos, H. Vilstrup, J. Olsen: Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark. In: Hepatology, 28, 4, 1998, S. 921–925, PMID 9755226
- P. Lipsett, H. Pitt, P. Colombani, J. Boitnott, J. Cameron: Choledochal cyst disease. A changing pattern of presentation. In: Ann Surg, 220, 5, 1994, S. 644–652, PMID 7979612
- M. Dayton, W. Longmire, R. Tompkins (1983): Caroli’s Disease: a premalignant condition? In: Am J Surg, 145, 1, S. 41–48, PMID 6295196
- J. Mecklin, H. Järvinen, M. Virolainen: The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma. In: Cancer, 69, 5, 2004, S. 1112–1114, PMID 1310886
- S. Lee, M. Kim, S. Jang, M. Song, K. Kim, H. Kim, D. Seo, D. Song, E. Yu, Y. Min: Clinicopathologic review of 58 patients with biliary papillomatosis. In: Cancer, 100, 4, 2004, S. 783–793, PMID 14770435
- C. Lee, C. Wu, G. Chen (2002): What is the impact of coexistence of hepatolithiasis on cholangiocarcinoma? In: J Gastroenterol Hepatol, 17, 9, S. 1015–1020, PMID 12167124
- C. Su, Y. Shyr, W. Lui, F. P'Eng: Hepatolithiasis associated with cholangiocarcinoma. In: Br J Surg, 84, 7, 1997, S. 969–973, PMID 9240138
- F. Donato, U. Gelatti, A. Tagger, M. Favret, M. Ribero, F. Callea, C. Martelli, A. Savio, P. Trevisi, G. Nardi: Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy. In: Cancer Causes & Control, 12, 10, 2001, S. 959–964, PMID 11808716
- D. Sahani, S. Prasad, K. Tannabe, P. Hahn, P. Mueller, S. Saini: Thorotrast-induced cholangiocarcinoma: case report. Abdom Imaging 28, 1, S. 72–74, PMID 12483389
- A. Zhu, G. Lauwers, K. Tanabe: Cholangiocarcinoma in association with Thorotrast exposure J Hepatobiliary Pancreat Surg 11, 6, 2004, S. 430–433, PMID 15619021
- Klatskin G.: Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis. An unusual tumor with distinctive clinical and pathological features. in: Am J Med 38, S. 241–256, PMID 14256720
- T. Roskams: Liver stem cells and their implication in hepatocellular and cholangiocarcinoma. In: Oncogene, 25, 27, 2006, S. 3818–3822, PMID 16799623
- C. Liu, J. Wang, Q. Ou: Possible stem cell origin of human cholangiocarcinoma. In: World J Gastroenterol, 10, 22, 2004, S. 3374–3376, PMID 15484322
- S. Sell, H. Dunsford: Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma. In: Am J Pathol, 134, 6, 1989, S. 1347–1363, PMID 2474256
- A. Sirica: Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy. In: Hepatology, 41, 1, 2005, S. 5–15, PMID 15690474
- F. Holzinger, K. Z'graggen, M. Büchler: Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma. In: Ann Oncol, 10 Suppl 4, S. 122–126, PMID 10436802
- G. Gores: Cholangiocarcinoma: current concepts and insights. In: Hepatology, 37, 5, 2003, S. 961–969, PMID 12717374
- P. de Groen, G. Gores, N. LaRusso, L. Gunderson, D. Nagorney: Biliary tract cancers. In: NEJM, 341, 18, 1999, S. 1368–1378, PMID 10536130
- D. Henson, J. Albores-Saavedra, D. Corle: Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates. In: Cancer, 70, 6, 1992, S. 1498–1501, PMID 1516001
- D. Nagorney, J. Donohue, M. Farnell, C. Schleck, D. Ilstrup: Outcomes after curative resections of cholangiocarcinoma. In: Arch Surg, 128, 8, 1993, S. 871–877, Diskussion S. 877–879, PMID 8393652
- A. Nakeeb, H. Pitt, T. Sohn, J. Coleman, R. Abrams, S. Piantadosi, R. Hruban, K. Lillemoe, C. Yeo, J. Cameron: Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors. In: Ann Surg, 224, 4, 1996, S. 463–473, Diskussion S. 473–475, PMID 8857851
- Mark Feldman, Lawrence S. Friedman, Lawrence J. Brandt (Hrsg.): Sleisenger and Fordtran’s Gastrointestinal and Liver Disease, 8. Auflage, Saunders, an imprint of Elsevier, 21. Juli 2006, ISBN 978-1-4160-0245-1, S. 1493 – 1496 (Abgerufen am 5. Mai 2008).
- Untersuchungen zum Nutzen des Nachweises von Tumormarkern für das Gallengangskarzinom wie CEA und CA 19-9 bei Patienten mit oder ohne primär sklerosierender Cholangitis:
- O. Nehls, M. Gregor, B. Klump: Serum and bile markers for cholangiocarcinoma. In: Semin Liver, Dis 24, 2, 2004, S. 139–154, PMID 15192787
- E. Siqueira, R. Schoen, W. Silverman, J. Martin, M. Rabinovitz, J. Weissfeld, K. Abu-Elmaagd, J. Madariaga, A. Slivka, J. Martini: Detecting cholangiocarcinoma in patients with primary sclerosing cholangitis Gastrointest Endosc 56, 1, 2002, S. 40–47, PMID 12085033
- C. Levy, J. Lymp, P. Angulo, G. Gores, N. Larusso, K. Lindor: (2005) The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis. in: Dig Dis Sci 50, 9, S. 1734–1740, PMID 16133981
- A. Patel, D. Harnois, G. Klee, N. La Russo, G. Gores: (2000) The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis. Am J Gastroenterol 95, 1, S. 204–207, PMID 10638584
- S. Saini: Imaging of the hepatobiliary tract. In: NEJM, 336, 26, 1997, S. 1889–1894, PMID 9197218
- M. Sharma, V. Ahuja: Aetiological spectrum of obstructive jaundice and diagnostic ability of ultrasonography: a clinician’s perspective. In: Trop Gastroenterol, 20, 4, S. 167–169, PMID 10769604
- C. Bloom, B. Langer, S. Wilson: Role of US in the detection, characterization, and staging of cholangiocarcinoma. In: Radiographics, 19, 5, S. 1199–1218, PMID 10489176
- C. Valls, A. Gumà, I. Puig, A. Sanchez, E. Andía, T. Serrano, J. Figueras: Intrahepatic peripheral cholangiocarcinoma: CT evaluation. In: Abdom Imaging, 25, 5, S. 490–496, PMID 10931983
- M. Tillich, H. Mischinger, K. Preisegger, H. Rabl, D. Szolar: Multiphasic helical CT in diagnosis and staging of hilar cholangiocarcinoma. In: AJR Am J Roentgenol, 171, 3, 1998, S. 651–658, PMID 9725291
- Y. Zhang, M. Uchida, T. Abe, H. Nishimura, N. Hayabuchi, Y. Nakashima: Intrahepatic peripheral cholangiocarcinoma: comparison of dynamic CT and dynamic MRI. In: J Comput Assist Tomogr, 23, 5, S. 670–677, PMID 10524843
- M. Sugiyama, H. Hagi, Y. Atomi, M. Saito: Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography. In: Abdom Imaging, 22, 4, S. 434–438, PMID 9157867
- L. Schwartz, F. Coakley, Y. Sun, L. Blumgart, Y. Fong, D. Panicek: Neoplastic pancreaticobiliary duct obstruction: evaluation with breath-hold MR cholangiopancreatography. In: AJR Am J Roentgenol, 170, 6, 1998, S. 1491–1495, PMID 9609160
- S. Zidi, F. Prat, O. le Guen, Y. Rondeau, G. Pelletier: Performance characteristics of magnetic resonance cholangiography in the staging of malignant hilar strictures. In: Gut, 46, 1, 2000, S. 103–106, PMID 10601064
- M. Lee, K. Park, Y. Shin, H. Yoon, K. Sung, M. Kim, S. Lee, E. Kang: Preoperative evaluation of hilar cholangiocarcinoma with contrast-enhanced three-dimensional fast imaging with steady-state precession magnetic resonance angiography: comparison with intraarterial digital subtraction angiography. In: World Journal of Surgery, 27, 3, 2003, S. 278–283, PMID 12607051
- T. Yeh, Y. Jan, J. Tseng, C. Chiu, T. Chen, T. Hwang, M. Chen: Malignant perihilar biliary obstruction: magnetic resonance cholangiopancreatographic findings. In: Am J Gastroenterol, 95, 2, 2000, S. 432–440, PMID 10685746
- M. Freeman, T. Sielaff: A modern approach to malignant hilar biliary obstruction. In: Rev Gastroenterol Disord, 3, 4, 2003, S. 187–201, PMID 14668691
- J. Szklaruk, E. Tamm, C. Charnsangavej: Preoperative imaging of biliary tract cancers. In: Surgical Oncology Clinics of North America, 11, 4, 2002, S. 865–876, PMID 12607576
- S. Weber, R. de Matteo, Y. Fong, L. Blumgart, W. Jarnagin: Staging laparoscopy in patients with extrahepatic biliary carcinoma. Analysis of 100 patients. In: Ann Surg, 235, 3, 2002, S. 392–399, PMID 11882761
- M. Callery, S. Strasberg, G. Doherty, N. Soper, J. Norton: Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy. In: J Am Coll Surg, 185, 1, 1997, S. 33–39, PMID 9208958
- F. Länger, R. von Wasielewski, H. H. Kreipe: (2006) The importance of immunohistochemistry for the diagnosis of cholangiocarcinomas. In: Pathologe, 27, 4, S. 244–250, PMID 16758167
- P. E. Darwin, A. Kennedy: Cholangiocarcinoma. eMedicine.com. URL: emedicine.com abgerufen am 5. Mai 2007.
- E. Zervos, D. Osborne, S. Goldin, D. Villadolid, D. Thometz, A. Durkin, L. Carey, A. Rosemurgy: Stage does not predict survival after resection of hilar cholangiocarcinomas promoting an aggressive operative approach. In: Am J Surg, 190, 5, 2005, S. 810–815, PMID 16226963
- J. Tsao, Y. Nimura, J. Kamiya, N. Hayakawa, S. Kondo, M. Nagino, M. Miyachi, M. Kanai, K. Uesaka, K. Oda, R. Rossi, J. Braasch, J. Dugan: Management of hilar cholangiocarcinoma: comparison of an American and a Japanese experience. In: Ann Surg, 232, 2, 2004, S. 166–174, PMID 10903592
- V. Rajagopalan, W. Daines, M. Grossbard, P. Kozuch: Gallbladder and biliary tract carcinoma: A comprehensive update, Part 1. In: Oncology (Williston Park), 18, 7, 2004, S. 889–896, PMID 15255172
- M. Yamamoto, K. Takasaki, T. Yoshikawa: Lymph Node Metastasis in Intrahepatic Cholangiocarcinoma. In: Japanese Journal of Clinical Oncology, 29, 3, 1999, S. 147–150.
- D. Farley, A. Weaver, D. Nagorney: “Natural history” of unresected cholangiocarcinoma: patient outcome after noncurative intervention. In: Mayo Clin Proc, 70, 5, 1995, S. 425–429, PMID 7537346
- M. K. Grove, R. E. Hermann, D. P. Vogt, T. A. Broughan: Role of radiation after operative palliation in cancer of the proximal bile ducts Am J Surg 161, 1991, S. 454–458.
- In folgenden Arbeiten wurde das Ergebnis der Tumorchirurgie distaler Gallengangskarzinome untersucht:
- A. Nakeeb, H. Pitt, T. Sohn, J. Coleman, R. Abrams, S. Piantadosi, R. Hruban, K. Lillemoe, C. Yeo, J. Cameron: Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors in: Ann Surg 224, 4, 1996, S. 463–473, Diskussion S. 473–475, PMID 8857851
- D. Nagorney, J. Donohue, M. Farnell, C. Schleck, D. Ilstrup: Outcomes after curative resections of cholangiocarcinoma. In: Arch Surg, 128, 8, 1993, S. 871–877, Diskussion S. 877–879, PMID 8393652
- J. Jang, S. Kim, D. Park, Y. Ahn, Y. Yoon, M. Choi, K. Suh, K. Lee, Y. Park: Actual long-term outcome of extrahepatic bile duct cancer after surgical resection. In: Ann Surg, 241, 1, 2005, S. 77–84, PMID 15621994
- L. Bortolasi, L. Burgart, G. Tsiotos, E. Luque-De León, M. Sarr: Adenocarcinoma of the distal bile duct. A clinicopathologic outcome analysis after curative resection. In: Digestive Surgery, 17, 1, 2000, S. 36–41, PMID 10720830
- Y. Fong, L. Blumgart, E. Lin, J. Fortner, M. Brennan: Outcome of treatment for distal bile duct cancer Br J Surg 83, 12, 1996, S. 1712–1715, PMID 9038548
- In folgenden Arbeiten wurde das Ergebnis der Tumorchirurgie intrahepatischer Gallengangskarzinome untersucht:
- A. Nakeeb, H. Pitt, T. Sohn, J. Coleman, R. Abrams, S. Piantadosi, R. Hruban, K. Lillemoe, C. Yeo, J. Cameron: Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors. In: Ann Surg, 224, 4, 1996, S. 463–473, Diskussion S. 473–475, PMID 8857851.
- M. Lieser, M. Barry, C. Rowland, D. Ilstrup, D. Nagorney: Surgical management of intrahepatic cholangiocarcinoma: a 31-year experience. In: J Hepatobiliary Pancreat Surg, 5, 1, 1998, S. 41–47, PMID 9683753
- A. Valverde, N. Bonhomme, O. Farges, A. Sauvanet, J. Flejou, J. Belghiti: Resection of intrahepatic cholangiocarcinoma: a Western experience. In: J Hepatobiliary Pancreat Surg, 6, 2, 1999, S. 122–127, PMID 10398898
- T. Nakagohri, T. Asano, H. Kinoshita, T. Kenmochi, T. Urashima, F. Miura, T. Ochiai: Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma. In: World J Surg, 27, 3, 2003, S. 289–293, PMID 12607053
- S. Weber, W. Jarnagin, D. Klimstra, R. DeMatteo, Y. Fong, L. Blumgart: Intrahepatic cholangiocarcinoma: resectability, recurrence pattern, and outcomes. In: J Am Coll Surg, 193, 4, 2001, S. 384–391, PMID 11584966
- In folgenden Arbeiten wurde die Fünfjahresüberlebensrate perihilärer Gallengangskarzinome untersucht:
- E. Burke, W. Jarnagin, S. Hochwald, P. Pisters, Y. Fong, L. Blumgart: Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system. In: Ann Surg, 228, 3, 1998, S. 385–394, PMID 9742921
- J. Tsao, Y. Nimura, J. Kamiya, N. Hayakawa, S. Kondo, M. Nagino, M. Miyachi, M. Kanai, K. Uesaka, K. Oda, R. Rossi, J. Braasch, J. Dugan: Management of hilar cholangiocarcinoma: comparison of an American and a Japanese experience. In: Ann Surg, 232, 2, 2000, S. 166–174, PMID 10903592
- R. Chamberlain, L. Blumgart: Hilar cholangiocarcinoma: a review and commentary. In: Ann Surg Oncol, 7, 1, S. 55–66, PMID 10674450
- W. Washburn, W. Lewis, R. Jenkins: Aggressive surgical resection for cholangiocarcinoma. In: Arch Surg, 130, 3, 1995, S. 270–276, PMID 7534059
- M. Nagino, Y. Nimura, J. Kamiya, M. Kanai, K. Uesaka, N. Hayakawa, H. Yamamoto, S. Kondo, H. Nishio: Segmental liver resections for hilar cholangiocarcinoma. In: Hepatogastroenterology, 45, 19, S. 7–13, PMID 9496478
- D. Rea, M. Munoz-Juarez, M. Farnell, J. Donohue, F. Que, B. Crownhart, D. Larson, D. Nagorney: Major hepatic resection for hilar cholangiocarcinoma: analysis of 46 patients. In: Arch Surg, 139, 5, 2004, S. 514–523, Diskussion S. 523–525, PMID 15136352
- B. Launois, R. Reding, G. Lebeau, J. Buard: Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepatic bile duct cancers. In: J Hepatobiliary Pancreat Surg, 7, 2, 2000, S. 128–134, PMID 10982604
- M. Kaya, P. de Groen, P. Angulo, D. Nagorney, L. Gunderson, G. Gores, M. Haddock, K. Lindor: Treatment of cholangiocarcinoma complicating primary sclerosing cholangitis: the Mayo Clinic experience. In: Am J Gastroenterol, 96, 4, 2001, S. 1164–1169, PMID 11316165
- A. Nakeeb, K. Tran, M. Black, B. Erickson, P. Ritch, E. Quebbeman, S. Wilson, M. Demeure, W. Rilling, K. Dua, H. Pitt: Improved survival in resected biliary malignancies. In: Surgery, 132, 4, 2002, S. 555–563, Diskussion S. 563–564, PMID 12407338
- C. Su, S. Tsay, C. Wu, Y. Shyr, K. King, C. Lee, W. Lui, T. Liu, F. P'eng: Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma. In: Ann Surg, 223, 4, 1996, S. 384–94, PMID 8633917
- J. K. Heimbach, G. J. Gores, M. G. Haddock et al.: Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma. in: Transplantation. 2006 Dec 27; 82 (12): S. 1703–1707.
- T. Todoroki, K. Ohara, T. Kawamoto, N. Koike, S. Yoshida, H. Kashiwagi, M. Otsuka, K. Fukao: Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma. In: Int J Radiat Oncol Biol Phys, 46, 3, 1994, S. 581–587, PMID 10701737
- M. Alden, M. Mohiuddin: The impact of radiation dose in combined external beam and intraluminal Ir-192 brachytherapy for bile duct cancer. In: Int J Radiat Oncol Biol Phys, 28, 4, 1994, S. 945–951, PMID 8138448
- D. González González, D. Gouma, E. Rauws, T. van Gulik, A. Bosma, C. Koedooder: Role of radiotherapy, in particular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma. In: Ann Oncol, 10, Suppl 4, S. 215–220, PMID 10436826
- H. Pitt, A. Nakeeb, R. Abrams, J. Coleman, S. Piantadosi, C. Yeo, K. Lillemore, J. Cameron: Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival Ann Surg 221, 6, 1995, S. 788–797, Diskussion S. 797–798, PMID 7794082
- T. Takada, H. Amano, H. Yasuda, Y. Nimura, T. Matsushiro, H. Kato, T. Nagakawa, T. Nakayama: Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma. In: Cancer, 95, 8, 2002, S. 1685–1695, PMID 12365016
- National Comprehensive Cancer Network (NCCN) guidelines on evaluation and treatment of hepatobiliary malignancies (PDF) abgerufen am 13. März 2007.
- J. Vauthey, L. Blumgart (1994): Recent advances in the management of cholangiocarcinomas. Semin. Liver Dis. 14, 2, S. 109–114, PMID 8047893
- B. Glimelius, K. Hoffman, P. Sjödén, G. Jacobsson, H. Sellström, L. Enander, T. Linné, C. Svensson: Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer. In: Ann Oncol, 7, 6, 1996, S. 593–600, PMID 8879373
- C. Choi, I. Choi, J. Seo, B. Kim, J. Kim, C. Kim, S. Um, J. Kim, Y. Kim: Effects of 5-fluorouracil and leucovorin in the treatment of pancreatic-biliary tract adenocarcinomas. In: Am J Clin Oncol, 234, 2000, S. 425–428, PMID 10955877
- J. Park, S. Oh, S. Kim, H. Kwon, J. Kim, H. Jin-Kim, Y. Kim: Single-agent gemcitabine in the treatment of advanced biliary tract cancers: a phase II study. In: Jpn J Clin Oncol, 35, 2, 2005, S. 68–73, PMID 15709089
- F. Giuliani, V. Gebbia, E. Maiello, N. Borsellino, E. Bajardi, G. Colucci: Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a multicenter phase II study of the Gruppo Oncologico dell’Italia Meridionale (GOIM). In: Ann Oncol, 17 Suppl 7 S. vii73–vii77, PMID 16760299
- P. Bhargava, C. Jani, D. Savarese, J. O’Donnell, K. Stuart, C. Rocha Lima: Gemcitabine and irinotecan in locally advanced or metastatic biliary cancer: preliminary report. In: Oncology (Williston Park), 17, 9 Suppl 8, 2003, S. 23–26, PMID 14569844
- J. Knox, D. Hedley, A. Oza, R. Feld, L. Siu, E. Chen, M. Nematollahi, G. Pond, J. Zhang, M. Moore: Combining gemcitabine and capecitabine in patients with advanced biliary cancer: a phase II trial. In: J Clin Oncol, 23, 10, 2005, S. 2332–2338, PMID 15800324
- R.R. Plentz, A. Vogel: Therapie des metastasierten Cholangiokarzinoms. Onkologe 2015;10:1064-1068. doi:10.1007/s00761-015-2932-2
- P. Philip, M. Mahoney, C. Allmer, J. Thomas, H. Pitot, G. Kim, R. Donehower, T. Fitch, J. Picus, C. Erlichman: Phase II study of erlotinib in patients with advanced biliary cancer. In: J Clin Oncol, 24, 19, 2006, S. 3069–3074, PMID 16809731
- M. Ortner, K. Caca, F. Berr, J. Liebetruth, U. Mansmann, D. Huster, W. Voderholzer, G. Schachschal, J. Mössner, H. Lochs: Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. In: Gastroenterology, 125, 5, 2003, S. 1355–1363, PMID 14598251
- T. Zoepf, R. Jakobs, J. Arnold, D. Apel, J. Riemann: Palliation of nonresectable bile duct cancer: improved survival after photodynamic therapy. In: Am J Gastroenterol, 100, 11, 2005, S. 2426–2430, PMID 16279895