Amnioten
Amnioten (Amniota) Amniontiere oder Nabeltiere sind eine Großgruppe der Landwirbeltiere (Tetrapoda). Ihre Vertreter sind vor allem durch die Fähigkeit gekennzeichnet, sich, anders als Amphibien, völlig unabhängig vom Wasser fortzupflanzen. Statt über eine kurze Embryonalphase mit anschließendem frei lebenden vollaquatischen Larvenstadium verläuft ihre Frühontogenese über eine lange Embryonal- bzw. Fetalphase ohne frei lebendes Larvenstadium. Die Embryonen bzw. Föten der Amniota entwickeln sich dabei in einer mit Amnionflüssigkeit (Fruchtwasser) gefüllten Amnionhöhle (Fruchtblase), die unmittelbar und vollständig vom Amnion und mittelbar mehr oder weniger vollständig von weiteren extraembryonalen Membranen umgeben ist.
| Amnioten | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Aus dem Ei schlüpfende Schildkröte | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Amniota | ||||||||||||
| Haeckel, 1866 |
Die Amniota gelten als monophyletisches Taxon, d. h., alle rezenten und ausgestorbenen Arten dieser Gruppe gehen auf eine einzige gemeinsame Ursprungsart zurück. Die rezenten Untergruppen der Amnioten sind die Schuppenechsen (Lepidosauria), die Schildkröten (Testudines), die Krokodile (Crocodylia), die Vögel (Aves) und die Säugetiere (Mammalia).
Das amniotische Ei
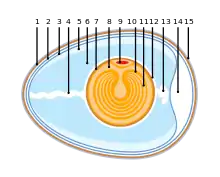
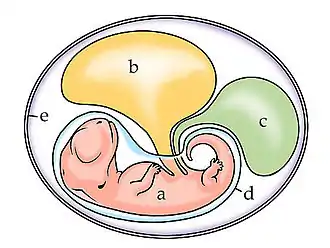
Das amniotische Ei oder Amnioten-Ei (engl.: amniotic egg oder auch cleidoic egg) gilt als eine Neuentwicklung und ein Schlüsselmerkmal der gemeinsamen Stammart aller rezenten und ausgestorbenen Amnioten. Es weist sowohl Modifikationen beim Bau des unentwickelten, frisch abgelegten Eis, als auch Modifikationen bei der Entwicklung des Embryos gegenüber Ei und Embryonalentwicklung nicht-amniotischer Tetrapoden auf.
Merkmale
Neben dem großen Dotter („Eigelb“), der überwiegend als Nährstoffvorrat (Nahrungsdotter oder Nährdotter genannt) fungiert, enthält ein amniotisches Ei auch Albumen („Eiklar“), das als Flüssigkeitsspeicher und Stoßdämpfer dient. Umschlossen wird es von einer relativ festen, entweder pergamentartigen oder kalkigen Schale. Die feste Schale, der hohe Wasseranteil und der große Nährstoffvorrat machen das amniotische Ei zu einer autonomen Überlebenskapsel für den sich darin entwickelnden Embryo, die ein Fötusstadium im eigentlichen Sinn überhaupt erst ermöglicht.
Hinsichtlich ihrer Fortpflanzungsbiologie können alle Sauropsiden, auch die Vögel, als rezente basale Amnioten gesehen werden. In ihren großdotterigen Eizellen sind Nahrungsdotter und Bildungsdotter (die eigentliche Keimanlage, auch Bildungsplasma, Keimfleck und beim voll ausgebildeten Hühnerei volkstümlich auch „Hahnentritt“ genannt) ungleich und asymmetrisch verteilt: Der Nahrungsdotter überwiegt bei weitem den randlich liegenden Bildungsdotter. Dieser Eizellentyp wird macrolecithal oder auch telolecithal genannt. Bei macro-/telolecithalen Eizellen umfasst die Furchung im Initialstadium der Embryonalentwicklung ausschließlich den Bildungsdotter. Dass auch die Kloakentiere als sehr ursprüngliche Säugetiere macro-/telolecithale Eizellen bzw. Eier besitzen, zeigt, dass dieser Typ wahrscheinlich den ursprünglichen Zustand bei allen Amnioten repräsentiert.
Der Amnioten-Embryo bildet im Frühstadium vier extraembryonale Membranen aus: das Amnion, das Chorion (Serosa), den Dottersack und die Allantois. Das Amnion umgibt den Embryo unmittelbar. Es formt eine Blase, die mit einer Flüssigkeit (Fruchtwasser) gefüllt ist, die von den Amnionzellen abgesondert wird. Dieser flüssigkeitsgefüllte Hohlraum wird Amnionhöhle, oder, insbesondere im Zusammenhang mit der Fetalentwicklung plazentaler Säugetiere, Fruchtblase genannt. Er schützt den Embryo bzw. Fötus unter anderem vor Austrocknung. Zwischen Amnion und Chorion erstreckt sich das ebenfalls flüssigkeitsgefüllte extraembryonale Coelom, dessen Volumen infolge des Wachstums des Embryos bzw. Fötus und damit der Amnionhöhle fortwährend schrumpft und schließlich gegen Null geht. Während die beiden Embryonalhüllen Amnion und Chorion nicht durchblutet sind, weisen Dottersack und Allantois, die in das extraembryonale Coelom hineinragen und mit dem Darm des Embryos bzw. Fötus verbunden sind, ein Geflecht aus Blutgefäßen auf. Über den Dottersack werden dem Embryo bzw. Fötus Nährstoffe aus dem Dotter zugeführt. Über die Allantois erfolgt ein Großteil des Gasaustauschs, d. h. die Zufuhr von Sauerstoff und die Abfuhr von Kohlendioxid. Außerdem nimmt der Membransack, der von der Allantois gebildet wird, die stickstoffhaltigen Stoffwechselendprodukte, den embryonalen bzw. fetalen Harn, auf („embryonale Harnblase“).
Einhergehende Modifikationen der Fortpflanzungsorgane und des Befruchtungsmodus
Infolge der Eiablage außerhalb von Gewässern und als Konsequenz der festen, für Flüssigkeiten weitgehend undurchlässigen Eischale ist bei den Amnioten eine deutlich vor der Eiablage stattfindende innere Befruchtung zwingend notwendig. Diese wird über den Ovidukt, das schon bei den anamnischen Wirbeltieren vorhandene „Eierlegeorgan“, abgewickelt, indem die Vagina des Weibchens die Spermien des Männchens aufnimmt, von wo aus sie tiefer in den Ovidukt vordringen und dort die aus dem Eierstock eingewanderten Eizellen befruchten.
Nachfolgend wird während ihrer Wanderung durch den Ovidukt in Richtung der Kloake um die befruchteten Eizellen herum das Albumen und schließlich im Uterus die äußere Eihülle sezerniert.[2]
Bedeutung
Sich außerhalb des Wassers fortpflanzen zu können, hatte für frühe anamniotische Landwirbeltiere das Potenzial, neue Lebensräume erschließen und so der Konkurrenz anderer anamnischer Arten ausweichen zu können. Mit Entwicklung des Amnioten-Eis, wie es heute bei Reptilien, Vögeln und monotremen Säugern vorkommt, konnte dieses Potenzial genutzt werden. Die Landwirbeltiere waren nunmehr in der Lage, sich auch in sehr trockene Regionen auszubreiten und die Kontinente flächendeckend zu besiedeln.
Bei den placentalen Säugern ist diese Strategie deutlich weiterentwickelt worden. Bei ihnen ist der Uterus nicht mehr das Organ, in dem die Eischale gebildet wird, sondern das Organ, in dem sich Embryo und Fötus innerhalb des Körpers des Muttertieres bis zur vollen Geburtsreife entwickeln (Gebärmutter). Hierbei verwächst ein Teil des Chorions mit einem Teil der Uteruswand und bildet die Plazenta, über die Ernährung und Exkretion des Embryos und Fötus erfolgen. Bei Beuteltieren reift der Fötus zwar nicht im Uterus, aber in einem mit einer Milchdrüse versehenen Brutbeutel des Muttertiers. Aufgrund dieser Abwandlungen des Fortpflanzungsmodus sind die Eizellen von „echten“ Säugetieren (Theria) nicht mehr macro-/telolecithal, sondern dotterarm mit symmetrischer Verteilung von Bildungs- und Nahrungsdotter (isolecithal).
Systematik
Der Begriff wurde erstmals 1866 von Ernst Haeckel („Amnionthiere“) für die „höheren“ Wirbeltierklassen Reptilien, Vögel und Säugetiere eingeführt – zur Abgrenzung von den „niederen“ Wirbeltierklassen, den Fischen und Amphibien, die von Haeckel unter der Bezeichnung „Anamnia“ zusammengefasst wurden. In der modernen, kladistisch geprägten Systematik der rezenten Landwirbeltiere ist die als Amphibia (auch Lissamphibia) bezeichnete Klade aus Froschlurchen (Anura), Schwanzlurchen (Urodela) und Blindwühlen (Gymnophiona) die Schwestergruppe der Amnioten.
Äußere Systematik
Die Amnioten entwickelten sich nicht in der Stammgruppe der heutigen Amphibien, sondern aus frühen, anamnischen Vertretern einer als Reptiliomorpha bezeichneten Gruppe. Letztgenannte schließt in der modernen Systematik auch die Amnioten mit ein. Insbesondere bei der Anatomie der Wirbel ist die Ähnlichkeit zwischen frühen Reptiliomorphen und Amnioten größer als zwischen frühen Reptiliomorphen und den frühesten Landwirbeltieren oder den mutmaßlichen fossilen Verwandten der heute lebenden Amphibien.
Die möglichen verwandtschaftlichen Beziehungen verdeutlicht folgendes stark vereinfachtes Kladogramm:
| Landwirbeltiere |
| ||||||||||||||||||||||||
Innere Systematik
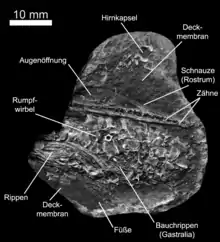
Die ersten Amnioten legten wahrscheinlich noch keine Eier mit verkalkter Schale.[4] Solche Eier sind fossil nur sehr schlecht erhaltungsfähig. Der älteste relativ klare Nachweis eines amniotischen Eis mitsamt enthaltenem Fötus stammt von Mesosaurus aus dem Unterperm von Uruguay.[3]§ Allerdings kommen Mesosaurus-Fossilien in diesen aquatischen Sedimentgesteinen in großen Stückzahlen in weitgehend anatomischem Zusammenhang (artikuliert) vor (vgl. → Konservatlagerstätte).[5][6] Das heißt, die damalige dortige Paläoumwelt bot gute Bedingungen für die Fossilerhaltung, sodass die statistische Wahrscheinlichkeit, dass dort auch einige Mesosaurus-Föten überliefert sind, relativ hoch ist.[4] Die Entstehung der ersten Amnioten dürfte jedoch in terrestrischen, trockenen Habitaten stattgefunden haben, in denen üblicherweise weit weniger gute Bedingungen für die Überlieferung von Fossilien herrschten. Des Weiteren gilt Mesosaurus unumstritten als sekundär (semi-)aquatisches Reptil,[7][8][9] was bedeutet, dass die Amnioten im Unterperm bereits eine gewisse adaptive Radiation durchlaufen haben müssen. Tatsächlich ist in anderen Regionen der Welt (Nordamerika, Europa) mit den „Pelycosauriern“ eine weitere unzweifelhafte Entwicklungslinie der Amnioten (siehe unten) am Ende des Karbons und im Unterperm mit unter anderem pflanzenfressenden (herbivoren), das heißt ökologisch ebenfalls bereits spezialisierten, Vertretern nachweisbar.[10][11]
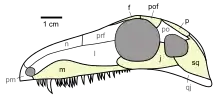
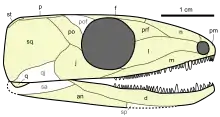
Wann die ersten Amnioten lebten, ist deshalb allein über den Fossilnachweis amniotischer Eier kaum zu erbringen. Abhilfe in dieser Frage schafft die systematische Untersuchung und Auswertung der Morphologie von Landwirbeltierfossilien: Die Amniota sind in der modernen, kladistisch geprägten Systematik eine Kronengruppe, das heißt, sie sind definiert über den jüngsten gemeinsamen Vorfahren (die hypothetische Stammart) aller heute lebenden Arten, die sich mit Hilfe des amniotischen Eis (oder entsprechender Weiterentwicklungen) fortpflanzen. Durch Untersuchung der Morphologie rezenter Amnioten und verschiedener fossiler Landwirbeltierarten können Stammbäume (genauer: Kladogramme) konstruiert werden, an denen abgelesen werden kann, welche fossilen Arten auf diese gemeinsame Stammart zurückgehen, auch ohne dass von diesen Arten oder aus der Zeit, in der sie lebten, amniotische Eier fossil überliefert sind.[12] Die geologisch ältesten bislang bekannten Arten, auf die dies zutrifft, sind Hylonomus lyelli, Protoclepsydrops haplous, Paleothyris acadiana und Archaeothyris florensis, vier eher kleine, eidechsenähnliche Tiere aus dem Oberkarbon von Nova Scotia (Kanada).
Demnach spalteten sich die Amnioten bereits vor dem Auftreten dieser vier Arten in ihre zwei Hauptlinien auf:
|
Tatsächlich ist Archaeothyris laut den durchgeführten Analysen ein Vertreter der Synapsidenlinie und Hylonomus und Paleothyris sind Vertreter der Sauropsidenlinie. Welcher der beiden Linien Protoclepsydrops angehört, ist noch unklar. Auch die Aufspaltung der Sauropsidenlinie in Eureptilien und Parareptilien musste bereits stattgefunden haben, denn Hylonomus und Paleothyris sind Vertreter der Eureptilia. Als ältestes Parareptil gilt Erpetonyx arsenaultorum aus dem jüngsten Karbon von Prince Edward Island (ebenfalls Kanada).[13]
Die verwandtschaftlichen Beziehungen der Amnioten verdeutlicht folgendes, stark vereinfachtes Kladogramm (man beachte die Stellung von Archaeothyris bzw. Hylonomus und Paleothyris an der Basis sowie die Stellung der Säugetiere bzw. der rezenten Reptilien und der Vögel an den „oberen Enden“ der beiden Hauptäste des Kladogramms):
| Amniota |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Literatur
- Robert L. Carroll: Paläontologie und Evolution der Wirbeltiere. Thieme, Stuttgart 1993, ISBN 3-13-774401-6.
- Michael J. Benton: Paläontologie der Wirbeltiere. Pfeil, München 2007, ISBN 3-89937-072-4.
- Bert De Groef, Sylvia V. H. Grommen, Veerle M. Darras: Hatching the Cleidoic Egg: The Role of Thyroid Hormones. In: Frontiers in Endocrinology. Band 4, Artikel-Nr. 63, Mai 2013, doi:10.3389/fendo.2013.00063.
- Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. 2. Auflage, Spektrum Akademischer Verlag, Heidelberg 2010, ISBN 978-3-8274-2039-8.
Einzelnachweise
- Wilfried Brade: Physiologie der Eibildung und Aufbau des Eies. S. 7–18 in: Wilfried Brade, Gerhard Flachowsky, Lars Schrader (Hrsg.): Legehuhnzucht und Eiererzeugung. Empfehlungen für die Praxis. Landbauforschung. Sonderheft 322. Johann Heinrich von Thünen-Institut, Braunschweig 2008, ISBN 978-3-86576-047-0 (PDF 6,9 MB komplettes Heft).
- Lauralee Sherwood, Hillar Klandorf, Paul Yancey: Animal Physiology: From Genes to Organisms. 2. Auflage. Brooks/Cole, Belmont (CA) 2013, ISBN 978-0-8400-6865-1, S. 764.
- Graciela Piñeiro, Jorge Ferigolo, Melitta Meneghel, Michel Laurin: The oldest known amniotic embryos suggest viviparity in mesosaurs. Historical Biology. Bd. 24, Nr. 6, 2012, S. 620–630, doi:10.1080/08912963.2012.662230.
- P. Martin Sander: Reproduction in early amniotes. Science. Bd. 337, Nr. 6096, 2012, S. 806–808, doi:10.1126/science.1224301
- Torsten Rossmann, Michael W. Maisch: Das Mesosaurier-Material in der Bayerischen Staatssammlung für Paläontologie und Historische Geologie: Übersicht und neue Erkenntnisse. Mitteilungen der Bayerischen Staatssammlung für Paläontologie und Historische Geologie. Bd. 39, 1999, S. 69–83 (BHL).
- Graciela Piñeiro, Alejandro Ramos, César Goso, Fabrizio Scarabino, Michel Laurin: Unusual environmental conditions preserve a Permian mesosaur-bearing Konservat-Lagerstätte from Uruguay. Acta Palaeontologica Polonica. Bd. 57, Nr. 2, 2012, S. 299–318, doi:10.4202/app.2010.0113.
- Burger W. Oelofsen, Dina C. Araújo: Mesosaurus tenuidens and Stereosternum tumidum from the Permian Gondwana of both Southern Africa and South America. South African Journal of Science. Bd. 83, Nr. 6, 1987, ISSN 0038-2353, S. 370–372.
- Sean Patrick Modesto: The Postcranial Skeleton of the Aquatic Parareptile Mesosaurus tenuidens from the Gondwanan Permian. Journal of Vertebrate Paleontology. Bd. 30, Nr. 5, 2010, S. 1378–1395, doi:10.1080/02724634.2010.501443.
- Pablo Nuñez Demarco, Melitta Meneghel, Michel Laurin, Graciela Piñeiro: Was Mesosaurus a fully aquatic reptile? Frontiers in Ecology and Evolution. Bd. 6, 2018, Art.-Nr. 109, doi:10.3389/fevo.2018.00109.
- Hans-Dieter Sues, Robert R. Reisz: Origins and early evolution of herbivory in tetrapods. Trends in Ecology and Evolution. Bd. 13, Nr. 4, 1998, S. 141–145, doi:10.1016/S0169-5347(97)01257-3.
- Robert R. Reisz, Jörg Fröbisch: The oldest caseid synapsid from the Late Pennsylvanian of Kansas, and the evolution of herbivory in terrestrial vertebrates. PLoS ONE. Bd. 9, Nr. 4, 2014, Art.-Nr. e94518, doi:10.1016/S0169-5347(97)01257-3.
- Robert R. Reisz: The origin and early evolutionary history of amniotes. Trends in Ecology and Evolution. Bd. 12, Nr. 6, 1997, S. 218–222, doi:10.1016/S0169-5347(97)01060-4.
- Sean P. Modesto, Diane M. Scott, Mark J. MacDougall, Hans-Dieter Sues, David C. Evans, Robert R. Reisz: The oldest parareptile and the early diversification of reptiles. Proceedings of the Royal Society B. Bd. 282, Nr. 1801, doi:10.1098/rspb.2014.1912.
- siehe Michael Conye: News and Legal Briefs: World’s Oldest Reptile Nest Found. Marine Turtle Newsletter. Nr. 83, 1999, S. 21 (PDF 370 kB, komplettes Heft); zitiert in Laurin & Gauthier: Amniota. Mammals, reptiles .... 2012 (siehe Weblinks).
- Jacques A. Gauthier, Arnold G. Kluge, Timothy Rowe: The early evolution of the Amniota. S. 103–155 in: Michael J. Benton (Hrsg.): The phylogeny and classification of the tetrapods, Volume 1: amphibians, reptiles, birds. Clarendon Press, Oxford 1988.
Weblinks
- Michel Laurin, Jacques A. Gauthier: Amniota. Mammals, reptiles (turtles, lizards, Sphenodon, crocodiles, birds) and their extinct relatives. The Tree of Life Web Project, Version vom 30. Januar 2012, abgerufen am 24. Juli 2015