Sauropoden
Die Sauropoden (Plural Sauropoda; von altgriechisch σαύρα/σαῦρος saúra/saúros, deutsch ‚Eidechse‘ und ποδ- pod-, dem Stamm zu πούς poús, deutsch ‚Fuß‘)[2][3] sind eine Gruppe von Echsenbeckendinosauriern (Saurischia), die zu den Sauropodomorpha zählen.
| Sauropoden | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Skelettrekonstruktion von Diplodocus im Berliner Hauptbahnhof | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Obertrias bis Oberkreide (Norium bis Maastrichtium)[1] | ||||||||||||
| 228 bis 66 Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Sauropoda | ||||||||||||
| Marsh, 1878 |
Sie waren eine der artenreichsten und am weitesten verbreiteten Gruppen pflanzenfressender Dinosaurier.[4] Ihr Habitus war durch einen tonnenförmigen Rumpf auf vier massiven Beinen, einen langen Hals und Schwanz und einen unverhältnismäßig kleinen Kopf gekennzeichnet. Als die größten landbewohnenden Tiere der Erdgeschichte gingen sie mit ihrem Gigantismus bis an die Grenzen des physiologisch und physikalisch Möglichen innerhalb des Bauplans der Landwirbeltiere. In der Tierwelt erreichen nur einige Walarten eine noch größere Körpermasse.
Die Sauropoden erschienen in der Obertrias vor etwa 228 Millionen Jahren und erreichten während des Oberjura ihren größten Artenreichtum. Vor 66 Millionen Jahren, am Ende der Kreidezeit, starben sie aus, zusammen mit allen anderen Nicht-Vogel-Dinosauriern. Ihre fossilen Überreste finden sich auf allen Kontinenten.[4] Unter den Dinosauriern sind sie die zweitartenreichste Gruppe; es werden über hundert Gattungen mit mehr als 150 validen Arten (Stand 2011) unterschieden.[4] Dennoch ist nur von fünf Gattungen ein vollständiges Skelett bekannt, da derart große Körper an Land äußerst selten im Ganzen im Sediment eingebettet wurden.
Sauropoden gehören zu den in der Populärkultur am häufigsten dargestellten Dinosauriern und treten in vielen Dokumentar- und Spielfilmen auf. Die Gattungen Brachiosaurus/Giraffatitan, Diplodocus und Brontosaurus gehören zu den populärsten Dinosauriern überhaupt.
Merkmale
Allgemeines

Sauropoden waren meist sehr große, teils gigantische, sich stets quadruped (vierfüßig) fortbewegende Pflanzenfresser. Der Körperbau war bei allen Vertretern ähnlich und ist durch einen meist extrem langen Hals und Schwanz, einen massigen, tonnenförmigen Körper mit säulenartigen Beinen sowie einen proportional sehr kleinen Kopf gekennzeichnet.[5] Ihre Größe reicht von sechs Metern Länge bei der in Deutschland entdeckten Inselform Europasaurus[6] bis zu über 30 Metern Länge und vermutlich über 70 Tonnen Gewicht bei Riesenformen wie Argentinosaurus,[7] deren tatsächliche Größe sich jedoch – aufgrund der meist nur fragmentarischen Funde – nur schätzen lässt.
Etwas ältere Abbildungen zeigen Sauropoden, wie sie ihre langen Hälse ähnlich einer Giraffe zum Abweiden von Bäumen fast senkrecht in die Höhe strecken und den Schwanz hinter sich herschleifen. Heute wird davon ausgegangen, dass die meisten Sauropoden den Hals waagerecht über den Boden hielten. Inwieweit der Hals seitlich und vertikal bewegbar war, hängt jedoch von den einzelnen Gattungen und ihrer Wirbelbeschaffenheit ab. Das fast völlige Fehlen von Schwanzabdrücken in fossilen Fährten lässt darauf schließen, dass der Schwanz stets über dem Boden gehalten wurde.[8]
Schädel
Funde von Schädelknochen, die zu den für die systematische Einordnung wichtigsten Skelettteilen gehören, sind bei Sauropoden äußerst selten. Chure et al. stellen 2010 fest, dass von weniger als einem Drittel der bekannten Gattungen Schädelmaterial gefunden worden ist und vollständige Schädel noch seltener sind.[9] Dies wird auf die sehr schwache Verbindung zwischen dem Atlas (dem ersten Halswirbel) und dem Schädel zurückgeführt, die dazu führt, dass sich letzterer nach dem Tod des Tieres leicht vom Hauptskelett abtrennen und so verlorengehen kann.[10]

Es gibt zwei Haupttypen von Sauropodenschädeln: Zum einen den flachen, langschnäuzigen Typ mit langen, stiftartigen Zähnen, wie er bei den Diplodociden vorkommt, und zum anderen den gewölbten, kurzschnäuzigen Typ mit dicken, spatelförmigen Zähnen, wie ihn die meisten anderen Sauropoden aufweisen.[5][10] Die ursprüngliche Form vermittelte vermutlich zwischen diesen beiden Typen, worauf überlieferte Schädelknochen in den basalen Arten Shunosaurus und Omeisaurus schließen lassen. Bei einigen fortgeschrittenen Titanosauriern haben sich viele Merkmale des Diplodociden-Typs konvergent entwickelt, sodass der Schädel ein Diplodociden-ähnliches Aussehen annimmt.[5]

Wie bei allen Sauropodomorphen weist der Schädel vergrößerte Schädelöffnungen für die Nasengänge (Naris) auf, die sich meist unmittelbar vor dem Orbitalfenster (Augenhöhle) befinden. Die Nasengänge sind zwar bei Diplodociden-Schädeln eher klein, bei anderen Arten wie Camarasaurus oder Brachiosaurus sind sie jedoch etwa ebenso groß wie die Orbitalfenster und bilden eine Wölbung auf der Oberseite des Schädels, die besonders bei Brachiosaurus und Europasaurus[6] deutlich zu sehen ist. Dem gegenüber ist das Antorbitalfenster, eine zusätzliche Schädelöffnung der Dinosaurier und anderer Archosaurier, bei Sauropoden recht klein. Die Schnauze ist breit und abgerundet. Das Prämaxillare, ein dem Oberkiefer vorgelagerter Knochen, ist robust und mit vier Zähnen bestückt, bei Diplodociden ist sie äußerst dünn und verlängert und reicht bis zu den Orbitalfenstern.[5]
Die Anzahl der Zähne nahm in der Evolution der Sauropoden ab. So hatte die basale Art Shunosaurus noch jeweils 21 Zähne im Ober- und Unterkiefer und glich damit den Prosauropoden, andere Sauropoden hatten weniger Zähne. Verglichen mit anderen Dinosauriern sind die Zahnreihen kurz. Bei Neosauropoden enden sie auf der Höhe des antorbitalen Fensters, bei Diplodociden ist sogar nur noch das vorderste Ende der Schnauze mit Zähnen bestückt. Bei vielen Sauropoden sind die Zähne nach vorne gerichtet, bei Brachiosaurus oder der Nemegtosauridae stehen sie jedoch etwa senkrecht. In den Kiefern befanden sich unter jedem Nutzzahn für gewöhnlich ein bis zwei Ersatzzähne auf Vorrat, bei Diplodociden sind es jedoch möglicherweise mehr als sieben.[5]
Wirbel
Sauropodenwirbel, insbesondere Hals und Rückenwirbel, weisen meist vielfältige Aushöhlungen und zusätzliche Streben auf, was eine für die Tiere vorteilhafte Verringerung des Gesamtgewichts zur Folge hatte. Dabei entstand eine enorme Formenvielfalt, weshalb die Wirbel für die Diagnose sehr wichtig sind. An ihnen lassen sich so besonders häufig Autapomorphien (für einzelne Taxa spezifische Merkmale) festmachen – sie wiegen den Nachteil des oft fehlenden Schädelmaterials teilweise auf.[10]

Ein wichtiges Merkmal zum Identifizieren verschiedener Gattungen ist die Anzahl der Dorsalwirbel (Rückenwirbel) und der Cervicalwirbel (Halswirbel). Die frühesten Sauropoden besaßen noch 10 Halswirbel, 15 Rückenwirbel, drei Sacralwirbel (Beckenwirbel), und 40–50 Caudalwirbel (Schwanzwirbel). Um die Entwicklung eines längeren Halses zu ermöglichen, kamen in der Evolution der Sauropoden bis zu sechs[10] neue Halswirbel hinzu. Darüber hinaus verlängerten sich die Halswirbel bei vielen Arten – in einigen Fällen auf mehr als einen Meter[10] – und Rückenwirbel wandelten sich in Halswirbel um. Gleichzeitig sank die Zahl der Rückenwirbel, während die Zahl der Sacralwirbel bei Neosauropoden durch die Integration von zwei Schwanz- und einem Rückenwirbel bis auf fünf anstieg, was die Beckenregion stabilisierte. Die Anzahl der Schwanzwirbel blieb etwa gleich, lediglich die Diplodociden hatten, bedingt durch die Entwicklung eines peitschenartigen Schwanzes, 70–80 Schwanzwirbel.[5]
Die mittleren und hinteren Rückenwirbel[5] zeigten, zusätzlich zu den gewöhnlichen mechanischen Verbindungen zwischen zwei Wirbeln (die Post- und Präzygapophysen), ein weiteres Verbindungselement, die Hyposphen-Hypantrum-Verbindung: Unterhalb der Postzygapophysen befindet sich ein nach hinten gerichteter Fortsatz (Hyposphen), welcher in eine Mulde (Hypantrum) des nachfolgenden Wirbels passt. Dieser Mechanismus stabilisierte die Wirbelsäule, schränkte aber gleichzeitig ihre Beweglichkeit ein. Dieses Merkmal wird als gemeinsam abgeleitetes Merkmal (Synapomorphie) der Saurischia betrachtet und hat sich somit bereits vor den Sauropoden entwickelt. Verschiedene Gruppen der Sauropoden haben dieses Merkmal unabhängig voneinander verloren, beispielsweise die Rebbachisauridae und die Titanosauria.[10][11]
Bei Shunosaurus und insbesondere bei den Diplodociden haben sich die Chevronknochen an der Unterseite des Schwanzes zu einer charakteristischen „Doppelbalken“-Form entwickelt; Fortsätze am unteren Ende des Knochens zeigen nach vorne und nach hinten.[10]
Schultergürtel und Gliedmaßen

Das große, verlängerte Schulterblatt (Scapula) ist am unteren Ende mit dem ovalen bis halbkreisförmigen, manchmal viereckigen Coracoid (Rabenbein) verbunden. Bei verschiedenen Gattungen, wie etwa Jobaria und Diplodocus, wurden zusätzliche kleine, schlanke Knochen gefunden; obwohl Nopcsa (1905) sie als Penisknochen deutete, werden diese heute als Schlüsselbeine angesehen.[5][10]
Die Vorderbeine sind – mit etwa 75 Prozent der Länge der Hinterbeine bei den meisten Arten – recht lang.[5] Der robuste[5] Oberarmknochen ist stets länger als der Unterarm.[10] Handgelenk-Knochen werden selten gefunden, so ist bisher aus der Gruppe der Titanosauria kein einziger bekannt. Die basale Form Shunosaurus besaß noch drei Knochen im Handgelenk, bei Brachiosaurus und Camarasaurus waren es zwei, während Apatosaurus nur noch einen Handgelenk-Knochen hatte.[5] Die fünf Finger standen nahezu senkrecht, wobei nur die Fingerspitzen den Boden berührten (digitigrad).[10] Die Anzahl der Fingerknochen nahm während der Evolution der Sauropoden ab; so hatten urtümlichere Arten wie Shunosaurus noch eine Fingerknochen-Formel von 2-2-2-2-1, viele spätere Arten hatten eine Formel von 2-1-1-1-1. Die Titanosauria zeigten lediglich extrem reduzierte Fingerglieder, während Handwurzelknochen und Krallen komplett zu fehlen scheinen. Der Daumen wies oft eine deutlich vergrößerte Klaue (Phalanx 1-2) auf.[5][12]
Das Femur (Oberschenkelknochen), oft der längste Knochen im Skelett, ist gerade und robust. Das Fußgelenk besteht aus dem Astragalus (Sprungbein), welcher auf den unteren Kopf der Tibia (Schienbein) passt, sowie dem wesentlich kleineren Calcaneus (Fersenbein), dessen obere Mulde auf dem unteren Ende der Fibula (Wadenbein) saß, jedoch in Opisthocoelicaudia anscheinend verloren gegangen ist.[13] Die fünf Zehen sind gespreizt. Die Mittelfußknochen waren fast horizontal ausgerichtet und berührten teilweise den Boden (semidigitigrade), Sauropoden waren also keine reinen Zehengänger wie alle anderen Saurischia. Die Fußunterseite wurde wahrscheinlich von einem fleischigen Polster gestützt. Die Hinterbeine weisen weit mehr Zehenknochen auf, als die Vorderbeine Fingerknochen aufweisen – die Phalanx-Formel ist meistens 2-3-4-2-1.[5][10][12]
Osteoderme und Hautabdrücke
- Hauptartikel → Osteoderme der Titanosauria

Osteoderme (Hautknochenplatten) wurden bisher bei zehn Gattungen aus der Gruppe der Titanosauria nachgewiesen.[14] Diese in der Lederhaut (Dermis) gelegenen und gebildeten Knochen fanden sich in Form von millimetergroßen, mosaikartig angeordneten Knöchelchen als auch in Form von Platten mit bis zu 59 Zentimetern Durchmesser, deren Oberfläche teilweise kammartige oder spitz zulaufende Fortsätze zeigt.[14] Asymmetrisch geformte Osteoderme bedeckten vermutlich die Flanken der Tiere, während zweiseitig symmetrisch geformte Osteoderme möglicherweise in einer Reihe auf der Mittellinie des Körpers über den Wirbelstacheln verliefen.[15] Da auch in Verbindung mit zusammenhängenden Skelettpartien jeweils höchstens einige wenige Osteoderme gefunden wurden, reichte die Anzahl der Osteoderme beim lebenden Tier wahrscheinlich nicht aus, um einen wirksamen Schutz vor Prädatoren zu ermöglichen.[14][16] Möglicherweise dienten die Osteoderme dieser Sauropoden stattdessen als Calcium-Reservoir.[17]
Seltene Funde von Hautabdrücken zeigen, dass die Hautoberfläche wie bei anderen Dinosauriern mit tuberkelartigen, sich nicht überlappenden Schuppen bedeckt war.[18] Wie Hautabdrücke von Tehuelchesaurus zeigen, waren die Schuppen in der Rückenregion größer als in der Bauchregion.[19] Zumindest einige Vertreter der Diplodocidae zeigten eine Reihe dreieckiger, keratinöser Stacheln, die entlang der Rückenlinie verliefen.[20][18]
Paläobiologie
Habitat
Obwohl sich Marsh und Cope die Sauropoden anfangs aufgrund der Beinstruktur terrestrisch vorstellten, glaubten sie später an eine amphibische Lebensweise in flachem Wasser. Diese Vorstellung hielt sich bis weit ins zwanzigste Jahrhundert. Diese Idee wurde unter anderem durch den langen Hals und den großen, auf der Oberseite des Kopfes angeordneten Nasenlöchern, denen eine schnorchelähnliche Funktion zugeschrieben wurde, und den mit Luft gefüllten (pneumatischen) Wirbeln gestützt, die, so meinten einige Forscher, für den Auftrieb gedient haben könnten. Im Gegensatz dazu wird seit den 1970ern von einer rein terrestrischen Lebensweise ausgegangen. Es wurde gezeigt, dass ihr Körperbau – die säulenartigen Beine, die kompakten Füße und der tonnenförmige Körper – deutliche Analogien zu modernen terrestrischen Großtieren wie Elefanten und Nashörnern aufweisen.[21]
Insgesamt scheinen Sauropoden flache, feuchte Gebiete zu bevorzugen – oft Delta- oder Küstenregionen – wie sich an einer Vielzahl von Lagerstätten mit Sauropodenfunden zeigt. Selbst die spätkreidezeitlichen mongolischen Arten Opisthocoelicaudia und Nemegtosaurus stammen nicht aus den berühmten Ablagerungen der Djadochta-Formation oder der Barun-Goyot-Formation, zu deren Ablagerungszeit trockenes Klima herrschte, sondern aus der darüberliegenden, aus Flussablagerungen bestehenden Nemegt-Formation.[21] Andere Forscher meinen jedoch, Sauropoden würden bevorzugt in halbtrockenen, vielleicht savannenähnlichen Gebieten mit saisonalen Regenfällen leben, wie es anscheinend in der Morrison-Formation der Fall war.[22]
Ernährung und Funktion des Halses
Alle Sauropoden waren Herbivoren – frühere Theorien, die als Nahrung Mollusken oder gar Fische vorschlugen, gelten heute als widerlegt und waren stark an die Idee einer amphibischen oder aquatischen Lebensweise gekoppelt. Es gibt bis heute jedoch keinen eindeutigen, direkten Nachweis, welche Pflanzen den Sauropoden als Nahrung gedient haben. Zwar wurde 1964 ein fossiler Mageninhalt beschrieben, dieser wurde jedoch in Frage gestellt, da das Pflanzenmaterial vielleicht erst nach dem Tod des Tieres in das Skelett gelangt sein könnte. Auch Koprolithen (versteinerter Kot), die in der nordamerikanischen Morrison-Formation gefunden wurden, können nicht sicher den Sauropoden zugeordnet werden.[23] Eventuell spielten Koniferen, Baumfarne, Ginkgos, Farne, Schachtelhalme und während der späten Kreide überdies Bedecktsamer als Nahrungsquelle eine Rolle.[21] Gras tauchte erst in der späten Kreide auf, ist jedoch jüngst in Koprolithen aus Indien nachgewiesen worden, die wahrscheinlich zu spätkreidezeitlichen Titanosauriern gehörten. Nach Ansicht der Forscher machte Gras jedoch keinen großen Teil der Nahrung dieser Sauropoden aus.[24]

Die Fressmechanismen variieren zwischen verschiedenen Sauropodengruppen deutlich. Bereits früh in der Evolution der Sauropoden scheint sich ein präziser Schneidemechanismus entwickelt zu haben, worauf Facetten an den Zähnen hindeuten, die durch das Ineinanderfassen der Zähne entstanden. Somit konnte mit einem kräftigen Biss Vegetation abgeschnitten und verschlungen werden, wobei jedoch ausgiebiges Kauen wegen fehlender Backen kaum möglich gewesen sein wird – die kräftige Zunge könnte jedoch teilweise Nahrung im Mund zur weiteren Zerkleinerung verschoben haben.[21]
Der Schneidemechanismus, der eine Verbesserung gegenüber den relativ einfachen[25] Anpassungen der Prosauropoden darstellt, findet sich besonders in basalen Eusauropoden wie Shunosaurus, aber auch in der späteren Gattung Camarasaurus.[26] Bei Brachiosaurus und den Titanosauria fassten die Zähne wahrscheinlich nicht ineinander, sondern standen sich bei geschlossenem Gebiss direkt gegenüber. Diplodociden wiederum besaßen wahrscheinlich einen gänzlich anderen Fressmechanismus, worauf Abnutzungsspuren schließen lassen, die vermutlich beim Kontakt des Zahns mit der Nahrung entstanden. Eventuell konnten Diplodociden Äste abstreifen, um das Laub zu lösen; diese Theorie wird auch von anderen Aspekten der Schädelmorphologie, wie der langen Schnauze oder der kammartig angeordneten stiftartigen Zähne, gestützt.[21]
Die Frage, welche Funktionen der lange Hals bei der Nahrungsaufnahme hatte, wurde und wird seit der Entdeckung derartiger Fossilien heftig diskutiert. Die traditionelle Vorstellung von Sauropoden, wie sie giraffenartig mit nach oben gestreckten Hälsen Baumkronen abweideten, wurde seit 1999 durch computergestützte Studien, insbesondere von Perrisch und Stevens, in Frage gestellt. Da sich der Kopf den Ergebnissen zufolge bei vielen Arten in seiner neutralen Position nur knapp über dem Boden befinden würde, vermuten die Forscher, der Hals könnte dazu gedient haben, ein großes Areal „wie ein Staubsauger“ abzuweiden, ohne den Hauptkörper bewegen zu müssen. Diese Forscher sind der Ansicht, dass selbst Brachiosaurus, der mit verlängerten Vorderbeinen dem Bau einer Giraffe näher kam als andere Sauropoden, seinen Hals für gewöhnlich lediglich waagerecht bis leicht nach unten gerichtet hielt.[23]
Aufgrund ihrer Ergebnisse spekulierten Perrisch und Stevens, dass sich Diplodociden, Dicraeosauriden und auch Euhelopus von bodennaher Vegetation ernährten. Camarasaurus wiederum scheint einen sehr flexiblen Hals gehabt zu haben, und der Kopf von Brachiosaurus befand sich aufgrund der langen Vorderbeine höher über dem Boden als bei anderen Sauropoden. Für diese Sauropoden vermuten die Forscher, dass sie sich sowohl von hochgelegener als auch von bodennaher Vegetation ernährt haben könnten. Einige Forscher gehen darüber hinaus davon aus, dass Camarasaurus[26] und Brachiosaurus aufgrund ihrer breiten, spatelförmigen Zähne und anderer Schädelmerkmale zäheres Pflanzenmaterial wie Baumfarne oder auch Koniferen gefressen haben könnten, während Arten mit stiftartigen Zähnen wie Diplodociden und einige Titanosaurier wie Nemegtosaurus relativ weiche Pflanzen zu sich genommen haben könnten.[23]
Dieses Fressen bodennaher, weicher Vegetation fand sein Extrem bei dem Rebbachisauriden Nigersaurus, der mit einem sehr leichten Schädel und einem stark verbreiterten Maul wahrscheinlich eine sehr bescheidene Kiefermuskulatur besaß, die lediglich weiche Nahrung zuließ. Nachweise aus dem inneren Ohr dieser Gattung haben ergeben, dass der sich meist unmittelbar über dem Boden befindende Kopf in der neutralen Haltung um −67° nach unten gerichtet war. Bei Diplodocus, der nach Ansicht vieler Forscher bodennahe Vegetation aufnahm, fand sich eine neutrale Kopfhaltung von −37°, während Camarasaurus eine von −15° aufwies.[27][23]
Eine andere, durch Computertomografie gestützte Studie von Berman und Rothschild, stellte zwei verschiedene Typen von Halswirbeln fest: Einen robusten Typ bei Camarasaurus und einem unbestimmten Titanosaurier, und einen grazilen Typ bei Diplodocus, Apatosaurus, Haplocanthosaurus, Barosaurus und Brachiosaurus. Die Forscher folgern aus ihren Ergebnissen, der robuste Wirbeltyp könnte auf eine nahezu senkrechte Haltung des Halses hinweisen, während Tiere mit dem grazilen Typ den Hals etwa horizontal hielten.[28]
In der Vergangenheit wurden weitere Hypothesen aufgestellt, wie sich Sauropoden ernährt haben könnten. Stevens und Perrisch merkten zum Beispiel an, dass Diplodociden sich ebenfalls von Wasserpflanzen ernährt haben könnten. Durch den Bau des Schädels und aufgrund der Tatsache, dass dieser in neutraler Position deutlich nach unten geneigt war, könnten die Tiere während des Weidens direkt über oder im Wasser den visuellen und olfaktorischen Kontakt mit der Umwelt aufrechterhalten haben.[23][29]
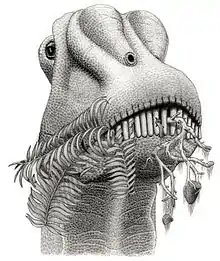
Die Nüstern der Sauropoden werden häufig, entsprechend der Position der Nasenöffnungen, im hinteren Bereich des Schädels oberhalb der Augen platziert dargestellt. Einige Forscher spekulierten aufgrund der Retraktion der Nasenlöcher auf einen Rüssel, der bei der Nahrungsaufnahme eine bedeutende Rolle gespielt hätte – andere Autoren verwerfen jedoch diese Idee. So bemerkt Coombs (1975), es sei unwahrscheinlich, dass Sauropoden die notwendige Gesichtsmuskulatur besaßen. Wie Witmer (2001) andeutet, könnten die Nüstern tatsächlich wesentlich tiefer in Richtung der Schnauze gelegen haben.[21]
Über die Menge der Nahrung, die von einem Sauropoden aufgenommen werden musste, sowie über innere Verdauungsorgane existieren lediglich Spekulationen, da entsprechende Fossilien fehlen. Allgemein wird aufgrund der Größe des Hauptkörpers ein langer Darm angenommen, welcher Fermentation durch Mikroorganismen erlauben würde. Viele heutige Vögel schlucken zur Zerkleinerung der Nahrung im Muskelmagen Steine, die als Gastrolithen (Magensteine) bezeichnet werden. Da seltsam glatt polierte Steine gelegentlich bei Sauropodenskeletten gefunden werden, wird davon ausgegangen, dass bei Sauropoden ebenfalls Gastrolithen vorkamen. Jedoch sind direkte Nachweise sehr selten, so könnten in Wirklichkeit nur einige wenige Arten Gastrolithen besessen haben.[21] Neuere Forschungen von Oliver Wings und Martin Sander, die entsprechende Studien an rezenten Straußen durchführten, stellen das Vorhandensein einer durch Gastrolithen funktionierenden Magenmühle in sauropoden Dinosauriern gänzlich in Frage. Gastrolithen wurden nur selten bei Sauropodenfossilien gefunden; außerdem seien sie bei Vögeln rau und unpoliert, und die Gesamtmasse der geschluckten Steine sei im Verhältnis zur Körpermasse bei Sauropoden zu gering, so die Forscher.[30][31]
Größe
Das auffälligste Merkmal nahezu aller Sauropoden war ihre enorme Größe,[21][32] die sich bereits bei den frühesten Sauropoden in der späten Trias zeigte.[22] Die größten Sauropoden, von denen fast vollständiges Skelettmaterial bekannt ist, sind Diplodocus mit einer gesicherten Länge von 27 Meter und der kürzere, aber massigere Brachiosaurus mit 22 Meter Länge.[33] Hinweise auf noch größere Arten finden sich in verschiedenen Abstammungslinien;[32] die tatsächliche Größe lässt sich jedoch aufgrund der meist fragmentarischen Überreste nur schätzen. Die Ermittlung des Gewichts ist besonders schwierig[22] und führte zu vielen Diskussionen – so wurde Brachiosaurus in einer Studie von Colbert (1962) auf 80 Tonnen geschätzt, wobei eine Studie von Béland und Russel (1980) auf lediglich 15 Tonnen kam.[8] Heute wird für Brachiosaurus ein Gewicht von 30 Tonnen angegeben.[33]

Zu den besonders großen Sauropoden zählt unter anderen der zu den Diplodociden gehörende Supersaurus, der schätzungsweise 33–34 Meter lang und 35–40 Tonnen schwer wurde.[34] Seismosaurus, der in den Populärmedien oft als „der längste Dinosaurier“ mit einer Länge von über 50 Metern gehandelt wird, gilt heute als juveniles Synonym mit Diplodocus und erreichte nach neueren Forschungsergebnissen wohl etwa 30 Meter Länge.[35][22] Wesentlich massiger war der argentinische Titanosaurier Argentinosaurus, welcher auf eine Länge von 30 Metern[22] und ein Gewicht von 73 Tonnen[7] geschätzt wurde. Der Brachiosauride Sauroposeidon soll schätzungsweise 32 Meter lang geworden sein, ist jedoch nur durch wenige Halswirbel bekannt.[33] Mysteriös ist Amphicoelias fragillimus, der im Jahr 1878 von Cope anhand eines riesigen, unvollständigen Rückenwirbels beschrieben wurde. Kurz nach seiner Beschreibung scheint der Wirbel jedoch verloren gegangen zu sein; die Beschreibung lässt allerdings auf einen Diplodociden schließen, der – hätte er den gleichen Körperbau wie Diplodocus gehabt – 58 Meter lang und über 9 Meter hoch gewesen wäre.[22]
Die Frage, warum Sauropoden so groß wurden, kann noch nicht zweifelsfrei beantwortet werden.[36] Vorteile einer derartigen Größe könnte die Erschließung weiterer Nahrungsquellen sein, die für kleinere Herbivoren nicht erreichbar wären, sowie der Schutz vor Räubern. Einige Forscher vermuten, dass durch ein größeres Körpervolumen die Effizienz der Verdauung steigt, besonders bei nährstoffarmen Pflanzen. So hat ein größerer Körper naturgemäß einen längeren Verdauungstrakt, wodurch die Nahrung länger im Körper verweilt. Dies erlaubt heutigen Großtieren wie Elefanten, Nashörnern oder Flusspferden das Überleben mit energiearmen Nahrungsquellen, besonders in Verbindung mit Fermentation im Dickdarm oder in speziellen Kammern. Sauropoden könnten auf diese Weise Dürreperioden überdauert haben.[22][21]
Atmung
Viele Forscher gehen davon aus, dass Sauropoden ein Luftsacksystem ähnlich dem der heutigen Vögel besaßen, wie vermutlich auch die Theropoden und die Pterosaurier. Hinweise darauf liefern die Wirbel mit ihren komplexen Gruben (Fossae), Öffnungen (Foramia) und Kammern, die vielleicht ähnlich wie bei den Vögeln mit Divertikeln (Ausstülpungen) der Luftsäcke ausgefüllt waren. Während bei basalen Sauropoden lediglich die präsacralen Wirbel pneumatisiert (mit Luft gefüllt) waren, hat sich dieses Merkmal bei vielen Neosauropoden bei den Sacralwirbeln ausgebildet. Unabhängig voneinander haben sich bei den Diplodociden und den Titanosauria pneumatisierte vordere Schwanzwirbel entwickelt. Funde von Wirbeln juveniler Tiere zeigen lediglich sehr einfache Kammern, weshalb davon ausgegangen wird, dass Individuen in einem noch frühen Entwicklungsstadium keine pneumatisierten Wirbel besaßen.[37][21]
Die Frage, wie der durch den langen Hals bedingte große Totraum überwunden werden konnte, wirft Probleme auf, wenn von dem eidechsenartigen Atmungssystem ausgegangen wird, welches sich auch bei Säugetieren findet. Gale (1998) vermutete, Sauropoden müssten, um die nötigen riesigen Luftmengen in den Körper und wieder hinaus zu transportieren, 50–100 % ihrer metabolischen Energie aufwenden. Mit einem Luftsacksystem könnte dieser Totraum kompensiert werden, wie es auch bei Vögeln der Fall ist, da sowohl beim Einatmen als auch beim Ausatmen sauerstoffhaltige Luft durch die Lunge strömen kann.[37][21]
Forscher um Daniela Schwarz rekonstruierten weiches Gewebe wie Luftsäcke, Bänder und Muskeln an den Halswirbeln von Diplodociden und Dicraeosauriden anhand von Vergleichen mit Krokodilen und Vögeln. Die Anordnung der Divertikel zeigte, dass die Luftsäcke im Zusammenspiel mit Bändern und Muskeln eine Stütz- und Stabilisierungsfunktion für den Hals gehabt haben könnten. Dies würde dicke Halsmuskeln zur Stabilisierung überflüssig machen, was eine weitere Gewichtsreduktion des Halses zur Folge gehabt hätte.[38]
Thermoregulation
Die Frage, ob Sauropoden poikilotherm (wechselwarm), tachymetabolisch (mit erhöhten Grundumsatz) oder gar homoiotherm (gleichwarm) waren, ist Gegenstand vieler Diskussionen der Thermoregulation. Eine häufige Annahme ist, dass die schiere Masse einen zusätzlich erhöhten Metabolismus zur Erhaltung der Körpertemperatur überflüssig bis kontraproduktiv macht. So könnte schon die vermutete Fermentation der Nahrung durch Mikroorganismen eine bedeutende Wärmequelle dargestellt haben. Zusätzlicher Metabolismus könnte das Tier leicht überhitzt haben, da ein großer Körper Wärme viel besser halten kann, da die Hautoberfläche verglichen mit der Körpermasse viel kleiner ist als bei einem kleineren Tier.[37][21]
Wedel (2003), der von einem Luftsacksystem zur Atmung ausgeht, merkt jedoch an, dass wie bei den Vögeln Evaporation (Verdunstung) in den Luftsäcken stattgefunden haben könnte, was einen sehr effektiven Kühlmechanismus darstelle. So könne der Körperkern auf diese Art direkt gekühlt worden sein. Weiter führt er an, dass Sauropoden eine sehr schnelle Wachstumsrate haben, die vergleichbar mit der von Säugetieren sei; während beispielsweise Krokodile eine viel langsamere Wachstumsrate haben. Deshalb hält der Forscher einen erhöhten Metabolismus (Tachymetabolismus) oder gar Homoiothermie bei Sauropoden für wahrscheinlich.[37]
Fortbewegung und fossile Fußspuren


Alle Sauropoden bewegten sich wahrscheinlich ausschließlich quadruped (vierfüßig) fort, trugen ihre Hauptlast jedoch auf den Hinterbeinen. Die Gliedmaßen wurden durch eine relativ schwache Muskulatur bewegt; der Gang ähnelte möglicherweise dem von Elefanten. Rothschild und Molnar (2005) fanden Ermüdungsfrakturen in fünf Prozent der von ihnen untersuchten Fußknochen und schließen daraus, dass der Antrieb hauptsächlich von den Hinterbeinen ausging.[39] Die Höchstgeschwindigkeit lag einer Schätzung von Alexander (1991) zufolge bei 25 km/h; fossile Fährtenfolgen weisen jedoch auf eine gewöhnliche Geschwindigkeit von nur 2–4 km/h hin.[21]
Fährten und Fährtenfolgen von Sauropoden finden sich weltweit. Da sie immer nur einen kurzen Ausschnitt aus dem Leben des Tieres darstellen, können sie Informationen beherbergen, die durch Knochenfunde alleine nicht gewonnen werden können. Da die digitigraden (mit den Zehenspitzen den Boden berührenden) Finger hufartig angeordnet sind, erscheinen Abdrücke der Vorderfüße oft halbmondförmig – sie liegen in der Fährtenfolge direkt vor den wesentlich größeren Hinterfuß-Eindrücken.[5]
Es können generell zwei Typen von Sauropoden-Fährtenfolgen anhand ihrer Breite unterschieden werden, die auf unterschiedliche Fortbewegungsweisen schließen lassen. Der „breitspurige“ Typ (Brontopodus) weist einen deutlichen Abstand zwischen linken und rechten Eindrücken auf und stammt häufig aus der Kreidezeit, bei den Verursachern handelt es sich wahrscheinlich um Titanosaurier. Der „schmalspurige“ Typ (Parabrontopodus) ist in jurassischen Schichten häufig und stammt von Nicht-Titanosauriern wie den Diplodociden – die Eindrücke grenzen an die Mittellinie der Fährtenfolge, liegen also eng beieinander. Die Ursache für diesen Unterschied in den Fährtenfolgen liegt an einer anderen Ausrichtung der Beine; so waren beispielsweise die Oberschenkelknochen der Titanosaurier etwas nach außen gerichtet, während sie bei anderen Sauropoden senkrecht unter dem Körper standen. Beweglichere Knie- und Ellbogengelenke deuten darauf hin, dass die Unterschenkel der Titanosaurier aktiver zur Fortbewegung beigetragen haben als bei anderen Sauropoden.[40][21]
Einige Sauropoden-Fährtenfolgen zeigen lediglich Abdrücke der Vorderbeine. Die erste derartige Entdeckung in Texas wurde von Bird (1944) als Hinweis auf einen schwimmenden Sauropoden interpretiert, der den Boden nur mit den Vorderbeinen berührte. Heute wird die Ansicht vertreten, dass die Vorderbeine für gewöhnlich tiefer in den Boden sanken als die Hinterbeine und deswegen als sogenannte Unterspuren sichtbar bleiben, selbst wenn darüberliegende Sedimentschichten mitsamt den Hinterfuß-Eindrücken verlorengehen.[41][42]
Fortpflanzung und Entwicklung
Fossile Eier, die eindeutig Sauropoden zugeschrieben werden können, sind sehr selten und konnten erst Anfang des 21. Jahrhunderts nachgewiesen werden. Zwar wurden zum Beispiel Eierfunde aus Frankreich bereits 1930 dem Titanosaurier Hypselosaurus priscus zugeschrieben,[43] ein sauropoder Ursprung lässt sich jedoch nicht beweisen, da keine Überreste von Embryonen oder Jungtieren bei den Eiern gefunden wurden. Bakker (1980) vermutete, Sauropoden könnten lebendgebärend gewesen sein und relativ große Jungtiere zur Welt gebracht haben, worauf er nicht zuletzt auf Grund des großen Beckenkanals schloss.[44]
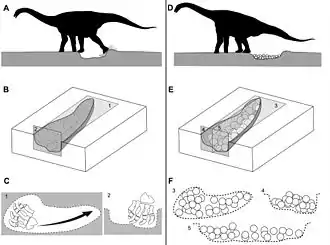
In Auca Mahuevo in Argentinien wurden tausende Gelege mit Eiern gefunden, die sich Titanosauriern zuordnen lassen. Einige der Eier beinhalten Knochen von Embryonen, darunter sogar vollständige Schädel. Die Eier sind nahezu rund, messen 13–15 cm im Durchmesser und haben ein Volumen von etwa 800 cm³.[21] Die Nester hatten einen Durchmesser zwischen 100 und 140 Zentimetern, waren 10 bis 18 Zentimeter tief und beherbergten mutmaßlich 20–40 Eier. Diese Funde gestatten Einsichten in das Brutverhalten der Sauropoden: So schachteten die Tiere die Nester zwar aus, begruben die Eier jedoch nicht mit Erde. Die Anzahl der Eier zeigt, dass die Sauropoden beim Legen der Eier in Herden lebten; verschiedene Ebenen mit Nestern lassen darauf schließen, dass sie diesen Ort mehrere Male zu unterschiedlichen Zeiten zum Brüten benutzt haben. Poren in den Eierschalen deuten auf eine hohe Feuchtigkeit im Nest hin, und aus runden Ornamenten, die eventuell zum Freihalten der Poren gedient haben, deuten einige Forscher, dass Sauropoden ihre Eier mit Pflanzenmaterial überdeckt haben.[46] Die Forscher schließen jedoch eine Brutpflege nach der Eiablage aus, da weder zertrampelte Eier, noch zertrampelter Boden („Dinoturbation“) entdeckt wurden. Gegen eine Brutpflege spricht außerdem der Größenunterschied zwischen gerade geschlüpften Jungtieren und erwachsenen Tieren – so könnten Jungtiere nur einen Meter lang und weniger als zehn Kilogramm schwer gewesen sein, während erwachsene Tiere zum Teil die Größe von Walen erreichten.[47][48]
Funde von Jungtieren sind generell selten, weshalb es nur wenige Studien über die Entwicklung (Ontogenese) eines Sauropoden gibt. Durch Vergleiche der Embryonenschädel aus Auca Mahuevo mit gut erhaltenen Titanosaurierschädeln (Nemegtosaurus und Rapetosaurus) fand man Hinweise auf starke Umformungen des Schädels während des Wachstums: So wurden Knochen umgelagert, während sich die Schnauze deutlich verlängerte.[48] Früher ging man von einem langsamen, stetigen Wachstum aus. Berechnungen von Case (1978), die auf die Wachstumsraten heutiger Reptilien basieren, kamen bei Hypselosaurus auf eine Geschlechtsreife mit 62 Jahren und eine volle Größe mit 82–118 Jahren.[21] Jüngere, knochenhistologische Analysen untersuchen das Wachstum anhand des Aufbaus des Knochengewebes, und schließen auf ein deutlich schnelleres Wachstum ähnlich dem der heutigen Säugetiere. Das Gewebe fossiler Knochen lässt sich anhand von Hohlräumen und der Anordnung von Mineralien in den Knochen rekonstruieren, inklusive der Blutgefäße und Kollagenfasern. Durch Vergleiche mit heutigen Wirbeltieren kann man unter anderem auf die Wachstumsgeschwindigkeit in verschiedenen Phasen der Entwicklung schließen: So hat Sander (2000) für Janenschia die Geschlechtsreife mit 11 Jahren, die maximale Größe mit 26 Jahren und den Tod mit 38 Jahren angegeben. Weiter zeigt der Forscher, dass Sauropoden ihre Geschlechtsreife bereits lange vor ihrer maximalen Größe erreichten – so war Brachiosaurus bereits mit 40 % seiner vollen Größe geschlechtsreif; bei Barosaurus waren es 70 %.[49][47]
Verhalten
Anders als andere Sauropoden hatten Diplodociden ein langes und sehr bewegliches peitschenartiges Schwanzende. Eine verbreitete Hypothese besagt, Diplodociden hätten ihren Schwanz zur Verteidigung in Richtung der Angreifer geschwungen, um diese zu vertreiben oder gar zu verletzen. Diese Idee ist jedoch in Verruf geraten, da die hinteren Schwanzwirbel weder stabil genug erscheinen, noch irgendwelche Schäden aufweisen. Außerdem waren seitliche Bewegungen des vorderen und mittleren Teils des Schwanzes nur eingeschränkt möglich. Viele Forscher vermuten heute, dass Diplodociden durch das Schwingen des Schwanzes ihr Schwanzende auf Überschallgeschwindigkeit beschleunigen und so laute Knalle erzeugen konnten, ähnlich einer Peitsche. Dies könnte vielleicht Angreifer vertrieben haben; ebenfalls ist eine soziale Funktion denkbar. Shunosaurus besaß am Schwanzende eine aus verschmolzenen Wirbeln bestehende Keule, die vielleicht tatsächlich zur Verteidigung eingesetzt wurde.[21]

Eine andere Hypothese nimmt an, einige Sauropoden seien fähig gewesen, sich zur Verteidigung gegen Fressfeinde oder zum Fressen höhergelegener Vegetation auf den Hinterbeinen aufzurichten, wobei der Schwanz als zusätzliche Stütze gedient haben könnte. Berühmt ist ein Barosaurus-Skelett im American Museum of Natural History, das in einer solchen Position aufgestellt ist. Jedenfalls bezweifeln viele Forscher diese Idee; so merkten Stevens und Perrisch (1999) an, dass es bei einer solchen Haltung zu Problemen bei der Blutversorgung des Kopfes gekommen sein müsste, da der Hals auf eine waagerechte Haltung ausgerichtet sei.[29] Rothschild und Molnar (2006) gestanden zwar zu, dass die Gelenke den nötigen Bewegungsspielraum boten. Jedoch fanden die Forscher keine Frakturen in den Handknochen oder den Rücken- und Lendenwirbeln, die während des Aufrichtens oder beim Herunterlassen gelegentlich entstanden sein müssten.[39]
Darüber hinaus gab es Diskussionen um die Funktion der vergrößerten Klaue an der Hand. Einige Forscher vermuten, die Klaue könnte während des Aufrichtens auf den Hinterbeinen als Waffe zur Verteidigung, zur Nahrungssuche oder zum Abstützen an Bäumen gedient haben. Dies erscheint jedoch fraglich, da die Klaue stumpf ist und die Vorderbeine wenig beweglich sind. Die andere Vermutung geht dahin, dass die Klaue zum Graben von Wasserlöchern oder zum Ausgraben von Nestern benutzt worden sein könnte.[21]
Fossile, parallel verlaufenden Fährtenfolgen lassen erkennen, dass einige Sauropoden zumindest zeitweilig in Herden lebten. Dafür sprechen auch die Massengräber, in denen Sauropoden besonders häufig gefunden werden. Die Ardely-Fundstelle in England, in der über 40 Fährtenfolgen ausgegraben wurden, zeigt darüber hinaus eine gemischte Herde aus Titanosaurierspuren und Spuren anderer Sauropoden.[50] Eine andere Spurenfundstelle aus Texas, die Davenport-Ranch-Fundstelle, wurde dahingehend interpretiert, dass große, ausgewachsene Tiere am Rand der Herde liefen, um kleinere Tiere in der Mitte der Herde zu beschützen.[42] Spätere Studien (Lockley, 1991) haben diese Theorie jedoch widerlegt; es gibt bis heute keine Hinweise auf strategische Strukturen in Sauropodenherden. Auch fehlen Hinweise auf sehr große Herden mit hunderten oder tausenden Tieren, wie sie bei den Ceratopsia und Hadrosauriden vermutet werden.[51][21]
Evolution und Biodiversität
Frühe Sauropoden
Über die Frühgeschichte der Sauropoden ist wenig bekannt.[52] Die ersten Skelettfunde von Dinosauriern stammen aus der südamerikanischen Ischigualasto-Formation und sind 228 Millionen Jahre alt, während die frühesten bekannten Sauropodomorphen aus dem Karnium stammen und fünf Millionen Jahre jünger sind. Jedoch lassen 238 Millionen Jahre alte Fußspuren darauf schließen, dass sich Sauropodomorphen und Theropoden bereits wesentlich früher voneinander trennten. Einige Funde, die Sauropoden zugeordnet wurden, stammen ebenfalls aus dem Karnium – ihre Zuordnung muss jedoch noch bestätigt werden. Die ersten Funde, die mit Sicherheit Sauropoden zugeordnet werden können, stammen aus der späten Trias; es handelt sich hierbei um die Fußspur Tetrasauropus (Norium–Rhaetium) und den geologisch gesehen vielleicht etwas jüngeren Isanosaurus aus Thailand.[53][12]
Heute wird davon ausgegangen, dass sich die Sauropoden spätestens im Karnium von ihrer Schwestergruppe, den Prosauropoden, getrennt haben.[12] Ihre Vorfahren waren wohl basale Sauropodomorphen; einige Forscher vertreten die Ansicht, dass frühe Prosauropoden die direkten Vorfahren der Sauropoden gewesen sind.[54] Die meisten Forscher gehen jedoch bei den Prosauropoden von einer monophyletischen Gruppe aus.[55]
Die Gattungen Blikanasaurus und Antetonitrus aus dem Norium (Obertrias) weisen sowohl Merkmale der Sauropoden als auch der Prosauropoden auf und haben sich wahrscheinlich bereits vierbeinig fortbewegt – ob es wirklich Sauropoden sind, ist jedoch umstritten. Auch bei anderen basalen Sauropoden, zum Beispiel bei Gongxianosaurus, fanden sich Anpassungen an eine quadrupede (vierfüßige) Lebensweise: Die Vorderbeine wurden länger, das Femur (Oberschenkelknochen) wurde gerade und länger als die Tibia (Schienbein), während die Fußknochen kürzer wurden.[53][56]
Gutes Schädelmaterial von frühen Sauropoden ist selten und findet sich lediglich bei Tazoudasaurus aus dem frühen Jura und dem basalen Eusauropoden Shunosaurus aus dem mittleren Jura. Eusauropoden wie Shunosaurus, die alle Sauropoden außer einigen basalen Arten mit einschließen, hatten bereits charakteristische Merkmale wie eine gerundete Schnauze, eine reduzierte Anzahl von sich überlappenden, breitkronigen Zähnen sowie einen präzisen Schneidemechanismus (s. o.). Der Nicht-Eusauropode Tazoudasaurus hingegen hatte noch viele Merkmale, die an Prosauropoden erinnern: So überlappten sich die Zähne nicht, setzten sich jedoch über die gesamte Länge des Unterkiefers fort, während die Schnauze nach vorne hin spitz zulief.[52]
Sauropoden im Jura

Während die Biodiversität (Artenvielfalt) der Sauropoden in der späten Trias noch recht niedrig war, stieg sie im frühen und mittleren Jura deutlich an. Im mittleren Jura waren die Sauropoden fast über die gesamte Welt verbreitet. Im Oxfordium (früher Oberjura) kam es unter Sauropoden zu einem kleinen Artensterben – wobei die Biodiversität jedoch im nachfolgenden Kimmeridgium und Tithonium (später Jura) wieder deutlich anstieg und mit mindestens 27 bekannten Gattungen ihren Zenit erreichte.[57] Im späten Jura stellten die Neosauropoda, eine Untergruppe der Eusauropoda, einen Großteil der Sauropodengattungen. Die Neosauropoda spalteten sich in zwei große Gruppen auf: die Diplodocoidea mit den Familien Diplodocidae, Dicraeosauridae und Rebbachisauridae, sowie die Macronaria, welche Camarasaurus, Brachiosaurus und die Titanosauria mit einschließt.[12]
Bei den Diplodocoiden setzte sich die Verbreiterung der Schnauze fort, während sich die Zahnreihen weiter verkürzten und sich zum Großteil in die Schnauzenspitze verschoben. Bei den Rebbachisauriden entwickelte sich dieses Merkmal zum Extrem, wie Nigersaurus aus der frühen Kreide zeigt: Der Kiefer war von oben betrachtet kastenförmig, während die Zähne in einer geraden Reihe die Schnauzenfront bildeten.[58] Entgegengesetzt zu der Entwicklung von breitkronigen Zähnen bei basalen Eusauropoden verkleinerten sich die Zahnkronen bei Diplodocoiden, wobei lediglich stiftartige Zähne übrig blieben. Dies begünstigte zudem die Bildung von weiteren Ersatzzähnen. Bei den Macronaria hingegen entwickelten sich ein breiterer Gang (s. o.) sowie vergrößerte Nasenöffnungen (Naris), welche die Größe der Orbitalfenster (Augenhöhlen) im Durchmesser übertrafen.[56][12]
Sauropoden in der Kreide
An der Jura-Kreide-Grenze gab es ein Massensterben unter Sauropoden, bei dem die Biodiversität vom Oberjura (Kimmeridgium) zur Unterkreide (Berriasium) innerhalb von 5,5 Millionen Jahren um 65 bis 93 Prozent sank. Die Diplodocidae und sämtliche Nicht-Neosauropoden starben aus, die meisten Gruppen überlebten jedoch bis in die frühe Kreide[57] – die Rebbachisauriden, die letzten bekannten Diplodocoiden, sind selbst noch aus dem Coniacium (frühe Oberkreide) bekannt.[59] Die dominierende Sauropodengruppe der Kreide waren die Titanosauria, eine Untergruppe der Macronaria und die einzige Sauropodengruppe, die bis zum Ende des Mesozoikums überlebte. Während die Großkontinente Gondwana und Laurasia in der Kreide vollständig zu den heutigen Kontinenten zerbrachen, waren die Titanosauria mit Ausnahme der Antarktika weltweit verbreitet und brachten es zu einer großen Vielfalt: Bis heute konnten über 30 Gattungen beschrieben werden, das macht mehr als ein Drittel der bekannten Sauropoden aus.[60][61]
Spätere Titanosauria zeigten einige konvergente Entwicklungen, die sich früher bereits bei den Diplodocoiden entwickelten: Die Zähne wurden stiftartig und beschränkten sich auf den vorderen Teil der Schnauze, der Schädel nahm ein pferdeartiges Aussehen an. Wie die Rebbachisauriden verloren die Titanosauria die zusätzlichen Verbindungen an den Wirbeln (zwischen Hyposphen und Hypantrum), welche andere Sauropoden auszeichnete; dadurch gewann die Wirbelsäule an Flexibilität.[59] Saltasauriden, eine Familie später Titanosaurier, besaßen einen im Vergleich zu früheren Sauropoden deutlich kürzeren Schwanz mit nur etwa 35 Wirbeln; außerdem waren die Fingerknochen deutlich reduziert.[60]
Obwohl die Biodiversität der Sauropoden während der Kreide offenbar leicht sank, erreichte sie am Ende der Oberkreide (Campanium bis Maastrichtium) nochmals einen Höhepunkt, der mit der Diversität während des mittleren Jura vergleichbar ist.[57] Während des Massenaussterbens vor 66 Millionen Jahren an der Grenze zwischen Kreide und Paläogen (→ Kreide-Paläogen-Grenze) verschwanden alle Sauropoden.
Systematik
Im späten 19. Jahrhundert, nachdem Marsh (1878) den Begriff Sauropoda geprägt hatte, bestand die Systematik der Sauropoden lediglich aus einigen Familien, die gleichberechtigt ohne höher gestellte Taxa existierten (unter anderem Atlantosauridae, Pleurocoelidae, Diplodocidae und Titanosauridae). Da diese Systematik keine Rückschlüsse auf Verwandtschaftsbeziehungen und Evolution innerhalb der Sauropoden zuließ, wurde bald nach neuen Möglichkeiten gesucht: So teilte Janensch (1920) die Sauropoden in zwei Familien ein, die Bothrosauropodidae und die Homalosauropodidae, denen er einige Unterfamilien zuordnete. Andere Autoren führten jedoch die traditionelle Systematik mit ranglosen Familien fort (z. B. McIntosh, 1990). Spätere Studien waren im Sinne der Kladistik; so stellte Upchurch (1995) fast alle Sauropoden in die Gruppe Eusauropoda, während er modernere Arten der Untergruppe Neosauropoda zuordnete.[12] Heute ist die Systematik der Sauropoden noch an vielen Stellen umstritten,[62] weshalb sich Analysen verschiedener Autoren in vielen Punkten unterscheiden. Es folgt ein aktuelles Beispiel (vereinfacht nach Weishampel, Dodson und Osmólska, 2004).[56]
| Sauropoda |
| ||||||||||||||||||||||||||||||||||||||||||
Entdeckungs- und Forschungsgeschichte
Frühe Entdeckungen in England
Die ersten wissenschaftlich untersuchten Sauropodenknochen wurden in England entdeckt. Bereits im Jahr 1825 meldete John Kingston fragmentarische Beinknochen aus dem mittleren Jura, weitere Riesenknochen aus jurassischen Gesteinen wurden innerhalb der nächsten 16 Jahre entdeckt. Der spätere Erstbeschreiber der Dinosauria Richard Owen, gab unwissentlich dem ersten Sauropodenfossil einen wissenschaftlichen Namen; er nannte einen Zahn Cardiodon, obwohl er nicht wusste, zu welchem Tier dieser gehörte.[63]
In seiner 1842 veröffentlichten Studie über fossile Reptilien aus England beschrieb Owen unter anderem die bisher gefundenen und später zu den Sauropoden gestellten Riesenknochen. Er meinte, sie gehörten zu einem großen Tier und könnten keiner bekannten Form zugeordnet werden, hätten gleich den Walen eine schwammige Knochenstruktur. Auf dieser Feststellung basierend nannte er das unbekannte Tier Cetiosaurus, was so viel wie „Walechse“ bedeutet.[63] Er ging von einem großen, marinen Krokodil aus.[64] 1860 erstellte Owen eine neue Unterordnung der Krokodile, die Opisthocaudia, wo er Cetiosaurus und Streptospondylus (später als Theropode neubeschrieben) einordnete.[63]
Zwar wurden in den 30 Jahren nach der Beschreibung von Cetiosaurus verschiedene fragmentarische Funde beschrieben (zum Beispiel Pelorosaurus und Aepisaurus), diese gelten jedoch als ungültig oder dubios. Ein erstes Bild von der wahren Natur der Sauropoden konnte man sich erst nach der Entdeckung eines teilweise erhaltenen, jedoch schädellosen, Cetiosaurus-Skelettes machen.[64] Dieses wurde in einem Steinbruch bei Gibraltar nahe Oxford geborgen und in dem 1871 veröffentlichten Buch „The Geology of Oxford“ von John Phillips detailliert beschrieben.[63] Phillips vermutete, dass die Knochen von einem großen, landlebenden Dinosaurier stammen.[64] Er entdeckte, dass die Beine nicht so abgespreizt stehen konnten wie bei Krokodilen, sondern gerader unter den Körper standen. Auch schloss er erstmals aus dem einzigen erhalten gebliebenen Zahn, dass es sich um einen Herbivoren handeln musste.[63]
Zwischen 1870 und 1890 wurden weitere für das Verständnis der Sauropoden-Anatomie wichtige Funde gemacht;[64] im Jahr 1877 wurde mit dem indischen Titanosaurus (Lydekker) der erste Sauropode aus einem südlichen Kontinent beschrieben.[65]
Entdeckungen in Nordamerika (Morrison-Formation)
Bereits 1856 wurden zwei Zähne aus Maryland als Astrodon beschrieben, der erste Nachweis eines Sauropoden aus Nordamerika. Ab 1877 setzte eine Flut von neuen Entdeckungen aus der spätjurassischen Morrison-Formation ein. Die beiden Rivalen E. D. Cope und O. C. Marsh beschrieben in ihren sogenannten „Knochenkriegen“ eine gewaltige Menge an Material (besonders aus Garden Park, Morrison und Como Bluff), mit dem Ziel, den anderen mit allen Mitteln zu überbieten. Dieser Konkurrenzkampf führte zwar zu insgesamt 142 neuen Dinosaurierarten, die Veröffentlichungen waren jedoch oft nur sehr kurz und in vielen Fällen war das zugrundeliegende Material zum Großteil noch nicht vom umliegenden Gestein befreit. Dies führte nicht zuletzt zu vielen Synonymen (Doppelbenennungen für dasselbe Tier).[63]

Die bedeutendsten Beiträge in Bezug auf Sauropoden kamen zu dieser Zeit von Marsh. Im Jahr 1878 stellte er die Gruppe Sauropoda auf und beschrieb zehn Merkmale, welche das neue Taxon charakterisieren. 1879 beschrieb er erstmals einen teilweise erhaltenen Schädel und nannte das Tier „Morosaurus“ („dumme Echse“), aufgrund der im Vergleich zum restlichen Körper winzigen Größe des Schädels. Morosaurus wurde später jedoch als ein Synonym mit dem von Cope beschriebenen Camarasaurus erkannt; da letzterer vor Morosaurus beschrieben wurde, ist Camarasaurus der heute gültige Name. 1883 beschrieb Marsh ein fast vollständiges Skelett als „Brontosaurus“ excelsus und veröffentlichte erstmals eine vollständige Rekonstruktion. Allerdings wurde auch Brontosaurus später als ein Synonym mit Apatosaurus (Marsh, 1877) erkannt, weshalb Brontosaurus heute als ungültig gilt. 1884 beschrieb Marsh die Gattung Diplodocus und damit den ersten vollständigen, verbundenen Sauropodenschädel.[63]
Um die Jahrhundertwende gab es bedeutende Entdeckungen aus Como Bluff und dem nahegelegenen Bone Cabin Quarry, zwei Dinosaurierfriedhöfen aus Wyoming. Alleine aus Bone Cabin Quarry wurden hunderte Funde gemacht, darunter viele verbundene Gliedmaßen-Knochen von Sauropoden. Die Funde führten unter anderem zu detaillierten Beschreibungen von Diplodocus (Hatcher, 1901), Apatosaurus (Hatcher, 1902) und Haplocanthosaurus (Hatcher, 1903). Abgüsse eines Skeletts von Diplodocus wurden an Museen auf der ganzen Welt versandt.[63]
Earl Douglass entdeckte 1909 den größten Fundort für Sauropoden-Knochen, das Dinosaur National Monument in Utah. Hier kamen neun komplette oder fast komplette Sauropodenschädel von Camarasaurus, Diplodocus und Apatosaurus zum Vorschein, sowie fünf Skelette. Auch die seltene Gattung Barosaurus ist unter den Funden.[64]
Entdeckungen aus der Tendaguru- und der Shaximiao-Formation

Anfang des zwanzigsten Jahrhunderts wurde eine weitere, heute vertraute, Sauropodenfauna in der ehemaligen deutschen Provinz Ostafrika (das heutige Tansania) entdeckt – die Fauna der spätjurassischen Tendaguru-Formation. So kamen durch eine deutsche Expedition Fossilien zum Vorschein, die von E. Fraas 1908 beschrieben wurden und heute als Tornieria und Janenschia bekannt sind. Weitere Ausgrabungen unter der Leitung von Werner Janensch brachten eine Vielzahl von Knochen zum Vorschein, welche später von Janensch von 1914 bis 1961 beschrieben wurden. Der Großteil dieser Knochen befindet sich heute im Humboldt Museum für Naturkunde in Berlin, inklusive Brachiosaurus und Dicraeosaurus.[64]
Aus den 1920ern und 1930ern gab es detaillierte Veröffentlichungen über Camarasaurus (Osborn und Mook, 1921) – erstmals wurde ein fast komplettes Sauropodenskelett beschrieben (Gilmore, 1925) – sowie über Apatosaurus (Gilmore, 1936). Weitere Veröffentlichungen schließen die umfassende Beschreibung des chinesischen Euhelopus (Wiman, 1929) sowie Beschreibungen der argentinischen und indischen Titanosaurier (Huene und Matley, 1933) mit ein.[64]
Ab dem Ende des Zweiten Weltkriegs gab es eine Folge von Veröffentlichungen des legendären[63] chinesischen Forschers C. C. Young über die reichen Fossilienvorkommen aus dem mittleren und späten Jura Chinas. Im Jahr 1972 wurde Mamenchisaurus aus Sichuan beschrieben, welcher einen im Verhältnis zum Körper bemerkenswert langen Hals aufweist.[66] Weitere Arten stammen aus der oberen Shaximiao-Formation, die heute, zusammen mit der nordamerikanischen Morrison-Formation und der ostafrikanischen Tendaguru-Formation, zu den am besten bekannten Sauropodenfaunen gehört – unter den Funden sind Shunosaurus, Datousaurus und Omeisaurus. China hat durch viele fragmentarische und vollständige Skelette heute eine große Bedeutung bei der Erforschung der Sauropoden gewonnen. Auch aus anderen Gebieten Asiens, vor allem der Wüste Gobi, gab es bemerkenswerte Funde, einschließlich Nemegtosaurus, Quaesitosaurus und Opisthocoelicaudia.[64]
Neuere Entdeckungen

Neben China ist Argentinien die Region, aus der heute die meisten neuen Sauropodenfunde stammen. Erwähnenswerte Funde aus dem mittleren Jura bis zur späten Kreide sind unter anderem Patagosaurus, Saltasaurus, und aus der jüngeren Vergangenheit Rayososaurus, Amargasaurus, Andesaurus und Argentinosaurus.[64] Weitere Funde stammen aus der Sahara Nordafrikas, wie beispielsweise Nigersaurus und Jobaria.[67]
Bedeutende neuere Entdeckungen schließen den Titanosaurier Rapetosaurus (2001) aus Madagaskar[61] und den kleinwüchsigen Europasaurus (2006) aus Deutschland[6] mit ein. Weitere wichtige Funde aus der jüngeren Vergangenheit sind unter anderem der primitive Spinophorosaurus (2009)[68] sowie die Titanosaurier Futalognkosaurus (2007)[69] und Tapuiasaurus (2011).[70]
Literatur
- Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3.
- Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1.
- David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2.
Weblinks
- Biology of the Sauropod Dinosaurs: The Evolution of Gigantism – Projektseite der Deutschen Forschungsgemeinschaft (deutsch, englisch)
- DFG Science TV: Die Supersaurier 12 dreiminütige Kurzfilme über den Fortgang des DFG-Projekts
Einzelnachweise
- Gregory S. Paul: The Princeton Field Guide To Dinosaurs. Princeton University Press, Princeton NJ u. a. 2010, ISBN 978-0-691-13720-9, S. 171–213, Online.
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 10. Januar 2022]).
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 10. Januar 2022]).
- Ignacio A. Cerda, Ariana Paulina Carabajal, Leonardo Salgado, Rodolfo A. Coria, Marcelo A. Reguero, Claudia P. Tambussi, Juan J. Moly: The first record of a sauropod dinosaur from Antarctica. In: Naturwissenschaften. Bd. 99, Nr. 1, 2012, S. 83–87, doi:10.1007/s00114-011-0869-x.
- Paul Upchurch, Paul M. Barrett, Peter Dodson: Sauropoda. Abschnitt: Anatomy. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 273–295.
- P. Martin Sander, Octávio Mateus, Thomas Laven, Nils Knötschke: Bone histology indicates insular dwarfism in a new Late Jurassic sauropod dinosaur. In: Nature. Bd. 441, Nr. 7094, 2006, S. 739–741, doi:10.1038/nature04633, Digitalisat (PDF; 264,58 kB) (Memento vom 7. Juli 2006 im Internet Archive).
- Gerardo V. Mazzetta, Per Christiansen, Richard A. Fariña: Giants and Bizarres: Body Size of Some Southern South American Cretaceous Dinosaurs. In: Historical Biology. Bd. 16, Nr. 2/4, 2004, ISSN 0891-2963, S. 71–83, doi:10.1080/08912960410001715132, Digitalisat (PDF; 574,66 kB).
- John S. McIntosh, Michael K. Brett-Surman, James O. Farlow: Sauropods. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 269–271.
- Daniel Chure, Brooks B. Britt, John A. Whitlock, Jeffrey A. Wilson: First complete sauropod dinosaur skull from the Cretaceous of the Americas and the evolution of sauropod dentition. In: Naturwissenschaften. Bd. 97, Nr. 4, 2010, S. 379–391, doi:10.1007/s00114-010-0650-6.
- John S. McIntosh, Michael K. Brett-Surman, James O. Farlow: Sauropods. Abschnitt: Sauropod Anatomy. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 269–271.
- Sebastián Apesteguía: Evolution of the Hyposphene-Hypantrum Complex within Sauropoda. In: Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1, S. 248–267.
- Jeffrey A. Wilson: Overview of Sauropod Phylogeny and Evolution. Kristina Curry Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a 2005, ISBN 0-520-24623-3, S. 15–49, Digitalisat (PDF; 384,37 kB).
- Daniel T. Ksepka, Mark A. Norell: Erketu ellisoni, a Long-Necked Sauropod from Bor Guvé (Dornogov Aimag, Mongolia) (= American Museum Novitates. Nr. 3508, ISSN 0003-0082). American Museum of Natural History, New York NY 2006, Digitalisat (PDF; 2,02 MB).
- Michael D. D'Emic, Jeffrey A. Wilson, Sankar Chatterjee: The titanosaur (Dinosauria: Sauropoda) osteoderm record: review and first definitive specimen from India. In: Journal of Vertebrate Paleontology. Bd. 29, Nr. 1, 2009, ISSN 0272-4634, S. 165–177, doi:10.1671/039.029.0131.
- Leonardo Salgado: Considerations on the bony plates assigned to titanosaurs (Dinosauria, Sauropoda). In: Ameghiniana. Bd. 40, Nr. 3, 2003, S. 441–456, Abstract.
- Jeffrey A. Wilson, Dhananjay M. Mohabey, Shanan E. Peters, Jason J. Head: Predation upon Hatchling Dinosaurs by a New Snake from the Late Cretaceous of India. In: PLoS Biol. Bd. 8, Nr. 3, 2010, e1000322, doi:10.1371/journal.pbio.1000322.
- Thiago da Silva Marinho: Functional aspects of titanosaur osteoderms. In: Nature Precedings. 2007, ZDB-ID 2637018-9, doi:10.1038/npre.2007.508.1.
- P. Martin Sander, Andreas Christian, Marcus Clauss, Regina Fechner, Carole T. Gee, Eva-Maria Griebeler, Hanns-Christian Gunga, Jürgen Hummel, Heinrich Mallison, Steven F. Perry, Holger Preuschoft, Oliver W. M. Rauhut, Kristian Remes, Thomas Tütken, Oliver Wings, Ulrich Witzel: Biology of the sauropod dinosaurs: the evolution of gigantism. In: Biological Reviews. Bd. 86, Nr. 1, 2011, ISSN 1464-7931, S. 117–155, doi:10.1111/j.1469-185X.2010.00137.x, Digitalisat (PDF; 1,25 MB).
- Olga del Valle Giménez: Skin impressions of Tehuelchesaurus (Sauropoda) from the Upper Jurassic of Patagonia. In: Revista del Museo Argentino de Ciencias Naturales. NS Bd. 9, Nr. 2, 2007, ISSN 1514-5158, S. 119–124, Digitalisat (PDF; 466,55 kB) (Memento vom 7. Oktober 2012 im Internet Archive).
- Stephen Czerkas: The history and interpretation of sauropod skin impressions. In: Martin G. Lockley, Vanda F. dos Santos, Christian A. Meyer, Adrian P. Hunt (Hrsg.): Aspects of sauropod paleobiology (= Gaia. Revista de Geociências. Nr. 10, ISSN 0871-5424). Museu Nacional de História Natural, Lisboa 1994, Digitalisat (PDF; 2,96 MB).
- Paul Upchurch, Paul M. Barrett, Peter Dodson: Sauropoda. Abschnitt: Paleobiology, Taphonomy, and Paleoecology. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 273–295.
- Kenneth Carpenter: Biggest of the big: a critical re-evaluation of the mega-sauropod Amphicoelias fragillimus Cope, 1878. In: John R. Foster, Spencer G. Lucas (Hrsg.): Paleontology and Geology of the Upper Jurassic Morrison Formation (= New Mexico Museum of Natural History & Science. Bulletin. 36, ISSN 1524-4156). New Mexico Museum of Natural History & Science, Albuquerque NM 2006, S. 131–138, online.
- Kent Stevens, Michael Parrish: Neck Posture, Dentition, and Feeding Strategies in Jurassic Sauropod Dinosaurs. In: Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1, S. 212–232.
- Vandana Prasad, Caroline A. E. Strömberg, Habib Alimohammadian, Ashok Sahni: Dinosaur Coprolites and the Early Evolution of Grasses and Grazers. In: Science. Bd. 310, Nr. 5751, 2005, S. 1177–1180, doi:10.1126/science.1118806.
- Paul M. Barrett, Emily J. Rayfield: Ecological and evolutionary implications of dinosaur feeding behaviour. In: Trends in Ecology & Evolution. Bd. 21, Nr. 4, 2006, ISSN 0169-5347, S. 217–224, doi:10.1016/j.tree.2006.01.002.
- Sankar Chatterjee, Zhong Zheng: Neuroanatomy and Dentition of ‚Camarasaurus lentus‘. In: Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1, S. 199–211.
- Paul C. Sereno, Jeffrey A. Wilson, Lawrence M. Witmer, John A. Whitlock, Abdoulaye Maga, Oumarou Ide, Timothy A. Rowe: Structural Extremes in a Cretaceous Dinosaur. In: PLOS ONE. Bd. 2, Nr. 11, 2007, e1230, doi:10.1371/journal.pone.0001230.
- David Berman, Bruce Rothschild: Neck Posture of Sauropods Determined Using Radiological Imaging to Reveal Three-Dimensional Structure of Cervical Vertebrae. In: Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1, S. 233–247.
- Kent A. Stevens, J. Michael Parrish: Neck Posture and Feeding Habits of Two Jurassic Sauropod Dinosaurs. In: Science. Bd. 284, Nr. 5415, 1999, S. 798–800, doi:10.1126/science.284.5415.798.
- Oliver Wings: A review of gastrolith function with implications for fossil vertebrates and a revised classification. In: Acta Palaeontologica Polonica. Bd. 52, Nr. 1, 2007, ISSN 0567-7920, S. 1–16, online.
- O. Wings, P. M. Sander: No gastric mill in sauropod dinosaurs: new evidence from analysis of gastrolith mass and function in ostriches. In: Proceedings. Biological sciences / The Royal Society. Band 274, Nummer 1610, März 2007, S. 635–640, doi:10.1098/rspb.2006.3763, PMID 17254987, PMC 2197205 (freier Volltext).
- Jeffrey A. Wilson, Kristina Curry Rogers: Monoliths of the Mesozoic. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 1–14, Digitalisat (PDF; 175,70 kB).
- Mathew J. Wedel, Richard L. Cifelli: Sauroposeidon: Oklahoma's Native Giant (= Oklahoma Geology Notes. Bd. 65, Nr. 2, ISSN 0030-1736). Oklahoma Geological Survey, Norman OK 2005, Digitalisat (PDF; 2,15 MB).
- David M. Lovelance, Scott A. Hartman, William R. Wahl: Morphology of a specimen of Supersaurus (Dinosauria, Sauropoda) from the Morrison Formation of Wyoming, and a re-evaluation of Diplodocoid phylogeny. In: Arquivos do Museu Nacional. Bd. 65, Nr. 4, 2007, ISSN 0365-4508, S. 527–544, Digitalisat (PDF; 1,9 MB) (Memento vom 22. August 2014 im Internet Archive).
- Spencer G. Lucas, Matthew C. Herne, Andrew B. Heckert, Adrian P. Hunt, Robert M. Sullivan: Reappraisal of Seismosaurus, A Late Jurassic Sauropod Dinosaur from New Mexico In: The Geological Society of America. Abstracts with Programs. Bd. 36, Nr. 5, 2004, ISSN 0016-7592, S. 422.
- Oliver Rauhut: 40 m lang und 100 t schwer. Der Gigantismus der sauropoden Dinosaurier. In: Fossilien. Bd. 22, Nr. 4, 2005, ISSN 0175-5021, S. 208–213, online.
- Mathew J. Wedel: Vertebral pneumaticity, air sacs, and the physiology of sauropod dinosaurs. In: Paleobiology. Bd. 29, Nr. 2, 2003, ISSN 0094-8373, S. 243–255, doi:10.1666/0094-8373(2003)029<0243:VPASAT>2.0.CO;2, Digitalisat (PDF; 860,30 kB) (Memento vom 17. Dezember 2008 im Internet Archive).
- Daniela Schwarz, Eberhard Frey, Christian A. Meyer: Pneumaticity and soft-tissue reconstructions in the neck of diplodocid and dicraeosaurid sauropods. In: Acta Palaeontologica Polonica. Bd. 52, Nr. 1, 2007, S. 167–188 (online).
- Bruce Rotschild, Ralph Molnar: Sauropod Stress Fractures as Clues to Activity. In: Virginia Tidwell, Kenneth Carpenter (Hrsg.): Thunder-lizards. The Sauropodomorph Dinosaurs. Indiana University Press, Bloomington IN u. a. 2005, ISBN 0-253-34542-1, S. 381–392.
- Jeffrey A. Wilson, Matthew T. Carrano: Titanosaurs and the Origin of „Wide-Gauge“ Trackways: A Biomechanical and Systematic Perspective on Sauropod Locomotion. In: Paleobiology. Bd. 25, Nr. 2, 1999, S. 252–267.
- Martin Lockley, Christian Meyer: Dinosaur Tracks and other fossil footprints of Europe. Columbia University Press, New York u. a. 2000, ISBN 0-231-10710-2, S. 164.
- Martin G. Lockley: A guide to the fossil footprints of the world. University of Colorado u. a., Denver CO u. a. 2002, ISBN 0-9706091-3-2.
- Eric Buffetaut, Jean Le Loeuff: The discovery of dinosaur eggshells in nineteenth-century France. In: Kenneth Carpenter, Karl F. Hirsch, John R. Horner (Hrsg.): Dinosaur Eggs and Babies. Cambridge University Press, Cambridge 1994, ISBN 0-521-44342-3, S. 31–34.
- Brooks B. Britt, Bruce G. Naylor: An embryonic ‚Camarasaurus‘ (Dinosauria, Sauropoda) from the Upper Jurassic Morrison Formation (Dry Mesa Quarry, Colorado). In: Kenneth Carpenter, Karl F. Hirsch, John R. Horner (Hrsg.): Dinosaur Eggs and Babies. Cambridge University Press, Cambridge 1994, ISBN 0-521-44342-3, S. 256–264.
- Bernat Vila, Frankie D. Jackson, Josep Fortuny, Albert G. Sellés, Àngel Galobart: 3-D Modelling of Megaloolithid Clutches: Insights about Nest Construction and Dinosaur Behaviour. In: PLoS ONE. Bd. 5, Nr. 5, 2010, e10362, doi:10.1371/journal.pone.0010362.
- Gerald Grellet-Tinner, Luis M. Chiappe, Rodolfo Coria: Eggs of titanosaurid sauropods from the Upper Cretaceous of Auca Mahuevo (Argentina). In: Canadian Journal of Earth Sciences. Bd. 41, Nr. 8, 2004, ISSN 0008-4077, S. 949–960, doi:10.1139/e04-049.
- Kristina Curry Rogers, Gregory M. Erickson: Sauropod Histology: microscopic views on the lives of giants. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 303–326, doi:10.1525/california/9780520246232.003.0012.
- Luis M. Chiappe, Frankie Jackson, Rodolfo A. Coria, Lowell Dingus: Nesting Titanosaurs from Auca Mahuevo and Adjacent Sites: Understanding Sauropod Reproductive Behavior and Embryonic Development. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 285–302, doi:10.1525/california/9780520246232.003.0011.
- P. Martin Sander: Longbone histology of the Tendaguru sauropods: implications for growth and biology. In: Paleobiology. Bd. 26, Nr. 3, 2000, S. 466–488, doi:10.1666/0094-8373(2000)026<0466:LHOTTS>2.0.CO;2.
- Julia J. Day, David B. Norman, Andrew S. Gale, Paul Upchurch, H. Philip Powell: A Middle Jurassic dinosaur trackway site from Oxfordshire, UK. In: Palaeontology. Bd. 47, Nr. 2, 2004, ISSN 0031-0239, S. 319–348, doi:10.1111/j.0031-0239.2004.00366.x.
- Joanna L. Wright: Steps in Understanding Sauropod Biology: The Importance of Sauropod Tracks. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 252–285, doi:10.1525/california/9780520246232.003.0010.
- Ronan Allain, Najat Aquesbi, Jean Dejax, Christian Meyer, Michel Monbaron, Christian Montenat, Philippe Richir, Mohammed Rochdy, Dale Russell, Philippe Taquet: A basal sauropod dinosaur from the Early Jurassic of Morocco. In: Comptes Rendus Palevol. Bd. 3, Nr. 3, 2004, ISSN 1631-0683, S. 199–208, doi:10.1016/j.crpv.2004.03.001, Digitalisat (PDF; 413,28 kB).
- Jeffrey A. Wilson: Integrating ichnofossil and body fossil records to estimate locomotor posture and spatiotemporal distribution of early sauropod dinosaurs: a stratocladistic approach. In: Paleobiology. Bd. 31, Nr. 3, 2005, S. 400–423, doi:10.1666/0094-8373(2005)031[0400:IIABFR]2.0.CO;2.
- Adam M. Yates: A new species of the primitive dinosaur Thecodontosaurus (Saurischia: Sauropodomorpha) and its implications for the systematics of early dinosaurs. In: Journal of Systematic Palaeontology. Bd. 1, Nr. 1, 2003, ISSN 1477-2019, S. 1–42, doi:10.1017/S1477201903001007.
- Peter M. Galton, Paul Upchurch: Prosauropoda. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 232–258.
- Paul Upchurch, Paul M. Barrett, Peter Dodson: Sauropoda. Abschnitt: Systematics and Evolution. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 295–314.
- Paul Upchurch, Paul M. Barrett: Phylogenetic and Taxic Perspectives on Sauropod Diversity. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 104–124, doi:10.1525/california/9780520246232.003.0004.
- Paul C. Sereno, Jeffrey A. Wilson: Structure and Evolution of a Sauropod Tooth Battery. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 157–177, doi:10.1525/california/9780520246232.003.0006.
- Pablo A. Gallina, Sebastián Apesteguía: Cathartesaura anaerobica gen. et sp. nov., a new rebbachisaurid (Dinosauria, Sauropoda) from the Huincul Formation (Upper Cretaceous), Río Negro, Argentina. In: Revista del Museo Argentino de Ciencias Naturales. NS Bd. 7, Nr. 2, 2005, ISSN 1514-5158, S. 153–166, Digitalisat (PDF; 1,03 MB) (Memento vom 6. Juli 2011 im Internet Archive).
- Jeffrey A. Wilson: An Overview of Titanosaur Evolution and Phylogeny. In: Fidel Torcida Fernández-Baldor, Pedro Huerta Hurtado (Hrsg.): Actas de las III Jornadas Internacionales sobre Paleontología de Dinosaurios y Su Entorno. = Proceedings of the 3rd International Symposium about Paleontology of Dinosaurs and their Environment Paleontología de dinosaurios y su entorno. Salas de los Infantes (Burgos, España), 16 al 18 de septiembre de 2004. Colectivo arqueológico-paleontológico de Salas, Salas de los Infantes (Burgos, España) 2006, ISBN 84-8181-227-7, S. 169–190.
- Kristina Curry Rogers: Titanosauria: A Phylogenetic Overview. In: Kristina Curry A. Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and Paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 50–103, doi:10.1525/california/9780520246232.003.0003.
- Jeffrey A. Wilson: Sauropod dinosaur phylogeny: critique and cladistic analysis. In: Zoological Journal of the Linnean Society. Bd. 136, Nr. 2, 2002, ISSN 0024-4082, S. 215–275, doi:10.1046/j.1096-3642.2002.00029.x.
- John S. McIntosh, Michael K. Brett-Surman, James O. Farlow: Sauropods. Abschnitt: The Discovery of Sauropods. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 264–269.
- Paul Upchurch, Paul M. Barrett, Peter Dodson: Sauropoda. Abschnitt: Historical Review. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 259–273.
- Jeffrey A. Wilson, Paul Upchurch: A Revision of Titanosaurus Lydekker (Dinosauria – Sauropoda), the first dinosaur genus with a ‚gondwanan‘ distribution. In: Journal of Systematic Palaeontology. Bd. 1, Nr. 3, 2003, S. 125–160, doi:10.1017/S1477201903001044.
- C. C. Young, H. C. Chao: [Mamenchisaurus hochuanensis sp. nov.]. In: Szechuan Academica Sinica. Institute of Vertebrate Palaeontology and Palaeoanthropology. Monographs. Series A, Bd. 8, 1972, S. 1–30, (In chinesischer Sprache und Schrift; englische Übersetzung: (PDF; 334,17 kB)).
- Paul C. Sereno, Allison L. Beck, Didier B. Dutheil, Hans C. E. Larsson, Gabrielle H. Lyon, Bourahima Moussa, Rudyard W. Sadleir, Christian A. Sidor, David J. Varricchio, Gregory P. Wilson, Jeffrey A. Wilson: Cretaceous Sauropods from the Sahara and the Uneven Rate of Skeletal Evolution Among Dinosaurs. In: Science. Bd. 286, Nr. 5443, 1999, S. 1342–1347, doi:10.1126/science.286.5443.1342.
- Kristian Remes, Francisco Ortega, Ignacio Fierro, Ulrich Joger, Ralf Kosma, José Manuel Marín Ferrer: A new basal sauropod dinosaur from the Middle Jurassic of Niger and the early evolution of sauropoda. In: PLoS ONE. Bd. 4, Nr. 9, 2009, e6924, doi:10.1371/journal.pone.0006924.
- Jorge O. Calvo, Juan D. Porfiri, Bernardo J. Gonzáles-Riga, Alexander W. A. Kellner: A new Cretaceous terrestrial ecosystem from Gondwana with the description of a new sauropod dinosaur. In: Anais da Academia Brasileira de Ciências. Bd. 79, Nr. 3, 2007, ISSN 0001-3765, S. 529–541, Digitalisat (PDF; 836,43 kB).
- Hussam Zaher, Diego Pol, Alberto B. Carvalho, Paulo M. Nascimento, Claudio Riccomini, Peter Larson, Rubén Juarez-Valieri, Ricardo Pires-Domingues, Nelson Jorge da Silva Jr., Diógenes de Almeida Campos: A Complete Skull of an Early Cretaceous Sauropod and the Evolution of Advanced Titanosaurians. In: PLoS ONE. Bd. 6, Nr. 2, 2011, e16663, doi:10.1371/journal.pone.0016663.