Amygdalin
Amygdalin (griechisch amygdalis, Mandelkern) ist ein cyanogenes Glycosid, das in Gegenwart von Wasser und dem Enzymgemisch Emulsin[2] Blausäure (HCN) abspaltet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
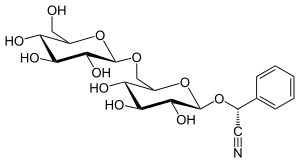 | ||||||||||||||||
| D-Amygdalin | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Amygdalin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C20H27NO11 | |||||||||||||||
| Kurzbeschreibung |
farblose[1] als Trihydrat orthorhombische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 457,4 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,4 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Chemische Eigenschaften
In verdünnten Säuren wird Amygdalin in Gentiobiose und Mandelonitril (das Nitril der Mandelsäure) gespalten. Letzteres zerfällt weiter zu den typischen Bittermandelaromen Benzaldehyd und Blausäure; die Gentiobiose wird zu zwei Glucose-Molekülen hydrolysiert.
Steinobst enthält das Enzymgemisch Emulsin, das aus β-Glucosidasen und Hydroxynitrillyase besteht[5]; dieses Gemisch spaltet ebenfalls Amygdalin in einer mehrstufigen Reaktion zu zwei Molekülen Glucose, Benzaldehyd und Blausäure.[2] Hierbei wird Amygdalin zunächst durch eine β-Glucosidase-Amygdalinhydrolase (EC 3.2.1.117) zu Prunasin und D-Glucose hydrolysiert, und anschließend der Glucoseanteil von Prunasin durch eine Prunasinhydrolase (EC 3.2.1.21) abgespalten, dabei entsteht Mandelonitril.[6] Mandelonitril kann zwar spontan zu Benzaldehyd und HCN zerfallen (im neutralen oder alkalischen Milieu), eine Mandelonitrillyase (auch bekannt als Hydroxynitrillyase, EC 4.1.2.10) katalysiert diese Reaktion erheblich.
Aus einem Gramm Amygdalin entstehen 59 mg HCN.[6]
Stereoisomere
Das L-Epimer, auch S-Stereoisomer (L-Mandelonitril-β-D-gentiobiosid) wird als Neoamygdalin bezeichnet. Amygdalin und Neoamygdalin sind Diastereomere, nicht aber Enantiomere, da sich die Konfigurationen der zehn stereogenen Zentren der Gentiobiose nicht ändern.[6]
Neoamygdalin und Amygdalin können durch chirale Chromatographie getrennt werden.
Vorkommen

Bittere Aprikosenkerne, Apfelkerne, Bittermandeln und Samen von anderen Steinfrüchten wie z. B. Zwetschgen enthalten Amygdalin in hohen Konzentrationen.[8] Dieses kann bei der Verarbeitung der Ölsamen, beispielsweise zu Persipan, in Blausäure, Benzaldehyd und Glukose aufgespalten werden. Die freigesetzte Blausäure muss entfernt werden, die Kerne werden „entbittert“.
1830 wurde Amygdalin aus Bittermandeln isoliert.[8]
Vorkommen in Lebensmitteln
Amygdalin, Prunasin und andere cyanogene (blausäureabspaltende) Glykoside (Linamarin, Lotaustralin (Lein, Hülsenfrüchtler, Maniok u. a.), Dhurrin (Hirse), Taxiphyllin (Bambussprossen), Sambunigrin (Holunder) und über 70 weitere) kommen in einigen unverarbeiteten Lebensmitteln in relevanten Mengen (>0,02 % gebundene Blausäure) vor. Durch Kochen wird der Blausäuregehalt aber auf ungefährliche Konzentrationen reduziert.

Die höchsten Blausäuregehalte weisen die Steinfrüchte einiger Rosengewächse auf, v. a. Bittermandeln und Aprikosenkerne. So enthalten Aprikosenkerne bis zu 8 % Amygdalin,[9] entsprechend etwa 0,4 % gebundene Blausäure, Bittermandeln bis zu 5 % Amygdalin[9] (entsprechend 0,3 % Blausäure).[10]
Von Anhängern des Amygdalin werden oft auch andere Lebensmittel genannt, die aber entweder nur unwesentliche Mengen an cyanogenen Glykosiden enthalten (Brombeeren, Erdbeeren, Gartenbohnen, Erbsen) oder bei denen durch Kochen die Blausäure weitestgehend entfernt wird (Maniok / Tapioka, Yams, Limabohne).
Die Limabohne enthält in rohem Zustand beispielsweise 0,2–0,3 % gebundene Blausäure (200–300 mg/100 g), Gartenbohnen und Erbsen aber nur 0,002 % (2 mg/100 g),[11] Kirschsaft immerhin noch 0,00005 % (500 µg/l). Aprikosenkerne enthalten bis zu 4 mg Blausäure pro Gramm Kern.[12] Das BfR empfiehlt, nicht mehr als zwei Kerne pro Tag zu verzehren, oder besser ganz darauf zu verzichten.[12] Die tödliche Dosis beim Menschen liegt bei etwa 50 mg Blausäure (0,5–3,5 mg/kg Körpergewicht),[12] Blausäure wird nur langsam mittels des Enzyms Rhodanase zu Rhodanid abgebaut. Daher sind ca. 40 Kerne in einer Stunde bei einem Erwachsenen mit 60 kg Körpergewicht tödlich.[13]
Als unbedenklich dagegen gelten 75 µg/kg Körpergewicht (etwa 2 Kerne pro Tag), wie sie durch gewöhnliche Lebensmittel niemals überschritten werden, zumal die Nahrungsmittel mit etwas höherem Gehalt an gebundener Blausäure (z. B. Hülsenfrüchte) üblicherweise gekocht verzehrt werden. Zu beachten ist aber, dass sich Blausäure im Körper anreichert, da sie schwer abgebaut wird. Daher kann eine regelmäßige Einnahme subletaler Dosen (z. B. die regelmäßige Einnahme von Aprikosenkernen) auf Dauer zu einer Blausäurevergiftung führen.[13]
Biosynthese
In Pflanzen wird Amygdalin aus L-Phenylalanin synthetisiert.[6] Hierbei wird Phenylalanin mit Hilfe von Cytochrom P450 enzymatisch zu Phenylacetaloxim unter CO2-Abspaltung umgesetzt, dieses dann unter Wasserabspaltung zu Phenylacetonitril. Ein Cyp71-Enzym hydroxyliert es im Anschluss zu Mandelonitril, es folgt die Glykosylierung mittels UDP-Glucose zu Prunasin. An dessen 6-Hydroxygruppe wird ein weiteres Glucosemolekül angeknüpft, wodurch schließlich Amygdalin entsteht.
Verwendung in der Alternativmedizin
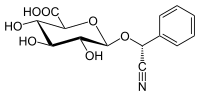
Amygdalin („Amigdalina“) wird, ebenso wie das halbsynthetische und gleichfalls cyanogene Laevo-Mandelsäurenitril-β-glucuronid („Laetril“, „Lätril“), auch unter dem von Ernst T. Krebs Jr.[14] vorgeschlagenen Phantasienamen Vitamin B17, alternativmedizinisch zur Vorbeugung vor und Behandlung von Tumorerkrankungen (Krebs), insbesondere in den USA ab den 1970er und 80er Jahren[15], verwendet.[8] Die Bezeichnung als Vitamin ist allerdings irreführend, da Amygdalin kein für den menschlichen Stoffwechsel essenzieller Stoff ist. Zudem hat Amygdalin keine nutritiven Eigenschaften.[8]
In der Krebsbehandlung ist die perorale („B17“-Tabletten, Zerkauen von Aprikosenkernen) und intravenöse Gabe von Amygdalin beschrieben. Aus Sicht der wissenschaftlich begründeten Medizin ist Amygdalin in dieser Anwendung als ein „unseriöses Wundermittel“ anzusehen. Der von Anhängern der Alternativmedizin behauptete Wirkmechanismus soll auf einer Aufspaltung des Amygdalins in Benzaldehyd, Glucose und die hoch toxische Blausäure (Cyanwasserstoff) unter Beteiligung des Enzyms β-Glucosidase beruhen. Durch ein angeblich vermehrtes Vorkommen von β-Glucosidase in Tumorzellen würde dort örtlich begrenzt vermehrt giftige Blausäure gebildet werden und selektiv zum Absterben der Tumorzelle führen. Tatsächlich aber kommt β-Glukosidase in weitgehend gleichen, zudem nur äußerst geringen Mengen in gesunden Zellen und in Tumorzellen vor,[16] was bereits in den 1980er Jahren gezeigt wurde.[17] Eine weitere Hypothese ist, dass das vermeintliche Fehlen des Enzyms Rhodanase in Tumorzellen dort selektiv eine Blausäureanhäufung bewirke. Rhodanase vermag geringere Mengen von Cyaniden durch Umwandlung in das vergleichsweise untoxische Thiocyanat zu entgiften. Jedoch verfügen auch Krebszellen über eine ähnliche Menge an Rhodanase wie normale Zellen.[18] Ferner wurde behauptet, dass Amygdalin nach Einnahme zu Mandelonitril hydrolysiert, und dieses nach Transport in die Leber dort zu einem β-Glucuronid umgesetzt werde; das β-Glucuronid soll dann zu den Krebszellen transportiert werden und dann Mandelonitril und schließlich Blausäure freisetzen. Das ist aber falsch, da Mandelonitril bereits vorher spontan zu Benzaldehyd und Blausäure dissoziiert, es kann nicht im Körper durch Glykosylierung stabilisiert werden.[6]
Amygdalin werde nach Injektion, so klinische Studien, fast vollständig mit dem Harn wieder ausgeschieden. Oral verabreichtes Amygdalin führe jedoch zu teilweise hohen und kritischen Blausäurekonzentrationen im Körper. Die Behauptung, Cyanide würden besonders in Krebszellen freigesetzt und führten dort selektiv zu einer therapeutischen Wirkung, ist durch Studien widerlegt. Hingegen gebe es Versuche, durch drug targeting die selektive Wirkung zu erhöhen, indem man β-Glukosidase an krebsassoziierte monoklonale Antikörper binde.
Es gibt keine wissenschaftlich fundierten Nachweise einer therapeutischen Wirksamkeit.[8] In den USA warnt die FDA bereits seit Jahrzehnten vor der Einnahme, es gilt als „Quacksalbermittel“.[17] Eine klinische Studie aus dem Jahr 1982[19] mit 178 Patienten zeigte bei an Krebs erkrankten Menschen keinen therapeutischen Effekt (Heilung, Stabilisierung oder Besserung der Erkrankung, Lebensverlängerung) nach Einnahme von Amygdalin, es traten jedoch bei einigen Patienten Symptome einer Cyanidvergiftung auf.[20] Ein Review aus dem Jahr 2006[21] ergab, dass es keine klinischen Studien gibt, die Hinweise auf eine therapeutische Wirksamkeit liefern. Zu diesem Schluss kam auch ein Cochrane-Review von 2011,[22] (bzw. das Update von 2015[23]) die negative Nutzen-Schaden-Bilanz wurde bestätigt.[17] Dagegen wurden zahlreiche Vergiftungserscheinungen sowie Dutzende Todesfälle durch die Anwendung oder irrtümliche Einnahme durch Kinder beschrieben, Amygdalin hat ein eindeutiges toxikologisches Potential.[8] Eine Anwendung außerhalb klinischer Prüfungen – und dort nur mit sehr hohen Sicherheitsvorkehrungen und engstem Monitoring – wird nicht befürwortet.[15] Die Toxizität von Amygdalin wird durch eine (hochdosierte) Vitamin-C-Einnahme weiter erhöht.[23] Dies liegt daran, dass Vitamin C die Bildung von Cyanid aus Amygdalin erhöht und gleichzeitig die Vorräte an für die Entgiftung notwendigem Cystein senkt.[17]
Rechtliche Aspekte für Deutschland
Ärzte haben im Rahmen der Therapiefreiheit eine freie Arzneimittelauswahl. Eingeschränkt wird diese allein durch § 5 des deutschen Arzneimittelgesetzes, der die Abgabe und Anwendung von bedenklichen Arzneimitteln verbietet. Amygdalinhaltige Fertigarzneimittel gibt es keine am Markt. Inwieweit amygdalin- bzw. andere mandelonitrilhaltige Einzelanfertigungen (Rezepturarzneimittel) als bedenklich anzusehen sind, kann fallweise verschieden sein. Von offizieller Seite werden sie grundsätzlich als bedenklich eingestuft,[24] da der begründete Verdacht auf eine Freisetzung von giftiger Blausäure besteht. Dennoch wurde 2007 einer Apotheke in Hannover nach einem Rechtsstreit die Verkehrsfähigkeit des dort auf ärztliche Verordnung angefertigten amygdalinhaltigen Rezepturarzneimittels rechtskräftig zugebilligt. Das Gerichtsurteil[25] stützte sich auf ein toxikologisches Gutachten, dem zufolge die Bildung von Blausäure im gegenständlichen Rezepturarzneimittel auszuschließen sei und dieses somit keine gesundheitliche Gefährdung darstelle. Bei dem verwendeten Ausgangsstoff handele es sich um hochreines Amygdalin, das aufgrund einer fehlenden Verunreinigung mit Amygdalase keine enzymatische Spaltung mit der Folge von Blausäurebildung erwarten lasse. Eine generelle Unbedenklichkeit von amygdalinhaltigen Rezepturarzneimitteln stellte das Gericht hingegen in Abrede und verwies auf die übereinstimmenden Meinungen von Apothekerkammer und Gerichtsgutachter, die davor warnten, Amygdalin unklarer Herkunft und ungeklärter Reinheit einzunehmen. Die behördliche Einschätzung der Bedenklichkeit amygdalinhaltiger Arzneimittel wurde 2014 durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) nochmals bekräftigt, unter anderem wurde dabei mit einer Datentabelle belegt, dass seit 1977 weltweit bereits 22 Fälle von unerwünschten Nebenwirkungen dokumentiert wurden. Darunter waren sogar vier Todesfälle, die sich zwischen 1977 und 1981 ereigneten.[26]
Unerwünschte Wirkungen
Nach der Einnahme von amygdalinhaltigen Lebensmitteln oder Zubereitungen besteht die Gefahr der tödlichen Vergiftung durch Blausäure. Tödliche Vergiftungsfälle durch Aprikosenkerne sind in der toxikologischen Literatur gut belegt.[27] In Regionen, in denen der Verzehr von Aprikosenkernzubereitungen üblich ist, wird durch die Zubereitungstechnik der Amygdalingehalt gesenkt. Werden diese Zubereitungstechniken nicht genau eingehalten, kann es zu tödlichen Vergiftungsfällen kommen. In der toxikologischen Literatur werden Vergiftungsfälle auch konkret für die Therapie mit Amygdalin beschrieben.
Amygdalin verursacht Kopfschmerzen, Schwindel, Übelkeit und Erbrechen, bei hohem Spiegel (> 3 μg/ml) besteht Lebensgefahr.[17] Falls es mit Lebensmitteln mit hohem Betaglukosidasegehalt, beispielsweise Aprikosenkernen, eingenommen wird, wird das Risiko einer Toxizität erhöht. Dies wird durch die Einnahme von Präparaten oder Lebensmitteln mit hohem Vitamin-C-Gehalt zusätzlich gesteigert.[17]
Die niedrigste tödliche Dosis einer erwachsenen Person mit 60 kg liegt bei 0,57 mg/kg Körpergewicht, das sind etwa 40 Aprikosenkerne.[28] Betrachtet man den Blausäuregehalt vor dem Hintergrund des niedrigsten Wertes der Metabolisierungsrate (Entgiftungsrate) für Blausäure von 0,1 mg/kg/h, resultieren daraus folgende Zahlen: Ein Erwachsener kann damit pro Stunde 6,0 mg Blausäure durch Metabolisierung entgiften, was einer Verzehrrate von rund 7 Kernen pro Stunde entspricht.[29] Die für Ratten bestimmte letale Dosis liegt zwischen 405 mg/kg (Reinstoff),[4] 522 mg/kg (Reinstoff),[30] unter 600 mg/kg (mit Glucosidase)[31] und 880 mg/kg (Reinstoff).[31]
Literatur
- C. Campa et al.: Analysis of cyanogenic glycosides by micellar capillary electrophoresis. In. J. Chromatogr. B Biomed. Sci. Appl. 739(1), 2000, S. 95–100, PMID 10744317.
Weblinks
- Zwei bittere Aprikosenkerne pro Tag sind für Erwachsene das Limit – Kinder sollten darauf verzichten (PDF; 35 kB) Aktualisierte Stellungnahme Nr. 009/2015 des BfR vom 7. April 2015.
- Laetrile. Unabhängige Fachinformation des CAM-Cancer-Projekts der Europäischen Kommission, CAM Summary, revidierte Fassung vom 13. Dezember 2011.
- Laetrile/Amygdalin (PDQ®)–Health Professional Version. In: National Cancer Institute. 26. März 2021, abgerufen am 22. Mai 2021 (englisch).
- Ralf Nowotny: Wurde ein krebsheilendes Vitamin verboten? In: mimikama. 3. November 2017, abgerufen am 15. Januar 2020.
Einzelnachweise
- Datenblatt Amygdalin (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Eintrag zu Amygdalin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Eintrag zu Amydaglin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Amygdalin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 9. Dezember 2016.
- Emulsin. In: spektrum.de. 1999, abgerufen am 10. April 2020.
- Acute health risks related to the presence of cyanogenic glycosides in raw apricot kernels and products derived from raw apricot kernels. In: EFSA Journal. 14, Nr. 4, 2016, ISSN 1831-4732. doi:10.2903/j.efsa.2016.4424.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Helvetica Chimica Acta, Zürich, 2006, ISBN 978-3-906390-29-1, S. 458.
- Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: für Prophylaxe, Beratung und Therapie. 1. Auflage. Elsevier, Urban&FischerVerlag, München 2008, ISBN 978-3-437-55361-5, S. 459.
- Steinobst (Prunoidaea). giftpflanzen.com
- Bittermandel (Prunus dulcis var. amara) auf giftpflanzen.com.
- H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage, 2008, Springer-Verlag Berlin / Heidelberg, ISBN 978-3-540-73201-3.
- Zwei bittere Aprikosenkerne pro Tag sind für Erwachsene das Limit – Kinder sollten darauf verzichten. (PDF) BfR, 7. April 2015, abgerufen am 12. Oktober 2021.
- Ralf Nowotny: Wurde ein krebsheilendes Vitamin verboten? In: mimikama. 3. November 2017, abgerufen am 15. Januar 2020.
- Laetrile/Amygdalin (PDQ®)–Health Professional Version. In: National Cancer Institute. 26. März 2021, abgerufen am 22. Mai 2021 (englisch).
- Stellungnahme Amygdalin. (PDF) In: Prävention und integrative Onkologie (PRiO). Deutsche Krebsgesellschaft, 24. April 2017, abgerufen am 15. Januar 2020.
- Unproven Methods of Cancer Management. Laetrile. In: CA Cancer J. Clin., Band 41, 1991, S. 187–192; PMID 1902140, PDF (Memento vom 16. März 2007 im Internet Archive).
- Bedenkliches „Krebsmittel“ Amygdalin/Laetrile – kein Ende in Sicht. (arznei-telegramm.de [abgerufen am 5. Oktober 2018]).
- James A. Duke: CRC Handbook of Medicinal Spices. 1. Auflage. Taylor & Francis Inc., 2003, ISBN 978-0-8493-1279-3, S. 261–262.
- C. G. Moertel et al.: A clinical trial of amygdalin (Laetrile) in the treatment of human cancer. In: N. Engl. J. Med. 306(4), 1982, S. 201–206, PMID 7033783.
- Thilo Bertsche, Martin Schulz: Amygdalin – ein neues altes Krebsmittel? In: Pharmazeutische Zeitung. 24. April 2003, online, abgerufen am 2. November 2016.
- Stefania Milazzo, Stephane Lejeune und Edzard Ernst: Laetrile for cancer: a systematic review of the clinical evidence. In: Supportive Care in Cancer: Official Journal of the Multinational Association of Supportive Care in Cancer. Band 15, Nr. 6, Juni 2007, S. 583–595, doi:10.1007/s00520-006-0168-9, PMID 17106659.
- Stefania Milazzo et al.: Laetrile treatment for cancer. In: The Cochrane Database of Systematic Reviews. Nr. 11, 9. November 2011, S. CD005476, doi:10.1002/14651858.CD005476.pub3, PMID 22071824.
- Stefania Milazzo, Markus Horneber: Laetrile treatment for cancer. In: The Cochrane Database of Systematic Reviews. Nr. 4, 28. April 2015, S. CD005476, doi:10.1002/14651858.CD005476.pub4, PMID 25918920, PMC 6513327 (freier Volltext).
- AMK-Empfehlungen zur Prüfung der Abgabefähigkeit von Rezepturarzneimitteln (PDF; 187 kB), April 2011.
- Urteil des Niedersächsischen Oberverwaltungsgerichts (AZ 11 LB 350/05) zu einem Amygdalin-Rezepturarzneimittel aus Hannover PDF (PDF; 165 kB)
- N. Lilienthal: Amygdalin – fehlende Wirksamkeit und schädliche Nebenwirkungen. In: Bulletin zur Arzneimittelsicherheit. Nr. 3, 2014, S. 7–13.
- V. Herbert: Laetrile: the cult of cyanide. Promoting poison for profit. In: Am. J. Clin. Nutr. 32(5), 1979, S. 1121–1158, PMID 219680, PDF (PDF)
- E. Lindner: Toxikologie der Nahrungsmittel. 4. Auflage, Wissenschaftliche Verlagsgesellschaft, 1990, ISBN 978-3-8047-1575-2.
- W. A. Kaschuba: Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit.
- G. W. Newton, E. S. Schmidt, J. P. Lewis et al.: Amygdalin toxicity studies in rats predict chronic cyanide poisoning in humans. In: The Western journal of medicine. Band 134, Nummer 2, 1981, S. 97–103, PMID 7222669, PMC 1272529 (freier Volltext).
- S. R. Adewusi, O. L. Oke: On the metabolism of amygdalin. 1. The LD50 and biochemical changes in rats. In: Canadian Journal of Physiology and Pharmacology. Band 63, Nummer 9, 1985, S. 1080–1083, PMID 2932206.
