Sohio-Verfahren
Das Sohio-Verfahren ist ein chemisch-technischer Prozess zur Herstellung von Acrylnitril und Acrolein. Er wurde vom gleichnamigen Unternehmen Sohio entwickelt. Nach dessen Übernahme durch BP wurden die Anlagen weiter betrieben und laufend verbessert. Die Synthesen laufen im Rahmen einer katalytischen Oxidation von Propen ab. Das Verfahren zur Herstellung von Acrylnitril ist sogar der größte industrielle Ammonoxidationsprozess.[1]
Historische Entwicklung
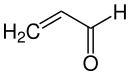
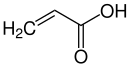
Im Jahre 1953 begann die Arbeit auf der Suche nach einem günstigen Verfahren Aldehyde aus einfachen aliphatischen Kohlenwasserstoffen herzustellen, was bis zu diesem Zeitpunkt sehr teuer war. Als Ausgangsstoffe wurden Propan und Propen betrachtet. Franklin Vaeth hatte die Idee Propen mit einem Metalloxid-Katalysator umzusetzen. Zwei Jahre später blieben wesentliche Erfolge aus und Sohio setzte Veath eine Frist von 6 Wochen. Innerhalb dieser Zeit gelang allerdings mit Hilfe eines modifizierten Vanadiumpentoxid-Katalysators tatsächlich die gewünschte Reaktion. Das Produkt, welches hierbei entstand, war Acrolein. Dieses wird durch einen weiteren Oxidationsprozess zu Acrylsäure, einem bis dahin sehr teuren Stoff, umgesetzt.
Also wurde 1955 doch noch eine weitere Testphase eingeleitet bei der durch Jim Callahan und Emily Ross ein Bismutphosphomolybdat-Katalysator gefunden wurde, der den Grundstein für den Sohio-Prozess legte. Jim Idol vermutete, dass mit diesem Katalysator Acrylnitril sogar direkt ohne einen weiteren Zusatzschritt gewonnen werden kann. Der Prozess wurde 1957 durch ihn und Evelyn Jonak entwickelt. Da ein Syntheseversuch bereits eine Ausbeute von 50 % ergab und die Produktion von Acrylnitril und Acrolein gleichzeitig zu kompliziert war, entwickelte man zunächst das Verfahren zur Synthese von Acrylnitril.[2]
Synthese von Acrylnitril
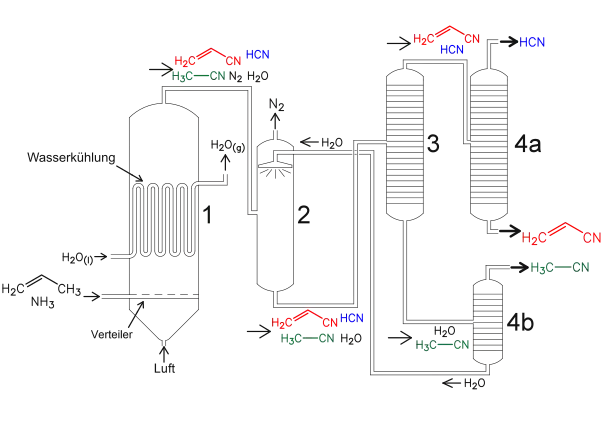
Die technische Verwirklichung wird an der schematischen Darstellung einer Anlage zu Herstellung von Acrylnitril betrachtet.
Technische Verwirklichung
| Strukturformel | Name | Summenformel | Siedetemperatur [in °C] |
|---|---|---|---|
| Acetonitril | C2H3N | 82 | |
| Acrylnitril | C3H3N | 77 | |
| Blausäure | HCN | 26 | |
| Wasser | H2O | 100 |
Die großtechnische Herstellung von Acrylnitril wird mit einer Anlage betrieben, die zu zwei Bereichen zusammengefasst werden kann. Im ersten Bereich wird Acrylnitril mit den anfallenden Nebenprodukten Cyanwasserstoff (HCN) und Acetonitril (C2H3N) synthetisiert und im zweiten Teil anschließend getrennt.
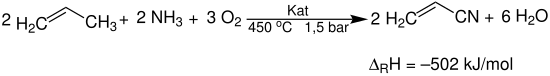
Zu Beginn wird im Wirbelschichtreaktor 1 Propen, Ammoniak und Luft zu einer fluidisierten Wirbelschicht des Katalysators zugesetzt. Die Reaktion verläuft stark exotherm. Um die Temperatur im Reaktor konstant zu halten, muss dieser permanent mit Wasser gekühlt werden. Das Hauptprodukt Acrylnitril entsteht nach folgender Reaktionsgleichung:[1][3]
Dann werden im zweiten Teil der Anlage die Produktgase mit den restlichen Bestandteilen der Luft in den Absorber 2 geleitet, wo diese voneinander getrennt werden. Übrig bleibt ein Gemisch aus Wasser, Acrylnitril, Blausäure und Acetonitril, die in die Destillationskolonne 3 geleitet werden. Hierbei entstehen zwei verschiedene Fraktionen. Die erste Fraktion (Acetonitril und Wasser) werden in die Destillationskolonne 4b geleitet und dort voneinander getrennt. Das Acetonitril kann als Flüssigkeit aufgefangen werden und das Wasser gelangt in den Absorber 2 zurück. Die zweite Fraktion (Acrylnitril und Blausäure) wird in die Destillationskammer 4a geleitet und dort voneinander getrennt.[4]
Katalysatorentwicklung
Im Laufe der Jahre war eine Entwicklung des Katalysators zwingend notwendig. Zu Beginn der Entwicklung ergab der Sohio-Prozess gerade einmal Ausbeuten von etwa 50 Prozent bezogen auf Acrylnitril. Die weitere Forschung zielte auf eine Verringerung des Anteils der auftretenden Nebenprodukte Cyanwasserstoff und Acetonitril ab. Ab 1960 wurden für die Herstellung Bismut-Phosphormolybdat-Kontakte verwendet. Zur Senkung des Anteils an Acetonitril wurde 1967 ein Uranylantimonat-Katalysator entwickelt. 1972 gelang erstmals die Verwendung des sogenannte „Katalysator 41“ verwendet, der ein eisenmodifizierter Bismutmolybdat-Katalysator ist und den Anteil sowohl von Blausäure als auch von Acetonitril gering hält.[1][4]
Selektivität und wirtschaftliche Bedeutung
Werden 100 Gramm Propen bei diesem Verfahren eingesetzt, ergeben sich etwa folgende optimierte Ausbeuten bezogen auf die Stoffmenge des eingesetzten Propens:[4]
| Name | Masse [in g] | Stoffmenge [in mol] | Ausbeute [in %] |
|---|---|---|---|
| Acrylnitril | 90 | 1,70 | 71,7 |
| Acetonitril | 2 | 0,05 | 2,1 |
| Blausäure | 15 | 0,55 | 23,2 |
Die wirtschaftliche Bedeutung dieses Verfahrens ist sehr hoch. Etwa 90 % des weltweiten Bedarfs an Acrylnitril werden über dieses Verfahren hergestellt. Das Unternehmen INEOS Köln GmbH (ehemalige BP und noch früher Bayer Erdölchemie) betreibt sogar mehrere Anlagen an ihrem Standort in Köln.
Die Weltjahresproduktion im Jahr 1991 betrug 4,4 Millionen Tonnen.[4]
Synthese von Acrolein
Die historische Entwicklung hat bereits aufgezeigt, dass auch Acrolein über das Sohio-Verfahren synthetisiert werden kann. Durch die Entwicklung des Katalysators zur Synthese von Acrylnitril gelang auch zur Acrolein-Herstellung der wirtschaftliche Durchbruch. Hier findet eine partielle Gasphasenoxidation von Propen in Gegenwart geeigneter heterogener Katalysatoren nach folgender Reaktionsgleichung statt:
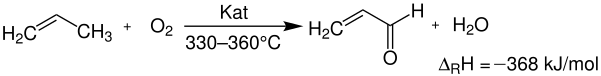
Diese Partialoxidation am heterogenen Katalysator erfolgt mit Luft als Oxidationsmittel bei Temperaturen um 330–390 °C, wobei Rohrbündelreaktoren eingesetzt werden, in denen die stark exotherme Reaktion mit Salzbädern gekühlt wird. Es wird nur eine relativ verdünnte Mischung von Propen mit Luft, meist noch in Gegenwart von Wasserdampf, eingesetzt. Dadurch wird die Bildung explosionsfähiger Gemische vermieden. Die mit modernen Katalysatoren erzielbaren Ausbeuten betragen bis über 80 % bezüglich Propen. Als Nebenprodukte entstehen um die 5 % Acrylsäure, Kohlenstoffmonoxid und Kohlenstoffdioxid, neben nicht umgesetztem Propen.[5]
Einzelnachweise
- Klaus Weissermel, Hans-Jürgen Arpe: Industrielle Organische Chemie, 5. Auflage, Wiley-VCH Verlag GmbH, Weinheim 1998, ISBN 3-527-28856-2, S. 335–336.
- Historischer Überblick über die Entwicklung des Sohio-Verfahrens.
- Wilhelm Keim, Arno Behr, Günter Schmitt: Grundlagen der Industriellen Chemie, 1. Auflage, Otto Salle Verlag GmbH &Co., Frankfurt am Main, Verlag Sauerländer AG, Aarau 1986, ISBN 3-7935-5490-2 (Salle), ISBN 3-7941-2553-3 (Sauerländer), S. 314–315.
- Ulfert Onken, Arno Behr: Chemische Prozeßkunde – Lehrbuch der Technischen Chemie, Band 3, 1. Auflage, Georg Thieme Verlag, Stuttgart 1996, ISBN 3-13-687601-6, S. 315–317.
- Patent DE4023239A1: Patent Verfahren zur katalytischen Gasphasenoxidation von Propen oder Iso-buten zu Acrolein oder Methacrolein – Google Patentsuche, abgerufen am 6. Februar 2017.
Weblinks
- Technische Darstellung, ab Seite 33
- Fluidization engineering, von Daizō Kunii, Octave Levenspiel
- Produktionsschema der INEOS GmbH für ihren Standort Köln