Andrussow-Verfahren
Das Andrussow-Verfahren ist ein Verfahren zur industriellen Herstellung von Blausäure (HCN) aus Methan, Ammoniak und Sauerstoff und ist nach seinem Erfinder, Leonid Andrussow, benannt.[1][2]

Thermodynamik
Die Reaktion eines Gemischs von Ammoniak und Methan an Platin-Netzen unter gleichzeitigem Einblasen von reinem Sauerstoff ist stark exotherm und führt bei hohen Temperaturen zu Cyanwasserstoff.
Die Reaktionsenthalpien berechnen sich aus den Bildungsenthalpien der gasförmigen Reaktionspartner Methan (−74,8 kJ/mol), Ammoniak (−46,1 kJ/mol), Cyanwasserstoff (+135,1 kJ/mol) und Wasser (−241,8 kJ/mol).[3]
Andrussow wies hierbei detailliert nach, dass im ersten Schritt Ammoniak zu einem als „Nitroxyl“ (HNO) bezeichneten Zwischenprodukt oxidiert wird und dieses in Folgeschritten mit Methan unter Abspaltung von Wasserstoff reagiert.[1][2] Wegen geringer Nebenreaktionen (z. B. CO-Bildung) muss ein Sauerstoffüberschuß von 0,3–0,4 mol eingesetzt werden, der umgekehrt aber auch das Reaktionsprodukt Wasserstoff zu Wasser oxidiert.
Die Prozesstemperatur beträgt ca. 1100 °C, anstelle von Sauerstoff wird industriell Luft als Trägergas für Methan und Ammoniak eingesetzt. An der Gesamtreaktion sind zahlreiche vorgelagerte Gleichgewichtsreaktionen mit hohen Aktivierungsenergien beteiligt.[5]
Verfahrensaufbau
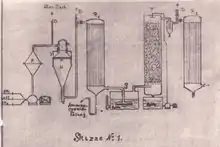
Flüssiges Ammoniak wird zunächst verdampft und anschließend mit dem gasförmigen Methan- und dem Luft-Zulauf gemischt. Das Gemisch wird vorgewärmt und anschließend in den Reaktor geleitet, wo ein Teil des Methans mit Sauerstoff verbrennt und Wärme frei wird, während die Bildung von Blausäure aus Methan und Ammoniak Wärme verbraucht. Die Verweilzeit ist nur sehr kurz. Das heiße Gas aus dem Reaktor wird sofort durch einen Wärmetauscher zum Abkühlen geleitet, in dem Dampf zur Energierückgewinnung erzeugt wird. Das abgekühlte Gas wird dann in eine Säurewäsche gefahren, in der überschüssiger Ammoniak abgetrennt wird. Nach der Ammoniakabtrennung wird die Blausäure durch Wäsche mit kaltem, leicht saurem Wasser abgetrennt. Die im Wasser gelöste Blausäure wird danach durch Rektifikation vom Wasser getrennt.
Katalysator
Der Katalysator besteht aus Netzen aus Platin, welches mit Rhodium dotiert wird. Platin ist dabei die eigentliche aktive Komponente, während Rhodium für Langzeitstabilität sorgt.[6] Der Katalysator erreicht seine optimale Aktivität nur nach einer längeren Aktivierungsperiode unter Reaktionsbedingungen. Während dieser Periode wird die Katalysatoroberfläche durch Verrauhung erhöht.
Reaktionsmechanismus an der Katalysatoroberfläche
Grabow et al.[6] postulierten folgenden Reaktionsmechanismus für die Bildungsreaktion von Blausäure. In ihrem Rechenmodell bedeuten x,y = 0,1, oder 2. X* steht für eine auf dem Katalysator adsorbierte Spezies und * für eine Leerstelle auf der Katalysatoroberfläche:
In diesem Reaktionsschema ist die Zersetzung von CH4 schnell, so dass die aktive Platinoberfläche einen hohen Bedeckungsgrad an Kohlenstoff aufweist. Die Zersetzung von NH3 wird durch Kohlenstoff auf der Oberfläche behindert und ist dadurch langsam. In der Folge wird die Geschwindigkeit der Bildung von N2 und HCN durch die Zersetzung von NH3 limitiert.
Anwendung
Blausäure wird heutzutage großtechnisch zum überwiegenden Teil nach dem Andrussow-Verfahren hergestellt und hauptsächlich als Vorprodukt für die Herstellung von Polyamid 66 (Nylon) und von Polymethylmethacrylat (Plexiglas) eingesetzt. Weitere Verwendung im großtechnischen Maßstab erfolgt zur Herstellung von NaCN, das in großen Mengen für die Cyanidlaugerei bei der Gewinnung von Edelmetallen aus Erzen mit geringen Metallgehalten angewandt wird.
Daneben wird HCN nach dem BMA-Verfahren der Degussa und nach dem Formamid-Spaltverfahren der BASF hergestellt.
Beim Ammonoxidation genannten Verfahren werden anstelle von Methan andere Kohlenwasserstoffe zu Nitrilen umgesetzt.
Literatur
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Hanns Hofmann, Ulfert Onken: Technische Chemie Lehrbuch. 480 Abbildungen, 190 Tabellen. Wiley-VCH Verlag GmbH September 2006, ISBN 3-527-31000-2.
- Rudolf Heinrich Häusler: Über Kinetik und Mechanismus von Ammoniak/Kohlenwasserstoff-Reaktionen an Platin-Tonerde-Katalysatoren. Dissertation.
- Theo Meyer: Über die Herstellung der Methylamine nach katalytischen Methoden. Dissertation.
Einzelnachweise
- Leonid Andrussow: Über die schnell verlaufenden katalytischen Prozesse in strömenden Gasen und die Ammoniak-Oxydation (V). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 60, 1927, S. 2005, doi:10.1002/cber.19270600857.
- L. Andrussow: Über die katalytische Oxydation von Ammoniak-Methan-Gemischen zu Blausäure. In: Angewandte Chemie. 48, 1935, S. 593, doi:10.1002/ange.19350483702.
- Bildungsenthalpien. - Durch Vergleich der Bildungsenthalpien verschiedener gasförmiger Substanzen (Methanol –201, Methylamin –23, Ethan –85, Formaldehyd –109, Ethylen –52, Kohlenmonoxid –111, Cyanwasserstoff +135, Acetylen +227, Stickstoffmonoxid +90, Distickstoffoxid +82 kJ/mol) kann man folgende Werte abschätzen: Methylenimin +100±30 kJ/mol und „Nitroxyl“ HNO +85±3 kJ/mol. – Nach der Benson-Methode lässt sich für Methylenimin +108 kJ/mol berechnen.
- Es ist bekannt, dass Keton- bzw. Olefin-bildende Dehydrierungen mit +21±7 kJ/mol endotherm sind.
- Überführung chemischer Prozesse aus dem Labor- in den Produktionsmaßstab (Memento vom 23. Januar 2014 im Internet Archive) Vorlesung Technische Chemie, Uni Frankfurt (PDF; 1,2 MB).
- Lars C. Grabow, Felix Studt, Frank Abild‐Pedersen, Vivien Petzold, Jesper Kleis, Thomas Bligaard, Jens K. Nørskov: Descriptor-Based Analysis Applied to HCN Synthesis from NH3 and CH4. In: Angewandte Chemie International Edition. Band 50, Nr. 20, 2011, S. 4601–4605, doi:10.1002/anie.201100353.