Chlorcyan
Chlorcyan, auch Cyanchlorid genannt, ist ein chemischer Stoff, der auch als chemischer Kampfstoff verwendet wird. Systematisch handelt es sich bei Chlorcyan um das Nitril der nicht beständigen Chlorameisensäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Chlorcyan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | ClCN | |||||||||||||||
| Kurzbeschreibung |
farbloses, zu Tränen reizendes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 61,47 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
12,9 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Ethanol und Diethylether[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,3 ml·m−3 bzw. 0,8 mg·m−3[3] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
138,0 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Chlorcyan kann durch Reaktion von Kaliumtetracyanozinkat(II) oder Natriumcyanid mit Chlor gewonnen werden.[6]
Eigenschaften
Chlorcyan bildet ein farbloses Gas. Die Verbindung schmilzt bei −6,9 °C und siedet unter Normaldruck bei 12,9 °C.[2] Der Tripelpunkt liegt bei −6,9 °C und 0,449 bar.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,66177, B = 1074,1 und C = −54.458 im Temperaturbereich von 196 bis 286 K.[7] Die mittlere molare Verdampfungsenthalpie liegt in diesem Temperaturbereich bis 32,2 kJ·mol−1.[7] Der kritische Punkt liegt bei einer Temperatur von 175 °C, einem Druck von 59,92 bar und einer Dichte von 0,273 g·cm−3.[2] Die Verbindung ist in Ethanol, Benzin, Ether und chlorierten Lösungsmitteln sehr gut löslich. Bei Kontakt mit Wasser oder Natronlauge wird das Molekül schnell hydrolysiert.[2]
Die Umsetzung mit Ammoniak ergibt Cyanamid.[8]
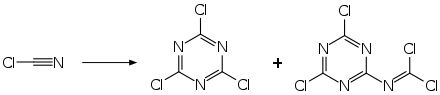
In Gegenwart von Spuren von Salzsäure oder Ammoniumchlorid kann eine heftige und stark exotherme Trimerisierung zum 2,4,6-Trichlor-1,3,5-triazin erfolgen.[9] Als Nebenprodukt entsteht hierbei auch ein Tetrameres als 2,4-Dichlor-6-isocyanodichlor-s-triazin.[10]
Verwendung
Im Ersten Weltkrieg wurde Chlorcyan mit Blausäure gemischt, um die tödliche Wirkung zu erhöhen. Im Gegensatz zur Blausäure wirkt Chlorcyan langsamer, da sich das Cyanidion langsamer freisetzt. Erstmals eingesetzt wurde Chlorcyan 1916 von der Entente. Die wichtigste technische Verwendung ist die kontrollierte Umsetzung zu 2,4,6-Trichlor-1,3,5-triazin, einem Ausgangsstoff für die Herstellung von Wirkstoffen mit herbizider Wirkung.
Chlorcyan oder Bromcyan werden in der organischen Chemie als Reagenzien für Cyanierungen und der Synthese von Heterocyclen verwendet.[11] So kann unter Friedel-Crafts-Bedingungen an Aromaten eine Cyanogruppe direkt eingeführt werden.[10][12][13] An Alkene und Alkine erfolgt unter Säurekatalyse eine direkte Addition.[10][14][15] Mittels beider Verbindungen kann eine C-terminale Schutzgruppe von gentechnisch hergestelltem Insulin-Fusionsprotein entfernt und dadurch korrekt gefaltetes Insulin erhalten werden.[16] Die Umsetzung mit Schwefeltrioxid ergibt das hochreaktive Chlorsulfonylisocyanat.[10][17][18]
Schutzmaßnahmen
Chlorcyan kann mit Basen wie Alkalihydroxiden, Ammoniak, Aminen und Pyridin neutralisiert werden. Gasmaskenfilter werden mit cyclischen Aminen imprägniert, um der „maskenbrechenden“ Wirkung des Chlorcyans entgegenzuwirken.
Siehe auch
Weblinks
- Ansyco: Infrarotspektrum von Chlorcyan
- WHO: Cyanogen Chloride in Drinking-water (PDF; 100 kB)
Einzelnachweise
- Eintrag zu Chlorcyan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Chlorcyan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 506-77-4 bzw. Chlorcyan), abgerufen am 2. November 2015.
- Eintrag zu Cyanogen chloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 630.
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022
- Latscha, H.P.; Kazmaier, U.; Klein, H.A.: Organische Chemie - Chemie-Basiswissen II, 6. Auflage Springer-Verlag 2008, ISBN 978-3-540-77106-7, S. 309.
- P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 87.
- E. Gail, S. Gos, R. Kulzer, J. Lorösch, A. Rubo, M. Sauer, R. Kellens, J. Reddy, N. Steier, W. Hasenpusch: Inorganic Cyano Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a08_159.pub3.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Cyanogen Bromide, abgerufen am 20. Januar 2015.
- E.H. Bartlett, C. Eaborn, D.R.M. Walton: Interaction of aryltrimethylstannanes with cyanogen chloride and bromide. A route to aryl cyanides in J. Organomet. Chem. 46 (1972) 267–269, doi:10.1016/S0022-328X(00)88327-8.
- R.Ch. Paul, R.L. Chauhan, R. Parkash: in J. Sci. Ind. Res. 33 (1974) 31–38.
- J.V. Bodrikov, B.V. Danova: in Zh. Org. Khim 8 (1972) 2462–2467.
- J. Iwai, T. Iwashige, Y. Yuma, N. Nakamune, K. Shinozaki: Studies on Acetylenic Compounds. XXXIX. The Addition Reaction of Cyanogen Bromide to Acetylenic Compounds in Chem. Pharm. Bull. 12 (1964) 1446–1451, doi:10.1248/cpb.12.1446, pdf.
- Beate Meichsner und Uwe Wirth: Insulin - Protein mit langer Geschichte-Der Schlüssel zur Diabetes-Therapie. In: Chemie in unserer Zeit. 2009, 43, 5, S. 340–346, doi:10.1002/ciuz.200900486.
- Roderich Graf: Chlorosulfonyl Isocyanate In: Organic Syntheses. 46, 1966, S. 23, doi:10.15227/orgsyn.046.0023; Coll. Vol. 5, 1973, S. 226 (PDF).
- Patent EP0294613A1 Verfahren und Anlage zur kontinuierlichen Herstellung von Chlorsulfonylisocyanat (Hoechst AG 1988).


