Cyanurchlorid
Cyanurchlorid ist eine reaktive heterocyclische Verbindung und ein halogenierter Heteroaromat. Der namensgebende Grundbaustein ist die von 1,3,5-Triazin (siehe auch Hantzsch-Widman-System) abgeleitete Cyanursäure (1,3,5-Triazin-2,4,6-triol).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
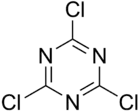 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyanurchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3Cl3N3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit chlorähnlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 184,41 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,92 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
194 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Cyanurchlorid wird in zwei Stufen durch Trimerisierung von Chlorcyan hergestellt. Im ersten Schritt wird Blausäure mit Chlor zu Chlorcyan halogeniert, dieses dann anschließend bei erhöhter Temperatur an einem Kohlekontakt trimerisiert:
2005 wurden weltweit etwa 200.000 Tonnen produziert.[4]
Eigenschaften
Cyanurchlorid ist ein weißes, feinkristallines Pulver. Es reizt die Schleimhäute und hat einen eigenartigen chlor- bzw. säurechloridähnlichen, stechenden Geruch. An trockener Luft, auch bei erhöhter Temperatur, ist es beständig; in Gegenwart von Feuchtigkeitsspuren hydrolysiert es zu Cyanursäure und HCl. Die Geschwindigkeit der Hydrolyse ist stark abhängig von Temperatur und pH-Wert. In auf pH = 7 gepuffertem Eiswasser als Suspension ist es mehrere Stunden stabil, über 10 °C erfolgt mit zunehmender Temperatur eine rasch zunehmende Hydrolyse, bei der die während der Hydrolyse gebildete Salzsäure autokatalytisch wirkt.[5] Analog reagieren auch Alkohole mit Cyanurchlorid in einer stark exothermen Reaktion.[5] Die drei Chlorsubstituenten im Cyanurchlorid unterscheiden sich erheblich in ihrer Reaktivität gegenüber Nucleophilen. Durch geeignete Wahl der Reaktionsbedingungen gelingt es selektiv diese mit drei verschiedenen Nucleophilen Nu1 bis Nu3 zur Reaktion zu bringen:
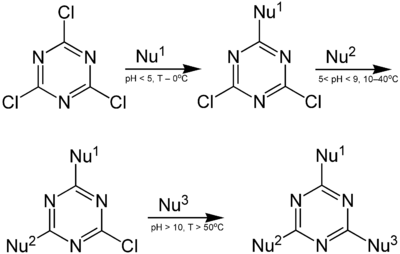
Mit Lösungsmitteln, wie N,N-Dimethylformamid und Dimethylsulfoxid, reagiert es heftig in einer stark exothermen Reaktion.[5]
Verwendung
Cyanurchlorid ist ein wichtiges Zwischenprodukt zur Herstellung von Direktfarbstoffen, Reaktivfarbstoffen für Baumwolle, optischen Aufhellern und Pestiziden. Viele Reaktivfarbstoffe leiten sich von den Dichlortriazinen und insbesondere den Monochlortriazinen ab.
Risikobewertung
Cyanurchlorid wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Cyanurchlorid waren die Besorgnisse bezüglich Umweltexposition und hoher (aggregierter) Tonnage sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT/vPvB-Stoffe und der möglichen Gefahr durch reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2017 statt und wurde von Polen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[6][7]
Einzelnachweise
- Eintrag zu 2,4,6-Trichlor-1,3,5-triazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Cyanurchlorid (PDF) bei Merck, abgerufen am 15. Juni 2017.
- Eintrag zu 2,4,6-trichloro-1,3,5-triazine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Klaus Huthmacher, Dieter Most: Cyanuric Acid and Cyanuric Chloride. In: Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a08_191.
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Cyanurchlorid, CD-ROM Ausgabe 4/2019, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2,4,6-trichloro-1,3,5-triazine, abgerufen am 26. März 2019.

