Schnecken
Schnecken (Gastropoda, griechisch für ‚Bauchfüßer‘), von althochdeutsch snahhan, ‚kriechen‘, sind eine Tierklasse aus dem Stamm der Weichtiere (Mollusca). Es ist die artenreichste der acht rezenten Klassen der Weichtiere und die einzige, die auch landlebende Arten hervorgebracht hat. Die Körpergröße der adulten Schnecken variiert von unter 0,5 mm (Ammonicera rota, Familie Omalogyridae) bis zu über 90 cm (Große Rüsselschnecke Syrinx aruanus).[1]
| Schnecken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Weinbergschnecke (Helix pomatia) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Gastropoda | ||||||||||||
| Cuvier, 1797 |
Merkmale
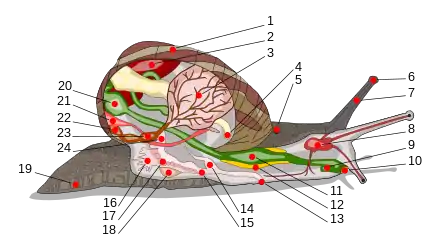
Der weiche Körper einer Schnecke besteht aus Kopf und Fuß (zusammen als Kopffuß bezeichnet) sowie dem rückenliegenden (dorsalen) Eingeweidesack, der von der Gewebeschicht des Mantels geschützt wird. Zellen im Mantel bilden die harte Schale, die zwar im Grundaufbau anderen Weichtierschalen ähnelt, aber im Gegensatz zu diesen meist asymmetrisch zu einer Seite des Körpers gewunden ist. Napfschnecken besitzen eine Schale, die eher an Muschelschalen als an die „typischen“ Schneckenhäuser erinnert, bei Nacktschnecken ist gar kein Gehäuse zu finden. Sie haben ihr Gehäuse im Lauf der Evolution wieder zurückgebildet. Deutlich erkennbar ist aber der Mantelsack am Kopfende, der ursprünglich den Schneckenkörper im Gehäuse umhüllte. Schnegel enthalten im Mantelsack noch ein kleines rudimentäres Kalkplättchen. Auch Glasschnecken und Daudebardien tragen ein deutlich zurückgebildetes Gehäuse, in die sie sich nicht mehr vollständig zurückziehen können.
Die Asymmetrie der Schneckenschale entsteht durch einen entwicklungsbiologischen Vorgang, den man als Torsion bezeichnet, bei dem der Eingeweidesack mit dem Mantel sich nach rechts dreht, so dass die ursprünglich hinten liegende Mantelhöhle mit den Atemorganen nach vorne wandert (sogenannte Vorderkiemerschnecken, Prosobranchia).[2] Zur Platzersparnis winden sich der Eingeweidesack und damit auch Mantel und Schale anschließend zur bekannten Spirale zusammen.
Bei den Hinterkiemerschnecken (Opisthobranchia) führt eine weitere Drehung dazu, dass die Mantelhöhle wieder nach hinten zu liegen kommt. Die Atemorgane (sogenannte Kammkiemen oder Ctenidien) werden dann sekundär zurückgebildet – die Atmung findet über andere Organe statt (zum Beispiel die dorsalen Fiederkiemen der meereslebenden Nacktkiemer, Nudibranchia).
Bei einigen Wasserschneckengruppen entstand nach Rückbildung der Kiemen eine funktionelle Lunge. Diese Entwicklung ermöglichte den Lungenschnecken (Pulmonata) die Besiedelung des trockenen Landes. Die anschließende adaptive Radiation und Anpassung an die vielfältigen Lebensräume des trockenen Landes führte zu einer großen Vielfalt.
Schale oder Gehäuse

Arianta arbustorum
Die als Schneckenhaus bekannte Schale der Schnecken besteht wie bei den übrigen Schalenweichtieren aus Kalk (Calciumcarbonat), unterscheidet sich aber durch ihre asymmetrisch spiralige Windung deutlich von diesen und kann so zum Beispiel von der Schale einer Muschel unterschieden werden. Während die Grundlagen der Schneckenschale (die ersten, als Primordialgewinde bezeichneten 1½ Windungen) bereits im Ei gelegt werden, wächst die übrige Schale bis zur Geschlechtsreife des Tieres. Der Kalk zum Schalenaufbau wird mit der Nahrung aufgenommen, kann aber zum Teil auch durch den Sohlenschleim aus dem Boden gelöst werden oder durch Anraspeln von anderen Weichtierschalen gewonnen werden.
In vielen Schneckengruppen verschließt nach dem Zurückziehen des Körpers ein Schalendeckel (Operculum) die Mündungsöffnung. Bei Strandschnecken kann so die Schale bei Niedrigwasser abgedichtet und die Schnecke gegen Austrocknung geschützt werden. Auch Landdeckelschnecken (Pomatiidae) schützen sich mit einem Operculum gegen Austrocknung. Aber auch zur Zeit der Winterstarre wird die Schneckenhausöffnung bis zum Erwachen im Frühjahr verschlossen. Der Schalendeckel der Landlungenschnecken wie zum Beispiel der Weinbergschnecke, das sogenannte Epiphragma, ist jedoch eine komplett andere Bildung, die im Frühling wieder abgeworfen wird.
Grundsätzlich ist die Windungsrichtung der Schneckenschale (bei den meisten Arten nach rechts) für jede Art spezifisch und wird matroklin (dem Genom des Muttertiers folgend) vererbt. Die Ausnahme bilden Abweichlinge, bei denen die Schale entgegengesetzt gewunden ist. Bei Weinbergschnecken bezeichnet man diese seltenen Exemplare als Schneckenkönige.
Fortbewegung und Orientierung


Der beim aktiven Tier außerhalb des Gehäuses sichtbare Körper der Schnecke ist auf der Bauchseite (ventral) zu einer Sohle abgeflacht, die der Fortbewegung dient und folgerichtig als Fuß bezeichnet wird. Am vorderen Ende läuft der Fuß in den Kopf aus, an dem Fühler der Schnecke zur Orientierung dienen. Während manche Schneckenarten nur zwei Fühler mit Augen an der Basis besitzen, haben die Landlungenschnecken (Stylommatophora) vier Fühler, deren größeres Paar jeweils ein Auge (siehe Weinbergschnecke) trägt. Nur bei diesen sind die Fühler einziehbar.
Während die Fortbewegung bei kleinen Wasserschnecken auf einem Wimperteppich stattfindet, kriechen die größeren und vor allem die landlebenden Arten auf einem Schleimteppich. Hierfür sondern Drüsen am vorderen Kopfende Schleim ab, über den sie mit raupenartigen Bewegungen der Sohle kriechen. Der Schleim besteht aus Polysacchariden und Proteinen und ist strukturviskos.[3] Das bedeutet, dass der Schleim bei geringen Dehnungen elastisch ist und bei höheren Dehnungen flüssig wird, was anhand des Schleimes der Bananenschnecke (Ariolimax columbianus) untersucht worden ist.[4] Es wurde festgestellt, dass der Schleim dehnungsabhängig zwischen einem viskoelastischen Zustand mit einem Schermodul von 100…300 Pa und einer Flüssigkeit mit einer Viskosität von 30…50 poise wechselt. Die verschiedenen Strukturzustände der Schleimschicht wandern wellenförmig unter der Schnecke, indem sie Teile des Fußes vorschiebt. Schnecken können aufgrund dessen sogar an glatten Flächen emporsteigen.
Während die Landlungenschnecken (Stylommatophora) sich mit einer wellenförmigen Sohlenbewegung fortbewegen, nutzen zum Beispiel die Landdeckelschnecken ihren zweigeteilten Fuß für eine Art zweifüßigen Schreitgang.[5] Der Schleim bleibt als Schleimspur zurück, u. a. daher ist die Fortbewegung der Schnecken sehr material- und energieaufwendig.
Der Fuß ist äußerst beweglich und kann zum Graben oder zum Formen von Eipaketen genutzt werden. Manche Wasserschnecken schwimmen mit Hilfe des Fußes, andere (zum Beispiel Schlammschnecken, Lymnaeidae) können an der Unterseite der Wasseroberfläche kriechen. Napfschnecken (zum Beispiel Patellidae) können sich mit großer Kraft am Felsen festsaugen und so fast unbehelligt das Niedrigwasser überdauern, ohne auszutrocknen. Nachts lösen sie sich von ihrem angestammten Ruheplatz und gehen auf Nahrungssuche, um anschließend wieder zurückzukehren. Andere Arten haben sich an eine sessile Lebensweise ähnlich den Muscheln angepasst.
Ernährung
Unter den Schnecken gibt es Pflanzenfresser, Aasfresser und Raubschnecken, wobei Pflanzenfresser oft auch Aas, und Aasfresser oft auch Pflanzen fressen, also Allesfresser sind. Die Nahrungsaufnahme findet mit Hilfe eines spezialisierten Organs statt, das ausschließlich innerhalb der Weichtiere entstanden ist und so im Tierreich einzigartig ist: Eine mit Zähnchen besetzte Raspelzunge (Radula). Ähnlich dem Gebiss anderer Tiere ist die Radula der Schnecken der Ernährung angepasst: Pflanzenfresser besitzen eine Vielzahl gleichförmiger Raspelzähnchen, mit denen Pflanzenmaterial abgeraspelt werden kann. Räuberische Arten besitzen oft weniger, lange, dolchartige Raspelzähnchen, mit denen die Beute festgehalten werden kann und Fleischstücke herausgerissen werden. Bei den meeresbewohnenden, räuberischen Kegelschnecken (Conidae), bilden sich nur wenige harpunenförmige Zähnchen, mit denen der Beute ein Gift injiziert und sie dadurch schnell genug gelähmt wird, um sie am Stück zu verschlingen.
Fortpflanzung

Hermaphroditismus
Im Gegensatz zu den meisten meereslebenden Schnecken sind neben manchen Wasserschnecken die Landlungenschnecken (Stylommatophora) ausschließlich Zwitter (Hermaphroditen): Geschlechts- und Hilfsorgane befinden sich in einem gemeinsamen Genitalapparat. Während viele meereslebende Schnecken sich über frei schwimmende Larven vom Veliger-Typ entwickeln, entwickeln sich die Landschnecken vollständig innerhalb des Eies und schlüpfen als beschalte Jungschnecken.
Einige festsitzende Arten der Wurmschnecken (Vermetidae) vermehren sich mit Hilfe des Wasserstroms. Andere sessile Arten wie die Pantoffelschnecke haben ein besonderes Zwittertum entwickelt: Abhängig vom Alter des Tieres reifen die Geschlechtsorgane, so dass sie in jungen Jahren männliche und in älteren weibliche Funktionen erfüllen. Da sie festsitzen und sich demnach nicht fortbewegen, setzt sich die Nachkommenschaft mit Vorliebe im beweglichen Stadium der Veligerlarve rechts auf ein älteres Tier. Nach Reifung der Larve zur erwachsenen männlichen Schnecke kann sie sich mit der älteren weiblichen Schnecke vermehren und das Spiel kann mit der Nachkommenschaft von vorne beginnen.

Liebesspiel und Paarung am Beispiel der Weinbergschnecke
Die Paarung der Weinbergschnecke findet nach einem mehrstündigen Liebesspiel statt, bei dem sich die Schnecken zunächst mit den Fühlern betasten, und mit den Fußsohlen aneinander hoch kriechen. Im Verlauf des Liebesspiels kann es zur Anwendung eines so genannten Liebespfeils kommen, mit dem ein hormonales Sekret übertragen wird, das die Fortpflanzungschancen der Samenzellen der betreffenden Spenderschnecke verbessert. Nach mehreren meist erfolglosen Begattungsversuchen kommt es schließlich zur eigentlichen Begattung, die bei Weinbergschnecken gleichzeitig und wechselseitig stattfindet, im Gegensatz zu anderen, auch zwittrigen, Schneckenarten, bei denen einer der beiden Partner als Männchen und der andere als Weibchen wirkt. Nach der Begattung bleiben die beiden Schnecken verbunden und tauschen ein Samenpaket, die so genannte Spermatophore, aus. Die darin enthaltenen Samenzellen werden im Genitalapparat der Schnecke in der Befruchtungstasche gespeichert. Später, unabhängig von der Paarung, entstehen in der Gonade (da sie auch die Samenzellen produziert, wird sie als Zwitterdrüse bezeichnet) Eizellen, die mit den gespeicherten Samenzellen befruchtet werden. Auf ihrer Wanderung durch den Eisamenleiter zum Genitalausgang entwickeln sich die befruchteten Eizellen zu Eiern, die bei der Weinbergschnecke auch über eine schützende Eierschale verfügen und in einer eigens gegrabenen Legehöhle abgelegt werden.

Verbreitung und Artenzahl
Über die genaue Artenzahl der Gastropoden liegen lediglich Schätzungen vor, welche teilweise weit voneinander abweichen. Während die meisten Schätzungen von etwa 100.000 Schneckenarten ausgehen,[6][7] finden sich in manchen Publikationen Angaben, die von höchstens 43.000 Schneckenarten ausgehen,[8] andere Quellen nennen hingegen Zahlen von bis zu 240.000 allein für die marinen Arten.[9] Unbestritten ist allerdings, dass die Schnecken den überwiegenden Anteil der Weichtiere ausmachen. Der Anteil an Land lebender Schnecken wird auf ca. 25.000 Arten geschätzt.[10] In Deutschland leben ca. 260 Arten Landlungenschnecken.
Der Grund für die stark divergierenden Angaben liegt offensichtlich im Fehlen einer kritischen Gesamtrevision der Schnecken-Taxonomie. In jüngerer Zeit sind infolge der Anwendung molekularer Analysemethoden bisher getrennte Arten zusammengefasst, andere auch in mehrere aufgetrennt worden. Einige bislang weitgehend unbearbeitete Lebensräume – z. B. die Tiefsee oder kleine Inselgruppen im Pazifik – beherbergen außerdem zahlreiche noch unbekannte Arten, die einer wissenschaftlichen Beschreibung harren.
Paläontologie

Älteste fossile Schnecken stammen dem frühen Kambrium vor ca. 530 Millionen Jahren, wobei bei den allerältesten Stücken nicht endgültig geklärt ist, ob sie wirklich zur Klasse der Schnecken zu zählen sind. Im Erdaltertum verbreitet waren Arten der Gattung Bellerophon. Echte Süßwasser- und Land-Lungenschnecken sind mit Sicherheit erst ab dem Erdmittelalter (Jurazeit) bekannt,[11] doch dürften in früheren Erdperioden (Trias, spätes Paläozoikum) durchaus auch schon Schnecken auf dem Festland oder im Süßwasser gelebt haben.
Systematik
Bei der äußeren Systematik sind die nächstverwandten Klassen innerhalb der Weichtiere noch nicht eindeutig identifiziert. Die anderen noch lebenden sieben Klassen der Weichtiere sind Muscheln, Kahnfüßer, Furchenfüßer, Schildfüßer, Käferschnecken, Einschaler und Kopffüßer.
Die früher teilweise vermutete nahe Verwandtschaft zu den Einschalern (Monoplacophora) gilt heute als überholt. Diskutiert wird die nahe Verwandtschaft im Sinne eines Schwestergruppenverhältnisses entweder zu den Kahnfüßern (Scaphopoda) oder zu den Kopffüßern (Cephalopoda). Als systematisches und primäres Kennzeichen der Schnecken gelten (neben molekularen Markern) die Ausbildung einer Streptoneurie durch Torsion, die Ausbildung einer rein vorderen Mantelhöhle, die Ausbildung von nur einem Paar Schalenmuskeln und nur einer (der rechten) Gonade, ferner die Ausbildung von einem Paar Kopftentakel.
Die innere Systematik der Schnecken wird in vielen Zügen noch immer kontrovers diskutiert. Einigkeit besteht aber darin, dass das traditionelle System als veraltet gilt, da es nicht auf monophyletischen Einheiten beruht (siehe die zweite Liste weiter unten). Die traditionell verwendeten Hauptgruppen – Prosobranchia (Vorderkiemerschnecken), Opisthobranchia (Hinterkiemerschnecken) und Pulmonaten (Lungenschnecken) – beschreiben Organisationsniveaus und werden nur noch als deskriptive Einheiten auf informeller Basis verwendet. Veraltet ist freilich auch die Unterteilung, etwa durch Pedanios Dioskurides, in Landschnecken, Meerschnecken und Feldschnecken.
Moderne Systematik
Neuere morphologische und genetische Merkmale bringen zunehmend neue Erkenntnisse bezüglich der Verwandtschaftsverhältnisse zwischen den einzelnen Schneckengruppen. Eine erste phylogenetische Analyse wurde von Ponder & Lindberg (1997) veröffentlicht. In diesem System wurden möglichst nur strikt monophyletische Gruppen beibehalten, soweit sie den Autoren als solche erkennbar waren.
Auch diese Analyse gilt heute allerdings infolge jüngerer Untersuchungen[12][13][14] als stellenweise überholt. So werden inzwischen die „Basommatophora“ nur noch als informelle Gruppe betrachtet und nicht mehr als monophyletisches Taxon, sie umfassen nach Bouchet & Rocroi (2005) auch nicht mehr die Glacidorboidea. Diese und viele weitere aktuelle Befunde werden hier noch nicht dargestellt, weil die Schneckensystematik noch im Fluss ist.
Klassifikation der Schnecken nach Ponder & Lindberg (1997)
Schnecken (Gastropoda) (Cuvier, 1797)


.jpg.webp)


- Incertæ sedis
- Ordnung Bellerophontida (fossil)
- Ordnung Mimospirina (fossil)
- Unterklasse Eogastropoda (Ponder & Lindberg, 1996) (ehemals Prosobranchia)
- Ordnung Euomphalida de Koninck 1881 (fossil)
- Überfamilie Macluritoidea
- Überfamilie Euomphaloidea
- Ordnung Patellogastropoda Lindberg, 1986 (echte Napfschnecken)
- Unterordnung Patellina Van Ihering, 1876
- Überfamilie Patelloidea Rafinesque, 1815 (Napfschnecken)
- Unterordnung Nacellina Lindberg, 1988
- Überfamilie Acmaeoidea Carpenter, 1857
- Überfamilie Nacelloidea Thiele, 1891
- Unterordnung Lepetopsina McLean, 1990
- Überfamilie Lepetopsoidea McLean, 1990
- Unterordnung Patellina Van Ihering, 1876
- Ordnung Euomphalida de Koninck 1881 (fossil)
- Unterklasse Orthogastropoda Ponder & Lindberg, 1996 (ehemals Prosobranchia, Opisthobranchia & Pulmonata)
- Incertæ sedis
- Ordnung Murchisoniina Cox & Knight, 1960 (fossil)
- Überfamilie Murchisonioidea Koken, 1889
- Überfamilie Loxonematoidea Koken, 1889
- Überfamilie Lophospiroidea Wenz, 1938
- Überfamilie Straparollinoidea Wagner, 2002
- Ordnung Murchisoniina Cox & Knight, 1960 (fossil)
- Grade Subulitoidea Lindström, 1884
- Überordnung Cocculiniformia Haszprunar, 1987
- Überordnung ‘Hot Vent Taxa' Ponder & Lindberg, 1997.
- Ordnung Neomphaloida Sitnikova & Starobogatov, 1983
- Überfamilie Neomphaloidea McLean, 1981 (Hydrothermal-Schnecken)
- Überfamilie Peltospiroidea McLean, 1989
- Ordnung Neomphaloida Sitnikova & Starobogatov, 1983
- Überordnung Vetigastropoda Salvini-Plawen, 1989
- Überfamilie Fissurelloidea Flemming, 1822
- Überfamilie Haliotoidea Rafinesque, 1815 (Seeohren)
- Überfamilie Lepetodriloidea McLean, 1988 (Hydrothermal-Schnecken)
- Überfamilie Pleurotomarioidea Swainson, 1840 (Schlitzbandschnecken)
- Überfamilie Seguenzioidea Verrill, 1884
- Überfamilie Trochoidea Rafinesque, 1815 (Kreiselschnecken)
- Überordnung Neritimorpha Koken, 1896 (= Neritopsina)
- Unsichere Stellung (alle Gruppen nur fossil)
- Überfamilie Nerrhenoidea Bandel & Heidelberger, 2001
- Überfamilie Oriostomatoidea Koken, 1896
- Überfamilie Palaeotrochoidea Knight, 1956
- Überfamilie Platyceratoidea Hall, 1879
- Ordnung Cyrtoneritomorpha (fossil)
- Ordnung Cycloneritimorpha Frýda, 1998
- Überfamilie Helicinoidea Férussac, 1822
- Überfamilie Hydrocenoidea Troschel, 1857
- Überfamilie Neritoidea Lamarck, 1809
- Überfamilie Neritopsoidea Gray, 1847
- Überfamilie Symmetrocapuloidea Wenz, 1938
- Unsichere Stellung (alle Gruppen nur fossil)
- Überordnung Caenogastropoda Cox, 1960
- Ordnung Architaenioglossa Haller, 1890
- Überfamilie Ampullarioidea J. E. Gray, 1824 (unter anderem Apfelschnecken)
- Überfamilie Cyclophoroidea J. E. Gray, 1847 (operculate Landschnecken)
- Ordnung Sorbeoconcha Ponder & Lindberg, 1997
- Unterordnung Discopoda P. Fischer, 1884
- Überfamilie Campaniloidea Douvillé, 1904
- Überfamilie Cerithioidea Férussac, 1822
- Unterordnung Hypsogastropoda Ponder & Lindberg, 1997
- Teilordnung Littorinimorpha Golikov & Starobogatov, 1975
- Überfamilie Calyptraeoidea Lamarck, 1809 (unter anderem Calyptraeidae)
- Überfamilie Capuloidea J. Fleming, 1822
- Überfamilie Pterotracheoidea Rafinesque, 1814 (ehemals Heteropoda und Carinarioidea)
- Überfamilie Cingulopsoidea Fretter & Patil, 1958
- Überfamilie Cypraeoidea Rafinesque, 1815 (unter anderem Kaurischnecken und Eischnecken)
- Überfamilie Ficoidea Meek, 1864 (Ficidae)
- Überfamilie Laubierinoidea Warén & Bouchet, 1990
- Überfamilie Littorinoidea (Children), 1834 (Strandschnecken, Grübchenschnecken, Landdeckelschnecken)
- Überfamilie Naticoidea Forbes, 1838 (Mondschnecken)
- Überfamilie Rissooidea J. E. Gray, 1847
- Überfamilie Stromboidea Rafinesque, 1815 (unter anderem Strombidae)
- Überfamilie Cassoidea Latreille, 1825 (syn. Tonnoidea Suter, 1913; unter anderem Cassidae, Ranellidae (Cymatiidae) und Personidae)
- Überfamilie Trivioidea Troschel, 1863 (Triviidae)
- Überfamilie Vanikoroidea J. E. Gray, 1840
- Überfamilie Velutinoidea J. E. Gray, 1840
- Überfamilie Wurmschnecken (Vermetoidea) Rafinesque, 1815
- Überfamilie Xenophoroidea Troschel, 1852 (Träger-Schnecken)
- Teilordnung Ptenoglossa J. E. Gray, 1853
- Überfamilie Eulimoidea Philippi, 1853
- Überfamilie Janthinoidea Lamarck, 1812
- Überfamilie Triphoroidea J. E. Gray, 1847
- Teilordnung Neuschnecken (Neogastropoda) Thiele, 1929
- Überfamilie Buccinoidea (zum Beispiel Buccinidae, Columbellidae)
- Überfamilie Cancellarioidea Forbes & Hanley, 1851
- Überfamilie Conoidea Rafinesque, 1815 (Kegelschnecken)
- Überfamilie Muricoidea Rafinesque, 1815 (unter anderem Olivenschnecken)
- Teilordnung Littorinimorpha Golikov & Starobogatov, 1975
- Unterordnung Discopoda P. Fischer, 1884
- Ordnung Architaenioglossa Haller, 1890
- Überordnung Heterobranchia J. E. Gray, 1840
- Ordnung Heterostropha P. Fischer, 1885
- Überfamilie Architectonicoidea J. E. Gray, 1840
- Überfamilie Nerineoidea Zittel, 1873 (fossil)
- Überfamilie Omalogyroidea G.O. Sars, 1878
- Überfamilie Pyramidelloidea J. E. Gray, 1840
- Überfamilie Rissoelloidea J. E. Gray, 1850
- Überfamilie Valvatoidea J. E. Gray, 1840
- Überfamilie Architectonicoidea J. E. Gray, 1840
- Ordnung Hinterkiemerschnecken (Opisthobranchia) Milne-Edwards, 1848
- Unterordnung Cephalaspidea P. Fischer, 1883
- Überfamilie Acteonoidea D’Orbigny, 1835
- Überfamilie Bulloidea Lamarck, 1801
- Überfamilie Cylindrobulloidea Thiele, 1931 (has to be included in the Sacoglossa)
- Überfamilie Diaphanoidea Odhner, 1914
- Überfamilie Haminoeoidea Pilsbry, 1895
- Überfamilie Philinoidea J. E. Gray, 1850
- Überfamilie Ringiculoidea Philippi, 1853
- Unterordnung Sacoglossa Von Ihering, 1876
- Überfamilie Oxynooidea H. & A. Adams, 1854
- Unterordnung Seehasen (Anaspidea) P. Fischer, 1883
- Überfamilie Akeroidea Pilsbry, 1893
- Überfamilie Aplysioidea Lamarck, 1809
- Unterordnung Notaspidea P. Fischer, 1883
- Überfamilie Tylodinoidea J. E. Gray, 1847
- Überfamilie Pleurobranchoidea Férussac, 1822
- Unterordnung Thecosomata Blainville, 1824
- Teilordnung Euthecosomata Meisenheimer, 1905
- Überfamilie Limacinoidea Gray, 1840
- Überfamilie Cavolinioidea Gray, 1850
- Teilordnung Pseudothecosomata Meisenheimer, 1905
- Überfamilie Peraclidoidea Gray, 1840
- Überfamilie Cymbulioidea Gray, 1840
- Teilordnung Euthecosomata Meisenheimer, 1905
- Unterordnung Gymnosomata Blainville, 1824
- Familie Clionidae Rafinesque, 1815
- Familie Cliopsidae Costa, 1873
- Familie Hydromylidae Pruvot-Fol, 1942
- Familie Laginiopsidae Pruvot-Fol, 1922
- Familie Notobranchaeidae Pelseneer, 1886
- Familie Pneumodermatidae Latreille, 1825
- Familie Thliptodontidae Kwietniewski, 1910
- Unterordnung Nacktkiemer (Nudibranchia) Blainville, 1814
- Teilordnung Anthobranchia Férussac, 1819
- Überfamilie Doridoidea Rafinesque, 1815
- Überfamilie Doridoxoidea Bergh, 1900
- Überfamilie Onchidoridoidea Alder & Hancock, 1845
- Überfamilie Polyceroidea Alder & Hancock, 1845
- Teilordnung Cladobranchia Willan & Morton, 1984
- Überfamilie Dendronotoidea Allman, 1845
- Überfamilie Arminoidea Rafinesque, 1814
- Überfamilie Metarminoidea Odhner in Franc, 1968
- Überfamilie Aeolidioidea J. E. Gray, 1827
- Teilordnung Anthobranchia Férussac, 1819
- Unterordnung Cephalaspidea P. Fischer, 1883
- Ordnung Lungenschnecken (Pulmonata) Cuvier in Blainville, 1814
- Unterordnung Systellommatophora Pilsbry, 1948
- Überfamilie Onchidioidea Rafinesque, 1815
- Überfamilie Otinoidea H. & A. Adams, 1855
- Überfamilie Rathouisioidea Sarasin, 1889
- Unterordnung Wasserlungenschnecken (Basommatophora) Keferstein in Bronn, 1864
- Überfamilie Acroloxoidea Thiele, 1931
- Überfamilie Amphiboloidea J. E. Gray, 1840
- Überfamilie Chilinoidea H. & A. Adams, 1855
- Überfamilie Glacidorboidea Ponder, 1986
- Überfamilie Lymnaeoidea Rafinesque, 1815
- Überfamilie Planorboidea Rafinesque, 1815
- Überfamilie Siphonarioidea J. E. Gray, 1840
- Unterordnung Eupulmonata Haszprunar & Huber, 1990
- Teilordnung Acteophila Dall, 1885 (= früher Archaeopulmonata)
- Überfamilie Melampoidea Stimpson, 1851
- Teilordnung Trimusculiformes Minichev & Starobogatov, 1975
- Überfamilie Trimusculoidea Zilch, 1959
- Teilordnung Landlungenschnecken (Stylommatophora) A. Schmidt, 1856
- Unterteilordnung Orthurethra
- Überfamilie Achatinelloidea Gulick, 1873
- Überfamilie Cochlicopoidea Pilsbry, 1900
- Überfamilie Partuloidea Pilsbry, 1900
- Überfamilie Pupilloidea Turton, 1831
- Unterteilordnung Sigmurethra
- Überfamilie Acavoidea Pilsbry, 1895
- Überfamilie Achatinoidea Swainson, 1840
- Überfamilie Aillyoidea Baker, 1960
- Überfamilie Arionoidea J. E. Gray in Turnton, 1840
- Überfamilie Buliminoidea Clessin, 1879
- Überfamilie Camaenoidea Pilsbry, 1895
- Überfamilie Clausilioidea Mörch, 1864
- Überfamilie Dyakioidea Gude & Woodward, 1921
- Überfamilie Gastrodontoidea Tryon, 1866
- Überfamilie Helicoidea Rafinesque, 1815
- Überfamilie Helicarionoidea Bourguignat, 1877
- Überfamilie Limacoidea Rafinesque, 1815
- Überfamilie Oleacinoidea H. & A. Adams, 1855
- Überfamilie Orthalicoidea Albers-Martens, 1860
- Überfamilie Plectopylidoidea Moellendorf, 1900
- Überfamilie Polygyroidea Pilsbry, 1894
- Überfamilie Punctoidea Morse, 1864
- Überfamilie Rhytidoidea Pilsbry, 1893
- Überfamilie Sagdoidea Pilsbry, 1895
- Überfamilie Staffordioidea Thiele, 1931
- Überfamilie Streptaxoidea J. E. Gray, 1806
- Überfamilie Zonitoidea Mörch, 1864
- ? Überfamilie Athoracophoroidea P. Fischer, 1883 (= Tracheopulmonata)
- ? Überfamilie Succineoidea Beck, 1837 (= Heterurethra)
- Unterteilordnung Orthurethra
- Teilordnung Acteophila Dall, 1885 (= früher Archaeopulmonata)
- Unterordnung Systellommatophora Pilsbry, 1948
- Ordnung Heterostropha P. Fischer, 1885
- Incertæ sedis
Traditionelle Systematik


Das traditionelle (und veraltete) System unterteilt die Schnecken hingegen in die drei Hauptgruppen Vorderkiemerschnecken (Prosobranchia), Lungenschnecken (Pulmonata) und Hinterkiemerschnecken (Opisthobranchia) mit diversen Untergruppen. Diese Untergliederung wird vielfach noch verwendet und soll daher hier kurz dargestellt werden. Einige Beispielarten sind ebenfalls angeführt.
Modifizierte traditionelle Systematik
- Vorderkiemerschnecken (Prosobranchia)
- Archaeogastropoda – Altschnecken
- Haliotis sp. – Seeohren
- Mikadotrochus sp. – Millionärsschnecke
- Patella sp. – Napfschnecke
- Pleurotomaria sp. – Schlitzbandschnecke
- Theodoxus fluviatilis – Flussnixenschnecke
- Mesogastropoda – Mittelschnecken
- Ampullariidae – Apfelschnecken
- Viviparus sp. – Sumpfdeckelschnecke
- Littorina sp. – Strandschnecke
- Turritella communis – Turmschnecke
- Hydrobia ulvae – Wattschnecke
- Crepidula fornicata – Pantoffelschnecke
- Cypraea sp. – Kaurischnecken
- Neogastropoda – Neuschnecken
- Murex brandaris – Herkuleskeule
- Nucella lapillus – Nordische Purpurschnecke
- Buccinum undatum – Wellhornschnecke
- Conus sp. – Kegelschnecken
- Madagaskaris spec. – Riesenschnecke von Madagaskar
- Allogastropoda
- Architectonica spec. – Sonnenuhrschnecke
- Odostomia sp. – Pyramidenschnecke
- Omalogyra sp. (kleinstes Gehäuse 0,1 mm)
- Archaeogastropoda – Altschnecken
- Lungenschnecken (Pulmonata)
- Archaeopulmonata – Altlungenschnecken
- Ovatella myosotis – Mausohrschnecke
- Carychium spec. – Zwergschnecke
- Onchidella celtica
- Siphonaria pectinata
- Trimusculus reticulatus
- Basommatophora – Wasserlungenschnecken
- Acroloxus lacustris – Teichnapfschnecke
- Lymnaea stagnalis – Spitzschlammschnecke
- Galba truncatula – Kleine Schlammschnecke
- Planorbarius corneus – Posthornschnecke
- Ancylus fluviatilis – Flussmützenschnecke
- Stylommatophora – Landlungenschnecken
- Succinea putris – Bernsteinschnecke
- Achatina fulica – Große Achatschnecke
- Arion ater – Schwarze Wegschnecke
- Limax cinereo-niger – Schwarzer Schnegel
- Limax maximus – Großer Schnegel oder Tigerschnegel
- Limax sarnensis – Sarner Schnegel
- Discus rotundatus (O. F. Müller)
- Discus ruderatus
- Helicella itala – Große Heideschnecke
- Cepaea spec. – Bänderschnecken
- Helix pomatia – Weinbergschnecke
- Arianta arbustorum – Gefleckte Schnirkelschnecke
- Ariolimax dolichophallus – Bananenschnecke
- Archaeopulmonata – Altlungenschnecken
- Hinterkiemerschnecken (Opisthobranchia)
- Cephalaspidea (Bullomorpha) – Kopfschildschnecken
- Acteon tornatilis
- Retusa obtusa
- Acochlidiacea
- Microhedyle lactaea
- Saccoglossa – Schlundsackschnecken
- Berthelinia sp.
- Midorigai spec.
- Thecosomata – Seeschmetterlinge
- Criseis acicula – Seeschmetterling
- Gymnosomata – Ruderschnecken
- Clione limacina
- Anaspidea
- Aplysia sp. – Seehase
- Umbraculomorpha – Schirmschnecken
- Umbraculum sinicum
- Pleurobranchmorpha – Seitenkiemer
- Pleurobranchus californicus
- Nudibranchia – Nacktkiemer
- Doridoidei – Sternschnecken
- Polycera faeroensis – Färöische Hörnchenschnecke
- Archidoris pseudoargus – Meerzitrone
- Dendronotoidei – Bäumchenschnecken
- Dendronotus frondosus – Zottige Bäumchenschnecke
- Arminodei – Furchenschnecken
- Aelidoidei – Fadenschnecken
- Facelina auriculata – Fadenschnecke
- Drummonds Fadenschnecke – Facelina bostoniensis
- Flabellina affinis – Violette Fadenschnecke
- Aerola kobaldis – Blaue Flugschnecke
- Tobacco blanca – Weiße Tabakschnecke
- Cephalaspidea (Bullomorpha) – Kopfschildschnecken
Schnecken als Überträger von Parasiten

Schnecken sind Nahrungsgrundlage zahlreicher Tiere und Zwischenwirte vieler Parasiten und Krankheitserreger. Die Arten der Gattungen Biomphalaria und Bulinus sind die Zwischenwirte für verschiedene Arten des Pärchenegels, die die Schistosomiasis (früher auch Bilharziose genannt) beim Menschen verursachen. Diese Parasiten leben gewöhnlich in tropischen Ländern. Die Bernsteinschnecke ist Zwischenwirt für den Saugwurm Leucochloridium paradoxum, der Vögel befällt. Andere Arten verbreiten Pflanzenpathogene, wie zum Beispiel viele Nacktschnecken. Kommt es durch das Wirken des Menschen zu einem Ungleichgewicht zwischen Schnecken und deren natürlichen Fressfeinden, kann Massenvermehrung zu negativen Effekten führen, die durch Monokulturen in der Landwirtschaft verstärkt werden. Auch Neozoen sind problematisch. Es sind vorwiegend Nacktschnecken, wie zum Beispiel die in den 1970er Jahren aus Westeuropa eingeschleppte Spanische Wegschnecke (Arion vulgaris), die viele Pflanzen bis zum Kahlfraß schädigen können, wohingegen Gehäuseschnecken in vielen Fällen Welkfutter den Frischpflanzen vorziehen.
Schnecken als Nahrungsmittel


Einige Schneckenarten, vor allem Weinbergschnecken, gelten seit der Antike als Delikatesse. Sie werden vornehmlich in Südeuropa (Frankreich, Italien, Spanien und Portugal) geschätzt, es gibt aber auch tradierte süddeutsche Schneckenrezepte (zum Beispiel die Badische Schneckensuppe). Auch Meeresschnecken landen auf der Speisekarte, beispielsweise Seeohren oder Napfschnecken als traditionelles Gericht „Lapas“ auf Madeira.
Inzwischen wurde die Weinbergschnecke in die Liste der geschützten Tierarten nach dem Washingtoner Artenschutzübereinkommen[15] aufgenommen, da ihr Bestand in einigen Gegenden stark abgenommen hatte oder sie nicht mehr vorhanden waren. Die Tiere werden in Schneckenfarmen aufgezogen und im Lebensmittelhandel verkauft.
Verwandte Themen
- Schneckenkönig, Schnecken mit umgekehrter Schraubrichtung ihres Hauses
- Jüngst wurde auf Hawaii eine Schmetterlingsart, Hyposmocoma molluscivora entdeckt, deren Raupen auf die Jagd auf Schnecken spezialisiert sind.
Literatur
- R. T. Abbott: Compendium of Landshells. A color guide to more than 2,000 of the World’s Terrestrial Shells. American Malacologists, Melbourne FL / Burlington MA 1989, ISBN 0-915826-23-2.
- R. T. Abbott, S. P. Dance: Compendium of Seashells. A full-color guide to more than 4,200 of the world’s marine shells. Odyssey Publishing, El Cajon CA 1998, ISBN 0-9661720-0-0.
- Ludger Buse, Dora Godan: Nacktschnecken – Auf leisen Sohlen durch die Welt. Edition Liberacion, Georgsmarienhütte 1999, ISBN 3-923792-44-1.
- R. Fechter, G. Falkner: Steinbachs Naturführer – Weichtiere. Mosaik-Verlag, München 1989.
- M. P. Kerney, R. A. D. Cameron, J. H. Jungbluth: Die Landschnecken Nord- und Mitteleuropas. Verlag Paul Parey, Hamburg/ Berlin 1983, ISBN 3-490-17918-8.
- B. Parkinson, J. Hemmen, K. Groh: Tropical Landshells of the World. Verlag Christa Hemmen, Wiesbaden 1987, ISBN 3-925919-00-7.
- W. F. Ponder, D. R. Lindberg: Towards a phylogeny of gastropod molluscs: an analysis using morphological characters. In: Zoological Journal of the Linnean Society. 119, 1997, S. 83–265.
- A. Robin: Encyclopedia of Marine Gastropods. Verlag ConchBooks, Hackenheim 2008, ISBN 978-3-939767-09-1.
- S. Sailer: Pflanzen, die Schnecken mögen oder meiden sowie Abwehrtipps gegen Schnecken. Verlag Susanne Sailer, Sulz a. N. 2004, ISBN 3-9809229-0-1.
- V. Wiese: Die Landschnecken Deutschlands. Finden – Erkennen – Bestimmen. 2. Auflage. Quelle & Meyer Verlag, Wiebelsheim 2016, ISBN 978-3-494-01686-3.
- Otto Grunert: Die Scaphopoden und Gastropoden der deutschen Trias. A. Vollrath, Erlangen 1898, archive.org.
- Emil Adolf Roßmäßler: Ungeahnte Schönheit bei verachteten Thieren. In: Die Gartenlaube. Heft 46, 1853, S. 505–507 (Volltext [Wikisource]).
Weblinks
Einzelnachweise
- Große Rüsselschnecke (Syrinx aruanus). Abgerufen am 1. Januar 2019.
- R. Kilias: 12. Stamm Mollusca. In: Lehrbuch der Speziellen Zoologie. 3. Auflage. Band I, 3. Teil, G. Fischer, Jena 1982, S. 63 ff.
- Thomas de Padova: Warum schleimen Schnecken?. In: Der Tagesspiegel, 10. Juli 2007, abgerufen am 18. Juli 2017.
- M. W. Denny, J. M. Gosline: The Physical Properties of the Pedal Mucus of the Terrestrial Slug, Ariolimax columbianus. In: dennylab.stanford.edu, 8. Mai 1980, abgerufen am 20. April 2020 (PDF, englisch).
- weichtiere.at
- R. Kilias: 10. Stamm Mollusca. In: Lehrbuch der Speziellen Zoologie. 5. Auflage. Band I, 3. Teil, G. Fischer, Jena 1993, S. 9–245.
- Wilfried Westheide, Reinhard Rieger: Spezielle Zoologie. Teil 1, 2. Auflage. Elsevier, 2006.
- M. Mizzaro-Wimmer, L. Salvini-Plawen: Praktische Malakologie. Springer, Wien 2001.
- W. Appeltans, P. Bouchet, G. A. Boxshall, K. Fauchald, D. P. Gordon, B. W. Hoeksema, G. C. B. Poore, R. W. M. van Soest, S. Stöhr, T. C. Walter, M. J. Costello (Hrsg.): World Register of Marine Species. 2011. Accessed at marinespecies.org vom 7. März 2011.
- G. Falkner, R. Fechter: Weichtiere. Mosaik, München 1990.
- Noel Morris, John Taylor: Global events and biotic interactions as controls on the evolution of gastropods. In: Stephen J. Culver, Peter F. Rawson: Biotic response to global change: The last 145 million years. Cambridge University Press, 2000.
- Winston Ponder, David Lindberg: Towards a phylogeny of gastropod molluscs; an analysis using morphological characters. In: Zoological Journal of the Linnean Society. 119, London 1997, S. 83–265. ISSN 0024-4082
- Paul Jeffery: Suprageneric classification of class Gastropoda. The Natural History Museum, London, 2001.
- Philippe Bouchet, Jean-Pierre Rocroi: Part 2. Working classification of the Gastropoda. In: Malacologia. 47, Ann Arbor 2005, S. 239–283 ISSN 0076-2997
- Liste der nach dem Washingtoner Artenschützübereinkommen geschützten Tiere auf einer Seite von „Haus der Natur“, abgerufen am 15. September 2012.




