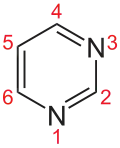
Pyrimidine
Die Pyrimidine bilden in der Chemie eine Stoffgruppe von organischen Verbindungen, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie leiten sich von der Stammverbindung Pyrimidin ab.
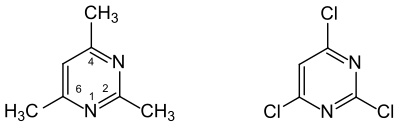
Wenn bei der Substitution das aromatische π-Elektronensystem erhalten bleibt, liegen Pyrimidinderivate im engeren Sinn vor, wie beispielsweise bei 2,4,6-Trimethylpyrimidin oder 2,4,6-Trichlorpyrimidin.
Vorkommen und Bedeutung
Substituierte Pyrimidinringe sind Teilstrukturen wichtiger Naturstoffe, wie beispielsweise des Vitamins B1 (Thiamin) und der in Milchprodukten vorkommenden Orotsäure, die gleichzeitig eine Zwischenstufe der Pyrimidin-de-novo-Synthese ist. Von der Barbitursäure leiten sich eine Reihe wichtiger Pharmazeutika ab, die sogenannten Barbiturate, die am fünften Kohlenstoffatom substituiert sind und als Schlafmittel Verwendung finden. Pyrimidin-Derivate spielen auch als Diuretika, Antibiotika, Antimetabolika und in der antiviralen Therapie eine Rolle.
 Vitamin B1 (Thiamin)
Vitamin B1 (Thiamin)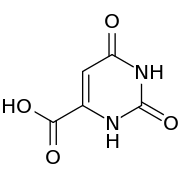 Orotsäure
Orotsäure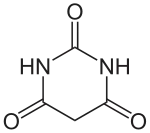 Barbitursäure
Barbitursäure
Als wichtigste Derivate des Pyrimidins müssen jedoch die Bausteine der Nukleinsäuren jeder Zelle betrachtet werden.
Biochemie
Pyrimidinbasen
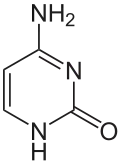
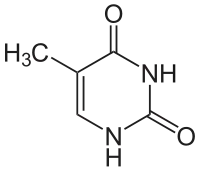
50 % der sogenannten "Basen" jedes DNA-Moleküls enthalten das Pyrimidin-Gerüst. Beim hydrolytischen Abbau der polymeren DNA wurden Uracil, Thymin (= Methyluracil) und Cytosin isoliert.
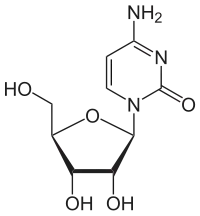
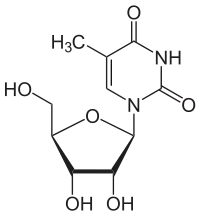
Sind Cytosin und Uracil in Position 1 mit dem ersten C-Atom (C-1) der Ribose verknüpft, ergeben sich die Nukleoside Cytidin und Uridin. Durch Veresterung der Ribose mit Phosphat entstehen die Nukleotide CMP und UMP, die Bausteine der RNA sind. Enthält das Nukleotid Cytosin oder Thymin und Desoxyribose, handelt es sich um die Bausteine der DNA, Desoxy-Cytidin- (dCMP) und Desoxy-Thymidinmonophosphat (dTMP).
| Nukleobase | Nukleosid | Desoxynukleosid |
|---|---|---|
 |
 |
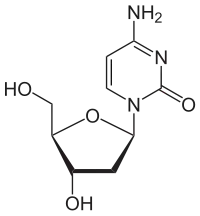 |
| Cytosin | Cytidin, C | Desoxycytidin, dC |
 |
 |
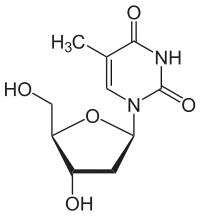 |
| Thymin | Ribothymidin T[1] (= 5-Methyluridin) | Desoxythymidin, dT |
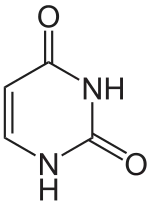 |
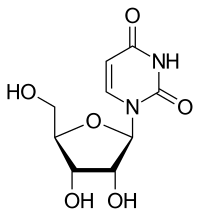 |
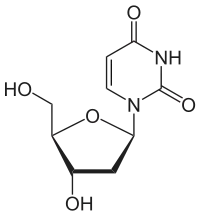 |
| Uracil | Uridin, U | Desoxyuridin, dU |
In der Biologie und Biochemie werden die Heterocyclen Uracil und Thymin als „Basen“ („Nukleinbasen“) bezeichnet. Allerdings entspricht dies nicht der sonst üblichen Definition einer Base in der Chemie. So besitzt Uracil einen pKs-Wert von 9,45 und ist damit eine schwache Säure. Cytosin hingegen enthält eine Aminogruppe, welche dem Molekül Basencharakter verleiht. Die biologische Funktion in den Nukleinsäuren beruht weniger auf der Basizität, sondern auf der Fähigkeit der „Pyrimidinbasen“, Wasserstoffbrückenbindungen (H-Brücken) auszubilden, und zwar können sie sowohl als H-Brücken-Akzeptoren als auch als H-Brücken-Donoren wirksam werden.
Auch die Verbindungen selbst sind starke H-Brückenbildner und besitzen daher recht hohe Schmelzpunkte: Uracil 335 °C, Thymin 321 °C, Cytosin 320–325 °C. Sie bilden Hydrate (Kristallwasser-Moleküle sind offenbar durch H-Brücken fixiert).
Biosynthese
Der heterocyclische Ring wird unabhängig von der Ribose aufgebaut und erst nach Fertigstellung mit dem Zucker verknüpft. Als Zwischenprodukt dieser Synthesekette erscheint die Orotsäure, das Endprodukt ist das Uridinmonophosphat (UMP), welches in weiteren Schritten zu CMP, dUMP, dCMP und dTMP umgebaut wird.
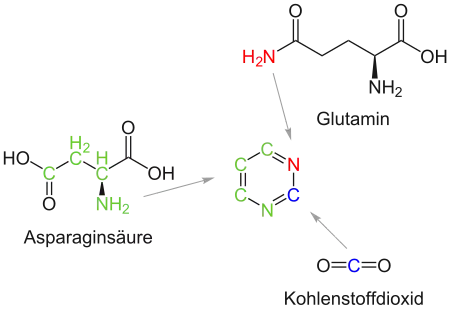
Die Produktion von Pyrimidinen im Körper erfolgt im Cytosol und beginnt mit der Bildung von Carbamoylphosphat aus Glutamin, 2 ATP und HCO3− zu Carbamoylphosphat + 2 ADP + Pi + Glutamat. Anschließend katalysiert das Enzym Aspartat-Transcarbamoylase (ATCase) die Bildung von N-Carbamoylaspartat aus Carbamoylphosphat und Aspartat. Daraus wird dann der Ring gebildet: N-Carbamoylaspartat cyclisiert unter Abspaltung von Wasser zu Dihydroorotat, das durch erneute Abspaltung von Wasser zu Orotat wird. Aus dem freien Pyrimidin Orotat werden dann die Pyrimidinnukleotide synthetisiert.
In Pilzen wie der Bäckerhefe oder Candida albicans kann Pyrimidin auf völlig andere Weise hergestellt werden, indem im Selbstmord-Enzym Pyrimidin-Synthase ein Histidinrest und Pyridoxalphosphat zum Pyrimidinring ligieren.[2]
Abbau und Modifizierung der Basen
Von den Nukleosiden und Nukleotiden werden als erstes die "Basen" abgespalten. Diese werden zu β-Alanin oder 3-Aminoisobutyrat abgebaut.
Durch salpetrige Säure (HNO2) wird die Aminogruppe des Cytosins in eine Hydroxygruppe umgewandelt. Dadurch entsteht aus Cytosin Uracil. Wirkt Salpetrige Säure auf die DNA (als Mutagen) ein, führt diese Änderung dazu, dass es bei der Vermehrung der DNA (Reduplication) zu fehlerhaften Basenpaarungen und damit zu einer veränderten Basensequenz kommt, die zu veränderten Proteinen und damit zu einem veränderten Phänotyp führen kann.
Anwendung in der Medizin
Früher wurde 6-Sulfa-2,4-diemethyl-pyrimidin (Sulfadimetin, Handelsnamen Aristamid, Elkosin) als Sulfonamid zur Behandlung von Infektionen eingesetzt. Weitere zu den Pyrimidinen gehörige Standard-Sulfonamide sind bzw. waren Sulfadiazin, Sulfamerazin und Sulfamethazin.[3] Wird die Synthese des Thymidins gestört, wirkt sich das auch als Störung der DNA-Synthese aus. Eine wirksame Möglichkeit ist die Hemmung der Thymidilat-Synthase durch 5-Fluoruracil, das sich vom Thymin dadurch unterscheidet, dass es an der Stelle der Methylgruppe ein Fluoratom aufweist. Damit steht ein wirksames Krebs-Medikament zur Verfügung. Allerdings wirkt sich die Störung der Zellteilung auch auf andere sich schnell vermehrende Zellen in den Haarfollikeln und im Knochenmark aus, was die schweren Nebenwirkungen bei einer Chemotherapie erklärt.
Ebenfalls auf einem Pyrimidingerüst beruht 5-Fluorcytosin, ein Antimykotikum.
Nomenklatur und Tautomerie
Uracil, Barbitursäure etc. stellen eigentlich nur formal Pyrimidine dar; es sind Abkömmlinge teilhydrierter Pyrimidine. Von der Struktur her kann man sie besser als ringförmige Harnstoffderivate (oder Lactame bzw. Imide) betrachten. Auch das Strukturelement der Enamine kann man in den Formeln dieser Heterocyclen erkennen. Bei diesen Molekülen tritt das Phänomen der Tautomerie auf. So kann Uracil formal als 2,4-Dihydroxypyrimidin betrachtet werden; die Röntgen-Kristallstrukturanalyse zeigt jedoch, dass es im festen Zustand keine Hydroxy-, sondern zwei Oxogruppen enthält. Ähnliches gilt für Barbitursäure (formal 2,4,6-Trihydroxypyrimidin), Cytosin, Thymin und Orotsäure (Abbildung). Die Moleküle enthalten das Grundmuster N=C–X–H (mit X = O, S oder NH). In den Oxo-Tautomeren liegt die Carbonsäureamid- (X = O), Thioamid- (X = S) oder Amidin-Funktion (X = NH) vor.

Die rationelle Nomenklatur dieser Verbindungen ist nicht sehr praktisch, es wären Pyrimidinone; Uracil und Thymin sind Pyrimidin-dione, Cytosin ein Aminopyrimidinon. Durch Röntgen-Kristallstrukturanalyse der drei Verbindungen wurden die Strukturen für den festen Zustand bewiesen. Spektroskopische Untersuchungen ergaben, dass auch in Lösungen ganz überwiegend diese Strukturen vorliegen.
Denkbare und früher häufig diskutierte tautomere Formen mit „echtem“, d. h. heteroaromatischem Pyrimidin-Gerüst, sind in Lösung bestenfalls in sehr kleinem Anteil vorhanden. Trotzdem bezeichnet man die Pyrimidinone oft als Hydroxypyrimidine, d. h. 2,4-Dihydroxypyrimidin (Uracil), 2,4-Dihydroxy-5-methylpyrimidin (Thymin) und 4-Amino-2-hydroxypyrimidin (Cytosin); besser wären, nach den Prinzipien der Suffix-Nomenklatur, wie im Englischen üblich, die Namen Pyrimidin-2,4-diol etc.
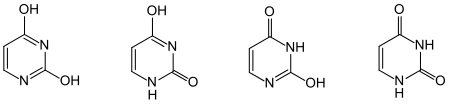
Synthesen von Pyrimidinen
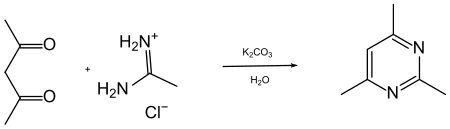
Von den zahlreichen Synthesen sei hier nur ein einziges wichtiges Syntheseprinzip betrachtet: Die Umsetzung von 1,3-Dicarbonylverbindungen (oder analoger 1,3-bifunktioneller Derivate) mit einem Amidin oder mit Harnstoff. Hierbei wird der Sechsring-Heterocyclus aus einer C3-Komponente und einer N-C-N-Komponente aufgebaut. So erhält man durch Kondensation von Pentan-1,3-dion („Acetylaceton“) mit Acetamidin 2,4,6-Trimethylpyrimidin.[4]
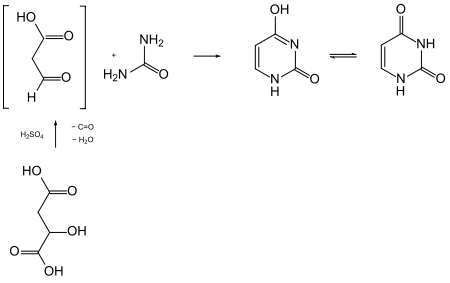
Die Pyrimidinone lassen sich als cyclische Harnstoff-Derivate auch aus Harnstoff synthetisieren. Beachte, dass die Verbindungen auch das Strukturelement der Enamine, besser Enamide, enthalten. Man verwendet daher 1,3-Dicarbonylverbindungen als Reaktionspartner. So lässt sich Uracil durch Kondensation von Harnstoff mit 3-Oxopropansäure („Formylessigsäure“, C3H4O3) erhalten. Die Synthese gilt auch als früher Strukturbeweis. Die C3-Komponente ist jedoch in diesem Fall nicht lagerfähig und wurde daher durch Äpfelsäure ersetzt. Diese wird in konzentrierter Schwefelsäure unter Wasserabspaltung decarbonyliert, verliert also Kohlenmonoxid. Die in situ gebildete 3-Oxopropansäure kondensiert mit dem Harnstoff in der schwefelsauren Lösung unter zweifacher Abspaltung von Wasser.
Anellierte Pyrimidinderivate
Von den Pyrimidinen leiten sich formal die Stoffklassen der Flavine, Pteridine und Purine ab. Diese enthalten neben dem Pyrimidinring einen zweiten heterocyclischen Ring mit einer gemeinsamen Bindung.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 21. Auflage, S. Hirzel Verlag, Stuttgart 1988, ISBN 3-7776-0438-0.
Einzelnachweise
- Löffler, Petrides, Heinrich: Biochemie und Pathobiochemie. 8. Auflage. Springer, Heidelberg 2007, ISBN 978-3-540-32680-9.
- Rung-Yi Lai, Siyu Huang u. a.: Thiamin Pyrimidine Biosynthesis in Candida albicans: A Remarkable Reaction between Histidine and Pyridoxal Phosphate. In: Journal of the American Chemical Society. 134, 2012, S. 9157–9159, doi:10.1021/ja302474a.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 43–46.
- A. Bowman: Notes: Some Pyrimidine Derivatives, in: J. Chem. Soc., 1937, S. 494–495; doi:10.1039/JR9370000494.