Ammoniumcyanid
Ammoniumcyanid ist eine chemische Verbindung aus der Gruppe der Cyanide. Es ist das Ammoniumsalz der Blausäure. In reiner Form bildet es farblose, würfelförmige Kristalle, die aufgrund langsamer Zersetzung gleichzeitig nach Ammoniak und Blausäure riechen.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
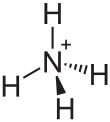 | ||||||||||
| Allgemeines | ||||||||||
| Name | Ammoniumcyanid | |||||||||
| Summenformel | NH4CN | |||||||||
| Kurzbeschreibung |
farbloser Feststoff mit Geruch nach Ammoniak[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 44,06 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
1,02 g·cm−3[1] | |||||||||
| Löslichkeit |
sehr leicht löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
0,4 kJ/mol[4] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Ammoniumcyanid kann durch trockenes Erhitzen von Ammoniumhexacyanidoferrat(II), (NH4)4[Fe(CN)6] · 3 H2O oder einem Gemisch von Kaliumcyanid und Ammoniumchlorid hergestellt werden. Bei gelindem Erwärmen im Wasserbad schmilzt das Gemisch und entwickelt dampfförmiges Ammoniumcyanid, das mit einer Eis-Kochsalzmischung zur Kondensation gebracht werden kann:
Ferner bildet es sich beim Überleiten von trockenem Ammoniak über in einer Porzellanschale glühende Kohlen und Auffangen des Cyanides in einer gekühlten Vorlage.
Eigenschaften
Ammoniumcyanid ist unter Kühlung unzersetzt haltbar, während es sich an der Luft bei gewöhnlicher Temperatur schon merklich zersetzt. Der Dampf lässt sich entzünden, er verbrennt mit gelblicher Flamme zu Ammoniumcarbonat. Die wässrige Lösung von Ammoniumcyanid reagiert alkalisch. In Ethanol ist es etwas besser löslich als in Wasser. Mit Brom und Chlor reagiert Ammoniumcyanid unter Wärmeentwicklung, durch Kaliumpermanganat wird es direkt zu Harnstoff oxidiert. Ammoniumcyanid ist ähnlich giftig wie Blausäure.
Ammoniumcyanid kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P42/mcm (Raumgruppen-Nr. 132).[1]
Sicherheitshinweise
Alle wasserlöslichen Cyanide sind giftig, wobei sie durch Blockieren des Enzyms Cytochrom-c-Oxidase in der Atmungskette zum Ersticken führen. Beim Arbeiten mit der Substanz sind Schutzhandschuhe, Staubmaske und Atemschutz Gasfilter B zu verwenden. Weiterhin sollte immer dann, wenn mit dem Auftreten von Blausäure gerechnet werden muss, unbedingt im Abzug gearbeitet werden.
Lagerung
Ammoniumcyanid sollte kühl und unter striktem Sauerstoff- und Feuchtigkeitsausschluss gelagert werden.
Literatur
- Brockhaus ABC. Band 1 A–K, VEB F.A. Brockhaus Verlag, Leipzig 1965.
Einzelnachweise
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 586 (eingeschränkte Vorschau in der Google-Buchsuche).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag salts of hydrogen cyanide with the exception of complex cyanides such as ferrocyanides, ferricyanides and mercuric oxycyanide and those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Blausäuresalze in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.

