Miller-Urey-Experiment
Das Miller-Urey-Experiment (auch Urey-Miller-Experiment oder Miller-Experiment) dient der Bestätigung der Hypothese, dass unter den Bedingungen einer postulierten Uratmosphäre die Bildung von organischen Verbindungen, insbesondere Aminosäuren, als Voraussetzung für die Entstehung primitiver einzelliger Lebensformen möglich ist (chemische Evolution).
Stanley Lloyd Miller simulierte 1953 zusammen mit Harold Clayton Urey im Labor der University of Chicago Umweltbedingungen, wie sie nach damaligem Forschungsstand in der Frühphase der Erdgeschichte (spätes Hadaikum) geherrscht haben könnten, und untersuchte, welche komplexen organischen Moleküle sich unter diesen Bedingungen bilden können. Eine erstmalige kurze Beschreibung des Experiments und seiner Ergebnisse erfolgte in dem Science-Artikel A production of amino acids under possible primitive Earth conditions (Herstellung von Aminosäuren unter möglichen Bedingungen der frühen Erde).[1]
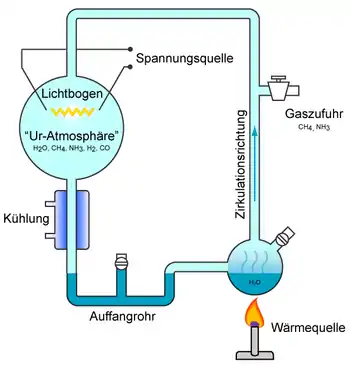
Versuchsaufbau
Im Miller-Urey-Experiment wird ein Gasgemisch, das einer hypothetischen frühen Erdatmosphäre entsprechen soll – Wasser (H2O), Methan (CH4), Ammoniak (NH3) und Wasserstoff (H2) – in einem Glaskolben elektrischen Entladungen (Lichtbögen) ausgesetzt. Die Lichtbögen, die Gewitterblitze auf der frühen Erde nachbilden, sollen die Gasmoleküle in hochreaktive freie Radikale aufspalten. Während Wasserdampf durch Erhitzen von Wasser in einem zweiten Kolben erzeugt wird, werden die übrigen Gase von außen zugeführt. In einem Kühler unterhalb des Kolbens, in dem die Lichtbögen erzeugt werden, wird der Wasserdampf kondensiert. Das kondensierte Wasser mit den Reaktionsprodukten wird in einem U-Stück aufgefangen und gelangt über einen Überlauf schließlich wieder in den zweiten Kolben.[1][2]
Somit wird in der Versuchsapparatur der frühirdische Wasserkreislauf stark vereinfacht nachgestellt: Wasser verdunstet aus dem „Urmeer“ im Kolben und steigt in die „Uratmosphäre“ auf, wo, vermittelt durch Blitze, die atmosphärischen Gase miteinander reagieren. Das atmosphärische Wasser kondensiert schließlich zu „Regen“ und transportiert die Reaktionsprodukte zurück ins „Urmeer“. In der Apparatur darf sich, wie in der hypothetischen Uratmosphäre, kein freier Sauerstoff (O2) befinden.[1][2]
Im unteren Kolben reichern sich nach und nach organische Moleküle an, die das Wasser des simulierten Urmeers nach einem Tag schwachviolett färben und nach einer Woche schließlich in eine tiefrote trübe Suspension verwandeln. Dieses Gemisch wurde nach Abbruch des Experiments mit Quecksilber(II)-chlorid (HgCl2) und Bariumhydroxid (Ba(OH)2) für die Analyse aufbereitet und mittels Papierchromatographie auf seine Zusammensetzung hin analysiert.[1][2]
Ergebnisse
Bei einer Ausgangsmenge von 59.000 Mikromol CH4 entstehen:[3]
| Produkt | Formel | Ausbeute (Stoffmenge in μmol) |
C-Atome | Stoffmenge der C-Atome in μmol |
|---|---|---|---|---|
| Ameisensäure | H–COOH | 2330 | 1 | 2330 |
| Glycin* | H2N–CH2–COOH | 630 | 2 | 1260 |
| Glycolsäure | HO–CH2–COOH | 560 | 2 | 1120 |
| Alanin* | H3C–CH(NH2)–COOH | 340 | 3 | 1020 |
| Milchsäure | H3C–CH(OH)–COOH | 310 | 3 | 930 |
| β-Alanin | H2N–CH2–CH2–COOH | 150 | 3 | 450 |
| Essigsäure | H3C–COOH | 150 | 2 | 300 |
| Propionsäure | H3C–CH2–COOH | 130 | 3 | 390 |
| Iminodiessigsäure | HOOC–CH2–NH–CH2–COOH | 55 | 4 | 220 |
| Sarcosin | H3C–NH–CH2–COOH | 50 | 3 | 150 |
| α-Amino-n-buttersäure | H3C–CH2–CH(NH2)–COOH | 50 | 4 | 200 |
| α-Hydroxy-n-buttersäure | H3C–CH2–CH(OH)–COOH | 50 | 4 | 200 |
| Bernsteinsäure | HOOC–CH2–CH2–COOH | 40 | 4 | 160 |
| Harnstoff | H2N–CO–NH2 | 20 | 1 | 20 |
| N-Methylharnstoff | H2N–CO–NH–CH3 | 15 | 2 | 30 |
| 3-Azaadipinsäure | HOOC–CH2–NH–CH2–CH2–COOH | 15 | 5 | 75 |
| N-Methylalanin | H3C–CH(NH–CH3)–COOH | 10 | 4 | 40 |
| Glutaminsäure* | HOOC–CH2–CH2–CH(NH2)–COOH | 6 | 5 | 30 |
| Asparaginsäure* | HOOC–CH2–CH(NH2)–COOH | 4 | 4 | 16 |
| α-Aminoisobuttersäure | H3C–C(CH3)(NH2)–COOH | 1 | 4 | 4 |
Summe: |
4916 | 8945 |
Insgesamt werden damit 18 % der Methanmoleküle in Biomoleküle umgewandelt, aus dem Rest entsteht eine teerartige Masse.
Ursprünglich im Jahr 1953 durchgeführt, hat dieses Experiment seitdem in vielen Varianten vergleichbare Ergebnisse ergeben. Es wird als Beweis dafür angesehen, dass die frühe Erdatmosphäre organische Moleküle in nicht zu vernachlässigenden Konzentrationen enthielt.
Im Jahr 2008 durchgeführte Untersuchungen an den von Miller verwendeten Originalgefäßen führten zur Identifikation von acht weiteren, meist hydroxylierten Aminosäuren, die mit den Analysemethoden der 1950er-Jahre übersehen worden waren.[4] Das Experiment kann aber keine Aussagen darüber machen, wie sich diese Moleküle etwa zu großen Strukturen verbunden hätten.
Abwandlungen der Versuchsbedingungen
- Als Kohlenstoffquelle: Kohlenstoffmonoxid (CO) oder Kohlenstoffdioxid
- Als Stickstoffquelle: molekularer Stickstoff N2
- Als Energiequelle: UV-Licht und Feuer als Hitzequelle
Was das Miller-Experiment allein nicht erklärt
- Die Aminosäuren entstehen als 1:1-Racematgemische, in den Organismen sind aber überwiegend nur die L-Aminosäuren zu finden. Das Problem ist lösbar durch Mineralien als Katalysatoren, die aber von Miller nicht verwendet wurden.
- Neben einigen Aminosäuren entstehen auch Verbindungen, die in heute lebenden Organismen nicht vorkommen, zum Beispiel die zwei zu Alanin isomeren Aminosäuren β-Alanin und Sarcosin (siehe Tabelle). Das Nichtvorhandensein dieser Verbindungen in heutigen Organismen könnte möglicherweise durch Selektion in der Evolution der Stoffwechselwege erklärt werden, wodurch alle Varianten bis auf die heute von Organismen verwendeten Aminosäuren eliminiert wurden.
Reaktionswege beim Miller-Experiment
Zunächst entstehen aus den Ausgangsstoffen Aldehyde (R–CHO) und Blausäure (Cyanwasserstoff HCN) als erste Zwischenprodukte.
In einer darauf folgenden Mehrstufenreaktion reagieren die Aldehyde mit Ammoniak als Katalysator zu Aminosäuren:
- Summengleichung:
- Aldehyd, Cyanwasserstoff und Wasser reagieren zur Aminosäure.
So entsteht aus dem Aldehyd Methanal (HCHO) die Aminosäure Glycin, aus Ethanal (CH3-CHO) entsteht Alanin.
- Summengleichung:
- Aldehyd, Cyanwasserstoff und Wasser reagieren zu α-Hydroxysäuren.
Aus Methanal entsteht die Glycolsäure (α-Hydroxyethansäure), aus Ethanal die Milchsäure (α-Hydroxypropansäure) und aus Propanal (CH3-CH2-CHO) die α-Hydroxybuttersäure.
Kritik an den Voraussetzungen
Die Ergebnisse des Experiments sind reproduzierbar. Es gibt jedoch ernste Zweifel daran, ob die Voraussetzungen für die frühe Erde realistisch sind. Der deutsche Chemiker Günter Wächtershäuser äußert sich hierzu eindeutig: „Die Theorie von der präbiotischen Ursuppe sieht sich verheerender Kritik ausgesetzt, weil sie unlogisch, mit der Thermodynamik unvereinbar, chemisch und geochemisch nicht plausibel, nicht im Einklang mit Biologie und Biochemie und experimentell widerlegt ist.“[5] Auch andere Wissenschaftler kommen zu dem Schluss, dass die urzeitlichen Bedingungen der frühen Erde nicht denen des im Experiment simulierten entsprachen.[6][7]
Literatur
- Stanley L. Miller: A production of amino acids under possible primitive earth conditions. In: Science. Band 117 (3046), 1953, PMID 13056598; doi:10.1126/science.117.3046.528, S. 528–529
- Stanley L. Miller und Harold C. Urey: Organic Compound Synthesis on the Primitive Earth. In: Science. Band 130 (3370), 1959, PMID 13668555; doi:10.1126/science.130.3370.245, S. 245–251
- Sven P. Thoms: Ursprung des Lebens. Fischer, Frankfurt 2005, ISBN 3-596-16128-2.
- Richard E. Dickerson: Chemische Evolution und der Ursprung des Lebens. In: Spektrum der Wissenschaft. Heft 9, 1979, S. 98–115
Weblinks
- 50 Jahre DNA-Doppelhelix und Miller-Experiment. Aus Nachrichten aus der Chemie, Juni 2003, S. 666–674 (PDF; 174 kB)
- Herunterladbare Filme, in denen Miller sein Experiment erklärt
- From Primordial Soup to the Prebiotic Beach - An interview with exobiology pioneer, Dr. Stanley L. Miller, University of California San Diego (Memento vom 11. Oktober 2007 im Internet Archive)
- Leslie Orgel: Origin of Life on Earth (Memento vom 6. Dezember 2007 im Internet Archive)
- Forschungsprojekt Miller-Urey-Experiment am IKS der TU Graz
Einzelnachweise
- S. L. Miller: A production of amino acids under possible primitive Earth conditions. 1953 (siehe Literatur)
- Miller-Experiment. In: Spektrum Online-Lexikon der Biologie, abgerufen am 1. Januar 2021
- Richard E. Dickerson: Chemische Evolution und der Ursprung des Lebens. In: Spektrum der Wissenschaft. Heft 9, 1979, S. 193
- Adam P. Johnson et al. (2008): The Miller Volcanic Spark Discharge Experiment. In: Science. Band 322(5900); S. 404; PMID 18927386; doi:10.1126/science.1161527
- Zit. n. Nick Lane: Der Funke des Lebens. Konrad Theiss Verlag: Darmstadt 2017, S. 348, Anm. 24.
- Eth Zurich: Uncovering Mysteries of Earth's Primeval Atmosphere 4.5 Billion Years Ago and the Emergence of Life. 29. November 2020. Abgerufen am 30. November 2020.
- Paolo A. Sossi, Antony D. Burnham, James Badro, Antonio Lanzirotti, Matt Newville, Hugh St C. O’Neill: Redox state of Earth's magma ocean and its Venus-like early atmosphere. In: Science Advances. 6, Nr. 48, 1. November 2020, ISSN 2375-2548, S. eabd1387. doi:10.1126/sciadv.abd1387.