mTOR
mTOR (Abk. für engl. mechanistic Target of Rapamycin, früher mammalian Target of Rapamycin, zu deutsch Ziel des Rapamycins im Säugetier) ist der Name des in allen Säugetieren vorkommenden Proteins, an welches das Immunsuppressivum Rapamycin indirekt bindet. Es handelt sich bei mTOR um ein für Überleben, Wachstum, Proliferation und Motilität von Zellen wichtiges Enzym, das eine Phosphatgruppe zu mehreren anderen Proteinen und Enzymen hinzufügt und diese so aktiviert. Damit ist mTOR Teil der Signaltransduktion im Körper und Anfang einer Kaskade von Signalwegen. Eine Hemmung von mTOR ist für die immunschwächenden Wirkungen von Rapamycin verantwortlich.
| MTOR | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 2549 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | FRAP1 | |
| Externe IDs | ||
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2475 | 56717 |
| Ensembl | ENSG00000198793 | ENSMUSG00000028991 |
| UniProt | P42345 | Q9JLN9 |
| Refseq (mRNA) | NM_004958 | NM_020009 |
| Refseq (Protein) | NP_004949 | NP_064393 |
| Genlocus | Chr 1: 11.11 – 11.26 Mb | Chr 4: 148.45 – 148.56 Mb |
| PubMed-Suche | 2475 | 56717 |
Erste molekulargenetische Untersuchungen wurden in den frühen 1990ern am Biozentrum der Universität Basel, Schweiz, und von Sandoz Pharmaceuticals (jetzt Novartis) von Michael N. Hall, Joseph Heitman und Rao Movva in Hefe durchgeführt. Dabei wurden FKBP12, TOR1 und TOR2 als Ziele von Rapamycin identifiziert. Die Forscher isolierten Rapamycin-resistente Mutanten von Saccharomyces cerevisiae und entdeckten, dass Mutationen in einem der drei Gene für die Resistenz verantwortlich sind.[1] Zwei der Gene, TOR1 und TOR2, wurden als Ziele von Rapamycin (target of rapamycin, kurz TOR) bezeichnet – in Anlehnung an das Spalentor, eines Tors der Stadt Basel und damit dem Ort, wo TOR zuerst entdeckt wurde. Für seine Arbeiten zu TOR erhielt Michael Hall im Jahr 2009 den Louis-Jeantet-Preis für Medizin.
Ein paar Jahre später, im Jahr 1994, wurde das Target of Rapamycin von Säugetieren (mTOR) durch Solomon Snyder und David M. Sabatini an der Johns Hopkins University und unabhängig von Robert Abraham und Stuart L. Schreiber an der Harvard University entdeckt.
Allgemeine Eigenschaften
mTOR ist Bestandteil eines Proteinkomplexes, der unterschiedliche Signalwege von Wachstumsfaktoren, Energiehaushalt und Sauerstoffkonzentration der Zelle integriert, die Translation von Proteinen reguliert und so Zellwachstum und Zellzyklus steuert.
mTOR wurde bei der Untersuchung, an welche Proteine Rapamycin bindet, entdeckt. mTOR besteht aus 2549 Aminosäuren. Die Molekülmasse beträgt 290 kDa.[2][3][4]
Aktivierung von mTOR durch Stimulation von Wachstumsfaktor-Rezeptoren
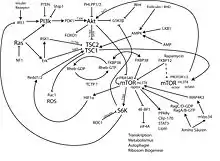
Werden die Wachstumsfaktor-Rezeptoren durch spezifische Liganden stimuliert (z. B. IGF-Rezeptor), phosphoryliert Phosphoinositid-3-Kinase (PI3K) Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Phosphatidylinositol-3,4,5-trisphosphat (PIP3). PIP3 ist ein second messenger, der dazu führt, dass weitere Kinasen wie PDK1 und die Proteinkinase B (AKT) an die Membran binden und aktiviert werden. Die Tumor-Suppressor-Phosphatase PTEN (Phosphatase and tensin homologue deleted on chromosome 10) hebt die Wirkung von PI3K durch Dephosphorylierung von PIP3 auf. Die Aktivierte Proteinkinase B (AKT) phosphoryliert und hemmt den Tuberous Sclerosis Complex (TSC) und hebt damit dessen hemmenden Einfluss auf mTOR auf. TSC besteht aus zwei Proteinen, TSC1 (Hamartin) und TSC2 (Tuberin). TSC2 ist ein GTPase-aktivierendes Protein (GAP), welches die mit Ras verwandte Kleine GTPase Rheb (Ras-homolog-enriched-in-brain) durch Hydrolyse von GTP zu GDP inaktiviert, die wiederum mTOR aktiviert.
Hemmung von mTOR durch Nahrungsmangel
Energiedepletion führt zum Abfall der Konzentrationen von Adenosintriphosphat (ATP) und Aminosäuren in der Zelle und zur Aktivierung von Serin-Threonin-Kinase 11 (STK11 oder LKB1). LKB1 ist ein Tumorsuppressorprotein, welches beim Peutz-Jeghers-Syndrom inaktiviert ist. LKB1 aktiviert AMP-aktivierte Proteinkinase (AMPK). AMPK wiederum phosphoryliert und aktiviert TSC2 und hemmt so mTOR.
Durch Integration dieser beiden Signalwege durch Rheb und mTOR wird das Zellwachstum (reguliert über den Wachstumsfaktor-PI3K-Akt-Weg) mit der Verfügbarkeit von Energie und Nahrungsstoffen (reguliert über den ATP-LKB1-TSC1/2-Weg) koordiniert.
Funktion von mTOR
mTOR liegt in Komplexen mit anderen Proteinen vor.
mTOR complex 1 (mTORC1) besteht aus mTOR, Raptor (regulatory associated protein of mTOR), mLST8/GβL (mammalian LST8/G-protein β-subunit like protein) und LST8 (lethal with sec thirteen 8)[5]). mTORC1 wird durch Rapamycin gehemmt. Eine Aktivierung von mTORC1 führt zur Phosphorylierung von zwei Schlüsselproteinen, welche die Translation von Proteinen regulieren: 4E-BP1 (eukaryotic initiation factor 4E (eIF-4E) binding protein-1) und S6K1 (protein S6 kinase 1).
mTOR Complex 2 (mTORC2) besteht aus mTOR, Rictor (rapamycin-insensitive companion of mTOR), GβL, und mSIN1 (mammalian stress-activated protein kinase interacting protein 1). mTORC2 wird durch Rapamycin nicht gehemmt. mTORC2 aktiviert AKT durch Phosphorylierung an der Ser473-Position.
4E-BP-1 und S6K1
4E-BP1 und S6K1 sind Regulatoren der Protein-Translation.
Unphosphoryliertes 4E-BP1 bindet an RNA-cap-bindendes Protein eIF-4E und hemmt dadurch die Kopplung an mRNA und den Translations-Initiations-Komplex, der zur Initiation der Translation cap-abhängiger mRNAs benötigt wird. Aktivierter mTORC1 phosphoryliert 4E-BP1, dadurch wird eIF-4E freigesetzt. Dieses bindet an cap-mRNA-Transkripte und andere Proteine des Initiations-Komplexes, diese Bindung initiiert cap-abhängige Translation. Die erhöhte Translation cap-abhängiger mRNAs führt unter anderem zur Synthese mehrerer Proteine, die die Zellproliferation kontrollieren und das Zellwachstum regulieren.
mTORC1 phosphoryliert S6K1. Dieser Schritt stimuliert die weitere Phosphorylierung von S6K1 durch die Master-Kinase PDK1. Aktiviertes S6K1 stimuliert die Initiierung der Protein-Biosynthese durch Aktivierung des ribosomalen Proteins S6 und anderer Komponenten der Translationsmaschinerie. In einer positiven Rückkopplungsschleife kann S6K1 mTORC1 phosphorylieren und die mTOR-Aktivität stimulieren.
Medizinische Bedeutung
Besonders empfindlich für eine Hemmung von mTOR sind T-Zellen, Zellen von Blut- und Lymphgefäßen, glatte Muskelzellen und Tumorzellen.[6]
In der Transplantationsmedizin wird der mTOR-Hemmer Rapamycin (Sirolimus) zur Vorbeugung gegen Abstoßungsreaktionen eingesetzt. Ein Vorteil von Rapamycin gegenüber anderen immunsuppressiven Medikamenten wurde in einem geringeren Auftreten von Tumoren gesehen, welcher aber in großen klinischen Studien nicht bestätigt werden konnte.[7] Wird Rapamycin unmittelbar nach Transplantation eingesetzt, kommt es aber wegen des antiangiogenetischen und antiproliferativen Effekts vermehrt zu Wundheilungsstörungen.
In der Kardiologie werden Stents in verschlossene oder verengte Herzkranzgefäße eingesetzt, um diese offen zu halten. Durch Gewebsneubildung kann es zu einem Verschluss des Stents kommen. Eine Beschichtung der Stents mit Rapamycin hemmt die Gewebsneubildung und senkt die Rate von Stentverschlüssen.
Temsirolimus, ein weiterer Hemmstoff von mTOR, verbessert das Überleben von Patienten mit fortgeschrittenem Nierenzellkarzinom.[8] Es ist auch zur Behandlung des seltenen Mantelzelllymphoms zugelassen.
Bei der erblichen Zystennierenkrankheit ist mTOR in den Epithelzellen der Nierenzysten hochreguliert. Im Tiermodell führt Rapamycin zur Apoptose der Zystenwand-Zellen und hemmt so das Wachstum der Zysten.[9]
Während mTOR beim akuten Nierenversagen eine wichtige Rolle bei Erholungs- und Reparaturvorgängen spielt, trägt bei chronischem Nierenversagen und diabetischer Nephropathie eine dauerhafte, inadäquate Aktivierung des mTOR-Signalweges zur Progression der Nierenschädigung bei.[10]
Bei Patienten mit tuberöser Sklerose und Lymphangioleiomyomatose führt die Behandlung mit Sirolimus zu einer Besserung des Krankheitsverlaufs.[11]
| Glossar: | |
|---|---|
| 4E-BP1 | eukaryotic initiation factor 4E (eIF-4E) binding protein-1 |
| AKT | Proteinkinase B |
| AMPK | AMP-aktivierte Proteinkinase |
| ADP | Adenosindiphosphat |
| ATP | Adenosintriphosphat |
| GAP | GTPase-aktivierendes Protein |
| GβL | mammalian LST8/G-protein β-subunit like protein |
| IGF | Insulin-like growth factor |
| IGFR | Insulin-like growth factor receptor |
| LKB1 | Serin Threonin Kinase 11 (STK11) |
| mLST8/GβL | mammalian LST8/G-protein β-subunit like protein |
| mSIN1 | mammalian stress-activated protein kinase interacting protein 1 |
| mTOR | mammalian Target of Rapamycin |
| PDK1 | Phosphoinositide-dependent kinase 1 |
| PI3K | Phosphatidylinositol-3-Kinase |
| PIP2 | Phosphatidylinositol-4,5-bisphosphat |
| PIP3 | Phosphatidylinositol-3,4,5-triphosphat |
| PTEN | Phosphatase and tensin homologue deleted on chromosome 10 |
| Raptor | regulatory associated protein of mTOR |
| Rheb | Ras-homolog-enriched-in-brain |
| Rictor | rapamycin-insensitive companion of mTOR |
| S6K1 | protein S6 kinase 1 |
| STK11 | Serin Threonin Kinase 11 (LKB1) |
| TSC | Tuberous Sclerosis Complex |
Einzelnachweise
- Heitman J, Movva NR, Hall MN.: Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast. In: Science. Nr. 253, 1991, S. 905–909, PMID 1715094.
- N. Hay, N. Sonenberg: Upstream and downstream of mTOR. In: Genes Dev. Nr. 18, 2004, S. 1926–1945 (Artikel). PMID 15314020
- Xuemin Wang, Christopher G. Proud: The mTOR Pathway in the Control of Protein Synthesis. In: Physiology. Nr. 21, 2006, S. 362–369 (Artikel).
- Janet E. Dancey: MTOR and Related Pathways. In: Cancer Biology & Therapy. Nr. 5, 2006, S. 1065–1073 (PDF).
- R. Loewith et al.: Two TOR Complexes, Only One of which Is Rapamycin Sensitive, Have Distinct Roles in Cell Growth Control. In: Molecular Cell. Vol.10(3), 2002, S. 457–468, PMID 12408816.
- G. Blaeser-Kiel: Sirolimus zum Transplantatschutz. Bessere Langzeitprognose durch geringere Tumorinzidenz. In: Deutsches Ärzteblatt. Nr. 104, 2007, S. A-1255 (Artikel).
- Henrik Ekberg et al.: Reduced Exposure to Calcineurin Inhibitors in Renal Transplantation. In: N Engl J Med. Nr. 357, 2007, S. 2561–2575 (Abstract).
- Gary Hudes et al.: Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. In: N Engl J Med. Nr. 356, 2007, S. 2271–2281, PMID 17538086.
- W. Kühn, G. Walz: Autosomal dominante polyzystische Nierenerkrankung. In: Dtsch Arztebl. Nr. 104(44), 2007, S. 3022–3028 (Artikel).
- Wilfred Lieberthal, Jerrold S Levine: The role of the mammalian target of rapamycin (mTOR) in renal disease. In: Journal of the American Society of Nephrology. 20, Nr. 12, Dezember 2009, S. 2493–2502. doi:10.1681/ASN.2008111186. PMID 19875810.
- John J. Bissler et al.: Sirolimus for Angiomyolipoma in Tuberous Sclerosis Complex or Lymphangioleiomyomatosis. In: N Engl J Med. Nr. 358, 2008, S. 140–151 (Abstract).