Pankreaslipase
Die Pankreaslipase (Lipase, PL) ist eins von zwei Enzymen, die im Dünndarm von Säugetieren die mit der Nahrung aufgenommenen Fette (Triglyceride) spaltet. Diese Reaktion ist unentbehrlich bei der Fettverdauung; so sind bereits etwa 80 Prozent der Triglyceride aus der Nahrung gespalten, wenn sie den mittleren Zwölffingerdarm erreichen. Die PL gehört zu den Lipasen und wird in der Bauchspeicheldrüse (Pankreas) produziert. Für die Funktion ist das Kofaktor-Protein Colipase erforderlich.[1]
| Pankreaslipase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 449 Aminosäuren | |
| Kofaktor | Colipase | |
| Bezeichner | ||
| Gen-Name | PNLIP | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.1.3, Lipasen | |
| Reaktionsart | Hydrolyse (hydrolytische Esterspaltung) | |
| Substrat | Tri-/Diacylglycerin + H2O | |
| Produkte | Di-/Monoacylglycerin + Fettsäure | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5406 | 69060 |
| Ensembl | ENSP00000358223 | |
| UniProt | P16233 | Q6P8U6 |
| Refseq (mRNA) | NM_000936 | NM_026925 |
| Refseq (Protein) | NP_000927 | NP_081201 |
| Genlocus | Chr 10: 116.55 – 116.57 Mb | Chr 19: 58.67 – 58.68 Mb |
| PubMed-Suche | 5406 | 69060 |
Die Pankreaslipase ist außerdem verantwortlich für die Hydrolyse von Retinylestern zu Retinol und Fettsäuren, womit ein Teil der Vitamin-A-Aufnahme über die Nahrung ermöglicht wird (Vitamin A wird auch als Provitamin oder als Retinol direkt zugeführt und aufgenommen).[2]
Die Pankreaslipase ist Target bei der medikamentösen Bekämpfung des Übergewichts. Seit 1998 wird der PL-Hemmer Orlistat mit dieser Indikation vermarktet.
Anwendungen in der Medizin
Lipase kommt in der Enzymsubstitutionstherapie bei eingeschränkter Funktion der Bauchspeicheldrüse (Pankreas-Insuffizienz) eine zentrale Bedeutung zu. Insbesondere bei der Mukoviszidose ist die Gabe von Enzympräparaten mit Pankreas-Pulver vom Schwein, die auf einen bestimmten Lipasegehalt normiert werden, Therapiestandard. Diese Arzneimittel werden zum Schutz der enthaltenen Enzyme mit magensaftresistenten Überzügen angeboten. In einigen Fällen kommt auch Lipase aus nicht-tierischen Quellen (Rhizolipase aus den japanischen Reispilzkulturen Rhizopus oryzae, Handelsname: Nortase) zum Einsatz, die sich durch eine natürliche Stabilität gegenüber der menschlichen Magensäure auszeichnet.
Labordiagnostik
In der Labordiagnostik wird die Aktivität der Lipase aus Heparin-Plasma oder Blutserum bei der Abklärung von Oberbauchschmerzen, speziell zur Diagnose einer akuten Pankreatitis gemessen.
Referenzbereich für Messungen bei 37 °C (Farbtest): Serum, Plasma <60 U/l
Bei einer akuten Pankreatitis steigt die Lipase an und liegt bereits 5 Stunden nach Einsetzen der Schmerzen über dem Referenzbereich von 60 U/l. In den meisten Fällen steigt der Wert über 180 U/l an und bleibt drei bis sechs Tage erhöht.
Allgemein ist die Methode der Lipase-Bestimmung weniger gut standardisiert und anfälliger auf Störfaktoren als die Pankreas-Amylase. In der Humanmedizin wird bei Verdacht auf akute Pankreatitis dennoch in erster Linie die Pankreaslipase bestimmt, da diese eine höhere Spezifität für eine Entzündung aufweist, insbesondere bei der alkoholbedingten Pankreatitis.[3] Die gleichzeitige Bestimmung der Amylase und Lipase erhöht nicht die Sensitivität des Tests.[4] Die Bestimmung der Lipase ist insbesondere dann sinnvoll, wenn aus technischen Gründen nur die Gesamt-Amylase gemessen werden kann oder wenn der Patient mit Plasmaexpandern (Hydroxyäthylstärke oder Dextran 70) behandelt wurde.[5] In der Tiermedizin wird bei Hunden und Katzen als Pancreatic lipase immunoreactivity die Gesamtkonzentration der Pankreaslipase im Serum zur Diagnostik der akuten Pankreatitis bestimmt.[6]
Die Lipase wird in der Niere glomerulär filtriert, dann aber nicht ausgeschieden, sondern rückresorbiert und abgebaut. Sie erscheint deshalb nicht im Urin, ist aber trotzdem bei Niereninsuffizienz erhöht.
Bei der endoskopischen Untersuchung des Pankreas (ERCP = Endoskopisch Retrograde Cholangiopankreatikographie) steigt die Lipase sofort an, erreicht nach sechs Stunden Werte von bis zu 720 U/l und bleibt bis zu drei Tage über dem Referenzbereich von 60 U/l.
Eine weitere Ursache für die Erhöhung der Lipase ohne Krankheitswert kann das Gullo-Syndrom sein.
Katalysierte Reaktion
Die Pankreas-Lipase spaltet bei Triglyceriden – z. B. 1 – nur die α-ständigen Fettsäurereste ab.[7] Dabei bilden sich die freien Fettsäuren 2a und 2b sowie das Monoglycerid 3:[8]
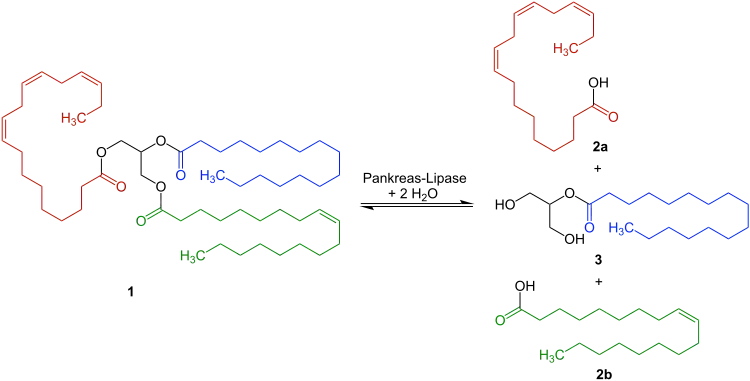
Reaktionsmechanismus
Die Lipase besitzt in ihrem aktiven Zentrum eine katalytische Triade aus den Aminosäuren Asparaginsäure, Histidin und Serin. Die Asparaginsäure entzieht dem Histidin ein Proton und aktiviert dieses damit. Das katalytisch aktive Histidin zieht vom Serin wiederum ein Proton ab, wodurch die Nucleophilie des Serinrestes ansteigt. Dieser kann nun an dem Carbonylkohlenstoff eines Substratesters angreifen, der bereits im aktiven Zentrum lokalisiert ist. Es bildet sich ein tetraedrisches Zwischenprodukt, aus dem ein Acyl-Enzym-Komplex entsteht. Durch Deacetylierung in einem Hydrolyseschritt wird das Produkt Fettsäure und das ursprüngliche Enzym frei.
Siehe auch
Literatur
- Birgid Neumeister, Ingo Besenthal, Hartmut Liebich (Hrsg.): Klinikleitfaden Labordiagnostik. 3. Auflage. Urban & Fischer, München u. a. 2003, ISBN 3-437-22231-7.
- Lothar Thomas (Hrsg.): Labor und Diagnose. Indikation und Bewertung von Laborbefunden für die medizinische Diagnostik. 6. Auflage. TH-Books, Frankfurt am Main 2005, ISBN 3-9805215-5-9.
Weblinks
- Lipase auf med4you.at
- Stabilität in Blutproben publiziert durch die WHO (pdf) (292 kB)
- D'Eustachio/reactome.org: Digestion of triacylglycerols by extracellular PTL:colipase
- D'Eustachio/reactome.org: Digestion of diacylglycerols by extracellular PTL:colipase
Einzelnachweise
- UniProt P16233
- A. M. van Bennekum, E. A. Fisher, W. S. Blaner, E. H. Harrison: Hydrolysis of retinyl esters by pancreatic triglyceride lipase. In: Biochemistry. Bd. 39, Nr. 16, April 2000, S. 4900–4906. PMID 10769148.
- Vivek Gumaste, Pradyuman Dave, George Sereny: Serum lipase: A better test to diagnose acute alcoholic pancreatitis. In: The American Journal of Medicine. Band 92, Nr. 3, März 1992, S. 239–242, doi:10.1016/0002-9343(92)90070-R (elsevier.com [abgerufen am 10. Dezember 2021]).
- John Treacy, Anthony Williams, Renz Bais, Krysten Willson, Christopher Worthley: Evaluation of amylase and lipase in the diagnosis of acute pancreatitis: AMYLASE AND LIPASE IN ACUTE PANCREATITIS. In: ANZ Journal of Surgery. Band 71, Nr. 10, Oktober 2001, S. 577–582, doi:10.1046/j.1445-2197.2001.02220.x (wiley.com [abgerufen am 10. Dezember 2021]).
- Ross C. Smith, James Southwell-Keely, Douglas Chesher: Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?. In: ANZ Journal of Surgery. Bd. 75, Nr. 6, Juni 2005, S. 399–404. doi:10.1111/j.1445-2197.2005.03391.x. PMID 15943725.
- Jörg M. Steiner (Hrsg.): Small Animal Gastroenterology. Schlütersche, Hannover 2008, ISBN 978-3-89993-027-6.
- Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank’sche Verlagshandlung, Stuttgart, 1983, 8. Auflage, S. 2377, ISBN 3-440-04513-7.
- Peter Nuhn: Naturstoffchemie, S. Hirzel Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2. Auflage, 1990, S. 308–309, ISBN 3-7776-0473-9.