Olaparib
Olaparib wurde 2015 als erster Vertreter der Wirkstoffklasse der PARP-Inhibitoren in den USA zugelassen (Handelsname: Lynparza, Hersteller: AstraZeneca).[2][3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
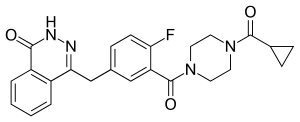 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Olaparib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H23FN4O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XX46 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 434,46 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete (Indikationen)
Lynparza darf als Monotherapie für die Erhaltungstherapie bei erwachsenen Patienten mit Platin-sensitivem Rezidiv eines BRCA-mutierten hochgradig serösen epithelialen Eierstock-, Eileiter- oder Peritoneal-Karzinom eingesetzt werden. Vor Behandlungsbeginn muss in Blut oder Tumorgewebe eine Mutation in den Genen BRCA1 oder BRCA2 nachgewiesen sein.[4] Im Dezember 2017 wurden auf dem San Antonio Breast Cancer Symposium (SABCS) erste Daten zur Behandlung von HER2-negativem metastasiertem Brustkrebs präsentiert. Merck (MSD) und AstraZeneca kooperieren in der klinischen Entwicklung von Olaparib.[5] Im Januar 2018 hat die US-Arzneimittelbehörde FDA das Indikationsgebiet für Olaparib um das metastasierte Mammakarzinom mit spezifischer genetischer Mutation (BRCA-Mutation) erweitert.[6] Im Mai 2020 folgte die Zulassungserweiterung in der Indikation Prostatakrebs.[7] Olaparib ist auch in der EU seit 2014 zugelassen (Ovarialkarzinom),[8] die Indikationserweiterungen erfolgten 2019 (Brustkrebs) und 2020 (Prostatakrebs, Adenokarzinom des Pankreas)[9]
Darreichungsformen
Zurzeit (Juni 2021) sind zwei verschiedene Darreichungsformen von Lynparza (Wirkstoff: Olaparib) erhältlich, Lynparza 50 mg Hartkapseln und Lynparza® 100 mg/-150 mg Filmtabletten. Der Hersteller AstraZeneca teilte im Juni 2021, dass er Ende 2021 die Produktion der Lynparza®50mg Hartkapseln einstellen wird. Die Ware wird noch maximal 6 Monate abverkauft, danach sind in Deutschland sowie weltweit nur noch Lynparza® 100 mg/-150 mg Filmtabletten verfügbar. Die Dosierungsempfehlungen für die Hartkapseln und die Filmtabletten sind jedoch unterschiedlich; es besteht dadurch das Risiko einer Überdosierung mit Zunahme von unerwünschten Arzneimittelwirkungen.[10]
Einzelnachweise
- Olaparib. Safety. Sigma-Aldrich, abgerufen am 17. November 2020.
- Lynparza Approval History, Zulassungshistorie auf drugs.com, abgerufen am 19. September 2017.
- FDA approves olaparib tablets for maintenance treatment in ovarian cancer, PM FDA vom 17. August 2017, abgerufen am 19. September 2017.
- NEUE ARZNEISTOFFE, Pharmazeutische Zeitung, abgerufen am 19. September 2017.
- New and Updated Data for Merck’s KEYTRUDA® (pembrolizumab) and Updated Data on LYNPARZA® (olaparib) in Multiple Breast Cancer Subtypes to Be Presented at the 2017 San Antonio Breast Cancer Symposium (SABCS), PM Merck/MSD vom 30. November 2017, abgerufen am 6. Dezember 2017.
- FDA approves first treatment for breast cancer with a certain inherited genetic mutation, PM FDA vom 12. Januar 2018, abgerufen am 18. Januar 2018.
- S. Siebenand: PARP-Hemmer Olaparib nun auch bei Prostatakrebs, www.pharmazeutische-zeitung.de, 20. Mai 2020.
- Übersicht über Lynparza und Begründung für die Zulassung in der EU, EMA vom April 2018, abgerufen am 18. Juni 2018.
- Europäische Arzneimittel-Agentur: Lynparza, abgerufen am 14. November 2020.
- LYNPARZA® 50 mg Hartkapseln (Wirkstoff Olaparib): Einstellung der Produktion Ende 2021, Informationsbrief AstraZeneca auf der WebSite der AKdÄ, abgerufen am 29. Juni 2021