Erlotinib
Erlotinib ist ein selektiver Inhibitor der Tyrosinkinase-Domäne des EGF-Rezeptors. Es wurde 2005 unter dem Namen Tarceva in der EU zugelassen zur Behandlung des Lungenkrebses (nicht-kleinzelliges Bronchialkarzinom), Anfang 2007 erfolgte die Indikationserweiterung zur Therapie des Bauchspeicheldrüsenkrebses (Pankreaskarzinom).[2]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
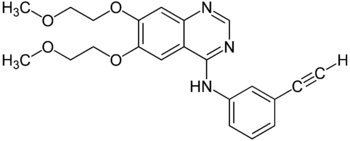 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Erlotinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 393,44 g·mol−1 (Erlotinib) | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Erlotinib ist ein Tyrosinkinase-Hemmer, der zu einer Blockade des Tumor-Zellwachstums führen kann. Indem Erlotinib die Tyrosinkinaseaktivität innerhalb der Zelle blockiert, verhindert es die Signalübertragung über den für das Zellwachstum wichtigen Wachstumsfaktorrezeptor HER1 (humaner epidermaler Wachstumsfaktor-Rezeptor 1), auch EGFR (epidermal growth factor receptor).
Zugelassene Anwendungsgebiete
Bei nicht-kleinzelligem Lungenkrebs (Non Small Cell Lung Cancer, NSCLC) wird Erlotinib in fortgeschrittenen Krankheitsstadien angewendet, bei denen eine übliche Chemotherapie versagt hat und eine L858R-Mutation im epidermalen Wachstumsfaktorrezeptor (EGFR) vorliegt.[3]
Lebensverlängernde Wirkungen bei nicht-kleinzelligem Lungenkrebs wurden in der am M.D. Anderson Krebszentrum in Houston durchgeführten TRIBUTE-Studie[4] jedoch nur für lebenslange Nichtraucher nachgewiesen.
| Zeitpunkt | Zulassungsbedingung |
|---|---|
| Nichtkleinzelliges Bronchialkarzinom (NSCLC) | |
| Erstlinie | bei NSCLC mit EGFR-Mutation |
| Wechsel-Erhaltungstherapie | bei lokal fortgeschrittenem oder metastasiertem NSCLC mit aktivierenden EGFR-Mutationen und unverändertem Krankheitszustand nach First-Line-Therapie |
| Zweitlinie | bei NSCLC mit oder ohne EGFR-Mutation |
| Metastasiertes Pankreaskarzinom | |
| Erstlinie | in Kombination mit Gemcitabin |
Zum Einsatz von Erlotinib als Erstmedikation und in der Kombinationstherapie bei Lungenkrebs werden zurzeit Studien durchgeführt.
Seit September 2005 ist Erlotinib in der EU zur Therapie bei fortgeschrittenem oder metastasiertem Lungenkrebs (NSCLC), die mindestens eine vorangegangene Chemotherapie erhalten haben, zugelassen. Die Zulassung wurde unabhängig vom EGFR-Mutationsstatus erteilt. In den folgenden Jahren wurde die Zulassung erweitert, so dass Erlotinib mittlerweile auch als Erstlinientherapie bei der oben genannten Patientengruppe, falls eine EGFR-Mutation vorliegt, zugelassen ist.[6]
Die empfohlene Dosis beim Bronchialkarzinom beträgt einmal täglich 150 mg.[5]
Im Januar 2007 erfolgte die Zulassung von Tarceva in Kombination mit dem Chemotherapeutikum Gemcitabin in der Erstlinientherapie von Patienten mit metastasiertem Bauchspeicheldrüsenkrebs (Pankreaskarzinom). Für das nicht-metastasierte, lokal fortgeschrittene Pankreaskarzinom konnte kein Überlebensvorteil nachgewiesen werden und hierfür besteht auch keine Zulassung.[7]
Die empfohlene Dosis beim Pankreaskarzinom beträgt einmal täglich 100 mg.[5]
Nebenwirkungen
Die häufigsten Nebenwirkungen von Erlotinib sind ein Akne-ähnlicher Hautausschlag (“Rash”) und Durchfall, während die hämatologische Toxizität insbesondere im Vergleich mit alternativen Medikamenten wie Pemetrexed oder Docetaxel gering ist. Der sogenannte Rash tritt bei etwa zwei Dritteln der mit Erlotinib behandelten Patienten in unterschiedlicher Ausprägung auf. Die Ergebnisse klinischer Studien zeigen, dass ein Zusammenhang zwischen der Stärke des Hautausschlages und dem Ansprechen auf das Medikament besteht: Je stärker der Rash, desto höher das Ansprechen auf Erlotinib.
Im Mai 2009 informierte die Hoffmann-La Roche AG Heilberufangehörige über das Bundesinstitut für Arzneimittel und Medizinprodukte über das erhöhte Risiko unter der Therapie von Erlotinib eine Magen-Darm-Perforation zu erleiden. Entsprechend sei die gleichzeitige Anwendung von Schmerzmitteln des Typs der nichtsteroidalen Antiphlogistika kontraindiziert.[8]
Handelsname
Tarceva (EU, CH, USA), (Roche)
Weblinks
- Seite über Erlotinib/Tarceva. Europäische Zulassungsbehörde
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 4-[(3-Ethynylphenyl)amino]-6,7-bis(2-methoxyethoxy)quinazoline im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Februar 2020.
- Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 160 kB) European Medicines Agency, EMA (deutsch).
- A $67 Million Fine for False Claims on Erlotinib. In: The American Journal of Managed Care (englisch).
- Erlotinib (Tarceva®) Plus Chemotherapy Fails to Improve Overall Survival in Non-Small Cell Lung Cancer (Memento vom 2. März 2009 im Internet Archive)
- ANHANG I: ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. (PDF) Europäische Arzneimittelagentur, abgerufen am 3. Januar 2016.
- Breiter Einsatzbereich von Erlotinib beim NSCLC. Oncotrends, 4. Juni 2014, abgerufen am 3. Januar 2016.
- Summary of the European Public Assessment Report (EPAR). European Medicines Agency, EMA (englisch).
- Rote-Hand-Brief Informationen über das Auftreten von Magen-Darm-Perforationen im Zusammenhang mit der Anwendung von Erlotinib (Tarceva) (PDF; 656 kB) vom 25. Mai 2009; abgerufen am 31. Mai 2012.