BRCA1
BRCA1 (BReast CAncer 1, early-onset), in einigen Publikationen auch als Brustkrebsgen 1 bezeichnet, ist ein menschliches Gen, bzw. dessen Genprodukt, also ein Protein. Es handelt sich dabei um ein Tumorsuppressorgen, was heißt, dass das Gen in seiner Funktion zur Unterdrückung von Tumoren beiträgt.
| BRCA1 | ||
|---|---|---|
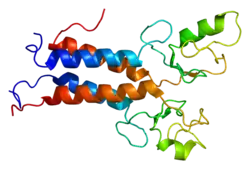
| ||
| nach 1jm7 | ||
| Andere Namen |
RING Fingerprotein 53 | |
|
Vorhandene Strukturdaten: 1JM7, 1JNX, 1N5O, 1OQA, 1T15, 1T29, 1T2U, 1T2V, 1Y98, 2ING, 3COJ, 3K0H, 3K0K, 3K15, 3K16, 3PXA, 3PXB, 3PXC, 3PXD, 3PXE, 4IFI, 4IGK, 4JLU, 4OFB, 4U4A, 4Y18, 4Y2G | ||
| Masse/Länge Primärstruktur | 7 bis 210 Kilodalton / 63 bis 1884 Aminosäuren (je nach Isoform) | |
| Isoformen | 8 | |
| Bezeichner | ||
| Gen-Name(n) | BRCA1 RNF53 | |
| Externe IDs | ||

Funktion von BRCA1
BRCA1 spielt eine wichtige Rolle in der Reparatur von Doppelstrangbrüchen. Eine Loss-of-function-Mutation oder Deletion des BRCA1-Gens erhöht die Wahrscheinlichkeit einer Tumorbildung, insbesondere für Brustkrebs (Mammakarzinom), Eierstockkrebs (Ovarialkarzinom), Dickdarmkrebs (Kolonkarzinom) und Prostatakarzinom. Das von BRCA1 codierte Protein besteht aus 1863 Aminosäuren und hat eine molare Masse von 207.732 Dalton. Es interagiert im Zellkern vieler normaler Körperzellentypen mit dem vom BRCA3 codierten Protein (RAD51C) und dem von BRCA2 codierten Protein. Alle drei Proteine zusammen reparieren Unterbrechungen in geschädigter DNA. Diese Unterbrechungen können beispielsweise durch ionisierende Strahlungen hervorgerufen werden. Aber auch bei der Zellteilung können diese Unterbrechungen natürlicherweise entstehen. Die Funktionen und Interaktionen der drei DNA-Reparaturproteine sind Gegenstand intensiver Forschungsarbeiten und noch nicht vollständig aufgeklärt bzw. verstanden.[1]
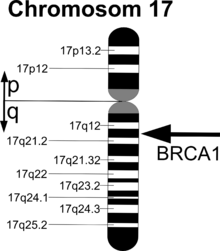
Die Lage von BRCA1 im Genom
Das BRCA1-Gen liegt beim Menschen auf dem langen Arm (q-Arm) von Chromosom 17 Genlocus q21.31 zwischen den Basenpaaren 41.196.311-41.277.500.[2] Momentan sind 31 verschiedene Transkripte (Isoformen) bekannt.[3]
Auswirkungen von BRCA1-Mutationen
Es wird angenommen, dass etwa 5 bis 10 Prozent aller Brustkrebserkrankungen einen autosomal dominanten Erbgang aufweisen. BRCA1 ist dabei das mit Abstand wichtigste verursachende Gen.[4][5][6][7] Frauen mit einer vererbten, also Keimbahn-Mutation in BRCA1 oder BRCA2 erkranken im Durchschnitt etwa 20 Jahre früher als Frauen ohne familiär-erbliches Risiko. Das Risiko einer Frau mit BRCA1- oder BRCA2-Mutation, im Laufe ihres Lebens an Brustkrebs zu erkranken, liegt bei etwa 50 bis 80 Prozent. Falls bei einer Mutationsträgerin in einer Brust schon Brustkrebs aufgetreten ist, liegt die Wahrscheinlichkeit, dass sich später auch in der anderen Brust eine Krebserkrankung entwickeln wird, bei etwa 60 Prozent.[7] Daneben stellen BRCA1-Mutationen auch einen Risikofaktor für die Entstehung von Ovarial-, Kolon-, Pankreas- und Prostatakarzinomen dar. Das lebenslange Risiko von BRCA1- oder BRCA2-Mutationsträgerinnen, ein Ovarialkarzinom zu entwickeln, wird auf etwa 10 bis 40 Prozent geschätzt.[7]
Auch Mutationen in den erst vor wenigen Jahren identifizierten Genen RAD51C (BRCA3) und RAD51D (beide auf dem langen Arm von Chromosom 17) scheinen ein ähnlich hohes Risiko für Brustkrebs zu vermitteln.[7]
Das amerikanische Nationale Krebsinstitut NCI betont, dass die meisten Untersuchungen über die Auswirkungen des BRCA1- und BRCA2-Gen an Familien durchgeführt wurden, in denen ein stark erhöhtes Auftreten von entsprechenden Krebserkrankungen vorhanden ist. Da sich die Familienmitglieder auch andere Gene teilen und sie häufig auch denselben Umwelteinflüssen unterworfen sind, gäben die Risikoeinschätzungen dieser Untersuchungen das Risiko einer Krebserkrankung durch BRCA-Genmutation der Allgemeinbevölkerung möglicherweise nicht angemessen wieder. Darüber hinaus lägen keine Zahlen aus der Allgemeinbevölkerung vor, die das Krebsrisiko von Trägerinnen einer BRCA1- oder BRCA2-Mutation, mit dem von Frauen ohne diese Mutation verglichen.[8]
BRCA1-Gentest
Es gibt einen Gentest, mit dessen Hilfe festgestellt werden kann, ob eine Patientin eine mutierte Form des BRCA1-Gens hat. Die Kosten für den Test betrugen im Jahr 2004 ca. 2500 Euro.[9] Mittlerweile kostet der kombinierte BRCA1-BRCA2-Test in Europa weniger als 1500 Euro.[10]
Für Frauen mit familiärer Belastung für Brust- und Eierstockkrebs übernehmen die gesetzlichen Krankenkassen die Kosten für Beratung, Gentest und Früherkennungsprogramm. Als sinnvoll wird die Durchführung des Tests angesehen, wenn eines der folgenden Kriterien zutrifft:
- mindestens zwei Frauen in der Familie sind oder waren an Brustkrebs erkrankt, davon mindestens eine vor dem 51. Lebensjahr
- drei Frauen mit Brustkrebs in der Familie (unabhängig vom Erkrankungsalter)
- eine Erkrankung in der Familie mit einseitigem Brustkrebs und einem Erkrankungsalter vor dem 31. Lebensjahr
- ein Fall von beidseitigem Brustkrebs in der Familie, wobei die erste Erkrankung im Alter von 41 Jahren oder früher aufgetreten ist
- ein Fall von Eierstockkrebs in der Familie, wenn die Erkrankung vor dem 41. Lebensjahr aufgetreten ist
- ein Fall in der Familie mit Brust- und Eierstockkrebs
- zwei oder mehr Fälle von Eierstockkrebs in der Familie.[11]
Vor und nach Durchführung des Gentests sind intensive Gespräche mit der Patientin von großer Wichtigkeit.[12][13]
2008 wurden am University College Hospital in London erstmals bei einer Frau nach einer In-vitro-Fertilisation die befruchteten Embryonen mittels Präimplantationsdiagnostik (PID) auf das BRCA1-Gen hin untersucht. Sechs der elf im „Reagenzglas“ erzeugten Embryonen trugen bei der drei Tage nach der Befruchtung durchgeführten PID das mutierte BRCA1-Gen und wurden zerstört. Zwei der verbliebenen Embryonen wurden in die Gebärmutter verpflanzt. Eines der Embryonen nistete sich erfolgreich ein. Die Mutter gebar Anfang Januar 2009 ein Mädchen.[14] Der Vorgang führte zu kontroversen Diskussionen, da diese Form der genetischen Selektion von Babys äußerst umstritten ist.[15]
Prävention
Patientinnen mit einer genetischen Prädisposition von BRCA1 bieten sich derzeit mehrere primär und sekundär präventive Maßnahmen an.[16]
Primäre Prävention
Unter primärer Prävention, auch Prophylaxe genannt, versteht man Maßnahmen zur Gesundheitsförderung beziehungsweise Gesunderhaltung des Patienten.
Chemoprävention
In mehreren Studien wurde die adjuvante Therapie mit Tamoxifen, im Vergleich zur Placebogabe, bezüglich der primären Prävention einer Brustkrebserkrankung untersucht. Tamoxifen ist ein selektiver Estrogenrezeptormodulator, der als Arzneistoff zur Therapie von Mammakarzinomen eingesetzt wird. Der Wirkstoff ist von der amerikanischen FDA auch zur Prävention von Brustkrebs bei Frauen mit erhöhtem Risiko zugelassen.
Vier Jahre nach Beginn der sogenannten NASABP P-1-Studie war das Risiko für Östrogenrezeptor-positive Formen von Brustkrebs durch Tamoxifen um 49 Prozent reduziert.[17] In den zwei nachfolgenden Studien konnten diese Risikoreduktion jedoch nicht nachgewiesen werden.[18][19]
Vorbeugende Entfernung der Eierstöcke und Eileiter
In mehreren Studien konnte gezeigt werden, dass eine beidseitige vorbeugende Entfernung der Eierstöcke und Eileiter (eine Salpingoovariektomie) eine Senkung des Krebsrisikos bei Trägerinnen einer BRCA1-Mutation bewirkt. Es sollten immer Eileiter und Eierstöcke bds. entfernt werden, da auch die Eileiter krebsgefährdet sind.[20]
Die Gesamtüberlebensrate über 30 Jahre wird durch eine Salpingoovariektomie im Alter von 40 Jahren um 15 % (absolut) erhöht. Eine Salpingoovariektomie zum früheren Zeitpunkt erhöht die Überlebensrate nicht und führt zu vermehrten unerwünschten Nebenwirkungen, vor allen Dingen Wechseljahresbeschwerden und Osteoporose. Bei BRCA2 Mutationen bringt eine Ovariektomie eine bestenfalls marginale Verbesserung der Gesamtüberlebensrate.[21]
Vorbeugende Entfernung der Brüste
Die vorbeugende Amputation der Brüste (prophylaktische Mastektomie) ist durch Fortschritte beim Screening und in der Behandlung vom Brustkrebs weitgehend unnötig geworden. Zwar wird das Brustkrebsrisiko weitestgehend eliminiert, der daraus resultierende Überlebensvorteil ist jedoch bestenfalls marginal.[21]
In mehreren randomisierten Studien konnte gezeigt werden, dass das Brustkrebsrisiko bei Mutationsträgerinnen von BRCA1 und BRCA2 durch eine vorbeugende beidseitige Brustentfernung (bilaterale prophylaktische Mastektomie) um über 90 Prozent gesenkt werden kann.[22][23][24][25]
Sekundäre Prävention
Das Ziel der sekundären Prävention ist es, die Mortalität durch Früherkennungsuntersuchungen zu reduzieren.[16]
Mammographie
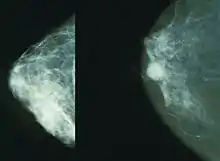

Mammographie-Reihenuntersuchungen ab dem 50. Lebensjahr können insgesamt eine Senkung der Mortalität von bis zu 30 Prozent erzielen.[26] Der Hauptgrund für diese Erfolge liegt im frühzeitigen Erkennen von kleinen, Lymphknoten-negativen und hoch differenzierten Karzinomen.[27] BRCA1 und BRCA2 basierende Brustkrebserkrankungen sind jedoch nur gering differenziert (Differenzierungsgrad G3).[28] Zudem sind die Risikopatientinnen in der Mehrzahl jünger als die durchschnittlichen Brustkrebs-Patientinnen. Dadurch haben sie ein dichteres, mammografisch nur schwer beurteilbares Drüsengewebe.
Ein weiteres potenzielles Problem der Mammographie an BRCA1- und BRCA2-Risikopatientinnen stellt die ionisierende Röntgenstrahlung der Untersuchungsmethode dar, die möglicherweise DNA-Schäden in den Zellen der Patientinnen verursacht. Diese Schäden können durch die Mutationen der BRCA1- und BRCA2-Gene mit den entsprechenden Proteinen möglicherweise nicht ausreichend repariert werden (siehe BRCA1 und ionisierende Strahlungen).
Sonographie
Ultraschalluntersuchungen der Brust sind bei jungen Frauen mit einem erhöhten familiären Brustkrebsrisiko deutlich sensitiver als Mammographien.[29] Es liegen zu einer abschließenden Beurteilung allerdings noch zu wenige Daten aus Studien vor.
Kernspintomographie
Die Magnetresonanztomographie (MRT) ist derzeit bei der Diagnostik der genetisch bedingten Brustkrebserkrankungen das Verfahren mit der höchsten Sensitivität. Die Spezifität hingegen ist weniger hoch, sodass mitunter falsch positive Befunde erhoben werden und die korrekte Auswertung eine hohe Erfahrung des Radiologen voraussetzt. Es sollte das Diagnoseverfahren der Wahl bei jungen Frauen mit genetisch nachgewiesenem erhöhtem Mammakarzinom-Risiko sein.[16]
BRCA1 und ionisierende Strahlungen
Ionisierende Strahlungen, wie beispielsweise Röntgenstrahlung, sind in der Lage Schäden an der DNA zu verursachen. Diese Schäden an der DNA können Tumoren verursachen. Da die Zellen des Körpers über ein DNA-Reparatursystem verfügen, können in den meisten Fällen die durch die ionisierende Strahlung entstandenen Schäden wieder repariert werden. Träger von Mutationen in den BRCA1- oder BRCA2-Genen verfügen jedoch in ihren Körperzellen über eine verminderte Fähigkeit zur DNA-Reparatur.
In einer retrospektiven Studie an der International Agency for Research on Cancer in Lyon wurde untersucht, ob Röntgenuntersuchungen des Thorax möglicherweise das Brustkrebsrisiko erhöhen. Nach einer einmaligen Röntgenuntersuchung des Thorax erkrankten BRCA1/2-Trägerinnen zu 54 Prozent häufiger an Brustkrebs. Das Risiko erhöhte sich deutlich bei Frauen unter 40 Jahren, und Frauen, die vor dem 20. Lebensjahr eine entsprechende Untersuchung erhalten hatten, erkrankten mehr als viermal häufiger als Frauen, deren Thorax niemals geröntgt wurde.[30]
Diese erste Studie lässt jedoch noch keine abschließende Beurteilung der Risiken von Röntgenuntersuchungen oder speziell Mammografien bei Risikopatientinnen zu. Retrospektiven Studien sind durch den sogenannten Recall Bias häufig verfälscht. So erinnerten sich beispielsweise Frauen, die an Brustkrebs erkrankt sind, möglicherweise häufiger an zurückliegende Röntgenuntersuchungen. Zudem fehlen in der Studie die Daten über die Dosis bei der Röntgenuntersuchung. Kausale Assoziationen sind über die Dosis-Wirkungs-Beziehung viel eindeutiger herzustellen.[30]
Eine Studie über die Erhöhung des Brustkrebsrisikos durch Mammografie bei Frauen mit BRCA1- oder BRCA2-Genmutationen kommt zu dem Schluss, dass es offenbar keinen Zusammenhang zwischen Mammografie und einer deutlichen Zunahme von Krebserkrankungen in dieser Personengruppe gibt.[31]
Die Entdeckung von BRCA1
Eine Forschergruppe um den US-Amerikaner J.M. Hall entdeckte 1990 das später mit BRCA1 bezeichnete Gen durch Kopplungsanalysen bei Mormonen-Familien auf Chromosom 17.[32] Die Entdeckung des Brustkrebsgens war zum damaligen Zeitpunkt revolutionär und heftig umstritten. Eine genetische Prädisposition als eine Ursache für eine Krebserkrankung sprach gegen die damalige Lehrmeinung. 1994 wurde BRCA1 von Miki als erstes Brustkrebsgen kloniert.[33]
1994 wurde mit BRCA2 auf dem Chromosom 13 Genlocus q12-13 ein zweites Brustkrebsgen kartiert und positionell kloniert.[34]
Bisher sind mehr als 75 verschiedene Mutationen von BRCA1 in mehr als 100 Familien beschrieben.[35][36][37]
BRCA1-Patente
Im Januar 2001 erteilte das Europäische Patentamt in München dem US-Biotech-Unternehmen Myriad Genetics ein Patent (EP 699 754) auf BRCA1.[38] Dies führte zu erheblichen internationalen Protesten.[39] 2004 widerrief dann das Europäische Patentamt die Rechte von Myriad.[9] Der Grund für den Widerruf war ein Fehler in der von Myriad im Patent beschriebenen Gen-Sequenz. Im November 2004 trat Myriad die US-Patentrechte an die University of Utah ab. Es wurde dann ein neuer Antrag beim Europäischen Patentamt gestellt, dem im Dezember 2008 endgültig stattgegeben wurde. Die University of Utah kann nun für jeden auf dem Markt befindlichen BRCA1- und BRCA2-Test Lizenzgebühren verlangen. Es ist noch nicht bekannt, ob sie dies auch zukünftig tun wird. Während in Europa der kombinierte BRCA1/2-Test maximal 1500 Euro kostet, ist in den USA der BRCA1-Test – bedingt durch die Lizenzgebühren – schon mehr als doppelt so teuer. In der Länderliste der europäischen Patentanmeldung der University of Utah wurden jedoch kleinere europäische Länder nicht aufgeführt. Dies bedeutet, dass der Test in Ländern wie beispielsweise Belgien auch zukünftig ohne Lizenzgebühren möglich ist.[10]
Siehe auch
Weiterführende Literatur
- S. V. Hodgson, P. J. Morrison, M. Irving: Breast cancer genetics: unsolved questions and open perspectives in an expanding clinical practice. In: American journal of medical genetics. Part C, Seminars in medical genetics Band 129C, Nummer 1, August 2004, S. 56–64, doi:10.1002/ajmg.c.30019. PMID 15264273. (Review).
- A. R. Venkitaraman: Cancer susceptibility and the functions of BRCA1 and BRCA2. In: Cell Band 108, Nummer 2, Januar 2002, S. 171–182, PMID 11832208. (Review).
- S. N. Powell, L. A. Kachnic: Roles of BRCA1 and BRCA2 in homologous recombination, DNA replication fidelity and the cellular response to ionizing radiation. In: Oncogene Band 22, Nummer 37, September 2003, S. 5784–5791, doi:10.1038/sj.onc.1206678. PMID 12947386. (Review).
- A. Antoniou, P. D. Pharoah, S. Narod, H. A. Risch, J. E. Eyfjord, J. L. Hopper, N. Loman, H. Olsson, O. Johannsson, A. Borg, B. Pasini, P. Radice, S. Manoukian, D. M. Eccles, N. Tang, E. Olah, H. Anton-Culver, E. Warner, J. Lubinski, J. Gronwald, B. Gorski, H. Tulinius, S. Thorlacius, H. Eerola, H. Nevanlinna, K. Syrjäkoski, O. P. Kallioniemi, D. Thompson, C. Evans, J. Peto, F. Lalloo, D. G. Evans, D. F. Easton: Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. In: American Journal of Human Genetics Band 72, Nummer 5, Mai 2003, S. 1117–1130, doi:10.1086/375033. PMID 12677558. PMC 118026 (freier Volltext).
- Gentest und prophylaktische Operation bei familiärer Häufung der BRCA1- oder BRCA2-Mutation. In: Der Gynäkologe 33, 2000.
- Stellungnahme zur Entdeckung des Brustkrebsgens BRCA1., Kommission für Öffentlichkeitsarbeit und ethische Fragen der Gesellschaft für Humangenetik e. V., 7. Auflage Okt. 2001. (PDF; 18 kB)
Weblinks
- Matthews/reactome: Phosphorylation of BRCA1 at multiple sites by ATM
- Penelope Farmer: Life within Fiction. Blog über den Kampf mit dem BRCA1-Krebs; ab 8. Mai 2015.
Einzelnachweise
- S. J. Boulton: Cellular functions of the BRCA tumour-suppressor proteins. In: Biochemical Society Transactions Band 34, November 2006, S. 633–645, doi:10.1042/BST0340633. PMID 17052168. (Review).
- genome.ucsc.edu: Human chr17:41,196,312-41,277,500 - UCSC Genome Browser v307
- ensemble.org: Ensemble Browser release 54
- J. M. Hall, M. K. Lee, B. Newman, J. E. Morrow, L. A. Anderson, B. Huey, M. C. King: Linkage of early-onset familial breast cancer to chromosome 17q21. In: Science Band 250, Nummer 4988, Dezember 1990, S. 1684–1689, PMID 2270482.
- mit.edu: MARY-CLAIRE KING - Genetic breast cancer detection. Abgerufen am 22. November 2007
- K. Hemminki, X. Li, K. Czene: Familial risk of cancer: data for clinical counseling and cancer genetics. In: International journal of cancer Band 108, Nummer 1, Januar 2004, S. 109–114, doi:10.1002/ijc.11478. PMID 14618624.
- Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms. (PDF; 4,7 MB) Langversion 3.0, Aktualisierung 2012. DKG/Deutsche Krebshilfe|AWMF, archiviert vom Original am 12. Mai 2013; abgerufen am 22. November 2021 (Seite 42 ff, Abschnitt 3.3.: Frauen mit erhöhtem Risiko für Brustkrebs, 3.3.1. Familiäres Mammakarzinom).
- National Cancer Institute: BRCA1 and BRCA2: Cancer Risk and Genetic Testing
- C. Berndt: Brustkrebs-Gentest freigegeben – Patentamt widerruft Rechte einer US-Firma zum Krebsgen BRCA1. In: Süddeutsche Zeitung Ausgabe vom 19. Mai 2004, Wissen, S. 12.
- aerzteblatt.de: Patentschutz für Krebsgen BRCA1 (Memento vom 7. Dezember 2008 im Internet Archive)
- K. Ullrich: BRCA1/2-Testung: Kriterien wurden modifiziert. In: Medical Tribune. Nr. 2, April 2008, S. 7.
- H. Keßler: Brustkrebs: Früherkennung durch Gentest – Erlösung oder Schicksalsschlag: wie ein Gentest das Leben von Frauen verändert. In: Die Zeit, Nr. 12/1996
- Beckmann MW, Hochrisikofamilien mit Mamma- und Ovarialkarzinomen: Möglichkeiten der Beratung, genetischen Analyse und Früherkennung., In Deutsches Ärzteblatt, 94, 1997, S. A161–A167
- unbekannt: Erstes Baby ohne Brustkrebs-Gen in London geboren. In: Sächsische Zeitung, 10. Januar 2009
- Erstes Baby ohne Brustkrebs-Gen in London erwartet. In: Neue Zürcher Zeitung, 20. Dezember 2008
- H. Eggemann: Das hereditäre Mammakarzinom – wieviele Frauen sind bedroht und was wird zur Prophylaxe / Therapie empfohlen? In: Journal Onkologie, Ausgabe 08/2005, Zeitschrift Online
- Fisher B et al., Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. In: J Natl Cancer Inst, 90/1998, S. 1371–88.
- T. Powles, R. Eeles, S. Ashley, D. Easton, J. Chang, M. Dowsett, A. Tidy, J. Viggers, J. Davey: Interim analysis of the incidence of breast cancer in the Royal Marsden Hospital tamoxifen randomised chemoprevention trial. In: The Lancet Band 352, Nummer 9122, Juli 1998, S. 98–101, doi:10.1016/S0140-6736(98)85012-5. PMID 9672274.
- U. Veronesi, P. Maisonneuve, A. Costa, V. Sacchini, C. Maltoni, C. Robertson, N. Rotmensz, P. Boyle: Prevention of breast cancer with tamoxifen: preliminary findings from the Italian randomised trial among hysterectomised women. Italian Tamoxifen Prevention Study. In: Lancet Band 352, Nummer 9122, Juli 1998, S. 93–97, PMID 9672273.
- T. R. Rebbeck, A. M. Levin, A. Eisen, C. Snyder, P. Watson, L. Cannon-Albright, C. Isaacs, O. Olopade, J. E. Garber, A. K. Godwin, M. B. Daly, S. A. Narod, S. L. Neuhausen, H. T. Lynch, B. L. Weber: Breast cancer risk after bilateral prophylactic oophorectomy in BRCA1 mutation carriers. In: Journal of the National Cancer Institute Band 91, Nummer 17, September 1999, S. 1475–1479, PMID 10469748.
- A. W. Kurian, B. M. Sigal, S. K. Plevritis: Survival analysis of cancer risk reduction strategies for BRCA1/2 mutation carriers. In: Journal of clinical oncology Band 28, Nummer 2, Januar 2010, S. 222–231, doi:10.1200/JCO.2009.22.7991. PMID 19996031. PMC 2815712 (freier Volltext).
- H. Meijers-Heijboer, B. van Geel, W. L. van Putten, S. C. Henzen-Logmans, C. Seynaeve, M. B. Menke-Pluymers, C. C. Bartels, L. C. Verhoog, A. M. van den Ouweland, M. F. Niermeijer, C. T. Brekelmans, J. G. Klijn: Breast cancer after prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 mutation. In: The New England Journal of Medicine Band 345, Nummer 3, Juli 2001, S. 159–164, doi:10.1056/NEJM200107193450301. PMID 11463009.
- T. R. Rebbeck, T. Friebel, H. T. Lynch, S. L. Neuhausen, L. van 't Veer, J. E. Garber, G. R. Evans, S. A. Narod, C. Isaacs, E. Matloff, M. B. Daly, O. I. Olopade, B. L. Weber: Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. In: Journal of clinical oncology Band 22, Nummer 6, März 2004, S. 1055–1062, doi:10.1200/JCO.2004.04.188. PMID 14981104.
- L. C. Hartmann, D. J. Schaid, J. E. Woods, T. P. Crotty, J. L. Myers, P. G. Arnold, P. M. Petty, T. A. Sellers, J. L. Johnson, S. K. McDonnell, M. H. Frost, R. B. Jenkins: Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer. In: The New England journal of medicine Band 340, Nummer 2, Januar 1999, S. 77–84, doi:10.1056/NEJM199901143400201. PMID 9887158.
- L. C. Hartmann, T. A. Sellers, D. J. Schaid, T. S. Frank, C. L. Soderberg, D. L. Sitta, M. H. Frost, C. S. Grant, J. H. Donohue, J. E. Woods, S. K. McDonnell, C. W. Vockley, A. Deffenbaugh, F. J. Couch, R. B. Jenkins: Efficacy of bilateral prophylactic mastectomy in BRCA1 and BRCA2 gene mutation carriers. In: Journal of the National Cancer Institute Band 93, Nummer 21, November 2001, S. 1633–1637, PMID 11698567.
- G. Pichert, B. Bolliger, K. Buser, O. Pagani: Evidence-based management options for women at increased breast/ovarian cancer risk. In: Annals of Oncology Band 14, Nummer 1, Januar 2003, S. 9–19, PMID 12488287. (Review).
- I. Schreer: Brustkrebs-Stand des Wissens zur Früherkennung. In: Forum DKG 13, 1998, S. 546–550.
- Pathology of familial breast cancer: differences between breast cancers in carriers of BRCA1 or BRCA2 mutations and sporadic cases. Breast Cancer Linkage Consortium. In: Lancet Band 349, Nummer 9064, Mai 1997, S. 1505–1510, PMID 9167459.
- E. Warner, D. B. Plewes, R. S. Shumak, G. C. Catzavelos, L. S. Di Prospero, M. J. Yaffe, V. Goel, E. Ramsay, P. L. Chart, D. E. Cole, G. A. Taylor, M. Cutrara, T. H. Samuels, J. P. Murphy, J. M. Murphy, S. A. Narod: Comparison of breast magnetic resonance imaging, mammography, and ultrasound for surveillance of women at high risk for hereditary breast cancer. In: Journal of clinical oncology : official journal of the American Society of Clinical Oncology Band 19, Nummer 15, August 2001, S. 3524–3531, PMID 11481359.
- aerzteblatt-studieren.de: Röntgenthorax erhöht Brustkrebsrisiko bei BRCA-1/2-Genträgerinnen (Memento vom 3. September 2007 im Internet Archive)
- D. Goldfrank, S. Chuai, J. L. Bernstein, T. Ramon Y Cajal, J. B. Lee, M. C. Alonso, O. Diez, M. Baiget, N. D. Kauff, K. Offit, M. Robson: Effect of mammography on breast cancer risk in women with mutations in BRCA1 or BRCA2. In: Cancer Epidemiology, Biomarkers & Prevention Band 15, Nummer 11, November 2006, S. 2311–2313, doi:10.1158/1055-9965.EPI-06-0176. PMID 17119064.
- J. M. Hall, M. K. Lee, B. Newman, J. E. Morrow, L. A. Anderson, B. Huey, M. C. King: Linkage of early-onset familial breast cancer to chromosome 17q21. In: Science Band 250, Nummer 4988, Dezember 1990, S. 1684–1689, PMID 2270482, siehe auch H. Pidde: Physikalische Kartierung und Genomische Struktur des Kariopherin Alpha 2 Gens. Dissertation, FU Berlin, 2000.
- Y. Miki, J. Swensen, D. Shattuck-Eidens, P. A. Futreal, K. Harshman, S. Tavtigian, Q. Liu, C. Cochran, L. M. Bennett, W. Ding: A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. In: Science Band 266, Nummer 5182, Oktober 1994, S. 66–71, PMID 7545954.
- R. Wooster, S. L. Neuhausen, J. Mangion, Y. Quirk, D. Ford, N. Collins, K. Nguyen, S. Seal, T. Tran, D. Averill: Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. In: Science Band 265, Nummer 5181, September 1994, S. 2088–2090, PMID 8091231.
- C. I. Szabo, M. C. King: Inherited breast and ovarian cancer. In: Human molecular genetics Band 4 Spec No, 1995, S. 1811–1817, PMID 8541881. (Review).
- J. Feunteun, G. M. Lenoir: BRCA1, a gene involved in inherited predisposition to breast and ovarian cancer. In: Biochimica et biophysica acta Band 1242, Nummer 3, März 1996, S. 177–180, PMID 8603070. (Review).
- S. L. Neuhausen, S. Mazoyer, L. Friedman, M. Stratton, K. Offit, A. Caligo, G. Tomlinson, L. Cannon-Albright, T. Bishop, D. Kelsell, E. Solomon, B. Weber, F. Couch, J. Struewing, P. Tonin, F. Durocher, S. Narod, M. H. Skolnick, G. Lenoir, O. Serova, B. Ponder, D. Stoppa-Lyonnet, D. Easton, M. C. King, D. E. Goldgar: Haplotype and phenotype analysis of six recurrent BRCA1 mutations in 61 families: results of an international study. In: American Journal of Human Genetics Band 58, Nummer 2, Februar 1996, S. 271–280, PMID 8571953. PMC 1914544 (freier Volltext).
- München: Neues Patent auf Brustkrebs-Gen erteilt. In: Welt Online, 1. Dezember 2001
- Kein umfassendes Patent auf das Brustkrebsgen. Greenpeace, 28. September 2007, abgerufen am 15. Februar 2017.