Flusspferd
Das Flusspferd (Hippopotamus amphibius), auch Großflusspferd genannt, ist eine Säugetierart aus der Familie der Flusspferde und der Ordnung der Paarhufer. Innerhalb der Gattung Hippopotamus gilt es inzwischen als einziges Mitglied. Nach den Elefanten und neben einigen Vertretern der Nashörner und der Giraffen zählt es zu den größten landbewohnenden Tieren. Besondere Kennzeichen stellen der große, fassförmige und weitgehend haarlose Körper, die kurzen Gliedmaßen und der massige Kopf mit einem breiten Maul dar, in dem die Schneidezähne und vor allem die unteren Eckzähne vergrößert sind. Als Anpassung an eine teils wasserbewohnende Lebensweise liegen die Ohren, die Augen und die Nasenlöcher sehr weit oben am Kopf. Das Verbreitungsgebiet des Flusspferdes umfasst das Afrika südlich der Sahara und ist teils stark fragmentiert. Als hauptsächliche Lebensräume fungieren offene Landschaften und Waldgebiete, jedoch fehlt es weitgehend im tropischen Regenwald. Ursprünglich kam das Flusspferd auch entlang des Nils bis zu seinem Mündungsdelta vor, woher der gebräuchliche Name Nilpferd rührt. Am gesamten Unterlauf des Nils ist es heute ausgestorben, am Weißen und am Blauen Nil existieren noch Bestände.
| Flusspferd | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
%252C_parque_nacional_de_Chobe%252C_Botsuana%252C_2018-07-28%252C_DD_80.jpg.webp)
Flusspferd (Hippopotamus amphibius) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Hippopotamus | ||||||||||||
| Linnaeus, 1758 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Hippopotamus amphibius | ||||||||||||
| Linnaeus, 1758 |
Die Tiere halten sich am Tag in Gewässern auf. Ihre hauptsächlichen Aktivitäten beginnen zur Dämmerungszeit oder nachts, wenn sie die Ruheplätze verlassen und zu ihren Weidegründen an Land gehen. Sie sind überwiegend Pflanzenfresser und ernähren sich von unterschiedlichen Grasarten, seltener von Wasserpflanzen und von geplünderten Kulturpflanzen. Unter Umständen fressen sie auch fleischliche Ressourcen. Das Flusspferd zeigt ein komplexes Sozialverhalten. Es kommen verschiedene, jedoch zumeist instabile Gruppenbildungen vor. So formieren sich Verbände aus weiblichen Tieren mit ihrem Nachwuchs, Gruppen aus männlichen Individuen sowie gemischte Zusammenschlüsse. Einzelgängerische männliche Tiere sind häufig territorial gebunden und verteidigen ihr Paarungsvorrecht, solange sie sich in ihrem Revier aufhalten. Die Kommunikation ist vielfältig und besteht aus einem Repertoire an Gesten, von denen das weit geöffnete Maul die bekannteste ist, und Lautäußerungen. Letztere sind bisher nur wenig erforscht. Die Tiere verwenden sie sowohl unter Wasser als auch an Land. Die Paarung und die Geburt des meist einzelnen Jungtieres finden ausschließlich im Wasser statt, ebenso das Säugen. Zwischen dem Geschlechtsakt und der Niederkunft des weiblichen Tieres vergehen rund acht Monate. Durch sein Gruppenleben und den langen Zeitraum, den es im Wasser verbringt, aber auch sein Nahrungsverhalten hat das Flusspferd einen großen ökologischen Einfluss auf seine direkte Umgebung.
Vertreter der Gattung Hippopotamus traten vermutlich im Unteren Pliozän vor rund 5 Millionen Jahren erstmals auf. Der Ursprung liegt in Afrika, wo sie über einen reichhaltigen Fossilbericht mit zahlreichen Arten verfügt. Im Laufe ihrer Stammesgeschichte erreichte sie zudem Vorderasien und Europa. Letzteres besiedelte die Gattung wahrscheinlich mehrfach, da von hier neben einzelnen ursprünglicheren Formen auch Reste des eigentlichen Flusspferdes vorliegen. Die Anwesenheit der Tiere war aber weitgehend auf die Warmzeiten des Pleistozäns beschränkt. Auf einigen Inseln des Mittelmeeres bildeten sich Zwergformen heraus, gleichfalls sind verzwergte Flusspferde von Madagaskar überliefert. Insgesamt wird die Systematik der fossilen Formen von Hippopotamus als überarbeitungsbedürftig eingeschätzt.
Die wissenschaftliche Erstbeschreibung des Flusspferdes als Art und Gattung erfolgte im Jahr 1758. Zuvor wurde es überwiegend in Reiseberichten erwähnt. Eine Haltung in der modernen westlichen Welt ist nicht vor 1850 belegt. Es sind aber zahlreiche Berichte antiker Gelehrter überliefert, die wenigstens bis in das 6. Jahrhundert v. Chr. zurückgehen. In vorgeschichtlicher Zeit dienten die Tiere als Nahrungs- und Rohstoffquelle. Von ihrer Bedeutung zeugen vor allem seit dem ausgehenden Pleistozän und dem Holozän zahlreiche Felsmalereien im nördlichen und südlichen Afrika. Im Alten Ägypten wurde das Flusspferd im Form der Göttin Taweret verehrt. Dem Tier wohnten nach damaligem Glauben fürsorgliche und zerstörerische Kräfte inne. Zu dieser Zeit entstanden zahlreiche Statuetten, die zu den Verstorbenen in die Gräber gelegt wurden.
Der Bestand des Flusspferdes, der schätzungsweise 115.000 bis 130.000 Tiere umfasst, gilt als gefährdet. Hauptbedrohungen sind die Lebensraumzerstörung und die teils intensive Jagd. Es besteht außerdem ein intensiver Handel mit den Zähnen der Tiere. Die Abhängigkeit des Flusspferdes vom Wasser führt darüber hinaus zu Konflikten mit der örtlichen Bevölkerung. Nach einer weit verbreiteten Meinung zählt das Flusspferd zu den gefährlichsten Tieren für den Menschen, wofür es aber keine statistische Grundlage gibt. Außerhalb des angestammten Verbreitungsgebietes des Flusspferdes in Afrika besteht seit den 1990er Jahren eine Population am Río Magdalena in Südamerika, die aus einer aufgegebenen Tierhaltung hervorgegangen ist.
Merkmale
Habitus

_grazing_(12033127823).jpg.webp)
Das Flusspferd ist ein großer und schwerer Vertreter der Paarhufer. Mehrere Untersuchungen wurden an einzelnen Populationen durchgeführt. So ergab sich an über 190 Tieren aus dem Kruger-Nationalpark in Südafrika eine Kopf-Rumpf-Länge von 259 bis 350 cm, eine Schulterhöhe von 110 bis 172 cm und ein Gewicht von 955 bis 1999 kg. Männliche Individuen sind in der Regel größer als weibliche. Die Maße ersterer lauten im Durchschnitt 312 cm, 150 cm und 1546 kg, die letzterer 299 cm, 144 cm und 1385 kg. In Uganda beträgt das Gewicht männlicher Tiere nach Messungen in den 1960er Jahren im Mittel 1536 kg mit einem Maximalwert von 2065 kg, das weiblicher 1386 kg beziehungsweise 1716 kg.[1] Ähnliche Angaben liegen für Untersuchungen an rund 440 Tieren im Murchison-Falls-Nationalpark in Uganda aus den 1950er Jahren vor. Hier wiesen männliche Individuen ein Durchschnittsgewicht von 1475 kg und ein Maximalgewicht von 1895 kg auf, weibliche von 1360 kg und 2018 kg.[2] Für mehrere hundert Tiere aus dem Flussgebiet des Luangwa in Sambia, die in den 1970er Jahren untersucht wurden, betrug die Schulterhöhe bei männlichen Individuen 130 bis 147 cm bei einem Gewicht von 1027 bis 1799 kg, bei weiblichen entsprechend 123 bis 151 cm und 891 bis 1565 kg.[3][4] Das größte bekannte Individuum, ein Bulle, wog 2660 kg.[5][Anm 1] Der Körper besitzt eine charakteristisch fassartige Form mit einem Rumpfumfang von gut 300 cm, die Gliedmaßen sind kurz und kräftig. Sie enden in jeweils vier nach vorn ragenden Zehen, die mit breiten Hufen ausgestattet und mit teilweise ausgebildeten Schwimmhäuten verbunden sind. Der Schwanz ist kurz und breit, seine Länge wird mit 40 bis 56 cm angegeben. Der Kopf zeigt sich massig und breit. Als typische Anpassung an ein semi-aquatisches Leben befinden sich die Ohren, Augen und Nasenöffnungen sehr weit oben am Kopf. Im Vergleich zum großen Kopf sind die Ohren sehr klein. Die Nasenlöcher können durch muskulöse Klappen verschlossen werden. Die Körperfärbung variiert zwischen dunkel rötlichbraun am Rücken und fleischfarben auf der Unterseite, sie ist jedoch individuell sehr verschieden. Die scheinbar nackte Haut ist von kurzen Haaren bedeckt, ihre Dichte liegt bei 20 bis 30 je 100 cm² am Rücken, sie dünnt auf etwa die Hälfte an den Seiten aus, am Bauch ist die Haarbedeckung noch spärlicher. Ein dünner Haarflaum ist auch jeweils an den Kopfseiten, den Lippen und am Nacken ausgebildet. Einige borstenartig dickere Haare finden sich am Maul und Schwanz.[6][7][1]
Schädel- und Gebissmerkmale

Der Schädel des Flusspferdes ist groß und wuchtig. Er wird bei männlichen Tieren 63,5 bis 77,0 cm lang und an den Jochbögen 36,8 bis 48,3 cm breit. Der Hirnschädel ist zwischen 17,4 und 22,2 cm hoch. Bei weiblichen Tieren fallen die Maße etwas geringer aus und lauten entsprechend 57,7 bis 69,0 cm, 32,7 bis 41,1 cm sowie 16,7 und 20,2 cm.[8][9] Der gesamte vordere Schädelabschnitt mit dem Rostrum ist umfangreicher ausgebildet als der hintere. Das Rostrum verbreitert sich nach vorn deutlich, was durch die Zahnfächer der Eckzähne bedingt ist. Auf Höhe der Prämolaren schnürt es wiederum markant ein. Dahinter setzt sich der kleine, rundliche Hirnschädel ab. Das breite Rostrum, die starke Verengung im mittleren Abschnitt und der etwas verbreiterte hintere Teil geben dem Schädel in Aufsicht die Form einer Sanduhr.[10] Auf dem Oberschädel treten kräftige Knochenrippeln auf, dazu zählen der Scheitelkamm und die Überaugenwülste. Ersterer ist massiv und steigt, bedingt durch die Form des Hirnschädels, auf. Beim Zwergflusspferd (Choeropsis liberiensis) hingegen ist er abwärts gerichtet. Letztere werden durch die hohe Lage der Orbitae auf knöchernen Sockeln hervorgerufen. Dadurch befindet sich der obere Rand der Augenhöhle deutlich oberhalb der Stirnlinie, der Abstand kann bis zu 5,5 cm betragen, während er beim Zwergflusspferd geringer ist. Zudem findet sich am vorderen Rand der Orbitae eine markante Grube, die zu den definierenden Merkmalen der Gattung Hippopotamus zählt. Als weiteres wichtiges Merkmal hat das Stirnbein keinen Kontakt mit dem Nasenbein, da sich ein stark vergrößertes Tränenbein dazwischen schiebt.[11] Der weit auskragende Jochbogen dient als Ansatzstelle für eine massive Masseter- und Temporalis-Muskulatur.[12][7][1]

Auch der Unterkiefer ist äußerst robust gestaltet und als eine einzigartige Besonderheit schwerer als der Schädel. Seine Länge variiert von 39,8 bis 62,0 cm, seine Höhe unterhalb des zweiten Mahlzahns von 10,9 bis 14,3 cm.[8] Auffallend ist die extrem weit nach hinten verlagerte Position des Gelenkfortsatzes, der nahe dem Hinterhaupt mit dem Schädel artikuliert. Dies ermöglicht die weite Maulöffnung der Tiere bis zu 150°. Der Winkelfortsatz am hinteren Ende des Unterkiefers zieht nach unten hakenförmig aus. Das Gebiss besteht aus 36 bis 40 Zähnen und zeigt folgende Zahnformel: . Das innere Schneidezahnpaar ist größer als das äußere. In der oberen Zahnreihe besitzen die Schneidezähne einen rundlichen, in der unteren einen dreieckigen Querschnitt. Die Eckzähne haben eine hauerartige Gestalt, die unteren sind größer und können eine Gesamtlänge von 70 cm erreichen (von denen 30 cm aus dem Zahnfleisch ragen), der größte Zahn wurde bei einem Tier aus dem Kongogebiet mit fast 164 cm Gesamtlänge registriert. Ihr dreieckiger Umriss weist mit der flachen Seite nach hinten und der spitzen nach vorn. An den oberen Eckzähnen ist hinten eine längsgerichtete, flache Rille ausgebildet. Die Innenseite der unteren Eckzähne wird durch den Kontakt mit den oberen Gegenstücken bei geschlossenem Maul glattgerieben. Der dicke Zahnschmelz der Eckzähne faltet sich zu markanten Rippeln, die an den unteren konvergent verlaufen. Sowohl die Schneide- als auch die Eckzähne haben keine Wurzeln und wachsen lebenslang. Der jährliche Zuwachs beträgt für die unteren Eckzähnen etwa 28 bis 30 mm bei jüngeren und 13 bis 14 mm bei älteren Individuen. Die Wachstumsrate der Eckzähne verlangsamt sich mit einem Alter von 20 bis 25 Jahren, sie ist bei weiblichen Tieren generell geringer als bei männlichen, so dass die Eckzähne bei ersteren nur halb so schwer werden wie bei letzteren. Gleiches gilt für die Schneidezähne.[13][14] Die vorderen Zähne dienen nicht der Nahrungsaufnahme, sondern erfüllen „repräsentative“ Zwecke. Die Prämolaren verfügen in der Regel über einen Höcker, die Molaren weisen zwei Paar Höcker auf, nur der hinterste drei. Die vorderen Backenzähne stehen parallel zueinander oder konvergieren leicht. Generell sind die Backenzähne stark hochkronig (hypsodont), so dass die Höhe in der Regel ihre Weite übertrifft. Die Länge der Backenzahnreihe des Unterkiefers reicht von 23,2 bis 29,8 cm, die des Oberkiefers von 21,3 bis 27,8 cm.[8][12][7][1][15]
Verbreitung
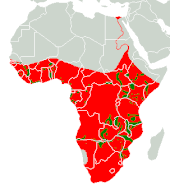
Das Flusspferd kommt derzeit in Afrika südlich der Sahara vor (Subsahara-Afrika). Das Verbreitungsgebiet reicht vom Senegal und Gambia im Westen ostwärts bis in den Sudan sowie Äthiopien beziehungsweise Somalia und südwärts bis in das nördliche Südafrika und bis nach Botswana. Die Tiere bewohnen überwiegend offene Graslandschaften und Miombo-Waldgebiete, die in jedem Fall mit Gewässern in Form von Strömen, Flüssen oder Seen verbunden sind. Abseits von großen Flussgebieten treten sie nicht in tropischen Regenwäldern auf. In Westafrika ist das Flusspferd auch an den Unterläufen von Strömen anzutreffen und dringt teilweise in küstennahe Meeresgewässer vor. Einzelne Bestände wurden im 19. und 20. Jahrhundert von der Insel Mafia rund 17 km vor der ostafrikanischen Küste berichtet, die eventuell bis in die Gegenwart überdauern. Erreicht haben die Tiere die Insel über die Mündung des Rufiji.[16] Für die Nachbarinseln Sansibar und Pemba liegen keine Belege vor.[17] Die Höhenverbreitung reicht dementsprechend vom Meeresspiegel bis auf 2000 m Gebirgslage. Für die höheren Lagen bemerkenswert ist das Vorkommen des Flusspferdes im Ngorongoro in Tansania, wozu die Tiere längere Strecken über trockene Landschaften und die Ersteigung der mehrere hundert Meter hohen Kraterwand absolviert haben müssen. Vergleichbares gilt für die mittlerweile verschwundenen Bestände in einigen Seen im Hanang-Gebiet von Tansania, das zu den trockensten der Region zählt.[7][1]
Insgesamt ist das Flusspferd in 29 Ländern vertreten. Die größten Populationen finden sich im südlichen und im östlichen Afrika mit rund 60.000 beziehungsweise 50.000 Individuen. Den größten Anteil daran haben Sambia mit 40.000 bis 45.000, Tansania mit bis zu 20.000 und Uganda mit bis zu 10.000 Individuen. Im westlichen Afrika ist die Art selten und die Population auf eine Reihe kleinerer Gruppen aufgeteilt, die insgesamt rund 7500 Tiere in 19 Ländern umfassen. In einigen Regionen wie in der Republik Kongo oder in Gambia werden nur einige Dutzend Tiere vermutet. In historischer Zeit kam das Flusspferd zudem in Nordafrika vor, hauptsächlich im Niltal, wo es um 1700 noch im Deltagebiet und am Unterlauf nachgewiesen war. Dort verschwand es Anfang des 19. Jahrhunderts durch Bejagung.[18] Ebenso wurde es in der Kapregion im südlichen Afrika ausgerottet. Hohe Populationsdichten sind aus dem Queen-Elizabeth-Nationalpark in Uganda und der Luangwa-Region Sambias bekannt mit 28 bis 42 Individuen je Quadratkilometer.[7][1][19]
Lebensweise
Anpassungen und Physiologie

_(28371752360).jpg.webp)

Das Flusspferd lebt semi-aquatisch und ist gut an dieses Milieu angepasst. Zu den begünstigenden Merkmalen hierfür gehören die sehr weit oben am Kopf positionierten Nase, Augen und Ohren, so dass die Tiere sie beim Schwimmen über der Wasserlinie halten können. Beim Tauchen verschließt ein Reflex die schlitzartigen Nasenlöcher und die Ohren, zum Atem muss ein Tier in Abständen von etwa sechs Minuten auftauchen. Die kurzen Gliedmaßen sind als eine funktionale Modifikation anzusehen, ebenso wie die kompakten und teils verdichteten Knochen, deren Markröhren mit spongiosem Material gefüllt sind. Die massiver ausgebildeten Vorderbeine tragen den größeren Teil des Körpergewichts, was unter anderem der Fortbewegung im Wasser zugutekommt. Allerdings fehlen dem Flusspferd auch einige typische Kennzeichen wie eine Stromlinienform, zudem zeigen Vorder- und Hinterläufe nur bedingt besondere Schwimmeigenschaften etwa in Form der partiell ausgebildeten Schwimmhäute.[20][21][7][1]
Die Epidermis der Haut ist sehr dünn, teilweise nur rund 1 mm wie am Rücken. Durch zahlreiche Nerven weist sie eine hohe Sensibilität auf. Sie kann durch Äste und Zweige von Büschen sehr leicht verletzt werden, heilt jedoch recht schnell. Außerdem bricht sie durch Trocknung an Land rasch und muss daher feucht gehalten werden. Die Dermis dagegen ist sehr dick. Am Rücken und an den Seiten erreicht sie 60 mm, am Kopf, Nacken und Bauch wird sie dünner. Insgesamt wiegt die Haut rund 270 kg, was rund 18 % des Körpergewichts eines Individuums ausmacht, und bedeckt eine Fläche von 10 m².[6][7][1]
Es sind keine Schweißdrüsen ausgebildet, allerdings sondern spezielle subdermale Hautdrüsen eine alkalische Flüssigkeit mit einem pH-Wert von 8,5 bis 10,5 ab, die die Tiere vor der Austrocknung schützt. Diese Ausscheidungsorgane verteilen sich in einem dichten Netz von einer Drüse je Quadratzentimeter über die Körperoberfläche, haben einen linsenförmigen Umriss und besitzen jeweils zwei Drüsenkanäle.[22][23] Die zunächst farblose Flüssigkeit verfärbt sich innerhalb von ein paar Minuten rötlich und später bräunlich. Bestandteil dieser Flüssigkeit sind zwei nicht-benzoide, aromatische Pigmente, ein rotes, das als Hipposudorinsäure, und ein orangefarbenes, das als Norhipposudorinsäure bezeichnet wird. Beide wirken sowohl als Sonnenschutz, indem sie UV-Strahlen absorbieren, als auch antibiotisch gegen verschiedene Krankheitserreger. Das rötliche Schimmern hat früher zu der Vermutung geführt, das Flusspferd würde Blut schwitzen.[24][25][7][1]
Eine weitere Funktion des Sekrets betrifft die Thermoregulation, die überwiegend über die Haut erfolgt. Sie findet über die Wasserverdunstung statt, die im Vergleich zu anderen Säugetieren beim Flusspferd sehr intensiv ausfällt, insbesondere wenn die Haut nass und mit den Drüsenflüssigkeiten bedeckt ist. Die Körpertemperatur liegt bei rund 36 °C und schwankt nur sehr wenig an Land. In der Regel vermeiden die Tiere Hitzestress und halten sich deshalb tagsüber im Wasser auf. Allerdings schließt dies auch verschiedene Sonnenbäder ein,[26][6][27] die je nach Jahreszeit und Umgebungstemperatur unterschiedlich lang ausfallen können.[28][7][1]
Aktivitätsrhythmus
Das Flusspferd ist weitgehend dämmerungs- und nachtaktiv. Es verbringt praktisch den ganzen Tag schlafend bzw. ruhend im Wasser oder in Gewässernähe, was mehr als zwölf Stunden in Anspruch nehmen kann. Bevorzugte Wassertiefen für die Ruheplätze reichen von 1,3 bis 1,5 m. Größere Aktivitäten im Gewässer entfalten sich am späten Nachmittag und frühen Abend zwischen 16:00 und 19:00 Uhr. Bei Dämmerung begeben sich die Tiere an Land und wandern zu ihren Weidestellen. Die Nahrungsaufnahme dauert bis zu sechs Stunden. Der Rhythmus ist weitgehend abhängig vom Wetter und von der Jahreszeit, da die Tiere unter feuchteren Bedingungen auch länger außerhalb der Gewässer verweilen und mitunter in ihren Weidegründen rasten oder diese mehrfach aufsuchen. Für Tiere aus den Boye-Feuchtgebieten bei Jimma in Äthiopien ergab sich eine Verteilung der Aktivität auf 51,2 % Ruhe, 34,2 % Wanderung, 19,6 % Nahrungsaufnahme und 3,7 % Paarung. Bullen rasten durchschnittlich länger als Kühe, die mehr Zeit in Wanderung und Ernährung investieren.[29][7][1]
Sozialorganisation und Raumnutzung

Ausgedehnte Studien zur Sozialstruktur des Flusspferdes fanden unter anderem im Queen-Elizabeth-Nationalpark in Uganda, im Masai Mara in Kenia oder im Okavangodelta in Botswana statt. Das Sozialverhalten des Flusspferdes ist variabel. Nach Untersuchungen im Masai Mara setzte sich eine 2800-köpfige Population zu 8 % aus Bullen, zu 36 % aus Kühen und zu 56 % aus Jungtieren zusammen, hier entfielen fast je eine Hälfte auf nahezu ausgewachsene Individuen und auf Neugeborene. Das Flusspferd tritt einzelgängerisch auf oder mehrere Individuen schließen sich zu einer Gruppe zusammen, deren durchschnittliche Größe im Masai Mara bei rund einem Dutzend Tiere liegt.[30] Dabei gibt es verschiedene Formen der Gruppenbildung, einerseits solche aus weiblichen Tieren mit ihrem Nachwuchs, andererseits Junggesellengruppen mit männlichen Individuen. Allerdings sind die Grenzen nicht eindeutig festgelegt, da sich häufig auch Vertreter des anderen Geschlechts in den jeweiligen Gruppen aufhalten können. Keiner der Verbände ist stabil, es handelt sich eher um lose Verbände von Tieren an begünstigten Plätzen. Sie können je nach Attraktivität des Gebietes bis zu 200 Individuen umfassen. In Regenzeiten teilen sich bestehende Gruppen häufig auf, so dass sich weniger Tiere in einer Gruppe finden als in Trockenzeiten. Die einzige dauerhafte Beziehung ist die zwischen der Mutter und ihrem Nachwuchs, die mehrere Jahre anhält.[31][7][1]
Einzelgängerische Bullen etablieren in der Regel ein eigenes Revier, ihre soziale Organisation beruht auf Territorialität. Die Territorien umfassen häufig die Uferlinien von Flüssen und Seen. Sie können sich über 50 und 100 m wie am Fluss Ishasha oder 250 bis 500 m wie am Eduardsee, beides im Queen-Elizabeth-Nationalpark, ausdehnen. Die Grenzen verschieben sich über das Jahr, da eine Abhängigkeit von der Populationsdichte einer Region besteht. Außerdem spielen natürliche Faktoren wie die Änderung der Wasserführung eines Flusses oder der Verlauf des Seeufers infolge von Dürren oder Regenfällen beziehungsweise Überflutungen eine Rolle. Häufig beansprucht ein Individuum sein Territorium über eine lange Zeit. Einzelne Beobachtungen erfolgten über viereinhalb bis zwölf Jahre, teilweise wird vermutet, dass ein einzelnes Tier sein Revier während seines gesamten Lebens besetzt. Die Grenzen eines Territoriums schließen einen oder mehrere Aktionsräume gruppenlebender Individuen ein. Dabei sind Territorien und Aktionsräume nicht identisch. Im Ruaha-Nationalpark in Tansania nutzen größere, fast ausgewachsene Jungtiere weitaus ausgedehntere Aktionsräume, die die Größe der Territorien dominanter Bullen um das Dreifache übertreffen. Die dafür erforderlichen Wanderungen von teils mehr als 4 km werden wohl daher unternommen, um innerartlichen Konflikten aus dem Weg zu gehen, vor allem zu den Trockenzeiten, wenn die einzelnen Gruppen enger zusammenrücken.[32][7][1]

Der Anspruch auf ein Revier wird durch die Anwesenheit des männlichen Tieres, seinem Dominanzgebaren und durch Defäkation ausgedrückt. Der Kot, den ein Bulle durch Wackeln mit dem Schwanz verteilt, häuft sich zu größeren Hügeln mit einer Fläche von mehreren Quadratmetern auf. Diese Hügel markieren aber nicht die eigentlichen Reviergrenzen, sondern dienen vielmehr als Orientierungspunkte. Sie verhindern auch nicht das Eindringen fremder Bullen in ein Territorium, mitunter stimulieren sie ein anderes Individuum, dort ebenfalls seine Fäkalien abzulegen. Benachbarte Bullen defäkieren teilweise ritualisiert zur gleichen Zeit im Wasser und schauen sich dabei an oder in die entgegengesetzte Richtung mit hoch gehobenen Kopf und nach vorn orientierten Ohren, was jeweils Dominanz bedeutet.[31][7][1]
_(13961802458).jpg.webp)
Wie andere Flusspferde begibt sich ein Bulle nachts zur Nahrungssuche landeinwärts und verlässt damit sein Revier. Überschreitet ein Bulle seine eigenen Reviergrenzen, verliert er seine dominante Stellung und erlangt den Status eines untergeordneten Tieres im Verhältnis zum Eigentümer des anderen Territoriums. Generell ist das Flusspferd aber friedfertig gegenüber allen Artgenossen, was auch Bullen einschließt, sofern sie das Zeugungsvorrecht des dominanten Tieres anerkennen. Mitunter können sich dadurch auch Junggesellengruppen mit einer Individuengröße von bis zu 100 Tieren im Revier eines territorialen Bullen aufhalten. Eine dichtere Drängung der Tiere an einzelnen Wasserstellen, wie häufig in der Trockenzeit, kann zu einer erhöhten Aggression führen, die sich gegen jedes Geschlecht und jede Altersstufe richtet, meist aber wenig Körpereinsatz mit sich bringt.[30] Kämpfe zwischen benachbarten Tieren sind ritualisiert und werden frontal geführt. Sie sind teilweise verbunden mit dem Aufspritzen von Wasser, was eine Grenze anzeigen soll. Echte Kämpfe hingegen finden in seitlicher Position statt. Jedes Tier versucht dann, mit Hilfe der großen Eckzähne die Seite des Gegenübers zu treffen. Trotz der insgesamt dicken Haut kann dies zu schweren Verletzungen bis hin zum Tod führen.[7][1]
Die vorwiegend in der Nacht aufgesuchten Weideflächen liegen teils mehrere Kilometer von den angestammten Wasserstellen entfernt. Im Gegensatz zu den Territorien der Bullen sind die Nahrungsgründe nicht monopolisiert. Sie werden daher gemeinsam genutzt und unterliegen keiner Verteidigung. Der Gang zu den Weideflächen und die Nahrungsaufnahme finden einzeln oder in Mutter-Jungtier-Gruppen statt. Mit Ausnahme letzterer kommt es dabei kaum zu sozialen Interaktion, so dass jedes Individuum für sich allein frisst. Im Masai Mara entfernen sich die Tiere dafür bis zu 1350 m von ihrer Wasserstelle, im Kruger-Nationalpark in Südafrika kann der Abstand bis zu 4,5 km betragen. Die Entfernungen sind meist abhängig von der Produktivität einer Landschaft.[31][33][7][1]
Fortbewegung und Kommunikation

Obwohl das Flusspferd einen Großteil seines Lebens im Wasser verbringt, ist es kein guter Schwimmer. Meistens läuft es auf dem Grund eines Gewässers entlang oder lässt sich vom Wasser tragen; die Fortbewegungsart wird manchmal als „Schwimmlaufen“ bezeichnet. Dabei nutzt das Flusspferd eine Art Galopp mit relativ ausgedehnten Sprungphasen, die länger dauern als die Kontaktphasen mit dem Grund. Bei jedem Sprung legt ein Tier zwischen 1,0 und 2,4 m zurück. Die erreichten Geschwindigkeiten liegen bei 0,2 bis 0,6 m je Sekunde. Tauchgänge können eine Dauer von 30 Minuten erreichen. An Land bewegt sich das Flusspferd hingegen bei niedrigen Geschwindigkeiten in einer Art Passgang vorwärts, bei dem zumeist drei Füße gleichzeitig den Boden berühren und so den massigen Körper stabilisieren. Lediglich in einer kurzen Sequenz kommt es zu einer bipedalen Phase. Höhere Geschwindigkeiten werden durch einen Trab mit diagonaler Beinbewegung erreicht. Maximale Geschwindigkeiten bei Flucht oder Angriff betragen rund 30 Kilometer pro Stunde. Das Flusspferd ist trotz seines massivem Körperbaus dadurch relativ agil.[21][7][1]
.jpeg.webp)
Die innerartliche Kommunikation des Flusspferds ist vielfältig. Hierzu gehören vor allem die Körpersprache und Gestik. Dominante Bullen sind häufig an vorgestellten Ohren erkennbar, Kühe und untergeordnete Tiere an zurückgelegten. Verbunden ist das Dominanzgebaren mit einem erhobenen Kopf und gekrümmtem Rücken, was eine größere Massivität ausdrückt. Zu den bekanntesten Gesten gehört das aufgerissene Maul. Hierbei wird der Kopf zurückgeworfen, so dass die Stirnlinie im rechten Winkel zum Rücken steht. Dominante Tiere halten diese Gebärde bis zu acht Sekunden lang. Allerdings wird das aufgerissene Maul von fast allen Mitgliedern einer Gruppe einschließlich der Jungtiere praktiziert und findet in größerem Maße abends vor dem Landgang statt. Eventuell ist dieses Verhalten ein Ausdruck der Aufregung. Bei Angriffen öffnen die Tiere ihr Maul nur teilweise. Unterwürfiges Verhalten zeigt sich durch einen gesenkten Kopf, Schwanzwedeln und Lippenschmatzen. Es beginnt an Land bereits in rund 100 m Entfernung zum Kontrahenten, manchmal kriechen untergeordnete Tiere die letzten Meter und schnüffeln dann an der Genitalregion des territorialen Bullen. Im Wasser spielen Nasenkontakte eine Rolle, mitunter verharrt das untergeordnete Individuum über Stunden in der Umgebung des dominanten Tieres. Teilweise kommt es auch zur Defäkation, wobei die Bedeutung hier nicht eindeutig ist.[30][7][1]
Über die Lautgebung des Flusspferdes liegen wenige Informationen vor. Am häufigsten ist sie zur Zeit der stärksten Aktivitäten im Wasser wahrnehmbar, die am späten Nachmittag stattfindet. An Land ist sie nur selten zu sehen. Als semi-aquatisch lebendes Tiere ist das Flusspferd befähigt, sich sowohl an Land als auch unter Wasser mittels Vokalisation mit Artgenossen zu verständigen. Normalerweise stößt eine Kommunikation, die über beide Medien gleichzeitig erfolgt, auf Schwierigkeiten, da Schallwellen an den Grenzen brechen. Nur rund 4 % aller Lautgebungen erfolgen ausschließlich durch die Luft. Dem gegenüber erzeugt das Flusspferd fast zwei Drittel seiner Vokalisationen unter Wasser. Sie sind an der Oberfläche schwer wahrnehmbar und benötigen kaum Luft für ihre Modulation. Die Funktion der Töne ist nicht in allen Fällen eindeutig. Weinlaute, die nur kurz dauern und teilweise mit einzelnen Klicklauten kombiniert werden, stehen möglicherweise mit Aggressoren in Verbindung. Dagegen werden Krächzlaute bei genereller Alarmbereitschaft oder Aufmerksamkeit ausgestoßen, beziehungsweise dienen als Kontaktrufe, etwa in trübem Wasser. Sie bestehen aus einer Serie von etwa einem halben Dutzend Pulsen, die jeweils meist 2 Millisekunden anhalten und Frequenzen von 600 bis 1800 Hz, im Maximum auch 9000 Hz erreichen. Dabei kann die Tonlage gleich bleiben oder sich ändern, was möglicherweise variable Motivationen ausdrückt. Während sozialer Interaktionen werden Klicklaute ausgestoßen, die sehr variantenreich sein können und sowohl im Breitband- als auch im Schmalbandbereich stattfinden. Auch diese setzen sich aus mehreren Pulsen zusammen, die kürzer sind als bei den Krächzlauten. Breitbandklicks erfolgen in Frequenzen bis 7800 Hz, Schmalbandklicks hingegen übersteigen nur selten 2000 Hz.[34] Ein Tier vermag dabei Laute individuell zu unterscheiden. Untersuchungen aus dem Jahr 2022 ergaben, dass Rufe aus der eigenen Gruppe nur wenige Reaktionen auslösen. Dagegen intensiviert sich die Aktivität bei Rufen gruppenfremder Artgenossen. Verbunden ist dies dann teilweise mit einem gesteigerten Markierungsverhalten.[35]
Nahezu ein Drittel der Laute des Flusspferdes ist amphibischer Natur und breitet sich demnach durch das Wasser und die Luft aus. Für diese Form der Kommunikation befinden sich die Tiere in halb abgetauchter Position mit den Augen und den Nasenlöchern über, dem Maul und der Kehle unter Wasser. Die hierfür benötigte Luft wird für die Überwasserkommunikation mittels des Rachens durch die Nase gepresst, für die Unterwasserkommunikation aktiviert der Kehlkopf die Haut- und Fettgewebe der Kehle. In völlig abgetauchter Position sind die Lautmodulationen teilweise mit einer aufsteigenden Luftblase verbunden. Die Wahrnehmung erfolgt für die luftgestützten Laute mittels der Ohren, für die wassergestützten wohl über die Knochenleitung des Unterkiefers. Die Schallwellen breiten sich aufgrund der variierenden Dichte der Medien unterschiedlich schnell aus und haben eine sehr unterschiedliche Reichweite. In der Luft sind sie langsamer mit niedrigeren Maximalfequenzen (um 210 Hz), im Wasser schneller und mit höheren Maximalfrequenzen (über 2000 Hz). Außerdem ist der Schalldruck im Wasser stärker, die höhere Dichte des feuchten Mediums führt aber zu einer geringeren Intensität der Laute. Amphibische Laute werden von den Tieren meist bei Störungen eingesetzt, etwa bei einem Kampf oder bei Anwesenheit von Löwen, die eine Gefahr für Jungtiere sind. Neben dem bereits erwähnten Krächzen, Klicken und Weinen können Flusspferde auch Schrei- sowie variable Knurr-, Grunz- und Schnaublaute ausstoßen, einschließlich eines Nasenflatterns. In der Regel ruft zuerst der dominante Bulle. Die Gruppe beantwortet dieses Signal und stimuliert damit benachbarte Ansammlungen. Durch die Luft können sich die Antworten über mehrere Territorien erstrecken bis zu einer Distanz von 3,2 km. Unter Wasser bleiben in der Regel die benachbarten Gruppen involviert, so dass die größte Ausbreitung rund 500 m beträgt.[36][7][1]
Ernährung

Das Flusspferd ist ein Pflanzenfresser. Es nimmt hauptsächlich Gräser zu sich. Bei Studien in den Boye-Feuchtgebieten in Äthiopien ließen sich 26 Arten bestimmen, unter denen Eriochloa mit einem Anteil von fast 12 %, Rohrkolben und Hühnerhirsen mit jeweils über 9 % sowie Hundszahngräser mit über 8 % zu den favorisierten Pflanzen zählen.[29] Im Masai Mara sind rund ein Dutzend Grasarten als Nahrung des Flusspferdes belegt. Hierzu gehören Themada, Sporobolus und Andropogon sowie Liebesgräser.[31] Im Queen-Elizabeth-Nationalpark konnten über 30 verschiedene Grasarten identifiziert werden, die von den Tieren konsumiert werden. Bedeutung haben vor allem Hundszahngräser, aber auch Gattungen wie Chloris, Heteropogon, Sporobolus und Themada sind mit einem hohen Anteil vertreten. Gelegentlich frisst das Flusspferd einzelne krautige Pflanzen wie Angehörige der Gattung Alternanthera. Dies gilt auch für Früchte wie solche vom Leberwurstbaum. Teilweise fressen die Tiere zusätzlich verschiedene Wasserpflanzen, darunter Wassersalat.[37] Ähnliches wurde im südlichen Afrika beobachtet, wo unter anderem Seerosen, Salden und Laichkräuter zum Nahrungsspektrum gehören. Aus dem zentralen und westlichen Afrika liegen bisher nur wenige Untersuchungen zur Ernährunsgweise des Flusspferds vor. Im Nationalpark Loango in Gabun ließen sich bei Feldstudien insgesamt neun Pflanzenarten feststellen, von denen das Süßgras Paspalmum mit 81 % den höchsten Anteil aufwies, gefolgt von Axonopus und Stenotaphrum. Daneben sind einzelne Schmetterlingsblütler und Wasserpflanzen wie Wassernabel dokumentiert.[38] Mit rund neun bevorzugten Pflanzen im Nationalpark W im Niger ist die Zahl ähnlich gering. Hier dominieren Tagblumen, Hühnerhirsen und Reis.[39] Tiere suchen regelmäßig Ackerflächen mit Reis, Mais oder Teff, teilweise auch Bananenplantagen auf und plündern dadurch Nutzpflanzen. Isotopenuntersuchungen an Individuen aus den unterschiedlichen Regionen Afrikas stimmen weitgehend mit den Beobachtungen überein. Demnach besteht ein Großteil der Nahrung aus C4-Pflanzen, in Regionen mit geschlossener Vegetation wie im zentralen Afrika kommen höhere Mengen an C3-Pflanzen hinzu. Darüber hinaus kann die Zusammensetzung den Daten zufolge regional sowie saisonal schwanken mit einem hohen Anteil an C4-Pflanzen in den trockenen Jahresabschnitten und mit einer gemischten Kost aus C3- und C4-Pflanzen in den feuchten Gebieten.[40][41][42] Einzelnen Berichten zufolge frisst das Flusspferd gelegentlich Aas und Fleisch von Tieren, das es selbst getötet hat,[43][44] was auch eigene Artgenossen einschließt.[45] Es wurde zwar selten beobachtet, grundsätzlich jedoch ist ihm das Verdauen von Fleisch möglich.[7][1]
Generell ist das Flusspferd ein opportunistischer Pflanzenfresser, der zwar einzelne Pflanzen bevorzugt, diese aber ohne Vorauswahl bestimmter vegetativer Teile konsumiert. Das große und dicklippige Maul und die spezielle Unterkieferaufhängung verhindern eine feine Selektion der Nahrung. Deshalb suchen die Tiere Bereiche mit häufigem Vorkommen ihrer favorisierten Pflanzen und fressen dann umfangreichere Flächen leer.[40] Die Menge der konsumierten Pflanzen ist umso höher, je weiter die Weideplätze von den Wasserstellen entfernt liegen. Insgesamt unterscheidet sich die Ernährungsstrategie des Flusspferdes mit der Beschränkung auf einen bestimmten Tagesabschnitt und Entfernung von den angestammten Aktionsräumen und Territorien von der anderer großer Pflanzenfresser wie den Elefanten oder Nashörnern, die über lange Zeit auf Nahrungssuche gehen und dabei weit umherschweifen.[46] In der Regel wird das Gras zwischen die Lippen gepresst und mit einer Kopfbewegung abgerissen. Die Schneide- und Eckzähne haben bei der Nahrungsaufnahme keine Funktion, erstere werden aber teilweise zum Graben eingesetzt.[33][13] Die Nahrungsaufnahme findet zumeist nachts statt und kann mehrere Stunden beanspruchen. Bei schlechter Pflanzenqualität frisst das Flusspferd auch tagsüber. Pro Tag nimmt ein Tier zwischen 20 und 45 kg Nahrung zu sich. Bezogen auf die Trockenmasse entspricht dies 0,9 bis 1,3 % des Körpergewichts. Der Magen fasst durchschnittlich 34,9 kg bei männlichen und 37,4 kg bei weiblichen Individuen, was 12,8 beziehungsweise 15,2 % des Körpergewichts ausmacht. Das Flusspferd hat einen konvergent zu den Wiederkäuern entwickelten vierkammerigen Magen. Dieser weist zwei Blindsäcke auf, in denen die Nahrung durch Mikroorganismen zersetzt wird. Sie käuen aber nicht wieder. Die Passagezeit der Nahrung ist relativ lang, was eine effiziente Verwertung der eher nährstoffarmen Gräser ermöglicht.[47][7][1]
Fortpflanzung
.jpg.webp)
.jpg.webp)
Die Paarung erfolgt das gesamte Jahr über. Sie findet im Wasser statt, dabei ist das Weibchen die meiste Zeit untergetaucht und kommt nur zum Luftholen an die Oberfläche. Es können bis zu sechs Begattungen pro Nacht stattfinden. Manchmal sucht die Kuh nach erfolgreicher Verpaarung noch zwei oder mehr Territorien für weitere Paarungsaktivitäten auf. Die Tragzeit beträgt rund 227 bis 240 Tage. Zumindest in manchen Regionen lässt sich eine Saisonalität bei der Fortpflanzung erkennen. So fallen in Uganda die meisten Geburten in die Monate Oktober und April, die Jahresabschnitte mit dem meisten Regen. Auch in Südafrika kommt die überwiegende Zahl der Jungtiere in den feuchten Monaten Oktober bis März zur Welt. Ähnliches wurde in Sambia beobachtet.[3][7][1]
Kurz vor der Niederkunft trennt sich das werdende Muttertier von der Gruppe. Die Geburt vollzieht sich in seichtem Wasser, bei Störungen sucht die Kuh tieferes Wasser auf. Üblicherweise kommt ein einzelnes Jungtier zur Welt, Zwillinge sind selten. Neugeborene wiegen zwischen 25 und 55 kg und können sofort nach der Geburt laufen und sich vom Wassergrund zur Oberfläche abstoßen. Gesäugt wird im Wasser, der Nachwuchs aktiviert dabei mit seiner Zunge die Milchdrüsen des Muttertiers. Vermutlich spritzt die Mutter einen Teil der Muttermilch durch Muskelkontraktion in das Maul des Jungen, ähnlich wie es bei Walen bekannt ist. Das Muttertier ist sehr fürsorglich. Es lässt den Nachwuchs in tieferem Wasser auf dem Rücken reiten und verteidigt ihn vehement gegen Fressfeinde und Artgenossen. Besonders aggressiv geschieht dies in den ersten zehn Tagen. Während dieser Zeit nimmt die Mutter kaum Nahrung zu sich. Erst danach beginnt sie tagsüber am Flussufer zu fressen, während das Junge in der Nähe ruht. Nach mehreren Wochen wandern Mutter und Junges gemeinsam in der Nacht zu den weiter entfernten Weidegründen. Das Junge bleibt im Gebüsch versteckt, während die Mutter weidet. Die erste feste Nahrung konsumieren die Jungtiere mit rund sechs bis acht Wochen. Nach rund sechs bis acht, teilweise auch erst nach zwölf Monaten wird der Nachwuchs entwöhnt. Die Wachstumsphase ist bei beiden Geschlechtern anfangs gleich, ab rund 24 Lebensjahren verlangsamt sie sich bei weiblichen Tieren, während männliche Individuen ihr gesamtes Leben lang an Größe zunehmen können.[33][3][7][1]
Die Geschlechtsreife tritt bei männlichen Individuen mit sieben bis acht Jahren ein, ermittelt an der Größe der Hoden, allerdings kann die Spermienbildung bereits mit zwei Jahren einsetzen. Bei weiblichen Tieren liegt der Zeitraum aufgrund der Größe der Follikel in der Regel bei etwa sieben Jahren, einzelne Individuen erreichten dies jedoch bereits mit drei Jahren. Die erste Fortpflanzung findet zumeist deutlich später statt. Im Kruger-Nationalpark wurde sie mit rund elf Jahren ermittelt, in Uganda und Sambia teilweise auch erst mit 20 Jahren.[48] Die Unterschiede sind wohl in der Populationsdichte und in der Qualität des Nahrungsangebots begründet. Tiere in menschlicher Gefangenschaft können sich mitunter schon im Alter von etwas mehr als zwei Jahren fortpflanzen. Männliche Tiere sind während ihres gesamten Lebens sexuell aktiv.[49][7][1]
Das Geburtsintervall beträgt rund zwei bis drei Jahre. Der Sexualzyklus dauert etwa 50 Tage, mit einem zwei bis drei Tage anhaltenden Östrus. Das Geschlechtsverhältnis bei der Geburt beträgt 1:1. Es gibt Hinweise darauf, dass Kühe kurz nach der Geburt wieder geschlechtsreif sind (Postpartum-Östrus), da rund 25 % der untersuchten weiblichen Tiere sowohl trächtig als auch milchgebend waren. Die Geburt eines neuen Jungen unterbricht nicht die bestehende Verbindung zum älteren Nachwuchs. Einige weibliche Tiere wurden mit bis zu drei Jungen unterschiedlichen Alters beobachtet. In der Marschordnung folgt das jüngste Tier direkt der Mutter, das älteste bildet den Schluss. Teilweise kommt es zum Infantizid an Jungtieren durch Bullen. Unter Umständen geschieht dies, wenn ein dominantes Tier ein neues Territorium übernimmt und so seinen Fortpflanzungserfolg garantieren will, ähnlich wie es bei Löwen bekannt ist. Andererseits sind Tötungen von Jungtieren häufig in der Trockenzeit beobachtet worden, so dass auch äußerer Stress einen wichtigen Faktor darstellen könnte. Jungtiere sind dadurch bis zu einem Lebensalter von 50 Tagen gefährdet.[50] Nach einzelnen Beobachtungen beschäftigen sich Muttertiere noch mehrere Stunden mit einem toten Jungen, verteidigen es gegen Beutegreifer und bringen es an Land. Das Flusspferd gehört zu den wenigen Huftieren, die ein solches Verhalten zeigen.[51] Wild lebende Flusspferde werden 30 bis 40 Jahre alt. Tiere in Gefangenschaft können über 50 Jahre erreichen, das höchste bekannte Alter eines Tieres betrug 61 Jahre.[13][48][7][1]
Fressfeinde, Kommensalen und Parasiten

Ein ausgewachsenes Flusspferd hat kaum natürliche Feinde; gelegentlich erbeuten Löwen ein Alttier, doch haben diese sporadischen Aktionen keinen Einfluss auf die lokale Population. Jungtiere fallen gelegentlich Hyänen oder ebenfalls Löwen zum Opfer. In der Regel verteidigen Muttertiere ihren Nachwuchs äußerst aggressiv. Das Nilkrokodil vermag ebenfalls Jungtiere und unter Umständen auch ausgewachsene Individuen zu reißen. In einem gemeinsam genutzten Gewässer tolerieren Flusspferdgruppen zumeist keine Krokodile in der unmittelbaren Umgebung von 2 m. Andererseits meiden Krokodile wiederum Flusspferde und tauchen in unmittelbarer Nähe ab. Nach Beobachtungen am Runde in Simbabwe vertreiben Flusspferde Krokodile auch von ihren Sonnenbädern. Ausnahmen stellen hier die größeren Exemplare ab Längen von 3,5 m dar, die wiederum von den Flusspferden gemieden wurden. In der Regel aber dominieren Flusspferdgruppen solche der Krokodile.[52][7][1]
Häufig tritt das Flusspferd in Vergesellschaftung mit verschiedenen Vogelarten auf. Bekannt dafür sind die Madenhacker, vor allem der Gelbschnabel-Madenhacker findet sich in nächster Umgebung zu den Tieren. Nach Untersuchungen aus dem Jahr 2018 konnte er in 11,3 % aller Beobachtungen nachgewiesen werden. Ebenfalls wären der Kuhreiher, der Lappenstar, der Piapia und das Blaustirn-Blatthühnchen zu nennen. Während die Madenhacker überwiegend vom parasitischen Befall ihrer Wirtstiere profitieren, ist das häufige Vorkommen der Kuhreiher wohl auf die Überschneidung der gemeinsam genutzten Lebensräume in Wassernähe zurückzuführen.[53][54] Im Wasser übernehmen Karpfenfische wie etwa Angehörige der Gattung Labeo die Rolle der Madenhacker und fressen Algenbestände von der Haut des Flusspferdes.[1]
Parasiten sind beim Flusspferd zahlreich belegt. Bedeutende äußere Schmarotzer finden sich vor allem in Zecken wie etwa Cosmiomma.[55] Eine Besonderheit bildet der Plattwurm Oculotrema, der sich in den Augen festsetzt. Mitunter können zwei Dutzend Individuen an einem Auge und bis zu drei Dutzend an einem Flusspferd parasitieren, auch treten verschiedene Generationen an einem Wirtstier auf.[56][57] Als innere Parasiten sind beispielsweise Pärchenegel und die Gattung Fasciola belegt, beide gehören zu den Saugwürmern und befallen das Blut beziehungsweise die Leber. Fadenwürmer sind unter anderem mit Toxocara, Stephanofilaria, Cobboldina und Hippopotamenema vertreten.[58][59][60][61] Außerdem ist das Flusspferd anfällig für die Rinderpest und für Milzbrand. Ein Milzbrandausbruch im Jahr 1987 in Sambia kostete über 4000 Tiere das Leben, einem weiteren im Jahr 2004 in Uganda fielen 300 Individuen zum Opfer. Andere krankheitsbildende Mikroorganismen sind Kokzidien wie Eimeria, Bakterien wie Brucellen oder Salmonellen sowie Flagellaten wie Trypanosomen.[62][63][7][1]
Ökologischer Einfluss
Als großer Pflanzenfresser übt das Flusspferd nachhaltigen Einfluss auf seine unmittelbare Umgebung aus. Es steht in Nahrungskonkurrenz mit einigen anderen grasfressenden Säugetieren, wodurch es zu ökologischen Wechselwirkungen kommen kann. Im Queen-Elizabeth-Nationalpark nimmt die Zahl der Wasserböcke ab, wenn das Flusspferd zahlreich ist, und steigt wieder, wenn die Bestandsdichte des Flusspferds sinkt. Die Tiere weiden häufig an kurzhalmigen Gräsern und fördern dadurch Grasarten, die von ihnen bevorzugt gefressen, von Wasserböcken jedoch gemieden werden.[64] Durch die Bevorzugung kürzerer Gräser und deren massenweises Abgrasen entsteht ein typischer, räumlich eng begrenzter „Hippo-Rasen“. In Verbindung mit Übergrasung und Übertrampelung der Fläche führen Regenfälle teils zu massiver Erosion, besonders an den Uferhängen der Flüsse. Dies gilt auch für die Pfade, die durch die sich täglich wiederholenden Wanderungen des Flusspferdes entstehen, die sogenannten „Hippo Trails“. Diese schneiden manchmal bis zu 1 m in den Untergrund der Fluss- und Seeufer ein oder sind an steileren Hängen auch schluchtartig. Häufig werden diese von anderen, kleineren Tieren genutzt. Im Okavango-Delta aber ebenso im Ngorongoro entstehen auf diese Weise teils neue Wasseradern.[31][65][66]
Durch die Weidetätigkeit des Flusspferds und anderer großer Pflanzenfresser wie Elefanten und Nashörnern kann es bei entsprechend dichter Population zu einem starken Rückgang der lokalen Vegetation kommen, was Erosion zur Folge hat. Das künstliche Offenhalten der Landschaften mindert den Waldbewuchs und befördert die vom Flusspferd bevorzugten Gräser. Allerdings entsteht unter Umständen bei einem Zusammenbruch der Populationen ein Rückkopplungseffekt. Beobachtet wurde dies im Queen-Elizabeth-Nationalpark, wo, ausgelöst durch zivile Unruhen und einer damit verbundenen intensiveren Bejagung, zwischen den Jahren 1960 und 2000 ein Großteil der ansässigen Großsäuger verschwand. Dies verursachte eine stärkere Ausbreitung von Wald- und Buschgemeinschaften. Den lokal verbliebenen Flusspferden standen damit nicht mehr genug Gräser zur Verfügung, weswegen sie vermehrt auf krautige Pflanzen umstiegen. Im Zuge dieses Prozesses nahm ihr Anteil von weniger als 20 % in der Nahrungsmenge in den 1960er auf teils bis zu 45 % in den 1980er und 1990er Jahren zu.[67]
Das häufige Absetzen von Kot und Urin in die Gewässer ändert mitunter auch deren chemische Zusammensetzung. Dies hat Einfluss auf die Fischgemeinschaft, die durch den Eintrag von Nährstoffen profitiert. So ernährt sich die Karpfenfischgattung Labeo nicht nur von Algen auf der Haut des Flusspferdes, sondern auch von dessen herabfallenden Exkrementen. Ebenso wirkt sich dies positiv auf die Bestände verschiedener Buntbarschgattungen (zum Beispiel Oreochromis, Sarotherodon und Tilapia) aus.[68] Vor allem in der Trockenzeit bei niedrigem Wasserstand und hoher Flusspferddichte treten aber teilweise eine starke Übersättigung und Sauerstoffmangel ein. Dies hat dann häufig einen Rückgang der lokalen Fisch- und Insektenfauna zur Folge, was sowohl die Gesamtzahl als auch die Diversität betrifft. Beobachtet wurde dies unter anderem im Ruaha-Nationalpark und im Masai Mara.[69][70] Der hohe Bedarf an Pflanzen und die Defäkation im Wasser bewirken außerdem, dass das Flusspferd einen großen Beitrag zum Siliziumkreislauf leistet. In den Mara-Fluss bringen die Tiere täglich rund 400 kg Silizium ein, was wohl rund drei Viertel der Gesamtmenge ausmacht. Silizium ist bedeutend für zahlreiche Kieselalgen in den tropischen Seen Afrikas, die einerseits wichtige Kohlenstoffspeicher und Sauerstoffproduzenten darstellen, andererseits auch die Basis der Nahrungskette bilden.[71]
Systematik
Innere Gliederung der Flusspferde nach Hassanin et al. 2012[72]
|

Das Flusspferd ist eine Art aus der Gattung Hippopotamus und der Familie der Flusspferde (Hippopotamidae). Innerhalb der Gattung bildet die Art den gegenwärtig einzig anerkannten Vertreter, wodurch diese monotypisch ist. Zur Familie wird rezent lediglich noch die Gattung Choeropsis gezählt, welche das Zwergflusspferd (Choeropsis liberiensis) enthält. Je nach Auffassung ist für Choeropsis auch eine Aufteilung in zwei rezente Arten möglich.[7][73] Äußerlich kennzeichnen sich die Flusspferde durch ihren plumpen, walzenförmigen Körper mit kurzen Beinen und durch den großen Kopf mit stark entwickelten Schneide- und Eckzähnen. Die beiden Gattungen Hippopotamus und Choeropsis können neben den allgemeinen Körpergrößenunterschieden unter anderem anhand des Aufbaus des vorderen Gebisses unterschieden werden. Erstere besitzt jeweils vier Schneidezähne im oberen und unteren Gebiss (tetraprotodont), letztere sechs (hexaprotodont).[74] Die Familie der Flusspferde wird traditionell in die Ordnung der Paarhufer (Artiodactyla) eingeordnet. Molekulargenetische und biochemische Untersuchungen sowie Fossilfunde haben jedoch zu der Erkenntnis geführt, dass die Wale (Cetacea) die nächsten lebenden Verwandten der Flusspferde darstellen. Aus kladistischer Sicht formen die Paarhufer und Wale somit eine gemeinsame Abstammungslinie, die als Cetartiodactyla zusammengefasst wird. Die engere Verwandtschaftsgruppe aus Walen und Flusspferden trägt dementsprechend die Bezeichnung Cetancodonta (manchmal auch Whippomorpha).[75][76][77][78] Den genetischen Daten zufolge trennten sich die Flusspferde und Wale vor rund 54 Millionen Jahren, also am Beginn des Unteren Eozäns. Eine stärkere Diversifizierung der Flusspferde begann aber nicht vor dem Oberen Miozän vor rund 8 Millionen Jahren.[72][79] Der Ursprung der Flusspferde ist nicht ganz eindeutig, fossil treten sie erstmals im Unteren Miozän in Erscheinung. Die große zeitliche Lücke zwischen der Abspaltung von den Walen und dem Erscheinen der Flusspferde lässt mehrere Interpretationen zu. Häufig favorisiert wird eine Herleitung der Gruppe von den Anthracotheriidae, einer ausgestorbenen Formengemeinschaft flusspferdähnlicher Paarhufer aus dem Eozän bis Pliozän Afrikas und Eurasiens.[80][81] Andere Autoren bevorzugen dagegen eine Abstammung von den Palaeochoeridae, schweineartigen Tieren, die vom Eozän bis Miozän in Eurasien vorkamen.[82][83]
Es werden mehrere Unterarten des Flusspferdes unterschieden, ihre genaue Anzahl ist unbekannt. Nach Hans Klingel, veröffentlicht im Jahr 2013 im Sammelwerk Mammals of Africa, sind es insgesamt fünf:[1]
- H. a. amphibius Linnaeus, 1758; Nominatform, von Gambia ostwärts bis zum Sudan und nach Äthiopien sowie südwärts über den Norden der Demokratischen Republik Kongo, Tansania bis nach Mosambik; wahrscheinlich auch im Niltal, dort allerdings ausgestorben; am Schädel ist die Einschnürung vor den Augen relativ moderat, lange Symphyse des Unterkiefers und große Backenzähne
- H. a. capensis Desmoulins, 1825; Sambia bis Südafrika; Schädel flacher als in H. a. tschadensis, so dass er an den Orbitae breiter als hoch ist
- H. a. constrictus Miller, 1910; südliche Demokratische Republik Kongo, Angola und Namibia; Schädel leichter als in der Nominatform und tiefe Einschnürung vor den Orbitae; Rostrum weniger breit, Symphyse kurz und Backenzähne kleiner
- H. a. kiboko Heller, 1914; Kenia und Somalia; Schädel mit breiten Nasenbeinen und geringer Einschnürung vor den Orbitae, Orbitae runder als in H. a. capensis und prominenter als in H. a. constrictus
- H. a. tschadensis Schwarz, 1914; Tschad und Nigeria; vergleichbar der Nominatform, aber mit prominenteren Orbitae, im Vergleich zu H. a. capensis kürzeres und breiteres Rostrum und eher vorwärtsgerichtete Orbitae
Dem gegenüber unterscheidet Rebecca Lewison im Jahr 2011 im zweiten Band des Standardwerkes Handbook of the Mammals of the World insgesamt drei Unterarten:[7]
- H. a. amphibius Linnaeus, 1758
- H. a. capensis Desmoulins, 1825
- H. a. kiboko Heller, 1914
In diesem Fall stellt H. a. tschadensis ein Synonym zu H. a. amphibius und H. a. constrictus zu H. a. capensis dar. Eine ähnliche Gliederung hatten auch Don E. Wilson und DeeAnn M. Reeder im Jahr 2005 vorgenommen.[84]
Innere Gliederung der Flusspferde nach Pandolfi et al. 2020[85]
|
Neben dem rezenten Flusspferd werden noch verschiedene ausgestorbene Arten innerhalb der Gattung Hippopotamus geführt. Diese waren ursprünglich nicht nur auf Afrika beschränkt, sondern kamen auch im westlichen Eurasien und auf Madagaskar vor:
- afrikanische Formen:
- aff. Hippopotamus aethiopicus Coryndon & Coppens, 1975
- aff. Hippopotamus afarensis (Gèze, 1985)
- aff. Hippopotamus coryndonae Gèze, 1985
- aff. Hippopotamus dulu (Boisserie, 2004)
- aff. Hippopotamus karumensis Coryndon, 1977
- aff. Hippopotamus protamphibius Arambourg, 1944
- Hippopotamus gorgops Dietrich, 1926 (Hippopotamus behemoth Faure, 1986 ?)
- Hippopotamus kaisensis Hopwood, 1926
- Hippopotamus sirensis Pomel, 1896
- eurasische Formen
- Hippopotamus antiquus Desmarest, 1822 (Hippopotamus georgicus Vekua, 1976 ?) (Festland)
- Hippopotamus creutzburgi Boekschoten & Sondaar, 1966 (Kreta)
- Hippopotamus melitensis Major, 1902 (Malta)
- Hippopotamus minor Desmarest, 1822 (Zypern)
- Hippopotamus pentlandi Meyer, 1832 (Sizilien, Malta)
- Hippopotamus tiberinus Mazza, 1991 (Festland)
- madagassische Formen:
- Hippopotamus guldbergi Fovet, Faure & Guérin, 2011 (Hippopotamus madagascariensis Guldberg, 1883)
- Hippopotamus laloumena Faure & Guérin, 1990
- Hippopotamus lemerlei Grandidier, 1868
Ein Großteil der afrikanischen Formen (aff. H. aethiopicus, aff. H. coryndonae, aff. H. karumensis, aff. H. protamphibius) wurde ursprünglich zur Gattung Hexaprotodon verwiesen, aff. H. afarensis wiederum stand in der eigenständigen Gattung Trilobophorus. Eine phylogenetische Studie aus dem Jahr 2005 durch Jean-Renaud Boisserie beschränkte Hexaprotodon jedoch weitgehend auf die asiatischen Flusspferde und sah die afrikanischen Vertreter näher mit dem eigentlichen Flusspferd verwandt. Allerdings ist für mehrere Formen die genaue taxonomische Position noch nicht gesichert.[12][74] Dies gilt auch für das zypriotische Flusspferd H. minor, dass zumeist als zur Gattung Phanourios gehörig betrachtet wird. Andere Autoren stufen Phanourios jedoch als direkten Abkömmling von Hippopotamus ein.[86] Genetisch trennte sich das zypriotische Flusspferd von der Linie des heutigen Flusspferdes vor rund 1,58 bis 1,36 Millionen Jahren ab.[87]
Verschiedene aus Eurasien benannte Formen und teils gebrauchte Namen müssen als Synonyme betrachtet werden. So ist bei den jüngeren Formen H. incognitus (Europa) mit H. amphibius gleichzusetzen. Bei den älteren Vertretern gilt H. major (Europa) als identisch mit H. antiquus, was wahrscheinlich auch für H. georgicus (Kaukasus) anzunehmen ist. Manche Wissenschaftler fassen dies auch für H. tiberinus (Europa) auf. Für die afrikanischen Flusspferde besteht die Möglichkeit, dass H. sirensis (Nordafrika) und H. gorgops (Ostafrika) nur Variationen einer Art sind und letzteres dann gemäß der Prioritätsregel in ersteres aufgehen müsste. Die meisten Wissenschaftler ziehen dies auch für H. behemoth aus Vorderasien in Betracht. Häufig wird zudem vermutet, dass das afrikanische H. gorgops die Vorgängerform des eurasischen H. antiquus darstellt, beide zeigen deutliche Übereinstimmungen. Somit könnten beide auch als konspezifisch aufgefasst werden, womit der gesamte Artname auf H. antiquus fallen würde. Allerdings sind bisher nördlich der Taurus-Zagros-Gebirgskette keine afrikanischen Formen angenommen worden. Prinzipiell mahnen Wissenschaftler eine umfassende Revision der eurasischen und afrikanischen Flusspferde an.[89]
Für die mediterranen Flusspferde bildet H. minutus ein Teilsynonym zu H. melitensis.[90][91][92] Das madagassische Flusspferd H. madagascariensis wurde ursprünglich von Gustav Adolf Guldberg eingeführt,[93] entspricht aber in seinem Typusexemplar weitgehend H. lemerlei. Ein im Jahr 1902 von Charles Immanuel Forsyth Major ebenfalls unter H. madagascariensis vorgestelltes Skelett weicht deutlich ab.[94] Als Konsequenz daraus wurde im Jahr 2011 H. madagascariensis mit H. lumerlei synonymisiert und H. guldbergi als Ersatzname für Majors Skelett vorgeschlagen.[95] Die Umbenennung ist aber nicht vollständig anerkannt.[96][97]
Stammesgeschichte
Entwicklung in Afrika
Die Gattung Hippopotamus trat in Afrika vermutlich schon während des Unteren Pliozäns auf. Fast alle frühen Funde kamen im nordöstlichen und östlichen Teil des Kontinents zu Tage. Für die meisten frühen Formen ist eine direkte Zuweisung aber momentan noch problematisch. Ihre nahe Verwandtschaft mit Hippopotamus drückt sich jedoch durch den teils stärker ausladenden Unterkiefer aus, bei denen die Zahnfächer der Eckzähne deutlich abstehen, was weniger an andere frühe Gruppen wie Hexaprotodon und Archaeopotamus erinnert. Dies betrifft unter anderem den Schädel und Unterkiefer von aff. Hippopotamus dulu aus der Sagantole-Formation im Gebiet des Awash im Afar-Dreieck in Äthiopien, der mit einem Alter von 5,2 bis 4,9 Millionen Jahren zu den frühesten Resten gehört. Insgesamt zeigt er noch deutliche Reminiszenzen an urtümlichere Vertreter wie Archaeopotamus, etwa im Bau der Unterkiefersymphyse. Aus der gleichen Region, jedoch aus der mit 3,4 bis 2,3 Millionen Jahren etwas jüngeren Hadar-Formation, wurden aff. Hippopotamus afarensis und aff. Hippopotamus coryndonae beschrieben. Für beide standen jeweils Schädelreste zur Verfügung. Hippopotamus afarensis besaß ein massives Rostrum, das in etwa dem des heutigen Flusspferdes glich, während aff. Hippopotamus coryndonae deutlich kleiner war.[98] In diesem Merkmal ähnelte die Form aff. Hippopotamus protamphibius. Im Unterschied aber zu aff. Hippopotamus coryndonae und ebenfalls zu den beiden anderen vorher genannten Arten, die jeweils über sechs Schneidezähne im oberen und unteren Gebiss verfügten und somit hexaprotodont waren, zeichnete sich aff. Hippopotamus protamphibius wie das heutige Flusspferd durch nur vier Schneidezähne aus, gehörte also zum tetraprotodonten Typus. Allerdings scheint dieses Merkmal bei aff. Hippopotamus protamphibius eher variabel gewesen zu sein, da einige Schädel auch jeweils sechs Incisiven aufweisen. Die Form ist über zahlreiches Fundmaterial aus dem Tal des Omo im südwestlichen Äthiopien überliefert. Dort verteilt es sich auf mehrere Gesteinseinheiten, von der Mursi- über die Usno- bis zur Shungura-Formation, und besitzt so eine zeitliche Reichweite von etwa 4,0 bis 1,9 Millionen Jahren. Allein die Shungura-Formation erbrachte über 8000 Flusspferdreste. Das reichhaltige Fundmaterial ermöglicht Einblicke in die Lebensweise. Hierbei zeigte sich, dass, offensichtlich gesteuert durch klimatische Veränderungen, vor rund 2,8 Millionen Jahren ein Wechsel von eher blatthaltiger zu stärker grashaltiger Nahrung erfolgte.[42][99] Weitere Funde sind aus der bedeutenden Koobi-Fora-Formation vom Turkana-See im nördlichen Kenia dokumentiert, die zwischen 2,0 und 1,4 Millionen Jahre alt ist. Von einzelnen Fundstellen am Turkana-See wurden mit aff. Hippopotamus karumensis und aff. Hippopotamus aethiopicus noch zwei weitere Formen eingeführt, die beide als tetraprotodont angesehen werden. Allerdings wies erstere Art manchmal nur zwei Schneidezähne im Unterkiefer auf. Bei ihr handelt es sich um einen insgesamt großen Vertreter, ähnlich dem heutigen Flusspferd. Die letztere Form erwies sich mit einer Größe vergleichbar zum rezenten Zwergflusspferd als eher klein.[100][11][74]
Im Übergang vom Pliozän zum Pleistozän vor rund 2,5 Millionen Jahren traten dann auch erstmals eindeutige Angehörige der Gattung Hippopotamus auf, die sich neben dem massiven Unterkiefer durch ihre gerippten unteren Eckzähne als typisches, mit der Gattung verbundenes Kennzeichen hervorheben. Aus der Kaiso-Formation in Uganda wurde Hippopotamus kaisensis berichtet, von dem unter anderem ein Schädel vorliegt. Insgesamt ist die Form nur wenig untersucht und es bestehen mitunter Abgrenzungsprobleme zum eigentlichen Flusspferd. Dies zeigen unter anderem Funde aus den Lusso Beds am oberen Semliki im Zentralafrikanischen Graben von Uganda. Die zahlreichen Zahnfunde ähneln stark denen des heutigen Flusspferdes und könnten so ein bereits sehr frühes Auftreten der Art schon vor rund 2,3 Millionen andeuten.[101] Allerdings lassen sich auch Überschneidungen mit Hippopotamus gorgops feststellen. Dieses sehr große Tier, das die rezenten Vertreter deutlich übertraf, ist von zahlreichen Fundstellen überliefert. Die wahrscheinlich frühesten Reste kamen am Turkana-See zu Tage und sind rund 2,5 Millionen Jahre alt. Den weitaus bedeutendsten Fundort bildet die auch für die frühmenschliche Entwicklung wichtige Olduvai-Schlucht im nördlichen Tansania. Dort ist die Art im Alt- und Mittelpleistozän über einen Zeitraum von vor 1,9 bis 0,6 Millionen Jahren belegt. Sie tritt dort relativ häufig auf, neben unzähligen Knochen sind auch teils gut erhaltene Skelette und selten fossilisierte Trittsiegel aufgefunden worden, letzte formen eine Art „Hippo trail“.[102][103] Anhand der Knochenfunde aus der Olduvai-Schlucht kann für Hippopotamus gorgops eine auffallende stammesgeschichtliche Veränderung im Schädelbau nachvollzogen werden. Waren die frühesten Vertreter noch dem heutigen Flusspferd ähnlich, so entwickelten sich spätere Formen zu extremen Spezialisten im Bezug auf die amphibische Lebensweise. Die Schnauze verlängerte sich deutlich, wodurch sich auch das Diastema zwischen dem zweiten und dritten Prämolaren des Unterkiefers streckte. Der hintere Schädel hingegen wurde kürzer und der Kamm des Hinterhauptsbeins verlagerte sich nach oben, wie auch allgemein der Schädel abflachte. Des Weiteren kam es zu einer zusätzlichen Aufschiebung der Augenhöhle, die so extrem periskopartig wirkte und woher auch der wissenschaftliche Artname herstammt (von griechisch γοργός (gorgos) für „schrecklich“ und ὤψ (ops) für „Gesicht“ oder „Antlitz“).[104][11] Hippopotamus gorgops erreichte eine weite Verbreitung im östlichen Afrika und ist an Fundstellen wie Olorgesailie in Kenia oder Buia in Eritrea aufgefunden worden. Letztere erbrachte zahlreiche Gebissfragmente aus dem Zeitraum von vor etwa 1 Million Jahren. Außerdem ist es der wahrscheinlich erste Vertreter der Gattung Hippopotamus, der das südliche Afrika erreichte. Funde liegen hier unter anderem mit einem rund 69 cm langen Schädel aus Cornelia in der südafrikanischen Provinz Freistaat vor. Er datiert in das Mittelpleistozän.[9][74] Bereits im frühen Altpleistozän erscheint Hippopotamus sirensis in Nordafrika. Die große Form ist dort von verschiedenen Fundstellen dokumentiert, so unter anderem von Tighénif (Ternifine) in Algerien oder Thomas Quarry in Marokko, die beide wegen ihrer Funde von Homo erectus von Bedeutung sind. Hippopotamus sirensis kam dort in den damals feuchten Landschaften recht zahlreich vor.[106][107][108]
Abseits von den bereits erwähnten problematischen Funden vom Semliki gilt ein Teilskelett aus Gafalo in der Gobaad-Ebene von Dschibuti als der derzeit älteste Nachweis des eigentlichen Flusspferdes, das damit im Altpleistozän vor rund 1,6 Millionen Jahren eindeutig fassbar ist. Der Kadaver von Hippopotamus amphibius wurde dort gemeinsam mit dem Skelett des Elefantenvertreters Palaeoloxodon recki aufgefunden.[109] Weitere frühe Funde kamen in den oberen Abschnitten der Shungura-Formation im Omo-Tal zum Vorschein. Ihr Alter beträgt rund 1,38 Millionen Jahre. Ein vergleichbares Alter weisen die Funde aus Nariokotome am westlichen Turkanasee auf. Bereits in das frühe Mittelpleistozän gehört ein Oberkiefer aus Asbole im Awash-Tal.[110] Ebenfalls aus der Region wurden in Gombore rund 700.000 Jahre alte Trittsiegel beschrieben, die teils 30 cm in den einst schlammigen Untergrund eingetieft sind und mitunter noch die vier Zehen erkennen lassen.[111] Andere nennenswerte Fossilreste verteilen sich auf die Fundstellen Lainyamok, Isenya und Kapthurin, allesamt Kenia.[110][107] Im südlichen Afrika ist Hippopotamus amphibius unter anderem mit mehr als 200 Knochenresten von rund einem Dutzend Individuen in Elandsfontein vertreten. Die Fundstelle liegt im Südwesten von Südafrika und hat eine mittelpleistozäne Zeitstellung.[112][113][114]
Vorderasiatische Funde

Vertreter der Gattung Hippopotamus wanderten mehrfach aus Afrika aus. Der Migrationsweg erfolgte wahrscheinlich über die Levante. Von hier ist umfangreiches Fossilmaterial unter anderem aus 'Ubeidiya in Israel belegt, das auf etwa 1,4 Millionen Jahre datiert. Die Zuweisung der Funde ist nicht ganz eindeutig, da diese wahlweise als Hippopotamus gorgops, Hippopotamus antiquus oder als Lokalform Hippopotamus behemoth angesprochen werden.[107][115] Wenig später treten Flusspferde auch in Latamne in Syrien auf. Hier sind die Altersdaten uneinheitlich, da sowohl eine alt- wie auch ein mittelpleistozäne Stellung in Frage kommt.[107][116] Im Mittelpleistozän erreichte auch Hippopotamus amphibius die Region, das eventuell schon in Gesher Benot Ya’aqov in Israel anwesend war. Die Fundstelle datiert zwischen 700.000 und 500.000 Jahren. Die Bestimmung des Fundmaterials erweist sich als häufig schwierig, da es überwiegend stark fragmentiert ist. Die Art verblieb hier aber noch bis in das Holozän und besiedelte die Flusstäler, möglicherweise aber mit einer Unterbrechung während der kühleren Abschnitte der letzten Kaltzeit.[117] Von der Levante breitete sich das Flusspferd bis auf die Arabische Halbinsel aus, wie dies eine größere Sammlung an Funden aus Khall Amayshan in der Nefud in Saudi-Arabien belegen. Hier bestanden während der letzten Warmzeit vor gut 110.000 Jahren einzelne Seen, an denen sich eine reichhaltige Fauna aufhielt.[118] Eine weitere Ostexpansion des Flusspferdes erfolgte nicht. Möglicherweise wurde dies dadurch verhindert, dass im südlichen und östlichen Asien eine vergleichbare ökologische Nische bereits durch Vertreter der Gattung Hexaprotodon besetzt war.[107][116][120]
Europa und die Inseln des Mittelmeers


In Europa sind Flusspferde wenigstens seit dem Altpleistozän nachgewiesen die frühen Formen werden zumeist Hippopotamus antiquus zugewiesen. Einer der frühesten Funde stammt mit einem oberen Schneidezahn von der Fundstelle Coste San Giacomo südöstlich von Rom im mittleren Italien. Der Fundstelle wird ein Alter von rund 2 Millionen Jahren zugesprochen.[121] Andere alte Hinweise fanden sich in Spanien, Frankreich und Griechenland, in ersteren unter anderem mit einer rund 1,6 Millionen Jahre alten Zahnreihe aus Venta Micena bei Granada.[122][115] Von hoher Bedeutung sind mehrere Teilskelette aus Untermaßfeld in Thüringen, die möglicherweise bei einer katastrophalen Flussüberschwemmung vor gut 1,07 Millionen Jahren angeschwemmt wurden. Von insgesamt über 320 Knochenresten, die zu etwa 20 Individuen gehören, erwiesen sich hier mehr als die Hälfte als zu Jungtieren gehörend.[123][124] Weitere bedeutende Funde sind aus Collecurti auf der halben Strecke zwischen Rom und Florenz, wiederum Italien, belegt. Auch diese kamen in Flussablagerungen zu Tage und setzen sich aus rund 400 Knochenelementen von rund einem Dutzend Individuen zusammen. Ihr geologisches Alter ist nahezu entsprechend zu dem der Untermaßfelder Flusspferde.[125] Dies gilt auch für einzelne Zähne aus der Westbury Cave in Somerset in England, die zu den ältesten Nachweisen von Flusspferden auf den Britischen Inseln gehören.[126] Eine Besonderheit stellen die Fossilreste von Het Gat dar, da sie vom Grund der Nordsee etwa in der Mitte zwischen den Niederlanden und England aufgefischt wurden.[127] Nach Osten drang die Form vermutlich bis in den Kaukasusregion vor, da wiederum Reste aus der rund 700.000 Jahre alten georgischen Fundstelle Achalkalaki stammen.[128] Hippopotamus antiquus war ein gewaltiges Tier, wahrscheinlich das größte Flusspferd, das in Europa auftrat. Die Längenmaße seiner einzelnen Skelettelemente sind zumeist um 106 bis 126 % größer als die Werte der rezenten Tiere. Anhand der Funde aus Untermaßfeld und Collecurti kann auf ein Gewicht von 2100 bis 3200 kg geschlossen werden, andere Angaben reichen bis 4200 kg, was etwa dem Doppelten des heutigen Flusspferdes entspricht.[130] Gegen Ende des Altpleistozäns ist dann noch Hippopotamus tiberinus nachweisbar. Dessen Reste sind aber weitaus spärlicher, belegt ist die Form unter anderem aus La Maglianella in Italien und eventuell aus Mosbach in Deutschland. Beide Formen haben möglicherweise eine nähere Verbindung zum afrikanischen Hippopotamus gorgops, was sich unter anderem an einzelnen Schädelmerkmalen zeigt. So erweist sich der Schädel als schlanker und länger im Vergleich zum eigentlichen Flusspferd und die Augenhöhlen treten prominenter hervor.[90][130]
Sowohl das letzte Auftreten der frühern europäischen Flusspferde und das erste Erscheinen des klassischen Flusspferdes Hippopotamus amphibius in Europa lässt sich momentan kaum bestimmen. Ursprünglich wurde die Art bereits aus dem frühen Mittelpleistozän berichtet. Als einzelne Hinweise galten einige Zahnfunde aus Isernia la Pineta in der Region Molise in Mittelitalien, die aber heute zu Hippopotamus antiquus gestellt werden. Eines der jüngsten Vorkommen von Hippopotamus tiberinus ist aus dem spätmittelpleistozänen Castel di Guido, wiederum im Mittelitalien, zu verzeichnen. Eine recht häufige Präsenz hat Hippopotamus amphibius während der Eem-Warmzeit vor circa 126.000 bis 115.000 Jahren. Wichtig in diesem Zusammenhang sind einige Fundstellen im Rheinland, an denen die Art gemeinsam mit dem Europäischen Waldelefanten und dem Wasserbüffel auftrat. Extrem weit nördliche Nachweise wurden bei Barrington in Cambridgeshire zu Tage gefördert, von wo umfangreiches Material von Hippopotamus amphibius bekannt ist. Einzelne Zähne und Wirbelreste stammen auch vom Ufer des Severn bei Gloucester in Gloucestershire, beide Fundstellen liegen in England.[131] Die in Barrington aufgefundenen Individuen erreichten mit einem geschätzten Körpergewicht von bis zu 3000 kg fast wieder die Ausmaße von Hippopotamus antiquus.[130] Die Besiedlung der mittel- und westeuropäischen Gebiete weit nördlich der Alpen während der letzten Warmzeit setzt einzelne ökologische Bedingungen voraus. Womöglich war das Klima damals stärker maritim beeinflusst mit warmen Sommern und vor allem milden, wenig frostigen Wintern. Dadurch fehlt die Art auch in den stärker kontinental geprägten Bereichen Mittel- und Osteuropas und zog sich zum Ende der Eem-Warmzeit wieder aus diesen nördlichen Refugien zurück.[132][133][134][135] Im südlichen Europa, so auf der Balkan-, Apenninen- und Iberischen Halbinsel hielt sich Hippopotamus amphibius vermutlich noch bis in die frühe Weichsel-Kaltzeit. Exemplarisch genannt sei hier die Grotta Romanelli bei Lecce in Süditalien.[136]

Im Verlauf ihrer Fossilgeschichte in Europa erreichten die Flusspferde verschiedene Inseln des Mittelmeers, was für Hippopotamus antiquus wie auch für Hippopotamus amphibius gilt. Dort bildeten sich jeweils verzwergte Formen heraus. Zu den forschungsgeschichtlich frühesten Funden gehören jene auf Sizilien und Malta. Hier werden in der Regel mit Hippopotamus pentlandi und Hippopotamus melitensis zwei Arten unterschieden, die sich bezüglich ihrer Körpergröße voneinander absetzen. Die größere Form, die rund 1100 kg auf die Waage brachte, wird durch Hippopotamus pentlandi gestellt und war auf beiden Inseln präsent. Sie gehört dem ausgehenden Mittel- und dem frühen Jungpleistozän an. Vor allem auf Sizilien finden sich zahlreiche Fundstellen, wie etwa bei Messina im Nordosten oder bei San Vito lo Capo im Nordwesten.[137][92] Hippopotamus melitensis hingegen ist weitgehend nur von Malta belegt und bildet mit einem Durchschnittsgewicht von etwa 900 kg die kleinere Form.[138] An einzelnen Fundstellen wie der Għar Dalam tritt sie gemeinsam mit Hippopotamus pentlandi auf.[139] Ihre genauere geologische Zeitstellung ist vielfach wenig geklärt. Beide Arten stellen möglicherweise unterschiedliche Stadien der Inselverzwergung dar, die bei letzterer durch die kleinere Inselfläche und stärkeren Endemismus weiter fortgeschritten ist. Sie werden jedoch aufgrund der Schädelmorphologie jeweils auf Hippopotamus amphibius als Ausgangsform zurückgeführt.[140][130] Auf Kreta kamen Funde von Flusspferden ebenfalls bereits Mitte des 19. Jahrhunderts zu Tage. Ein größerer Teil stammt aus dem östlichen Inselbereich, so etwa von der Lasithi-Hochebene oder der Karoumes-Bucht bei Sitia. Weitere Fossilrest konnten auch von Akrotiri an der Nordwestküste geborgen werden. Sie stehen weitgehend in einem alt- bis mittelpleistozänen Zusammenhang, was unter anderem durch die Beifunde von Kritimys ausgedrückt wird. Es handelt sich um einen kleinen Vertreter der Flusspferde, der im Jahr 1966 mit Hippopotamus creutzburgi seinen Namen erhielt.[141][142] Der Ursprung dieser Form war lange Zeit in Diskussion, heute gilt zumeist Hippopotamus antiquus als Vorfahr. Gegenüber diesen war Hippopotamus creutzburgi mit einem Gewicht von knapp 400 kg deutlich verzwergt.[138][140][130] Der kleinste Angehörige der mediterranen Flusspferde ist von Zypern bekannt und wird unter der wissenschaftlichen Bezeichnung Hippopotamus minor geführt. Rekonstruiert wurden die Tiere nur rund 132 kg schwer.[138][86] Die Form erfuhr die stärksten Überprägungen im Schädelbau. So ist der Scheitelkamm nicht mehr ausgebildet, ebenso wie die hintersten Prämolaren fehlen. Die deutlichen Abweichungen von den festländischen Vertretern führen auch zu einen Verweis in eine eigene Gattung unter der Bezeichnung Phanourios. Zusätzlich wird dadurch die phylogenetische Ableitung erschwert, so dass der direkte Vorfahr bisher nicht bestimmt werden konnte. Es sind mehrere Dutzend Fundstellen auf der Insel bekannt, die sowohl Höhlen und Abris als auch Freilandplätze umfassen. Eine der bedeutendsten findet sich im Süden auf der Halbinsel Akrotiri, wo in der eingestürzten Höhle Aetokremnos mehr als 218.000 Flusspferd-Reste von mehr als 500 Individuen dokumentiert sind. Sie repräsentieren mehr als 90 % des gesamten faunistischen Fundmaterials. Die immense Ansammlung von Flusspferdresten, das Fehlen größerer Beutegreifer auf der Insel und ursprüngliche Radiokarbonmessungen, die den Funden ein Alter von rund 11.800 Jahren vor heute und damit eine Stellung am Ende des Pleistozäns gaben, führten zu der Ansicht, dass frühe menschliche Siedler dafür verantwortlich seien.[143][144][145] Aufgrund fehlender Nachweise menschlicher Manipulation wurde diese Ansicht aber teils kritisch gesehen.[140] Neuere Datierungen verweisen für die untersten Schichtabschnitte mit dem höchsten Aufkommen an Flusspferden auf ein Alter von rund 12.500 Jahren vor heute. Sie liegen damit außerhalb der Zeit des ersten Auftretens des Menschen auf Zypern, womit die Knochenansammlungen wohl als natürlich zu werten sind.[146]
Flusspferde Madagaskars

Neben den verschiedenen Inseln des Mittelmeers erreichte das Flusspferd auch Madagaskar, welches sich wenigstens 400 km östlich von Afrika befindet. Dort bildeten sich ebenfalls mehrere Zwergformen aus. Wann die Art die Insel erstmals betrat ist unklar. Die bisher ältesten Funde sind aus der Höhle Belobaka im Nordwesten der Insel überliefert und weisen ein Alter von rund 20.600 Jahren auf, sie stammen somit aus der Hochphase der Letzten Kaltzeit. Es handelt sich lediglich um einzelne Zähne und Fußknochen eines Jungtieres. Diese frühen Vertreter waren allerdings noch nicht verzwergt, sondern kamen bezüglich ihrer Größe der afrikanischen Ausgangsform nahe. Sie werden der Art Hippopotamus laloumena zugewiesen.[147] Beschrieben wurde die Art anhand eines Unterkiefers aus Mananjary an der Ostküste, der allerdings möglicherweise nur 2500 Jahre alt ist.[148][149] Neben dieser Form gehören mit Hippopotamus lemerlei und Hippopotamus guldbergi noch zwei weitere Arten zu den madagassischen Flusspferden, die deutlich kleiner waren und mit jeweils einem Gewicht von etwa 374 beziehungsweise 393 kg dem heutigen Zwergflusspferd entsprachen.[138][86] Beide madagassischen Formen unterscheiden sich etwa in der Position der Augenhöhle relativ zur Schädellinie, den Verdickungen der Höhlenränder und in ihren Gliedmaßenproportionen. So hat erstere Art erhöhte Orbitae mit verdickten Rändern, bei letzterer zeigt sich ein längeres Schienbein und ein kürzerer Oberschenkelknochen. Die Variationen sind wohl Ausdruck einer abweichenden Lebensweise.[150][74][95] Der bisher früheste Nachweis für Hippopotamus guldbergi kommt aus der Umgebung von Tsaramody im Sambaina-Becken im zentralen Hochland von Madagaskar. Er datiert mit einem Alter von 17.600 Jahren vor heute in das Ende der letzten Kaltzeit. Gefunden wurden mehrere Teile des Bewegungsapparates.[151] Hippopotamus lemerlei ist mit einem Schädel vom Fluss Ihazofotsy im südlich-zentralen Hochland des Isalo-Gebirges aus dem Beginn des Holozäns vor rund 11.000 Jahren belegt.[152] An mehreren Stellen wurden beide Arten gemeinsam aufgefunden und hatten somit wohl ein teils sympatrisches Auftreten. Zu diesen gemeinsamen Vorkommen gehören Ampoza und Taolambiby im Südwesten Madagaskars sowie Belo Sur Mer an der Westküste. Das Alter der Fundstellen reicht von 1220 bis 2713 Jahren vor heute. Einige der aufgefundenen Flusspferdknochen tragen Marken, die teilweise als Schnittspuren verursacht durch den Menschen interpretiert werden. Die Ansicht ist nicht vollständig akzeptiert, da einerseits Ähnlichkeiten zu Nagespuren von Beutegreifern bestehen, andererseits manche absoluten Altersdaten außerhalb der frühesten Besiedlung der Insel liegen, die in einer traditionellen Sichtweise auf den Zeitraum um 500 v. Chr. angesetzt wird. Zu den jüngsten Funden von Flusspferden, die direkt datiert wurden, zählen jene von Itampolo an der Südwestküste, die rund 1000 Jahre alt sind. Möglicherweise überlebten aber noch einzelne Restpopulationen bis zum Kontakt mit den Europäern im 16. und 17. Jahrhundert oder darüber hinaus, was einzelne Erwähnungen und folkloristische Elemente annehmen lassen.[149][153][154][155]
Ausbreitung der Flusspferde und Konsequenzen der Inselverzwergung
Die Untersuchungen zur Fortbewegung des Flusspferdes und seine nur begrenzten Schwimmfähigkeiten in tieferem Wasser[21] warfen die Frage auf, wie die Tiere die unter Umständen entfernten Inseln erreicht haben könnten. Im Fokus standen vor allem Inseln wie Zypern, Kreta oder Madagaskar, die im Verlauf der jüngeren erdgeschichtlichen Vergangenheit während der Tiefststände der Meere im Zuge der verschiedenen Kaltphasen des Pleistozäns nicht mit dem Festland verbunden waren. Nach Paul P. A. Mazza konnte das Flusspferd demnach nur über potentielle Landbrücken oder bei seichtem Wasser während maximaler Vereisungsphasen entfernte Inseln erreichen.[156][157] Allerdings haben diese Umstände im Fall der drei genannten Inseln im Pliozän und Pleistozän nicht bestanden. Alexandra van der Geer und Kollegen führen daher an, dass es verschiedene Ausbreitungsszenarien gäbe. Hier könnten auch mehr oder weniger zufällige Ereignisse greifen, etwa katastrophale Begebenheiten wie Tsunamis oder Überflutungen, wodurch Flusspferdgruppen ins Meer gelangten. Ebenso könnten, wenn auch untergeordnet, Brandungsrückströmungen oder driftende Pflanzen eine Rolle spielen. Die spezielle Beschaffenheit der Haut des Flusspferdes und der langsame Metabolismus verhelfen den Tieren solche Extremsituationen zu überleben. Hinzu kompensiert der Auftrieb im salzigen Meerwasser den schweren Knochenbau. Dies ist wahrscheinlich auch der Grund, warum heute das Flusspferd auf Central Island im Turkana-See vorkommt. Die Insel liegt rund 9 km vom Festland entfernt und ist von 50 m tiefem, jedoch stark salzhaltigem Wasser umgeben. Außerdem sind Jungtiere deutlich bessere Schwimmer als ausgewachsene Individuen und erhöhen dadurch die Chancen auf ein Weiterbestehen der Gruppe als solche. Letztendlich vermochten auch andere große Säugetiere wie Elefanten entfernte Inseln zu erreichen.[158]
Die Besiedlung verschiedener Inseln führte zur Inselverzwergung der einzelnen Formen. Daraus resultierten allgemein eine Verschlankung des Skelettbaus und Kürzungen im Gesichtsschädel, was wiederum Veränderungen in der Gebissstruktur zur Folge hatte.[159][85] Dieser Prozess hat auf den kleineren Mittelmeerinseln eventuell einen anderen Hintergrund als auf dem wesentlich größeren Madagaskar. Bedingt durch die Größe trägt Madagaskar zahlreiche unterschiedliche Habitate. Möglicherweise unterlagen die Tiere daher diversen evolutiven Zwängen und bildeten die vergleichsweise große Diversität aus. Hippopotamus guldbergi zeigt deutlich weniger Anpassungen an eine semi-aquatische Lebensweise als Hippopotamus lemerlei und war wohl eher terrestrisch aktiv.[150][74][151] Jedoch auch auf den Mittelmeerinseln entstanden in ihrer Lebensweise abweichende Formen verglichen mit dem eigentlichen Flusspferd. Ein Teil davon ist dem zumeist steinigen Untergrund und wahrscheinlich auch dem merklich trockeneren Klima geschuldet. Einige Zwergformen des Flusspferdes entwickelten kurze Handwurzelknochen und Phalangen. Letzteres wird teilweise mit dem Verlust der breiten Hufe erklärt, womit sich die Tiere stärker als Zehenspitzengänger fortbewegt haben könnten, ähnlich den Ziegen. Durch eine überwiegend in Längsrichtung orientierte Hand- und Fußbewegung mit verminderten seitlichen Ausschermöglichkeiten erschlossen sich die Tiere so die felsigen Habitate und waren befähigt, entlang an Steilhängen und auf Klippen zu laufen. Auch nutzten sie Höhlen als Unterschlupf oder eventuell als Ressource für mineralhaltige Wässer.[160][161][162] Eine weitere auffallende Veränderung betrifft die Gehirngröße, die sich nicht im gleichen Maße wie die Körpergröße reduzierte. Das heutige Flusspferd besitzt ein Gehirnvolumen von 800 bis 955 cm³. Für die madagassischen Zwergflusspferde lag dieses rekonstruiert bei 305 bis 485 cm³, was der Variationsbreite beim Zwergflusspferd entspricht. Hippopotamus minor als kleinstes verzwergtes Flusspferd wies ein 218 cm³ großes Gehirn auf. Der Enzephalisationsquotient stieg somit von 0,41 beim heutigen Flusspferd auf 0,58 bei Hippopotamus minor. Generell besitzt das Flusspferd im Vergleich mit anderen Huftieren ein sehr kleines Gehirn. Der Trend zu einer relativen Gehirngrößenzunahme ist aber auch bei Zwergelefanten belegt.[86]
Forschungsgeschichte
Erwähnungen in antiker Literatur
Einzelne antike Autoren widmeten sich bereits sehr früh dem Flusspferd. Die älteste Beschreibung stammt von Hekataios von Milet aus dem 6. Jahrhundert v. Chr. Er gab an, dass das Tier gespaltene Hufe habe, aber in Schwanz, Mähne und Stimme dem Pferd gleiche. Dies wurde von zahlreichen späteren Gelehrten übernommen,[163] so auch von Herodot, der in seinen Historien im 5. Jahrhundert v. Chr. schrieb:
„Die Flußpferde gelten im Gau von Papremis als heilig, im übrigen Ägypten nicht. Das Flußpferd sieht folgendermaßen aus: es hat vier Füße, gespaltene Klauen, eine stumpfe Nase, eine Mähne wie ein Pferd, hervorstehende Zähne, Roßschweif und -stimme und ist so groß wie ein sehr großes Rind. Die Haut ist so dick, daß man aus der getrockneten Haut Lanzenschäfte macht.“
Ebenso berichtete Aristoteles vom Flusspferd und vermerkte in seiner Historia animalium aus dem 4. Jahrhundert v. Chr. die Ähnlichkeit der inneren Organe mit denen der Esel und Pferde, beim Schwanz glich es jedoch eher den Schweinen. Andere Autoren wie Zenobios und Aelian hoben die Gefährlichkeit und Gewalttätigkeit der Tiere hervor. In der Naturalis historia gibt Plinius der Ältere im ersten nachchristlichen Jahrhundert ein genaues Abbild der Lebensweise des Flusspferdes wieder, wobei er aber Teile von Herodot übernahm. Jedoch erwähnte er bereits die charakteristisch roten Hautausscheidungen. Des Weiteren ist seinem Werk zu entnehmen, dass um 58 v. Chr. ein Flusspferd in einer römischen Arena eingesetzt wurde. In der Folgezeit ließen diverse römische Herrscher Flusspferde nach Rom schaffen, um diese bei Spielen auftreten zu lassen, so etwa Nero und Antoninus Pius. Allein Commodus soll nach Cassius Dio sechs Flusspferde bezwungen haben. Doch bereits im 4. Jahrhundert musste Themistios resümieren, dass das Flusspferd in Unterägypten ausgerottet war, da es Pflanzungen zerstörte, das Verschwinden der Tiere aber negative Auswirkungen auf die Spiele in Rom habe. Ähnlich äußerte sich Ammianus Marcellinus im etwa gleichen Zeitraum, der zusätzlich angab, dass die Tiere weiter im Süden bei den Blemmyern in Nubien zu finden seien.[163][165]
Frühe Neuzeit und Erstbeschreibung
_BHL4770169.jpg.webp)

Eine der ältesten Beschreibungen des Flusspferdes in der westlichen Welt erstellte der französische Naturforscher Pierre Belon im Jahr 1553, in der er sich auf mehreren Seiten dem Tier widmete. Darin präsentierte er auch mehrere Abbildungen, unter anderem eine, auf dem das Flusspferd kämpfend mit einem Krokodil zu sehen ist. Belons Abhandlung ist Bestandteil seiner Reiseberichte, die basierend auf seinen Expeditionen durch die Inselwelt des Mittelmeers, den Vorderen Orient und Ägypten in den Jahren 1547 und 1549 entstanden.[166] Im Jahr 1598 begab sich Christoph Harant von Polschitz und Weseritz ebenfalls in die Region und schrieb seine Erlebnisse nieder, die aber erst gut 80 Jahre später auf Deutsch erschienen. Seine Ausführungen zum Flusspferd sind stark von den antiken Autoren beeinflusst.[167] In der Wende vom 16. zum 17. Jahrhundert berichtet der italienische Arzt Federico Zerenghi von seinen Unternehmungen nach Oberägypten, auf denen er nach eigenen Aussagen zwei Flusspferde erlegt und deren Häute mit in seine Heimat gebracht hatte. Seine Publikation wurde im Jahr 1603 veröffentlicht, versehen mit einer Darstellung des Flusspferdes. Die Häute wurden später in Venedig ausgestopft.[168] Die dadurch entstandenen Präparate beinhalten jedoch einige anatomisch Abweichungen, etwa im Bereich des Kopfes und der Füße, letztere erhielten ein Aussehen, das eher an Hundepfoten erinnert. Eines der beiden Präparate gelangte vermutlich in das Museum La Specola in Florenz, wo es unter der Bezeichnung Ippopotamo di Boboli ausgestellt ist. Der Name rührt daher, dass angeblich in der Wende vom 17. zum 18. Jahrhundert unter Cosimo III. ein Flusspferd im Boboli-Garten frei herumlief,[169] worüber es allerdings keine Aufzeichnungen gibt. Der Verbleib des zweiten Präparats ist momentan ungeklärt.[170] Im weiteren Verlauf des 17. und im 18. Jahrhundert erwähnen auch mehrere Erforscher des südlichen Afrikas das Flusspferd, darunter Étienne de Flacourt, der Gouverneur von Madagaskar, in seinen Reisebeschreibungen aus dem Jahr 1658.[171] Johann Schreyer, der von 1668 bis 1674 das südliche Afrika bereiste, schildert im Jahr 1681 eindringlich die amphibische Lebensweise der Tiere und ihre nächtlichen Wanderungen von den Rastplätzen am Wasser zu den Weidegründen, er bezeichnet sie allerdings als „See-Kühe“.[172] Ähnlich äußerte sich nur wenig später Simon van der Stel, der erste Gouverneur der Kapprovinz, der zwischen 1685 und 1686 das Namaqualand im Südwesten Afrikas auf der Suche nach Kupferlagerstätten erkundete und am Fluss Verlorevlei, seinem Zeekoejen-valey („Seekuh-Tal“), Flusspferde sichtete.[173]



Neben diesen Forschungsreisenden beschäftigten sich auch die Gelehrten Europas schon früh mit dem Flusspferd, bekamen aber kaum ein lebendes Exemplar zu Gesicht. Im Jahr 1606 veröffentlichte der italienische Naturforscher Fabio Colonna in seiner Ekphrasis einen längeren Abschnitt über das Flusspferd, dem er auch eine Abbildung beisteuerte. Diese wirkt im Bezug auf Körper-, Kopf- und Fußgestaltung wie schon bei Belon zuvor etwas unrealistisch. Seine Angaben zu dem Tier hatte Colonna weitgehend von Plinius dem Älteren übernommen. Er erwähnte allerdings auch Zerenghi,[174] so dass vermutet wird, dass sein Bild vom Flusspferd durch eine der ausgestopften Häute des Arztes beeinflusst worden war.[170] Colonnas Porträt des Flusspferdes sollte in der Nachfolgeszeit starken Einfluss auf das Bild des Tieres in Europa haben. Teilweise zu erkennen ist dies auch in dem Gemälde „Die Nilpferdjagd“ von Peter Paul Rubens, das im 1615 entstand und das Flusspferd mit ähnlicher Kopf- und Fußgestaltung zeigt. Darüber hinaus entstanden auch deutliche Abwandlungen, die dem Tier ein stärker pferdeartiges- bis rinderartiges Aussehen gaben.[175] Die weitaus genaueste und umfassendste Abhandlung jener Zeit zum Flusspferd verfasste Georges-Louis Leclerc de Buffon im Jahr 1764. Sie erschien im zwölften Band seines zusammen mit Louis Jean-Marie Daubenton herausgegebenen Werkes Histoire naturelle, générale et particulière. Buffon hatte zwar auch kein lebendes Tier gesehen, doch standen ihm für seine Arbeiten neben den bereits publizierten Aufsätzen von Belon, Zerenghi, Colonna und anderen, die er umfangreich zitiert und kritisch beurteilt, auch ein Fötus, mehrere Schädel und Fußknochen zur Verfügung. Diese befanden sich im Cabinet du roi, dem Naturalienkabinett des französischen Königs und späteren Muséum national d’histoire naturelle in Paris. Dem Fötus widmet er in seinem Werk einen Kupferstich mit einem ausgewachsenen Tier im Hintergrund, das eine Kopie von Colonnas Tier ist und Buffon très-défectueuse („ungemein fehlerhaft“) vorkommt. Seine ausführlichen Beschreibungen stellen nicht nur den Fötus genau vor, auch erklärt er die inneren Organe und die Nabelschnur. Gleiches erfolgt zu den Schädeln und Fußknochen in Wort und Bild.[176]
Noch bevor Buffon seine umfassenden Ausarbeitungen zum Flusspferd aufsetzte, stellte Linnaeus im Jahr 1758 die wissenschaftliche Erstbeschreibung sowohl von Gattung als auch Art im Rahmen der 10. Ausgabe seines für die binominale Nomenklatur bedeutenden Werkes Systema Naturae vor. Als charakteristisch für die Gattung Hippopotamus benannte er die Struktur des Gebisses. Hierin wies er Belons Abhandlung von 1553 als seine Hauptquelle aus. Mit habitat in Nilo et bambolo Africae et ad ostia fluviorum Asiae gab Linnaeus den Nil, den Senegal und die Flussmündungen Asiens als Typusgebiet an.[177] Oldfield Thomas beschränkte dies im Jahr 1911 auf den Nil. Neben dem Flusspferd führte Linnaeus noch den Flachlandtapir (Tapirus terrestris) innerhalb der Gattung Hippopotamus. Beide Formen differenzierte er anhand der Zehenanzahl, sie sind aber nicht näher miteinander verwandt.[178]
Im 19. Jahrhundert wurden dann erstmals auch ausgestorbene Flusspferde wissenschaftlich eingeführt. Georges Cuvier beschrieb im Jahr 1804 mehrere Formen aus Europa, ohne diese dabei wissenschaftlich zu benennen. Er unterschied einzelne Größenvarianten, darunter eine große, die über Fossilfunde aus der Toskana und der Umgebung von Paris vorlag, sowie eine kleine mit Resten unbekannter Herkunft, für die Cuvier aber aufgrund der Gesteinsbrekzie, in der sie eingelagert waren, einen mediterranen Ursprung annahm.[179][180] Basierend auf Cuviers Arbeit vergab dann Anselme Gaëtan Desmarest im Jahr 1822 verschiedene wissenschaftliche Namen. Von diesen sind mit Hippopotamus antiquus für die große Form und mit Hippopotamus minor für die kleine zwei Vertreter bis heute anerkannt.[181] Nur zehn Jahre später folgte Hermann von Meyer mit der Beschreibung von Hippopotamus pentlandi anhand von zahlreichen Knochenresten aus einer Höhle aus der Umgebung von Palermo, Sizilien.[182] Es sollte dann wiederum rund dreieinhalb Jahrzehnte dauern, bis Alfred Grandidier 1868 mit Hippopotamus lemerlei Reste ausgestorbener Flusspferde von Madagaskar vorstellte.[183]
Etymologie
Bei der Bezeichnung Hippopotamus für das Flusspferd handelt es sich um eine Lehnübersetzung und latinisierte Form des griechischen Wortes ἱπποπόταμος (hippopótamos), welche sich aus den Teilen ἵππος (hippos) für „Pferd“ und ποταμός (potamos) für „Fluss“ zusammensetzt. Verwendet wurde sie bereits seit der Antike. So findet sie sich unter anderem bei Herodot im 5. Jahrhundert v. Chr., der damals allerdings noch ἵππος ποτάμιος (hippos potamios) angab, was so viel wie „Pferd aus dem Fluss“ bedeutet. Des Weiteren nutzten sie Nikandros aus Kolophon im 2. Jahrhundert v. Chr. und Strabon um die Zeitenwende. Das Artepitheton amphibius ist ebenfalls griechischen Ursprungs (ἀμφίβιος) und bezieht sich auf die amphibische Lebensweise im Wasser und an Land. Darauf wiesen gleichfalls bereits einzelne Autoren des Altertums hin, etwa Plinius der Ältere.[163]
Flusspferd und Mensch
Vorgeschichtliche Nutzung

Die Beziehungen zwischen dem Menschen und dem Flusspferd begannen bereits im Altpleistozän. Sie bestehen hauptsächlich aus der Nutzung der Kadaver der Tiere durch den Menschen. Ob das Flusspferd als ein großes und gefährliches Lebewesen zu diesem Zeitpunkt auch gejagt wurde, ist ungewiss. Die ältesten Hinweise auf die Verwendung der Tiere finden sich in Schnittmarken auf Knochen oder in zerschlagenen beziehungsweise aufgebrochenen Skelettelementen. Beobachtet wurden solche anthropogenen Einwirkungen unter anderem bereits in den unteren Schichten der Olduvai-Schlucht (FLK site) in Tansania sowie in Koobi Fora in Kenia, zudem auch in El Kherba in Algerien,[184] sie sind jeweils zwischen 1,8 und 1,5 Millionen Jahre alt und stehen damit in einem altpaläolithischen Kontext. In der Regel handelt es sich um einzelne Funde, die eine gelegentliche Nutzung der Flusspferd-Reste andeuten. Dies bleibt in der darauf folgenden Zeit bestehen, so dass das Flusspferd wohl ein regelmäßiges, wenn auch seltenes Element der Nahrungs- und Rohstoffversorgung des Menschen repräsentiert. Auch hier liegen Beispiele aus Olduvai (BK site und SHK site) vor,[185][186] zusätzlich etwa von Buia in Eritrea.[187] An keiner dieser im Zusammenhang mit menschlichen Hinterlassenschaften stehenden Fundstellen tritt das Flusspferd in nennenswert hoher Anzahl auf. Teilweise wurden die vom Menschen abgetrennten Körperteile später durch Raubtiere weitergenutzt, wie dies ein Schulterblatt aus Gombore in Äthiopien dokumentiert.[188] Eine Besonderheit in der Hinsicht der Nutzung von Flusspferd-Resten als Rohmaterial bildet ein aus einem Oberschenkelknochen gefertigter, etwa 12,8 cm langer Faustkeil von der rund 1,4 Millionen Jahre alten Fundstelle Konso, ebenfalls in Äthiopien.[189] Auch in Europa lässt sich das Flusspferd gelegentlich im Zusammenhang mit archäologischen Fundplätzen nachweisen, so etwa in Marathousa auf der Peloponnes in Griechenland, wobei auch hier in der Regel Einzelfunde vorliegen.[190]
Einen deutlich höheren Anteil weist das Flusspferd an einigen Fundstellen im Affad-Becken am Mittellauf des Nils im Sudan auf, die in das ausgehende Jungpleistozän vor rund 15.000 Jahren gehören und auf Menschen des späten Mittelpaläolithikums zurückgehen. Hier wurden unter anderem eine Knochenkonzentration aus über 180 Skelettelementen des Flusspferdes gefunden, was gut 19 % des bestimmbaren Faunenmaterials entspricht. Allerdings ist an keinem der Knochen eine direkte Manipulation feststellbar.[191] Mit der nachfolgenden Sesshaftwerdung des Menschen bildeten sich verschiedene neolithische Kulturen heraus. Vor allem im Niltal wurden in dieser Zeit unter anderem die Zähne des Flusspferdes zur Herstellung verschiedener Gegenstände verwendet. Zu nennen ist in diesem Zusammenhang das Gräberfeld von Kadruka auf der Höhe des dritten Kataraktes des Nils. Hier wurde in einem Grab ein aus einem Eckzahn gefertigter Kosmetikbehälter, bucrania genannt (eigentlich ein Zierelement aus einem Rinderhorn), gefunden. Zeitlich gehört die Fundstelle dem frühen bis mittleren Neolithikum des 5. vorchristlichen Jahrtausends an.[192] Ein weiteres Beispiel ist das ebenfalls im neolithischen Kontext stehende und etwa gleichalte Gräberfeld von Kadero nordöstlich von Khartum. In einigen der mehr als 240 Gräber fanden sich verschiedentlich Objekte aus den Eckzähnen des Flusspferdes gefertigt. Aber auch andere Körperpartien fanden Einzug in die materielle Kultur des Menschen. So barg das Grab 244 von Kadero neben mehreren Gefäßen, Armreifen und Muschelschalen zusätzlich einzelne langschmale Objekte mit Ausmaßen von rund 5 × 30 cm. Nach Gebrauchspurenuntersuchungen stellen sie wohl Schrapinstrumente dar, gefertigt aus den Rippen eines Flusspferdes. Bemerkenswert an Kadero ist, dass die Flusspferdfunde häufig in Verbindung mit Männer- oder Kinderbestattungen stehen und teilweise sehr reich ausgestattet sind. Einige Forscher vermuten daher, dass zu jener Zeit die Jagd auf die Tiere einer bestimmten Gruppe von Menschen vorbehalten war.[193]
Außerhalb Afrikas sind im Neolithikum und im Chalkolithikum die Zähne des Flusspferdes auch in der Levante vom Menschen verarbeitet worden. Möglicherweise bilden die dichtere Struktur und die deutlichere weiße Farbgebung die ausschlaggebenden Gründe für die Verwendung von Flusspferd-Elfenbein gegenüber etwa Elefanten-Elfenbein.[117] Ähnliches kann zum ägäischen Raum gesagt werden. Dort diente Elfenbein zur Herstellung von Siegeln, Intarsien oder Plaketten beziehungsweise Belägen, die, da die Rohstoffe eingeführt werden mussten, zumeist Luxusgegenstände repräsentieren. Dies hielt bis wenigstens zur mykenischen Zeit an. Zwar fanden hierbei überwiegend die Stoßzähne der Elefanten Verwendung, doch bestehen einzelne Objekte auch aus Flusspferd-Zähnen.[194] Als Herkunftsorte für die Flusspferd-Zähne kommen der Vordere Orient und das Niltal in Nordafrika in Betracht, möglicherweise mit einem Transport über das Mittelmeer. Dies lässt unter anderem das Schiff von Uluburun annehmen, das vor rund 3400 Jahren vor dem heutigen Kaş im Südosten der Türkei unterging und in den 1980er Jahren untersucht wurde. Es enthielt neben zahlreichen wertvollen Objekten aus Gold, Bronze und Glas sowie verschiedensten Keramikformen auch Elefanten-Stoßzähne und Zähne von Flusspferden.[195]
Künstlerische Darstellungen
Neben der Nutzung des Flusspferdes als Nahrungs- und Rohmaterialressource in vorgeschichtlicher Zeit fand es auch Einzug in die darstellende Kunst. Hiervon zeugen unter anderem mehrere tausend Jahre alte Felsmalereien, wie sie unter anderem im Tassili-n'Ajjer-Gebirge in Algerien gefunden wurden. Die Gebirgskette, die durch den rund 80.000 km² großen Tassili-n'Ajjer-Nationalpark geschützt wird, birgt schätzungsweise rund 15.000 Einzelbilder, von denen einige auch dem Flusspferd gewidmet sind. So findet sich die Abbildung eines Jungtieres in der Schlucht Oued Djerat im Norden des Gebirges. Von großer Bedeutung ist die Big hippo site in der Oued Afar rund 20 km südlich der Oued Djerat, wo allein 22 Abbildungen des Flusspferdes entdeckt wurden, die größte darunter 4,62 m lang. Die Darstellungen sind recht einfach gehalten und geben den Umriss der Tiere einschließlich des charakteristischen Kopfes mit Schnauze, Augen und Ohren wieder, ohne weitere Einzelheiten erkennen zu lassen. In der Regel werden einzelne Individuen, in manchen Fällen auch mehrere abgebildet. Eine szenische Darstellung wiederum zeigt ein Flusspferd einem Bogenschützen gegenüber stehend. Ein Teil der Abbildungen im Tassili-n'Ajjer mit der Wiedergabe von Wildtieren wie dem Flusspferd, aber auch von Giraffen, Elefanten, Nashörnern und anderen entstand wohl in der Frühphase der Felskunst der Region, als durch die klimatischen Bedingungen noch feuchtere Bedingungen herrschten. Die Phase der Felskunst wird lokal als „Phase der Großwildfauna“ bezeichnet und datiert zwischen 12.000 und 6.000 Jahren vor heute. Mit der zunehmenden Austrocknung der Landschaften verschwanden die großen Tiere. Die bildlichen Darstellungen gingen daher verstärkt zu Nutztieren über, weswegen hier auch von der „Pastoralen Phase“ gesprochen wird.[196][197] Weitere Felsbilder von Flusspferden sind unter anderem aus dem Messak Settafet in Libyen dokumentiert, so im Wadi Taleschout mit allein 15 Einzeldarstellungen.[198] Abseits der nordafrikanischen Felskunst können auch verschiedentlich Porträts von Flusspferden im südlichen Teil des Kontinents genannt werden. Als herausragendes Beispiel etwa gelten jene des Matopo-Gebirges, das durch den Matobo-Nationalpark im Westen von Simbabwe eingeschlossen wird. Darüber hinaus sind Abbildungen aus dem Mashonaland im Norden des Staates bekannt. Im letzteren Gebiet zeigt beispielsweise eine Darstellung zwei Tiere mit sich bewegenden Menschen drumherum, die möglicherweise eine Art Regentanz aufführen und so der Affinität des Flusspferdes zu Wasser Bedeutung verleihen.[199][200]

Durch seine Präsenz am Nil war das Flusspferd auch im Alten Ägypten bekannt. Bereits aus der Badari- und der Naqada-Kultur der prädynastischen Zeit sind verschiedenste Objekte mit flusspferdartigem Umriss bekannt. Sie hatten variierende Funktionen und umfassen Gefäße, Anhänger oder Figurinen. Als Materialien wurde Elfenbein, Chrysopras und ähnliches verwendet. Mehrere dieser Objekte kamen in Gräbern zum Vorschein, wie etwa auf dem großen Bestattungsareal von Mostagedda. In einigen Fällen sind die Objekte sehr deutlich als Flusspferd erkennbar, manchmal ist auch nur der Kopf dargestellt, in anderen wirken sie eher abstrakt. Die Bedeutung der Objekte ist nicht eindeutig, standen aber eventuell in einem magischen Kontext.[201] Im Alten Reich ließ sich Pepi II. auf einem Relief in seinem Totentempel in Sakkara bei der Flusspferdjagd darstellen. Hierbei harpuniert der Pharao in einer Szene das Tier, in einer anderen wird es auf einem Schlitten abtransportiert. Nach geläufiger Ansicht war die Jagd im Alten Reich nicht als Sport zu verstehen, sondern symbolisierte den Sieg der Ordnung, verbildlicht durch den Herrscher, über das Chaos, repräsentiert durch das Wildtier. Wesentlich intimer waren Flusspferddarstellungen im Mittleren und Neuen Reich. Nicht nur das die Jagd auf die Tiere auf Skarabäen und privaten Siegelamuletten verbildlicht wurde, auch kamen in dieser Zeit zahlreiche kleine Figurinen aus Fayence auf, allein aus dem Mittleren Reich sind rund 50 bis 60 solcher Figurinen belegt. Häufig gelangten sie als Beigaben in Grablegungen. Eventuell ersetzten sie hier gleichwertig die Tempelreliefs und hatten dann eine vergleichbare Funktion. Darstellungen von Flusspferden standen aber möglicherweise auch mit der ägyptischen Göttin Taweret in Zusammenhang, der als Herrin des Haushalts der Schutz über schwangere Frauen oblag und die als Mischwesen den Kopf eines Flusspferdes trug, mitunter ist auch der Körper flusspferdartig gestaltet. Sie erlangte im Neuen Reich eine größere Bedeutung, zuvor wurde ihre Position von anderen, teils auch mit dem Flusspferd verbundenen Göttinnen wie Ipet und Reret eingenommen. Im altägyptischen Glauben besaß das Flusspferd jedoch nicht nur protektive Eigenschaften, da es in Gefolgschaft von Seth, dem Gott des Verderbens und des Chaos sowie Tawarets Gemahl, auch zerstörerische Kräfte entwickelte. Letztere Attribute erhielt es aber weitgehend erst im Neuen Reich mit der Verfemung des Seth.[202][203][163][204]
Weitere kulturelle Bezüge
Die Göttin Tawaret beziehungsweise ihre älteren Inkarnationen standen nach Meinung einiger Wissenschaftler Pate für den „Minoischen Genius“, eine Art dämonischer Kreatur, die während der mittelminoischen Zeit im zweiten Jahrtausend v. Chr. aufkam und bei religiösen Festen und Zeremonien von Bedeutung war. In der Anfangsphase ähnelte der „Minoische Genius“ noch stark seinem ägyptischen Gegenstück, trug einen flusspferd- oder löwenartigen Kopf und besaß den Körper einer schwangeren Frau. In späteren Zeiten veränderten sich aber seine äußeren Attribute, sie wurde löwenhafter mit männlichem Körper bis hin zu einem insektoiden Erscheinungsbild. In dieser Abwandlung erreichte er dann auch das griechische Festland. Bisher ungeklärt ist der Weg der Verbreitung dieser mythischen Figur. Während einige Wissenschaftler eine direkte Herkunft aus Ägypten sehen, favorisieren andere einen Umweg über die Levante, wo in der gleichen Zeit ähnliche Figuren in Erscheinung treten.[205][206][207] Abseits des Transfers mythischer Figuren fanden sich in einigen antiken Stätten des Mittelmeers Knochenreste von Zwergflusspferden. Anders als bei den Zwergelefanten, die teilweise mit den Kyklopen der griechischen Mythologie in Verbindung gebracht wurden, gibt es für die Zwergflusspferde kein entsprechendes Äquivalent. In jüngerer Zeit hielt man die Knochen eher für Reste von Drachen oder Heiligen und zermahlte sie zu Pulver für medizinische Zwecke.[208]
Das aus dem jüdischen Umfeld bekannte Ungeheuer Behemoth wird teilweise als Flusspferd gedeutet. Im Buch Hiob findet sich eine detailliertere Beschreibung des Behemoth, die ihn als großes und kräftiges Wesen darstellt, das im Wasser oder Schlamm liegt und mit geöffnetem Maul den Fluss verschlingt. Außerdem würde es Gras wie ein Rind fressen.[209][210] Der Vergleich des Behemoth mit dem Flusspferd wird aber nicht in jedem Fall geteilt.[163] Nichtsdestotrotz hatte dies Einfluss auf die Benennung des Tieres in verschiedenen Sprachen: so wird das Flusspferd auf Russisch, Belarussisch und Ukrainisch als бегемот (transkribiert Begemot beziehungsweise Behemot) bezeichnet, was auch Eingang in die kasachische, aserbaidschanische und die tadschikische Sprache (Баҳмут, Bachmut) gefunden hat.
Mittelalterlicher und frühneuzeitlicher Elfenbeinhandel
Die Verwendung von Elfenbein als Rohmaterial unabhängig seines Ursprungs von Elefanten oder vom Flusspferd, ist in Afrika wie aufgezeigt seit prähistorischer Zeit nachweisbar. Die Tradition wurde auch in späterer Zeit fortgesetzt. Vor allem vom 10. bis 14. Jahrhundert unter muslimischer Herrschaft bestand ein reger Handel von West- nach Nordafrika, der teilweise auch das südliche Europa erreichte. Bedeutende Handwerksstätten fanden sich beispielsweise im Maghreb. Die arabischen Gelehrten der damaligen Zeit unterschieden aber selten in der Herkunft des Rohmaterials, so dass nur selten auf das Flusspferd direkt verwiesen wird. Als Ursache wird teils angenommen, dass ihnen die Elefanten zwar vertraut, das Flusspferd aber weitgehend unbekannt war. Dadurch kam es auch zu Verwechslung der Tiere wie etwa bei der Reise von Ibn Battūta durch Mali im 14. Jahrhundert. Auf die wohl große Bedeutung des Flusspferd-Elfenbeins verweist allerdings ein im Jahr 1993 entdeckter Hortfund aus Gao in Mali, der in das 11. Jahrhundert datiert und aus wenigstens 53 Zähnen besteht, die in einer Grube abgelegt worden waren.[211] Größere Dimensionen erhielt der Elfenbeinhandel während der europäischen Kolonialzeit. So verschifften die Portugiesen beispielsweise Stoßzähne von Elefanten von der südostafrikanischen Küste nach Indien und tauschten sie gegen Gewürz ein. Dass sich darunter auch Zähne von Flusspferden befanden, zeigt der Fund eines Wracks aus dem 17. Jahrhundert vor der Küste des indischen Bundesstaates Goa, das insgesamt neun Exemplare enthielt.[212]
Ein Neozoon in Südamerika
Die einzige freilebende Flusspferdpopulation außerhalb Afrikas existiert in Südamerika in Seen im Einzugsgebiet des Río Magdalena in Kolumbien. Im Jahr 1981 hatte Pablo Escobar, Anführer des Medellín-Kartells, vier aus einem Zoo in den USA stammende Tiere (drei weibliche und ein männliches) eingeführt. Anfangs lebten sie gemeinsam mit anderen Arten im Privatzoo des Drogenhändlers auf der Hacienda Nápoles bei Puerto Triunfo und rund 13,5 km westlich des Río Magdalena. Mit dem Tod Escobars im Jahr 1993 wurden die meisten Tiere in Zoos verteilt, die Flusspferde, die schwer zu transportieren waren, verblieben jedoch auf der Hacienda Nápoles, die nach und nach verfiel. Dreizehn Jahre später, nachdem das Gelände in einen touristischen Freizeitpark umgestaltet worden war, lebten bereits 16 Flusspferde in der Umgebung, die aus verschiedenen Sumpf- und Feuchtgebieten (ciénagas), künstlichen Seen und kleinen Flussläufen besteht. Bereits im Jahr 2009 fanden sich einzelne Individuen in einer Region rund 75 km weiter nördlich. Im Jahr darauf wurde erstmals ein Flusspferd im Río Magdalena beobachtet und drei Jahre später im Río Cocorná, einem Nebenfluss.[213][214]
Schätzungen zufolge lebten im Jahr 2020 in der Region zwischen 65 und 80 Individuen, einzelne Sichtungen erfolgten in bis zu 150 km Entfernung vom Ursprungsort. Bei einer konservativen Annahme einer Fortpflanzungsrate von 7 bis 8 %, was etwa der des Flusspferdes in Afrika entspricht, könnte die Population bis zum Jahr 2050 auf 400 bis 800 Individuen anwachsen, unter günstigen Umständen mit einer Wachstumsrate von 11 % – die Tiere haben in Südamerika keine natürlichen Feinde und die Sterberate der Jungtiere ist sehr gering – auch auf bis zu 5000.[214] Wie in Afrika sorgen die Tiere für einen erheblichen Nährstoffeintrag in ihre Wohngewässer, indem sie an Land grasen und im Wasser ihre Ausscheidungen abgeben, was zu einer Blüte des Phytoplanktons und infolge dessen auch zu einer starken Vermehrung des Zooplanktons führt.[215]
Nach Auffassung einiger Forscher sind die Auswirkungen aber wenig dramatisch, da es sich möglicherweise um die Herstellung eines ursprünglichen Zustands handelt, der bis zum Aussterben der Megafauna am Ende des Pleistozäns im Zuge der Quartären Aussterbewelle vorgeherrscht hatte. Demnach nimmt das Flusspferd in Südamerika die Position ein, die damals ebenfalls semi-aquatisch lebende Vertreter der ausgestorbenen Südamerikanischen Huftiere wie etwa Trigonodops im Ökosystem südamerikanischer Flüsse innehatten.[216] Andererseits leben in der Region mit dem Karibik-Manati und dem Capybara zwei größere aquatisch bis semi-aquatisch angepasste Säugetiere, so dass durch das Flusspferd für diese zusätzliche Konkurrenz entsteht. Daher plädieren andere Wissenschaftler für eine Ausrottung des Flusspferd-Bestandes, sei es durch Sterilisation oder durch gezielte Tötung.[217] Im Oktober 2021 begannen die kolumbianischen Behörden mit der Sterilisation der Flusspferde. Zwei Dutzend Tieren wurde das Immunokastrationsmittel GonaCon verabreicht, das die Flusspferde über einen begrenzten Zeitraum sterilisiert. Bei elf weiteren Tieren erfolgte eine herkömmliche Sterilisation.[218][219]
Bedrohung und Schutz


Die IUCN stuft das Flusspferd in seinem Gesamtbestand als „gefährdet“ (vulnerable) ein. Nach Schätzungen aus dem Jahr 2016 leben weltweit rund 115.000 bis 130.000 Tiere. Frühere Angaben für den Gesamtbestand von bis zu 148.000 Individuen, die die IUCN im Jahr 2008 veröffentlicht hatte, werden auf eine Überschätzung einzelner regionaler Populationen zurückgeführt. Insgesamt erwies sich dadurch der Bestand des Flusspferdes als relativ stabil. Regional und lokal können dabei aber Schwankungen auftreten. So nahm die Anzahl der Tiere im Masai Mara entlang des Mara-Flusses und angrenzender Gebiete von 2330 Individuen im Jahr 1984 auf 4170 im Jahr 2006 zu, was möglicherweise mit den begünstigenden Landschaftsverhältnissen der Region zusammenhängt.[220] In anderen Gebieten wie im Gonarezhou-Nationalpark in Simbabwe kam es in einem vergleichbaren Zeitraum zu einem Rückgang des Bestandes, teilweise ausgelöst durch Dürrephasen.[221] Im Bereich seines Vorkommens ist das Flusspferd in zahlreichen Schutzgebieten präsent, teilweise kann die Art auch außerhalb angetroffen werden. Allerdings ist sie in einigen Teilen auch ausgestorben oder sehr selten geworden.[19]
Als ein großer Bedrohungsfaktor wird der Verlust an Lebensraum angesehen, was häufig mit der Ausbreitung land- und viehwirtschaftlich genutzter Flächen oder wasserregulierender Maßnahmen einhergeht. Die Abhängigkeit des Flusspferdes von Wasser führt dabei zu Konflikten mit der lokalen Bevölkerung. In Kenia wurden in dem Zeitraum von 1997 und 2008 fast 4500 Mensch-Flusspferd-Konflikte registriert, die unter anderem in Zeiten größerer Dürre zunahmen. Zudem wurden aber auch häufiger Plünderungen von Feldern durch Flusspferde beobachtet.[222] Im westlichen und zentralen Afrika spielen auch die Zersplitterung der Populationen des Flusspferdes in kleine Einheiten eine Rolle, die dann häufig auf einzelne, mitunter schlecht verwaltete Reservate beschränkt sind. Einen weiteren bestandsgefährdenden Einfluss nimmt die illegale Jagd ein, die unter anderem in den 1990er und Anfang der 2000er Jahre zu starken Einbrüchen im Bestand des Flusspferdes führte. Das Fleisch bildet einerseits eine Nahrungsressource, etwa in Burkina Faso, Burundi, in der Elfenbeinküste oder im Südsudan, andererseits wird das Elfenbein der Zähne intensiv gehandelt. Vor allem in Ländern mit anhaltenden zivilen Unruhen oder Bürgerkriegen kann letzteres stark ansteigen. So brach die Flusspferdpopulation in der Demokratischen Republik Kongo Anfang des 21. Jahrhunderts infolge von achtjährigen Unruhen um 95 % ein, in Mosambik sank zwischen 1980 und 1992 während des Bürgerkrieges der Bestand um rund 70 %. Der Handel mit Flusspferd-Elfenbein stieg des Weiteren auch mit dem Verbot von Elefanten-Elfenbein im Jahr 1989 massiv an. Allein zwischen 1991 und 1992 wurden in Uganda rund 27 t an Eckzähnen des Flusspferdes gehandelt, in den zwei Jahren zuvor waren es noch 12 t. Ein Großteil des Austausches findet über Hongkong statt, in 75 % der Fälle sind Uganda und Tansania die Herkunftsländer. Teilweise werden in Hong Kong aber mehr Flusspferdzähne ein-, als offiziell aus den Ursprungsländern ausgeführt. Nach Untersuchungen des CITES betraf dies für den Zeitraum von 1995 bis 2013 insgesamt 14,2 t, was umgerechnet ungefähr 2700 Flusspferd-Individuen oder rund 2 % des Gesamtbestandes betrifft. Dadurch hat neben der Landschaftserhaltung auch die Reduzierung der illegalen Jagd eine große Bedeutung für den Schutz des Flusspferdes.[223][19]
Im Gegensatz zu anderen Großtieren wie den Elefanten oder den Nashörnern erregte das Flusspferd relativ spät Aufmerksamkeit in der westlichen Welt. Das erste in jüngerer Zeit in einem Zoo gehaltene Tier war ein Individuum namens „Obaysch“, das 1850 in den Londoner Zoo kam und für eine regelrechte „Hippomania“ sorgte.[224] Auch anderenorts avancierten Flusspferde später zu beliebten Zootieren, beispielsweise „Knautschke“ im Berliner Zoo. Heute ist die Art relativ häufig in zoologischen Einrichtungen anzutreffen. Allein in Deutschland gibt es mehr als ein halbes Dutzend Haltungen, zahlreiche zusätzliche kommen europaweit und im Nahen Osten hinzu.[225]
Gefährlichkeit für den Menschen

Es besteht die weite Auffassung, das Flusspferd sei eines der gefährlichsten Großtiere Afrikas und würde mehr Todesfälle als etwa Krokodile oder Großkatzen verursachen. Die Tiere können trotz ihres behäbigen Aussehens sehr aggressiv sein, insbesondere Mütter mit Jungtieren und bedrängte oder verwundete Individuen. Viele Berichte betreffen Fischer, die mit ihren Booten zu nah an oder in Flusspferdgruppen gelangten und bei etwaigen Angriffen kenterten sowie verletzt oder getötet wurden. Auch nachts an Land kann es zu gefährlichen Situationen kommen, wenn Menschen in Flusspferdgruppen geraten, die auf dem Weg zu ihren Weidegründen sind. Allerdings gibt es über die tatsächliche Anzahl und den Verlauf derartiger Begegnungen keine Statistiken. Häufig tolerieren die Tiere Menschengruppen bis hin zu gewissen Entfernungen.[1]
Literatur
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore 1999, ISBN 0-8018-5789-9
- Hubert Hendrichs: Artiodactyla (Paraxonia), Paarhufer. In: Wilfried Westheide, Reinhard Rieger (Hrsg.): Wirbel- oder Schädeltiere. Spektrum, Heidelberg 2004, ISBN 3-8274-0307-3 (Spezielle Zoologie. Teil 2)
- Hans Klingel: Hippopotamus amphibius Common Hippopotamus. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 68–78
- R. L. Lewison: Family Hippopotamidae (Hippopotamuses). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 318
Einzelnachweise
- Hans Klingel: Hippopotamus amphibius Common Hippopotamus. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 68–78
- R. M. Bere: Queen Elizabeth National Park: Uganda The Hippopotamus Problem and Experiment. Oryx 5 (3), 1959, S. 116–124
- P. J. Marshall and J. A. Sayer: Population Ecology and Response to Cropping of a Hippopotamus Population in Eastern Zambia. Journal of Applied Ecology 13 (2), 1976, S. 391–403
- Chansa Chomba: Population structure of the Common Hippopotamus (Hippopotamus amphibius) in the Luangwa River, Zambia. Global Journal of Biology, Agriculture & Health Sciences 5 (4), 2016, S. 29–39
- R. Norman Owen-Smith: Megaherbivores. The influence of very large bodysize on ecology. Cambridge University Press, 1988, S. 1–369 (S. 13)
- C. P. Luck und P. G. Wright: Aspects of the anatomy and physiology of the skin of the hippopotamus (H. amphibius). Quarterly Journal of Experimental Physiology and Cognate Medical Science 49, 1964, S. 1–14
- R. L. Lewison: Family Hippopotamidae (Hippopotamuses). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 318
- D. A. Hooijer: The fossil Hippopotamidae of Asia, with notes on the recent species. Zoologische Verhandelingen Museum Leiden 8, 1950, S. 1–124
- D. A. Hooijer: Pleistocene remains of Hippopotamus from the Orange Free State. Navorsinge van die Nasionale Museum 1, 1958, S. 259–266
- Zoran Zorić, Olivera Lozanče, Darko Marinković, Miloš Blagojević, Ivana Nešić, Natalija Demus und Milena Đorđević: Skull bone anatomy of the young Common hippopotamus (Hippopotamus amphibius). Acta Veterinaria-Beograd 68 (3), 2018, S. 361–372, doi:10.2478/acve-2018-0030
- Shirley C. Coryndon: Hippopotamidae. In: Vincent J. Maglio und H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harvard University Press, 1978, S. 483–495
- Jean-Renaud Boisserie: The phylogeny and taxonomy of Hippopotamidae (Mammalia: Artiodactyla): a review based on morphology and cladistic analysis. Zoological Journal of the Linnean Society 143, 2005, S. 1–26
- R. M. Laws: Dentition and ageing of the Hippopotamus. East African Wildlife Journal 6, 1968, S. 19–52
- Benjamin H. Passey, Thure E. Cerling, Gerard T. Schuster, Todd F. Robinson, Beverly L. Roeder und Stephen K. Krueger: Inverse methods for estimating primary input signals from time-averaged isotope profiles. Geochimica et Cosmochimica Acta 69 (16), 2005, S. 4101–4116, doi:10.1016/j.gca.2004.12.002
- S. Keith Eltringham, Jonathan Kingdon und Jean-Renaud Boisserie: Genus Hippopotamus Common Hippopotamus. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 64–67
- Dieter Kock und William T. Stanley: Mammals of Mafia Island, Tanzania. Mammalia 73 (4), 2009, S. 339–352, doi:10.1515/MAMM.2009.046
- R. H. W. Pakenham: The mammals of Zanzibar and Pemba Island. Harpenden, 1984, S. 1–81
- Nicolas Manlius: Biogéographie et Ecologie historique de l’hippopotame en Egypte. Belgian Journal of Zoology 130, 2000, S. 59–66
- R. L. Lewison und J. Pluháček: Hippopotamus amphibius. The IUCN Red List of Threatened Species 2017. e.T10103A18567364 (); zuletzt abgerufen am 13. Mai 2020
- William P. Wall: The Correlation between High Limb-Bone Density and Aquatic Habits in Recent Mammals. Journal of Paleontology 57 (2), 1983, S. 197–207
- Brittany L. Coughlin und Frank E. Fish: Hippopotamus underwater locomotion: reduced gravity movements for a massive mammal. Journal of Mammalogy 90 (3), 2009, S. 675–679
- Siegmund von Schumacher: Histologische Untersuchung der äusseren Haut eines neugeborenen Hippopotamus amphibius. Denkschriften der Kaiserlichen Akademie der Wissenschaften Mathematisch-Naturwissenschaftliche Classe 94, 1918, S. 1–52 ()
- David Allbrook: The morphology of the subdermal glands of Hippopotamus amphibius. Proceedings of the Zoological Society of London 139, 1962, S. 67–73
- Yoko Saikawa, Kimiko Hashimoto, Masaya Nakata, Masato Yoshihara, Kiyoshi Nagai, Motoyasu Ida und Teruyuki Komiya: The red sweat of the hippopotamus. Nature 429, 2004, S. 363, doi:10.1038/429363a
- Kimiko Hashimoto, Yoko Saikawa und Masaya Nakata: Studies on the red sweat of the Hippopotamus amphibius. Pure and Applied Chemistry 79 (4), 2007, S. 507–517, doi:10.1351/pac200779040507
- C. P. Luck und P. G. Wright: The body temperature of the hippopotamus. Journal of Physiology 147 (suppl. 1), 1959, S. P53–P54
- P. G. Wright: Thermoregulation in the hippopotamus on land. South African Journal of Zoology 22 (3), 1987, S. 237–242
- Christian Noirard, M. Le Berre, R. Ramousse und J. P. Lena: Seasonal variation of thermoregulatory behaviour in the Hippopotamus (Hippopotamus amphibius). Journal of Ethology 26, 2008, S. 191–193
- Sefi Mekonen und Birnesh Hailemariam: Ecological behaviour of common hippopotamus (Hippopotamus amphibius, LINNAEUS, 1758) in Boye wetland, Jimma, Ethiopia. American Journal of Scientific and Industrial Research 7 (2), 2016, S. 41–49, doi:10.5251/ajsir.2016.7.2.41.49
- E. L. Karstad und R. J. Hudson: Social organization and communication of riverine hippopotami in southwestern Kenya. Mammalia 50 (2), 1986, S. 153–164
- R. C. D. Olivier und W. A. Laurie: Habitat utilization by hippopotamus in the Mara River. East African WiIdIife Journal 12, 1974, S. 249–271
- Keenan Stears, Tristan A. Nuñez, Epaphras A. Muse, Benezeth M. Mutayoba und Douglas J. Mccauley: Spatial ecology of male hippopotamus in a changing watershed. Scientific Reports 9, 2019, S. 15392, doi:10.1038/s41598-019-51845-y
- U. De V. Pienaar, P. Van Wyk und N. Fairall: An experimental cropping scheme of Hippopotami in the Letaba river of the Kruger National Park. Koedoe – African Protected Area Conservation and Science 9 (1), 1966, S. 1–15
- William E. Barklow: Some underwater sounds of the hippopotamus (Hippopotamus amphibius). Marine Freshwater Behavior and Physiology 29, 1997, S. 237–249
- Julie Thévenet, Nicolas Grimault, Paulo Fonseca und Nicolas Mathevon: Voice-mediated interactions in a megaherbivore. Current Biology 32, 2022, S. R70–R71, doi:10.1016/j.cub.2021.12.017
- William E. Barklow: Amphibious communication with sound in hippos, Hippopotamus amphibius. Animal Behaviour 68, 2004, S. 1125–1132, doi:10.1016/j.anbehav.2003.10.034
- C. R. Field: A Study of the Feeding Habits of the Hippopotamus (Hippopotamus Amphibius Linn.) in the Queen Elizabeth National Park, Uganda, With Some Management Implications. Zoologica Africana 5 (1), 1970, S. 71–86
- Adrien Michez, Jean-Louis Doucet, Nicolas Dendoncker, Philippe Bouché und Cédric Vermeulen: Preliminary description of the diet of Hippopotamus amphibius L. in Loango National Park (Gabon). Biotechnology, Agronomy, Society and Environment 17 (4), 2013, S. 580–583
- C. Noirard, M. le Berre, R. Ramousse, C. Sepulcre und P. Joly: Diets of sympatric hippopotamus (Hippopotamus amphibius) and zebus (Bos indicus) during the dry season in the W National Park (Niger Republic). Game and Wildlife Science 21 (3), 2004, S. 423–431
- Jean-Renaud Boisserie, T. Antoine Zazzo, Gildas Merceron,Cécile Blondel, Patrick Vignaud, Andossa Likius, Hassane Taïsso Mackaye und Michel Brunet: Diets of modern and late Miocene hippopotamids: Evidence from carbon isotope composition and micro-wear of tooth enamel. Palaeogeography, Palaeoclimatology, Palaeoecology 221, 2005, S. 153–174
- T. E. Cerling, J. M. Harris, J. A. Hart, P. Kaleme, H. Klingel, M. G. Leakey, N. E. Levin, R. L. Lewison und B. H. Passey: Stable isotope ecology of the common hippopotamus. Journal of Zoology 276 (2), 2008, S. 204–212
- Antoine Souron, Marie Balasse und Jean-Renaud Boisserie: Intra-tooth isotopic profiles of canines from extant Hippopotamus amphibius and late Pliocene hippopotamids (Shungura Formation, Ethiopia): Insights into the seasonality of diet and climate. Palaeogeography, Palaeoclimatology, Palaeoecology 342–343, 2012, S. 97–110, doi:10.1016/j.palaeo.2012.05.007
- Joseph P. Dudley: Reports of carnivory by the common hippo Hippopotamus amphibius. South African Journal of Wildlife Research 28 (2), 1998, S. 58–59
- Joseph P. Dudley, Bernard Mudenda Hang'Ombe, Fabian H. Leendertz, Leejiah J. Dorward, Julio de Castro, Amanda L. Subalusky und Marcus Clauss: Carnivory in the common hippopotamus 'Hippopotamus amphibius': implications for the ecology and epidemiology of anthrax in African landscapes. Mammal Review 46 (3), 2016, S. 191–203, doi:10.1111/mam.12056
- Leejiah Jonathan Dorward: New record of cannibalism in the common hippo, Hippopotamus amphibius (Linnaeus, 1758). African Journal of Ecology 53 (3), 2015, S. 385–387, doi:10.1111/aje.12197
- Rebecca L. Lewison und Jacoby Carter: Exploring behavior of an unusual megaherbivore: a spatially explicit foraging model of the hippopotamus. Ecological Modelling 171, 2004, S. 127–138, doi:10.1016/S0304-3800(03)00305-3
- Pamela Arman und C. R. Field: Digestion in the hippopotamus. East African Wildlife Journal 11 (1), 1973, S. 9–17
- J. A. Sayer und A. M. Rakha: The age of puberty of the hippopotamus (Hippopotamus amphibius Linn.) in the Luangwa River in eastern Zambia. East African Wildlife Journal 12, 1974, S. 227–232
- G. L. Smuts und I. J. Whyte: Relationships between reproduction and environment in the Hippopotamus Hippopotamus amphibius in the Kruger National Park. Koedoe 24, 1981, S. 168–185
- Rebecca Lewison: Infanticide in the hippopotamus: evidence for polygynous ungulates. Ethology Ecology & Evolution 10, 1998, S. 277–286
- Victoria L. Inman und Keith E. A. Leggett: Observations on the response of a pod of hippos to a dead juvenile hippo (Hippopotamus amphibius, Linnaeus 1758). African Journal of Ecology 58 (1), 2020, S. 123–125, doi:10.1111/aje.12644
- Christopher P. Kofron: Behavior of Nile Crocodiles in a Seasonal River in Zimbabwe. Copeia 2 (3), 1993, S. 463–469
- John Kioko, Emily Boyd, Erin Schaeffer, Sidra Tareen und Christian Kiffner: Cattle Egret Bubulcus ibis interactions with large mammals in the Tarangire-Manyara Ecosystem, Northern Tanzania. Scopus 36 (1), 2016, S. 15–20
- Peter Mikula, Jiří Hadrava, Tomáš Albrecht und Piotr Tryjanowski: Large-scale assessment of commensalistic-mutualistic associations between African birds and herbivorous mammals using internet photos. PeerJ 6, 2018, S. e4520, doi:10.7717/peerj.4520
- A. R. Walker, A. Bouattour, J.-L. Camicas, A. Estrada-Peña, I. G. Horak, A. A. Latif, R. G. Pegram und P. M. Preston: Ticks of Domestic Animals in Africa: a Guide to Identification of Species. Bioscience Reports, Edinburgh, 2003, S. 1–221 (S. 30, 35)
- Louis H. du Preez und Itumeleng A. Moeng: Additional morphological information on Oculotrema hippopotami Stunkard, 1924 (Monogenea: Polystomatidae) parasitic on the African hippopotamus. African Zoology 39 (2), 2004, S. 225–233
- Nataliya Y. Rubtsova, Richard A. Heckmann, Willem J. Smit, Wilmien J. Luus-Powell, Ali Halajan und Francois Roux: Morphological Studies of Developmental Stages of Oculotrema Hippopotami (Monogenea: Polystomatidae) Infecting the Eye of Hippopotamus Amphibius (Mammalia: Hippopotamidae) Using SEM and EDXA with Notes on Histopathology. Korean Journal of Parasitology 56 (5), 2018, S. 1–13, doi:10.3347/kjp.2018.56.5.1
- M. Maung: An ascaridoid nematode from a hippopotamus. International Journal for Parasitology 5, 1975, S. 431–439
- J. Boomker, O. Bain, A. Chabaud und N. P. J. Kriek: Stephanofilaria thelazioides n. sp. (Nematoda: Filariidae) from a hippopotamus and its affinities with the species parasitic in the African black rhinoceros. Systematic Parasitology 32, 1995, S. 205–210
- Sagata Mondal und Buddhadeb Manna: On a new species of the genus Cobboldina (Nematoda: Atractidae) from Hippopotamus (Hippopotamus amphibius Linnaeus, 1758) captivated at the Alipore Zoological Garden, Kolkata, West Bengal, India. Journal of Parasitic Diseases 36, 2012, S. 251–255, doi:10.1007/s12639-012-0118-z
- Sagata Mondal und Buddhadeb Manna: Hippopotamenema aliporensis gen. n. sp. n. (Nematoda: Atractidae) from Hippopotamus (Hippopotamus amphibius Linnaeus, 1758) Captivated at the Alipore Zoological Garden, Kolkata, West Bengal, India. Science and Culture 81 (1–2), 2015, S. 44–47
- Daniel F. Cowan, William M. Thurlbeck und R. M. Laws: Some Diseases of the Hippopotamus in Uganda. Veterinary Pathology 4 (6), 1967, S. 553–567
- S. Rietmann und C. Walzer: Parasitological examination of common hippopotamus (Hippopotamus amphibius) faeces in the Gamba Complex of Protected Area in Gabon. Wiener Tierärztliche Monatsschrift – Veterinary Medicine Austria 101, 2014, S. 66–73
- C. A. Spinage: The Natural History of Antelopes. Croom Helm, London 1986, ISBN 0-7099-4441-1, S. 58
- T. S. McCarthy, W. N. Ellery und A. Bloem: Some observations on the geomorphological impact of hippopotamus (Hippopotamus amphibius L.) in the Okavango Delta, Botswana. African Journal of Ecology 36, 1998, S. 44–56
- Daniel M. Deocampo: Sedimentary Structures Generated by Hippopotamus amphibius in a Lake-margin Wetland, Ngorongoro Crater, Tanzania. Palaios 17 (2), 2002, S. 212–217
- Kendra L. Chritz, Scott A. Blumenthal, Thure E. Cerling und Hans Klingel: Hippopotamus (H. amphibius) diet change indicates herbaceous plant encroachment following megaherbivore population collapse. Scientific Reports 6, 2016, S. 32807, doi:10.1038/srep32807
- A. E. Onyeanusi: Some ecological roles of Hippopotamus (Hippopotamus amphibious Linn. 1758) in fish production: possibilities for integrated fish-cum Agric production system. In: 13th Annual Conference of the Fisheries Society of Nigeria (FISON), 3-8 November 1996, New Bussa, Nigeria. Fisheries Society of Nigeria, 1999, S. 282–285
- Keenan Stears, Douglas J. McCauley, Jacques C. Finlay, James Mpemba, Ian T. Warrington, Benezeth M. Mutayoba, Mary E. Power, Todd E. Dawson und Justin S. Brashares: Effects of the hippopotamus on the chemistry and ecology of a changing watershed. PNAS 115 (22), 2018, S. E5028–E5037, doi:10.1073/pnas.1800407115
- Christopher L. Dutton, Amanda L. Subalusky, Stephen K. Hamilton, Emma J. Rosi und David M. Post: Organic matter loading by hippopotami causes subsidy overload resulting in downstream hypoxia and fish kills. Nature Communications 9, 2018, S. 1951, doi:10.1038/s41467-018-04391-6
- Jonas Schoelynck, Amanda L. Subalusky, Eric Struyf, Christopher L. Dutton, Dácil Unzué-Belmonte, Bart Van de Vijver, David M. Post, Emma J. Rosi, Patrick Meire und Patrick Frings: Hippos (Hippopotamus amphibius): The animal silicon pump. Science Advances 5, 2019, S. eaav0395, doi:10.1126/sciadv.aav0395
- Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer, Bettine Jansen van Vuuren, Conrad Matthee, Manuel Ruiz-Garcia, François Catzeflis, Veronika Areskoug, Trung Thanh Nguyen und Arnaud Couloux: Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes. Comptes Rendus Palevol 335, 2012, S. 32–50
- Colin Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. 54–55)
- Eleanor Weston und Jean-Renaud Boisserie: Hippopotamidae. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, Los Angeles, London, 2010, S. 853–871
- John Gatesy, Cheryl Hayashi, Mathew A. Cronin und Peter Arctander: Evidence from milk Casein genes that cetaceans are close relatives to hippopotamid artiodactyls. Molecular Biology and Evolution 13 (7), 1996, S. 954–963
- John Gatesy: More DNA support for a Cetacea/Hippopotamidae clade: The blood-clotting protein gene γ-Fibrinogen. Molecular Biology and Evolution 14 (5), 1997, S. 537–543
- Mitsuru Shimamura, Hiroshi Yasue, Kazuhiko Ohshima, Hideaki Abe, Hidehiro Kato, Toshiya Kishiro, Mutsuo Goto, Isao Munechika und Norihiro Okada: Molecular evidence from retroposons that whales form a clade within even-toed ungulates. Nature 388, 1997, S. 666–670
- Masato Nikaido, Alejandro P. Rooney und Norihiro Okada: Phylogenetic relationships among cetartiodactyls based on insertions of short and long interpersed elements: Hippopotamuses are the closest extant relatives of whales. PNAS 96, 1999, S. 10261–10266
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. Molecular Phylogenetics and Evolution 133, 2019, S. 256–262
- Maeva Orliac, Jean-Renaud Boisserie, Laura MacLatchy und Fabrice Lihoreau: Early Miocene hippopotamids (Cetartiodactyla) constrain the phylogenetic and spatiotemporal settings of hippopotamid origin. PNAS 107 (26), 2010, S. 11871–11876
- Fabrice Lihoreau, Jean-Renaud Boisserie, Fredrick Kyalo Manthi und Stéphane Ducrocq: Hippos stem from the longest sequence of terrestrial cetartiodactyl evolution in Africa. Nature Communications 6, 2015, S. 6264, doi:10.1038/ncomms7264
- Martin Pickford: The myth of hippo-like anthracothere: The eternal problem of homology and convergence. Revista Española de Paleontología 23 (1), 2008, S. 31–90
- Martin Pickford: Encore hippo-thèsis: Head and neck posture in Brachyodus (Mammalia, Anthracotheriidae) and its bearing on hippopotamid origins. Communications of the Geological Survey of Namibia 16, 2015, S. 223–262
- Don E. Wilson und DeeAnn M. Reeder: Mammal Species of the World. A taxonomic and geographic Reference. Johns Hopkins University Press, 2005 ()
- Luca Pandolfi, Roberta Martino, Lorenzo Rook und Paolo Piras: Investigating ecological and phylogenetic constraints in Hippopotamidae skull shape. Rivista Italiana di Paleontologia e Stratigrafia 126 (1), 2020, S. 37–49
- George A. Lyras: Brain Changes during Phyletic Dwarfing in Elephants and Hippos. Behavior and Evolution 92, 2018, S. 167–181, doi:10.1159/000497268
- Nikolaos Psonis, Despoina Vassou, Loucas Nicolaou, Socrates Roussiakis, George Iliopoulos, Nikos Poulakakis und Spyros Sfenthourakis: Mitochondrial sequences of the extinct Cypriot pygmy hippopotamus confirm its phylogenetic placement. Zoological Journal of the Linnean Society, 2021, doi:10.1093/zoolinnean/zlab089
- Jan van der Made, Jordi Rosell und Ruth Blasco: Faunas from Atapuerca at the Early–Middle Pleistocene limit: The ungulates from level TD 8 in the context of climatic change. Quaternary International 433, 2017, S. 296–346, doi:10.1016/j.quaint.2015.09.009
- Paul Mazza: New evidence on the Pleistocene hippopotamuses of Western Europe. Geologica Romana 31, 1995, S. 61–241
- C. Petronio: Note on the taxonomy of Pleistocene hippopotamuses. Ibex 3, 1995, S. 53–55
- Daria Petruso und Fabrizio Taschetta: New data on the Middle Pleistocene endemic Sicilian hippo (Hippopotamus pentlandi). Natura Rerum 1, 2011, S. 5–20
- Gustav Adolf Guldberg: Undersøgelser over en subfossil flodhest fra Madagascar. Christiania Videnskabsselskab forhandlinger 6, 1883, S. 1–24 ()
- Charles Immanuel Forsyth Major: Some account of a nearly complete skeleton of Hippopotamus madagascariensis Guld., from Sirabé, Madagascar, obtained in 1895. Geological Magazine 4 (9), 1902, S. 193–199 ()
- William Fovet, Martine Faure und Claude Guérin: Hippopotamus guldbergi n. sp.: révision du statut d’Hippopotamus madagascariensis Guldberg, 1883, après plus d’un siècle de malentendus et de confusions taxonomiques. Zoosystema 33 (1), 2011, S. 61–82
- Marius Rakotovao, Yves Lignereux, Maëva J. Orliac, Francis Duranthon und Pierre-Olivier Antoine: Hippopotamus lemerlei Grandidier, 1868 et Hippopotamus madagascariensis Guldberg, 1883 (Mammalia, Hippopotamidae): anatomie crânio-dentaire et révision systématique. Geodiversitas 36 (1), 2014, S. 117–161
- Martine Faure, Claude Guérin und Annemarie Ohler: Le statut du nom Hippopotamus madagascariensis Guldberg, 1883. Réponse à Rakotovao et al.2014. Geodiversitas 37 (2), 2015, S. 267–269
- Raymond Gèze: Répartition paléoécologique et relations phylogénétiques des Hippopotamidae (Mammalia, Artiodactyla) du Néogène d’Afrique Orientale. In: M. Beden, A. K. Behrensmeyer, N. T. Boaz, R. Bonnefille, C. K. Brain, H. B. S. Cooke, Y. Coppens, R. Dechamps, V. Eisenmann, A. W. Gentry, D. Geraads, R. Gèze, C. Guérin, M. J. Harris, J. Koeniguer, F. Letouzey, G. Petter, A. Vincens und E. S. Vrba (Hrsg.): L’environnement des hominidés au Plio–Pléistocène. Paris, 1985, S. 81–100
- Faysal Bibi, Antoine Souron, Hervé Bocherens, Kevin Uno und Jean-Renaud Boisserie: Ecological change in the lower Omo Valley around 2.8 Ma. Biology Letters 9, 2013, S. 20120890, doi:10.1098/rsbl.2012.0890
- Shirley C. Coryndon und Yves Coppens: Une espèce nouvelle d’Hippopotame nain du Plio–Pléistocène du bassin du lac Rodolphe (Ethiopie, Kenya). Comptes Rendus de l’Académie des Sciences Paris 280, 1975, S. 1777–1780 ()
- Parissis P. Pavlakis: Plio–Pleistocene Hippopotamidae from the Upper Semliki. In: N. T. Boaz (Hrsg.): Results from the Semliki Research Expedition. Virginia Museum of Natural History, 1990, S. 203–223
- Gail M. Ashley und Cynthia M. Liutkus: Tracks, trails and trampling by large vertebrates in a rift valley paleo-wetland, lowermost Bed II, Olduvai Gorge, Tanzania. Ichnos 9,2002, S. 23–32
- Faysal Bibi, Michael Pante, Antoine Souron, Kathlyn Stewart, Sara Varela, Lars Werdelin, Jean-Renaud Boisserie, Mikael Fortelius, Leslea Hlusko, Jackson Njau und Ignacio de la Torre: Paleoecology of the Serengeti during the Oldowan-Acheulean transition at Olduvai Gorge, Tanzania: The mammal and fish evidence. Journal of Human Evolution 120, 2018, S. 48–75, doi:10.1016/j.jhevol.2017.10.009
- Shirley C. Coryndon: The extent of variation in fossil Hippopotamus from Africa. Mammal Review 1 (2), 1970, S. 32
- Denis Geraads: Plio-Pleistocene mammalian biostratigraphy of Atlantic Morocco. Quaternaire 13 (1), 2002, S. 43–53
- H. J. O’Regan, L. C. Bishop, A. Lamb, S. Elton und A. Turner: Large mammal turnover in Africa and the Levant between 1.0 and 0.5 Ma. In: M. J. head und P. L. Gibbard (Hrsg.): Early–Middle Pleistocene Transitions: The Land–Ocean Evidence. Geological Society, London, Special Publications 247, 2005, S. 231–249
- Denis Geraads: The Faunal Context of Human Evolution in the Late Middle/Late Pleistocene of Northwestern Africa. In: J.-J. Hublin und S. P. McPherron (Hrsg.): Modern Origins: A North African Perspective. Springer Science+Business Media B.V., 2012, S. 49–60
- Martine Faure und Claude Guérin: Gafalo, nouveau site à Palaeoloxodon recki et Hippopotamus amphibius du Pléistocène ancien du Gobaad (Répub ique de Djibouti). Comptes Rendus de l’Académie des Sciences – Series IIA 324 (12), 1997, S. 1017–1021
- Denis Geraads, Zeresenay Alemseged, Denné Reed, Jonathan Wynn und Diana C. Roman: The Pleistocene fauna (other than Primates) from Asbole, lower Awash Valley, Ethiopia, and its environmental and biochronological implications. Geobios 37, 2004, S. 697–718, doi:10.1016/j.geobios.2003.05.011
- Flavio Altamura, Rita T. Melis und Margherita Mussi: A Middle Pleistocene hippo tracksite at Gombore II-2 (Melka Kunture, Upper Awash, Ethiopia). Palaeogeography, Palaeoclimatology, Palaeoecology 470, 2017, S. 122–131, doi:10.1016/j.palaeo.2017.01.022
- D. A. Hooijer und Ronald Singer: The fossil hippopotamus from Hopefield, South Africa. Zoologische Mededelingen 37, 1960, S. 157–165
- J. Luyt, J. A. Lee-Thorp und G. Avery: New light on Middle Pleistocene west coast environments from Elandsfontein, Western Cape Province, South Africa. South African Journal of Science 96, 2000, S. 399–403
- Richard G. Klein, Graham Avery, Kathryn Cruz-Uribe und Teresa E. Steele: The mammalian fauna associated with an archaic hominin skullcap and later Acheulean artifacts at Elandsfontein, Western Cape Province, South Africa. Journal of Human Evolution 52, 2007, S. 164–186, doi:10.1016/j.jhevol.2006.08.006
- Jan van der Made: Faunal exchanges through the Levantine Corridor and human dispersal: The paradox of the late dispersal of the Acheulean industry. In: Proceedings of the International Symposium. Africa, cradly of humantiy. Recent discoveries. Sétif les 26, 27 et 28 octobre 2009 Travaux du Centre National de Recherche Préhistoriques Anthropologiques et Historiques NS 18, 2013, S. 255–296
- H. J. O’Regan, A. Turner, L. C. Bishop, S. Elton und A. L. Lamb: Hominins without fellow travellers? First appearances and inferred dispersals of Afro-Eurasian large-mammals in the Plio-Pleistocene. Quaternary Science Reviews 30 (11–12), 2011, S. 1343–1352, doi:10.1016/j.quascirev.2009.11.028
- Liora Kolska Horwitz und Eitan Tchernov: Cultural and Environmental Implications of Hippopotamus Bone Remains in Archaeological Contexts in the Levant. Bulletin of the American Schools of Oriental Research 280, 1990, S. 67–76 ()
- Mathew Stewart, Julien Louys, Paul S. Breeze, Richard Clark-Wilson, Nick A. Drake, Eleanor M.L. Scerri, Iyad S. Zalmout, Yahya S. A. Al-Mufarreh, Saleh A. Soubhi, Mohammad A. Haptari, Abdullah M. Alsharekh, Huw S. Groucutta und Michael D. Petraglia: A taxonomic and taphonomic study of Pleistocene fossil deposits from the western Nefud Desert, Saudi Arabia. Quaternary Research 95, 2020, S. 1–22, doi:10.1017/qua.2020.6
- Mathew Stewart, Julien Louys, Gilbert J. Price, Nick A. Drake, Huw S. Groucutte und Michael D. Petraglia: Middle and Late Pleistocene mammal fossils of Arabia and surrounding regions: Implications for biogeography and hominin dispersals. Quaternary International 515, 2019, S. 12–29, doi:10.1016/j.quaint.2017.11.052
- Luca Bellucci, Ilaria Mazzini, Giancarlo Scardia, Luciano Bruni, Fabio Parenti, Aldo Giacomo Segre, Eugenia Segre Naldini und Raffaele Sardelle: The site of Coste San Giacomo (Early Pleistocene, central Italy): Palaeoenvironmental analysis and biochronological overview. Quaternary International 267, 2012, S. 30–39, doi:10.1016/j.quaint.2011.04.006
- M. T. Alberdi und A. Ruiz Bustos: Descripción y significado biostratigráfico y climático del Equus e Hippopotamus en el yacimento de Venta Micena (Granada). Estudios geológicos 41, 1985, S. 251–261
- Ralf-Dietrich Kahlke: The Early Pleistocene (Epivillafranchian) faunal site of Untermaßfeld (Thuringia, central Germany) Synthesis of new results. Eraul 92, 2000, S. 123–138
- Ralf-Dietrich Kahlke und Sabine Gaudzinski: The blessing of a great flood: Differnetiation of mortality patterns in the large mammal record of the Lower Pleistocene fluvial site of Untermaßfeld (Germany) and its relevance for the interpretation of faunal assemblages from archaeological sites. Journal of Archaeological Science 32, 2005, S. 1202–1222, doi:10.1016/j.jas.2005.03.004
- Paul P. A. Mazza und D. Ventra: Pleistocene debris-flow deposition of the hippopotamus-bearing Collecurti bonebed (Macerata, central Italy): Taphonomic and palaeoenvironmental analysis. Palaeogeography, Palaeoclimatology, Palaeoecology 310, 2011, S. 296–314, doi:10.1016/j.palaeo.2011.07.022
- Neil F. Adams, Ian Candy und Danielle C. Shreve: An Early Pleistocene hippopotamus from Westbury Cave, Somerset, England: support for a previously unrecognized temperate interval in the British Quaternary record. Journal of Quaternary Science, 2021, S. 1–14, doi:10.1002/jqs.3375
- Dick Mol, Klaas Post, Jelle W. F. Reumer, John de Vos und Cees Laban: Het Gat: Preliminary note on a Bavelian fauna from the North Sea with possibly two mammoth species. Deinsea 9, 2003, S. 253–266
- A. Vekua: The Lowere Pleistocene Mammalian Fauna of Akhalkalaki (Southern Georgia, USSR). Palaeontographica Italica 74, 1986, S. 63–96
- Paul P. A. Mazza und Adele Bertini: Were Pleistocene hippopotamuses exposed to climate-driven body size changes? Boreas 42, 2013, S. 194–209, doi:10.1111/j.1502-3885.2012.00285.x
- Danielle C. Shreve: A new record of Pleistocene Hippopotamus from River Severn terrace deposits, Gloucester, UK – palaeoenvironmentral setting and stratigraphical significance. Proceedings of the Geologists’ Association 120, 2009, S. 58–64, doi:10.1016/j.pgeola.2009.03.003
- Thijs van Kolfschoten: The Eemian mammal fauna of central Europe. Netherlands Journal of Geosciences 79 (2/3), 2000, S. 269–281
- Wighart von Koenigswald: Mode and causes for the Pleistocene turnovers in the mammalian fauna of Central Europe. Deinsea 10, 2003, S. 305–312
- Diana Pushkina: The Pleistocene easternmost distributions in Eurasia of the species associated with the Eemian Palaeoloxodon antiquus assemblage. Mammal Review 37 (3), 2007, S. 224–245
- Anthony J. Stuart and Adrian M. Lister: Patterns of Late Quaternary megafaunal extinctions in Europe and Northern Asia. Courier Forschungsinstitut Senckenberg 259, 2007, S. 287–297
- Luca Pandolfi und Carmelo Petronio: A brief review of the occurrences of Pleistocene hippopotamus (Masmmalia, Hippopotamidae) in Italy. Geologia Croatica 68 (3), 2015, S. 313–319
- Laura Bonfiglio: Campagna die Scavo 1987 nel deposito pleistocenico a Hippopotamus pentlandi di Acquedolci (Messina, Sicilia nord-orientale). Bollettina della Società Paleontologica Italiana 30 (2), 1992, S. 157–173
- Mark V. Lomolino, Alexandra A. van der Geer, George A. Lyras, Maria Rita Palombo, Dov F. Sax und Roberto Rozzi: Of mice and mammoths: generality and antiquity of the island rule. Journal of Biogeography 40 (8), 2013, S. 1427–1439, doi:10.1111/jbi.12096
- Charles Savona-Ventura und Anton Mifsud: Għar Dalam Cave: A review of the sediments on the cave floor stratigraphy. Xjenza 3 (1), 1998, S. 5–12
- Antonella Cinzia Marra: Pleistocene Hippopotamuses of Mediterranean islands: looking for ancestors. In: J. A. Alcover und P. Bover (Hrsg.): Proceedings of the International Symposium „Insular Vertebrate Evolution: the Palaeontological Approach“. Monografies de la Societat d’Història Natural de les Balears 12, 2005, S. 193–204
- G. J. Boekschoten und P. Y. Sondaar: The Pleistocene of the Katharo basin (Crete) and its Hippopotamus. Bijdragen Dierkunde 36, 1966, S. 17–44
- Siegfried E. Kuss: Hippopotamus creutzburgi parvus n. ssp., ein pleistozänes Zwergflußpferd von der Insel Kreta. Berichte der Naturforschenden Gesellschaft zu Freiburg im Breisgau 65, 1975, S. 5–23
- Alan H. Simmons: Extinct pygmy hippopotamus and early man in Cyprus. Nature 333, 1988, S. 554–557
- Rolfe D. Mandel und Alan H. Simmons: Geoarchaeology of the Akrotiri Aetokremnos Rockshelter, Southern Cyprus. Geoarchaeology: An International Journal 12 (6), 1997, S. 567–605
- Alan H. Simmons: Akrotiri-Aetokremnos (Cyprus) 20 years later: An Assessment of its significance. Eurasian Prehistory 10 (1–2), 2014, S. 139–156
- Antoine Zazzo, Matthieu Lebon, Anita Quiles, Ina Reiche und Jean-Denis Vigne: Direct Dating and Physico-Chemical Analyses Cast Doubts on the Coexistence of Humans and Dwarf Hippos in Cyprus. PLoS ONE 10 (8), 2015, S. e0134429, doi:10.1371/journal.pone.0134429
- Martine Faure, Claude Guérin, Dominique Genty, Dominique Gommery und Beby Ramanivosoa: Le plus ancien hippopotame fossile (Hippopotamus laloumena) de Madagascar (Belobaka, Province de Mahajanga). Comptes Rendus Palevol 9, 2010, S. 155–162, doi:10.1016/j.crpv.2010.04.002
- Martine Faure und Claude Guérin: Hippopotamus laloumena nov. sp., la troisième espèce d’hippopotame holocène de Madagascar. Comptes Rendus de l’Académie des sciences Ser. II 310, 1990, S. 1299–1305 ()
- David A. Burney, Lida Pigott Burney, Laurie R. Godfrey, William L. Jungers, Steven M. Goodman, Henry T. Wright und A. J. Timothy Jull: A chronology for late prehistoric Madagascar. Journal of Human Evolution 47, 2004, S. 25–63, doi:10.1016/j.jhevol.2004.05.005
- Solweig Stuenes: Taxonomy, habits, and relationships of the subfossil Madagascan hippopotami Hippopotamus lemerlei and H. madagascariensis. Journal of Vertebrate Paleontology 9 (3), 1989, S. 241–268
- Karen E. Samonds, Brooke E. Crowley, Tojoarilala Rinasoa Nadia Rasolofomanana, Harimalala Tsiory Andrianavalona, Tolotra Niaina Ramihangihajason, Ravoniaina Rakotozandry, Zafindratsaravelo Bototsemily Nomenjanahary, Mitchell T. Irwin, Neil A. Wells und Laurie R. Godfrey: A new late Pleistocene subfossil site (Tsaramody, Sambaina basin, central Madagascar) with implications for the chronology of habitat and megafaunal community change on Madagascar’s Central Highlands. Journal of Quaternary Science 34 (6), 2019, S. 379–392, doi:10.1002/jqs.3096
- Kathleen M. Muldoon, Brooke E. Crowley, Laurie R. Godfrey, Armand Rasoamiaramanana, Adam Aronson, Jukka Jernvall, Patricia C. Wright und Elwyn L. Simons: Early Holocene fauna from a new subfossil site: A first assessment from Christmas River, south central Madagascar. 7 (1), 2012, S. 23–29, doi:10.4314/mcd.v7i1.5
- Brooke E. Crowley: A refined chronology of prehistoric Madagascar and the demise of the megafauna. Quaternary Science Reviews 29, 2010, S. 2591–2603, doi:10.1016/j.quascirev.2010.06.030
- Atholl Anderson, Geoffrey Clark, Simon Haberle, Tom Higham, Malgosia Nowak Kemp, Amy Prendergast, Chantal Radimilahy, Lucien M. Rakotozafy, Ramilisonina, Jean-Luc Schwenninger, Malika Virah-Sawmy und Aaron Camens: New evidence of megafaunal bone damage indicates late colonization of Madagascar. PLoS ONE 13 (10), 2018, S. e0204368, doi:10.1371/journal.pone.0204368
- Steven M. Goodman und William L. Jungers: Extinct Madagascar. Picturing the island's past. University of Chicago Press, 2014, S. 1–206
- Paul P. A. Mazza: If hippopotamuses cannot swim, how did they colonize islands? Lethaia 47 (4), 2014, S. 494–499, doi:10.1111/let.12074
- Paul P. A. Mazza: To swim or not to swim, that is the question: a reply to van der Geer et al. Lethaia Focus 48, 2015, S. 289–290, doi:10.1111/let.12129
- Alexandra A. E. van der Geer, George Anastasakis und George A. Lyras: If hippopotamuses cannot swim, how did they colonize islands: a reply to Mazza. Lethaia 48 (2), 2014, S. 147–150, doi:10.1111/let.12095
- Alexandra A. E. van der Geer, George A. Lyras, Philipp Mitteroecker und Ross D. E. MacPhee: From Jumbo to Dumbo: Cranial Shape Changes in Elephants and Hippos During Phyletic Dwarfing. Evolutionary Biology 45 (3), 2018, S. 303–317, doi:10.1007/s11692-018-9451-1
- P. Y. Sondaar: Island mammals of the past. Science Progress 75 (3/4), 1991, S. 249–264 ()
- Eleftherios Hadjisterkotis und David S. Reese: Considerations on the potential use of cliffs and caves by the extinct endemic late pleistocene hippopotami and elephants of Cyprus. European Journal Wildlife Research 54, 2008, S. 122–133, doi:10.1007/s10344-007-0121-3
- Michail K. Georgitsis, Dionysia Ε. Liakopoulou und Georgios E. Theodorou: Morphofunctional examination of the carpal bones of pygmy hippopotamus from Ayia Napa, Cyprus. The Anatomical Record, 2021, doi:10.1002/ar.24738
- Almuth Behrmann: Das Nilpferd in der Vorstellungswelt der Alten Ägypter. Teil II. Textband. Frankfurt, 1996, S. 1–203 (S. 78–85 und 174–181)
- Herodot: Historien. Deutsche Gesamtausgabe, übersetzt von August Horneffer, herausgegeben von Hans Wilhelm Haussig, 4. Auflage, Alfred Kröner, Stuttgart 1971, S. 130 (Buch 2, Kapitel 71) ISBN 3-520-22404-6 ()
- Michael MacKinnon: Supplying exotic animals for the Roman amphitheatre games: New reconstructions combining archaeological, ancient textual, hsitorical and ethnographic data. Mouseion, Series III 6 (2), 2006, S. 137–161, doi:10.1353/mou.2006.0040
- Pierre Belon: Petri Bellonii cenomani de aquatilibus, libri duo cum ei conibus ad viuam ipsorum effigiem, quoad eius fieri potuit, expressis: Ad amplissimum cardinalem Castillionæum. Paris, 1553, S. 1–448 (S. 25) ()
- Christoph Harant von Polschiz: Der Christliche Ulysses, Oder Weit-versuchte Cavallier : Fürgestellt In der Denckwürdigen Bereisung So wol deß Heiligen Landes, Als vieler anderer morgenländischer Provintzen. Nürnberg, 1678, S. S. 1–881 (S. 762–763) ()
- Federico Zerenghi: Vera Descrittione dell’Hippopottamo, animale amfibio, che nasce in Egitto, dove si mostra la sua vera effigie con le misure di ciascuna parte di esso animale. Mailand, 1603, S. 55–76 ()
- Liv Emma Thorsen: The Hippopotamus in Florentine Zoological Museum „la Specola“. A discussion of stuffed animals as sources of cultural history. Museologica scientifica 21 (2) 2004, S. 269–281
- Felicitas Noeske: Die Häute des Hippopotamus. Bericht auf bibliotheca.gym vom 6. Juni 2015 ()
- Étienne de Flacourt: Histoire de la grande isle Madagascar. Paris, 1661, S. 1–471 (S. 152) ()
- Johann Schreyer: Neue Ost-Indianische Reise-Beschreibung. Leipzig, 1681, S. 1–144 (S. 24) ()
- L. C. Rookmaker: The Zoological Exploration of Southern Africa. Rotterdam, 1989, S. 1–368 (S. 12–26)
- Fabio Colonna: Minus cognitarum stirpium aliquot ac etiam rariorum nostro coelo orientium ekphrasis: item de aquatilibus, aliisque animalibus quibusdam paucis libellus. Rom, 1610, S. XXVIII–XXXV ()
- Joannes Jonstonus: A description of the nature of four-footed beasts. Amsterdam, 1678, S. 1–119 (60–61) ()
- Georges-Louis Leclerc de Buffon: Histoire naturelle, générale et particulière., Tome Douzième. Paris, 1764, S. 22–68 ()
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 74 ().
- Oldfield Thomas: The mammals of the tenth edition of Linnaeus; an attempt to fix the types of the genera and the exact bases and localities of the species. Proceedings of the Zoological Society of London 1911, S. 120–158
- Georges Cuvier: Sur les ossemens fossiles d’Hippopotame. Annales du Muséum d’histoire naturelle 5, 1804, S. 99–122 ()
- Georges Cuvier: Recherches sur les ossemens fossiles, où l’on rétablit les caractères de plusieurs animaux dont les révolutions du globe ont détruit les espèces., Tome Primiere. Paris, 1821, S. 1–340 (S. 304–334) ()
- Anselme Gaëtan Desmarest: Mammalogie ou description des espèces de mammifères. Seconde Partie. Paris, 1822, S. 277–555 (S. 386–389) ()
- Hermann von Meyer: Palaeologica zur Geschichte der Erde und ihrer Geschöpfe. Frankfurt.1832, S. 1–560 (S. 533) ()
- Alfred Grandidier: Sur les découvertes zoologiques faites récemment à Madagascar. Annales des Sciences naturelles 5 (1), 1868, S. 375–378 ()
- Mohamed Sahnounia, Jordi Rosell, Jan van der Made, Josep María Vergès, Andreu Ollé, Nadia Kandi, Zoheir Harichane, Abdelkader Derradji und Mohamed Medig: The first evidence of cut marks and usewear traces from the Plio-Pleistocene locality of El-Kherba (Ain Hanech), Algeria: implications for early hominin subsistence activities circa 1.8 Ma. Journal of Human Evolution 64, 2013, S. 137–150, doi:10.1016/j.jhevol.2012.10.007
- M. Domínguez-Rodrigo, H. T. Bunn, A. Z. P. Mabulla, E. Baquedano, D. Uribelarrea, A. Pérez-González, A. Gidna, J. Yravedra, F. Diez-Martin, C. P. Egeland, R. Barba, M. C. Arriaza, E. Organista und M. Ansón: On meat eating and human evolution: A taphonomic analysis of BK 4b (Upper Bed II, Olduvai Gorge, Tanzania), and its bearing on hominin megafaunal consumption. Quaternary International 322–323, 2014, S. 129–152, doi:10.1016/j.quaint.2013.08.015
- Manuel Domínguez-Rodrigo, Fernando Diez-Martín, José Yravedra, Rebeca Barba, Audax Mabulla, Enrique Baquedano, David Uribelarrea, Policarpo Sánchez und Metin I. Eren: Study of the SHK Main Site faunal assemblage, Olduvai Gorge, Tanzania: Implications for Bed II taphonomy, paleoecology, and hominin utilization of megafauna. Quaternary International 322–323, 2014, S. 153–166, doi:10.1016/j.quaint.2013.09.025
- Ivana Fiore, Luca Bondioli, Alfredo Coppa, Roberto Macchiarelli, Rezene Russom, Habtom Kashay, Tekeste Solomon, Lorenzo Rook und Yosief Libsekal: Taphonomic analysis of the Late Early Pleistocene Bone Remains from Buia (Dandiero Basin, Danakil Depression, Eritrea): Evidence for large mammal and reptile butchering. Rivista Italiana di Paleontologia e Stratigrafia· 110 (suppl), 2004, S. 89–97, doi:10.13130/2039-4942/5766
- Flavio Altamura, Matthew R. Bennett, Kristiaan D’Août, Sabine Gaudzinski-Windheuser, Rita T. Melis, Sally C. Reynolds und Margherita Mussi: Archaeology and ichnology at Gombore II-2, Melka Kunture, Ethiopia: everyday life of a mixed-age hominin group 700,000 years ago. Scientific Reports 8, 2018, S. 2815, doi:10.1038/s41598-018-21158-7
- Katsuhiro Sano, Yonas Beyene, Shigehiro Katoh, Daisuke Koyabu, Hideki Endo, Tomohiko Sasaki, Berhane Asfaw und Gen Suwa: A 1.4-million-year-old bone handaxe from Konso, Ethiopia, shows advanced tool technology in the early Acheulean. PNAS 117 (31), 2020, S. 18393–18400, doi:10.1073/pnas.2006370117
- George E. Konidaris, Athanassios Athanassiou, Vangelis Tourloukis, Nicholas Thompson, Domenico Giusti, Eleni Panagopoulou und Katerina Harvati: The skeleton of a straight-tusked elephant (Palaeoloxodon antiquus) and other large mammals from the Middle Pleistocene butchering locality Marathousa 1 (Megalopolis Basin, Greece): preliminary results. Quaternary International 497, 2018, S. 65–84, doi:10.1016/j.quaint.2017.12.001
- Marta Osypińska und Piotr Osypiński: Animal Exploitation and Behaviour of the Latest Middle Stone Age Societies in the Middle Nile Valley: Archaeozoological and Taphonomic Analysis of Late Pleistocene Fauna from the Affad Basin, Sudan. African Archaeological Review 33, 2016, S. 107–127, doi:10.1007/s10437-016-9220-4
- Jaques Reinold: Kadruka and the Neolithic in the Northern Dongola Reach. Sudan & Nubia 5, 2001, S. 2–10 ()
- Marek Chłodnicki, Michal Kobusiewicz und Karla Kroeper: The Lech Krzyżaniak Excavations in the Sudan. Kadero. Poznań, Archaeological Museum Poznań, 2011, hier besonders Agniezka Krzyżaniak: Neolithic cemetery., S. 57–198 und Małgorzata Winiarska-Kabacińska: Musical instruments., S. 355–358
- O. H. Krzyszkowska: Ivory in the Aegean Bronze Age: Elephant Tusk or Hippopotamus Ivory? The Annual of the British School at Athens 83, 1988, S. 209–234
- George F. Bass: A Bronze Age Shipwreck at Ulu Burun (Kaş): 1984 Campaign. American Journal of Archaeology 90 (3), 1986, S. 269–296
- David Coulson und Alec Campbell: Rock Art of the Tassili n Ajjer, Algeria. Adoranten, 2010, S. 24–38
- Alec Campbell und David Coulson: Big Hippo Site, Oued Afar, Algeria. Sahara 21, 2010, S. 81–92
- Victoria Waldock: The Taleschout hippos: An enigmatic site in the Messak Settafet, southwest Libya. Sahara 21, 2010, S. 93–106
- Nick Walker: The Rock Art of the Matobo Hills, Zimbabwe. Adoranten, 2012, S. 38–59
- David Coulson und Alec Campbell: Afrikanische Felsenbilder. Malereien und Gravuren auf Stein. Weingarten, 2001, S. 1–256 (S. 101)
- Maarten Horn: A Badarian-Naqadian cognitive link? A possible insight on the basis of a Badarian hippopotamus-shaped pendant from Egypt. Polish Archaeology in the Mediterranean 23 (2), 2014, S. 41–70
- Peter Lacovara: A New Date for an Old Hippopotamus. Journal of the Museum of Fine Arts, Boston 4, 1992, S. 17–26
- Almuth Behrmann: Zur Bedeutung der Nilpferd-Fayencen. Göttinger Miszellen 96, 1987, S. 11–22
- Magdalena Stoof: Pferd, Nilpferd und Thoeris – Motive auf Siegelamuletten im Alten Ägypten. Hamburg, 2017, S. 1–139
- Judith Weingarten: The transformation of Egyptian Taweret into the Minoan Genius. A study of cultural transmission in the Middle Bronze Age. Studies in Mediterranean Archaeology 88, 1991, S. 1–16
- Fritz Blakolmer: The many-faced „Minoan Genius“ and his iconographical prototype Taweret. On the character of Near Eastern religious motifs in Neopalatial Crete. In: J. Mynářová, P. Onderka und P. Pavúk (Hrsg.): There and Back Again – the Crossroads II. Prague, 2015, S. 197–219
- Nora Kuch: Entangled Itineraries. A Transformation of Taweret into the „Minoan Genius“? Distant Worlds Journal 3, 2017, S. 44–66
- Eleftherios Hadjisterkotis und Richard Keshen: Misconceptions about the Fossil Bones of the Large Mammals of Cyprus from Prehistoric Times until Today. Proceedings of the XXVth International Congress of the International Union of Game Biologists – IUGB and the IXth International Symposium Perdix 2, 2005, S. 1–21
- Hiob 40,15-24
- Michael V. Fox: Behemoth and Leviathan. Biblica 93 (2), 2012, S. 261–267
- Timothy Insoll: A cache of hippopotamus ivory at Gao, Mali; and a hypothesis of its use. Antiquity 69, 1995, S. 327–336
- Sila Tripati und Ian Godfrey: Studies on elephant tusks and hippopotamus teeth collected from the early 17th century Portuguese shipwreck off Goa, west coast of India: Evidence of maritime trade between Goa, Portugal and African countries. Current Science 92 (3), 2007, S. 332–339
- Jacob Dembitzer: The Case for Hippos in Colombia. Israel Journal of Ecology & Evolution 63 (3/4), 2017, S. 5–8, doi:10.1163/22244662-06303002
- Amanda L. Subalusky, Elizabeth P. Anderson, Germán Jiménez, David M. Post, David Echeverri Lopez, Sebastián García-R., Laura J. Nova León, Juan F. Reátiga Parrish, Ana Rojas, Sergio Solari und Luz F. Jiménez-Segura: Potential ecological and socio-economic effects of a novel megaherbivore introduction: the hippopotamus in Colombia. Oryx, 2019, doi:10.1017/S0030605318001588
- Jonathan B. Shurin, Nelson Aranguren-Riaño, Daniel Duque Negro, David Echeverri Lopez, Natalie T. Jones, Oscar Laverde‐R, Alexander Neu und Adriana Pedroza Ramos: Ecosystem effects of the world’s largest invasive animal. Ecology 101 (5), 2020, S. e02991, doi:10.1002/ecy.2991
- Erick J. Lundgren, Daniel Ramp, John Rowan, Owen Middleton, Simon D. Schowanek, Oscar Sanisidro, Scott P. Carroll, Matt Davis, Christopher J. Sandom, Jens-Christian Svenning und Arian D. Wallach: Introduced herbivores restore Late Pleistocene ecological functions. PNAS 117 (14), 2020, S. 7871–7878, doi:10.1073/pnas.1915769117
- D. N. Castelblanco-Martínez, R. A. Moreno-Arias, J. A. Velasco, J. W. Moreno-Bernal, S. Restrepo, E. A. Noguera-Urbano, M. P. Baptiste, L. M. García-Loaiza und G. Jiménez: A hippo in the room: Predicting the persistence and dispersion of an invasive mega-vertebrate in Colombia, South America. Biological Conservation 253, 2021, S. 108923, doi:10.1016/j.biocon.2020.108923
- BBC: Pablo Escobar: Colombia sterilises drug lord's hippos. BBC News vom 16. Oktober 2021 ()
- Frankfurter Allgemeine Zeitung: Dutzende Nilpferde auf Farm von Pablo Escobar sterilisiert. Frankfurter Allgemeine Zeitung vom 16. Oktober 2021 ()
- Erustus M. Kanga, Joseph O. Ogutu, Han Olff und Peter Santema: Population trend and distribution of the Vulnerable common hippopotamus Hippopotamus amphibius in the Mara Region of Kenya. Oryx 45 (1), 2011, S. 20–27, doi:10.1017/S0030605310000931
- Patience Zisadza, Edson Gandiwa, Hugo van der Westhuizen, Elsabe van der Westhuizen und Vimbainashe Bodzo: Abundance, distribution and population trends of hippopotamus in Gonarezhou National Park, Zimbabwe. South African Journal of Wildlife Research 40 (2), 2010, S. 149–157, doi: 10.3957/056.040.0206
- Erustus M. Kanga, Joseph O. Ogutu, Hans-Peter Piepho und Han Olff: Human–hippo conflicts in Kenya during 1997–2008: vulnerability of a megaherbivore to anthropogenic land use changes. Journal of Land Use Science 7 (4), 2012, S. 395–406, doi:10.1080/1747423X.2011.590235
- Alexandra Andersson und Luke Gibson: Missing teeth: Discordances in the trade of hippo ivory between Africa and Hong Kong. African Journal of Ecology 56 (1), 2017, S. 235–243, doi:10.1111/aje.12441
- Nina J. Root: Victorian England’s Hippomania. Natural History 103, 1993, S. 34–39
- Zootierliste (), zuletzt abgerufen am 12. Oktober 2020
Anmerkungen
- Teilweise werden für die Kopf-Rumpf-Länge und für das Gewicht Extremwerte von 509 cm und 4500 kg angegeben, so etwa bei Ronald M. Nowak in Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore 1999. Bereits in der ersten Auflage von 1964 wurde das Gewicht mit 3 to 4.5 metric tons beziffert, was weit über den Werten liegt, die bei Untersuchungen verschiedener Populationen in der wissenschaftlichen Literatur genannt werden. Vor allem in den 1950er und 1960er wurden Gewichtsangaben verschiedentlich in pound (lb) angegeben, so beispielsweise bei Bere 1959 in Oryx 5 (3), S. 116–124 und Pienaar et al. 1966 in Koedoe 9 (1), S. 1–15. Bei Pienaar et al. 1966 ergeben sich so Gewichtsmaße von ausgewachsenen Flusspferden zwischen 3,000-over 4,000 lbs. (summiert für beide Geschlechter). Die hier angeführte Maximalangabe für ein Individuum aus dem Kruger-Nationalpark in Südafrika von 4,412 lbs. führt zu einem Gewicht von 1999 kg. Bei Bere 1959 entspricht die Maximalangabe für ein Tier aus dem Murchison-Falls-Nationalpark in Uganda von 4,454 lb. umgerechnet 2018 kg. Ob bei Walker’s Mammals of the World ein Einheitenfehler vorliegt, ist allerdings ungeklärt.
Weblinks
- Literatur von und über Flusspferd im Katalog der Deutschen Nationalbibliothek
- Hippopotamus amphibius in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: R. L. Lewison & J. Pluháček, 2016. Abgerufen am 9. Oktober 2020.
- Flusspferd auf ultimateungulate.com (englisch)
