Zecken
Die Zecken (Ixodida) sind eine Ordnung der Milben (Acari), die der Überordnung Parasitiformes zugeordnet werden. Unter den Zecken finden sich die größten Milbenarten. Alle Arten sind blutsaugende Ektoparasiten an Wirbeltieren, darunter auch dem Menschen. Viele Zeckenarten sind bedeutende Krankheitsüberträger. 2004 waren weltweit etwa 900 Zeckenarten bekannt.[1]
| Zecken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Erwachsene Igelzecke (Ixodes hexagonus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Ixodida | ||||||||||||
| Leach, 1815 | ||||||||||||
| Familien | ||||||||||||
|
Merkmale
Wie bei den meisten Milbenarten besteht der Körper der Zecken aus zwei beweglich gegeneinander abgesetzten Abschnitten. Der vordere Abschnitt, bei den Milben generell Gnathosoma benannt, trägt bei den Zecken (aus historischen Gründen) den abweichenden Namen Capitulum. Dieser Abschnitt entspricht dem, was landläufig als Zeckenkopf bezeichnet wird. Der übrige Rumpf wird Idiosoma genannt. Der vordere, die Beine tragende Abschnitt, das Podosoma, geht ohne scharfe Grenze in den hinteren Abschnitt, das Opisthosoma, über. Auf dem hinteren Abschnitt des Capitulum tragen viele Schildzecken zwei auffallende Porenfelder, die nach verschiedenen Ansichten entweder als Drüsen oder als Sinnesorgan dienen. Seitlich am Idiosoma sitzen die vier Beinpaare. Die Beine bestehen aus sechs deutlich gegeneinander abgesetzten Segmenten (benannt Coxa-Trochanter-Femur-Patella oder Genu-Tibia-Tarsus). An der Spitze des Tarsus sitzen zwei Krallen und bei den Schildzecken (und den Larven der Lederzecken) ein Haftpolster (Pulvillus) zum Festhalten an glatten Oberflächen. Seitlich am Idiosoma sitzen zwei Öffnungen der Tracheen, die Stigmen heißen und luftgefüllte Kanäle sind, die die Körperoberfläche für die Atmung vergrößern. Vor allem bei Schildzecken sitzen sie meist innerhalb eines sklerotisierten und auffallend skulpturierten Stigmenfelds. Viele Zeckenarten besitzen kleine, wenig auffallende Augen, die bei den Schildzecken paarweise auf der Körperoberseite (dorsal) sitzen, aber z. B. bei der Gattung Ixodes fehlen. Bei den Lederzecken kann eine höhere Anzahl vorkommen, die randlich auf der Körperunterseite (ventral) sitzen. Zumindest bei einer Zeckenart, der Kamelzecke Hyalomma dromedarii, ist optische Wirtsfindung (Skototaxis) durch die Wahrnehmung der Silhouette des Wirts nachgewiesen.[2]
Die beiden Familien Schildzecken und Lederzecken unterscheiden sich dadurch, dass bei den Schildzecken der namengebende Schild (Scutum) ausgebildet ist, der oben (dorsal) auf dem Idiosoma sitzt. Bei vielen Zeckenarten wie dem Gemeinen Holzbock bedeckt er beim Männchen den gesamten Rumpf, beim Weibchen nur etwa die Hälfte. Bei den Lederzecken fehlt ein Schild. Außerdem sitzt bei den Lederzecken das Capitulum mit den Mundwerkzeugen etwas bauchseitig (ventral) am Körper, so dass es bei Betrachtung von oben nicht sichtbar ist.
Mundwerkzeuge und Saugvorgang
Kennzeichnend für die Zecken sind vor allem die vorn am Capitulum sitzenden Mundwerkzeuge. Diese sind für die blutsaugende Lebensweise eigentümlich umgestaltet. Außen sitzen zwei viergliedrige Taster (Palpen), die Sinnesorgane sind und nicht am Saugvorgang teilnehmen. Sie umhüllen in Ruhestellung häufig die eigentlichen Mundwerkzeuge. Zentral sitzt ein Hypostom genannter Stechrüssel, der häufig Zähne aufweist, die als Widerhaken wirken. Auf der Oberseite (dorsal) und meist von unten her nicht sichtbar sitzen die beiden Cheliceren. Diese bestehen aus einem zweiteiligen Schaft, der parallel zum Hypostom nach vorne gestreckt wird und der unbeweglich mit breiter Basis am basalen Teil des Capitulums ansitzt. An der Spitze tragen sie mehrere bewegliche zahnförmige Vorsprünge, Chelicerenfinger genannt. Die Zecke ritzt beim Saugvorgang mit ihren Cheliceren die Haut ein und schiebt anschließend das Hypostom in die Wunde. Entgegen einer verbreiteten Vorstellung ist das Hypostom aber kein hohler Saugrüssel: die Mundöffnung liegt basal zu ihm auf der breiteren Basis des Capitulums. Das Hypostom kann eine eingesenkte Nahrungsrinne tragen. Dieser Vorgang wird umgangssprachlich als Zeckenbiss bezeichnet, korrekt ist jedoch Zeckenstich.
 Hirschzecke (Ixodes scapularis)
Hirschzecke (Ixodes scapularis) Braune Hundezecke (Rhipicephalus sanguineus)
Braune Hundezecke (Rhipicephalus sanguineus) Amblyomma americanum
Amblyomma americanum Zecke von unten
Zecke von unten
Beim Saugvorgang schafft das Tier mit den Mundwerkzeugen eine Wunde, indem Gewebe mit kleinen Blutkapillaren aufgerissen wird. Das sich hier ansammelnde Blut wird anschließend aufgesaugt (sog. Pool feeder). Langrüsselige Tiere (Prostriata) wie der Gemeine Holzbock verankern sich beim Saugvorgang vorwiegend mit den Mundwerkzeugen, kurzrüsselige (Metastriata) wie die Dermacentor-Arten scheiden zu diesem Zweck eine leim- oder kittartige Substanz aus. Der Saugvorgang ist bei den Lederzecken relativ kurz, etwa 30 bis 60 Minuten, Ausnahmen bilden die Larven. Bei den Schildzecken kann er viele Tage bis Wochen dauern. Der Körper der weiblichen Schildzecken kann dabei auf das Zwanzigfache seines ursprünglichen Volumens und das Hundertfache des Gewichts anschwellen, daran sind neben der Dehnung der Kutikula auch echte Wachstumsvorgänge beteiligt. Bei den Lederzecken wird weniger Blut, meist etwa das Fünffache des Körpervolumens und das Zehnfache des Gewichts bei einem Saugvorgang aufgenommen.
Beim Saugvorgang gibt die Zecke Speichel in die Wunde ab. Dieser enthält bei den bisher untersuchten Arten viele Hundert unterschiedliche Proteine, die größtenteils bei keiner anderen Tiergruppe gefunden wurden.[3] Wichtigste Funktion des Speichels ist es, das Zusammenklumpen der Blutplättchen zu verhindern, das ansonsten den Wundverschluss einleitet. Dazu greifen etliche Enzyme an verschiedenen Stellen der Signalkaskade ein. Auch die weitere Blutgerinnung wird so unterdrückt. Außerdem werden Entzündungsreaktionen unterdrückt (z. B. durch Prostaglandine) und das Schmerzempfinden gehemmt, um Abwehrreaktionen des Wirts zu vermeiden. Gegen Hormone und Signalstoffe wie Histamin, Serotonin und Bradykinin wirksame Hemmstoffe können teilweise mehrere dieser Zwecke parallel erreichen. Der abgegebene Speichel kann Bakterien, Viren und andere Krankheitserreger enthalten, durch die der Zeckenstich sein besonderes Risiko erhält. Obwohl der Zeckenspeichel generell die Funktion der körpereigenen Immunabwehr an der Einstichstelle vermeidet, kann es beim Menschen in seltenen Fällen zu allergischen Reaktionen vom Soforttyp kommen. Die immunmodulatorischen Beziehungen zwischen Parasit und Wirt sind dabei äußerst komplex. Nach wiederholten Kontakten mit Zecken kann die Immunabwehr stark ansteigen, was allerdings artspezifisch ist, weil Zeckenarten wirtsspezifische Immunmodulatoren entwickelt haben.[4] Dabei können unerwartete Wechselbeziehungen auftreten. Beispielsweise waren Mäuse dann immun gegen Zecken-Borreliose, wenn sie vorher mehrfach von nicht infizierten Zecken gestochen worden waren.[5] Selten, aber lebensgefährlich ist die Zeckenparalyse, bei der ein als Nervengift wirkender Stoff eine Hemmung der motorischen Nerven bewirken kann, die sich von der Einstichstelle her fortsetzt.
Nach einer ausgedehnten Blutmahlzeit erreichen vor allem weibliche Zecken eine Größe von bis zu 3 cm.
.jpg.webp) männliche Zecke
männliche Zecke.jpg.webp) etwas vollgesogene Zecke
etwas vollgesogene Zecke Vollgesogene Zecke (von unten)
Vollgesogene Zecke (von unten) Vollgesogene Zecke (von oben)
Vollgesogene Zecke (von oben) Paarung: Das kleinere Männchen liegt Bauch an Bauch unter dem deutlich größeren Weibchen.
Paarung: Das kleinere Männchen liegt Bauch an Bauch unter dem deutlich größeren Weibchen. Paarungsvorbereitung. Das kleinere Männchen schiebt seine Cheliceren in die Geschlechtsöffnung des Weibchens
Paarungsvorbereitung. Das kleinere Männchen schiebt seine Cheliceren in die Geschlechtsöffnung des Weibchens
Verbreitung

Zecken sind weltweit verbreitet und kommen überall da vor, wo ihre Wirtsarten leben. Die Verbreitung der einzelnen Arten hängt von der Verbreitung ihrer jeweiligen Wirte und außerdem von Umweltfaktoren wie Temperatur und Luftfeuchte ab. Die meisten Zeckenarten besitzen einen oder mehrere Vorzugswirte, können aber bei Nahrungsmangel notfalls auch an anderen Wirten Blut saugen. Etwa zwanzig Zeckenarten kommen in Deutschland vor, einige davon sehr selten oder eventuell nur vorübergehend eingeschleppt. Die Schildzecke Gemeiner Holzbock (Ixodes ricinus) ist dabei die deutsche Zeckenart, die am häufigsten Menschen befällt. Andere häufige Schildzeckenarten sind hier z. B. die Igelzecke (Ixodes hexagonus), die Schafzecke (Dermacentor marginatus), in Süddeutschland auch die Auwaldzecke (Dermacentor reticulatus). Eine Reihe weiterer Arten lebt fast nur an Vögeln oder ist sehr selten und geht so gut wie nie auf den Menschen über. Weltweit die häufigste Art, die auch auf dem Menschen parasitiert, ist die Braune Hundezecke (Rhipicephalus sanguineus), die in Deutschland wegen zu geringer Wärme aber nicht dauerhaft leben kann.
Die meisten Arten der Familie der Lederzecken sind auf die Tropen und Subtropen beschränkt. In Mitteleuropa lebt die Art Argas vespertilionis an Fledermäusen. Häufigste Art ist aber die Taubenzecke Argas reflexus, die an Stadttauben, seltener auch an anderen Vogelarten, in Mitteleuropa ausschließlich in Häusern und anderen Gebäuden, lebt.
Verhalten
Unter den Zeckenarten gibt es prinzipiell zwei Strategien der Wirtsfindung:
- Lauerer klettern auf eine Pflanze (z. B. einen Grashalm oder einen Busch) und halten sich mit den hinteren Beinen fest. Das vordere Beinpaar strecken sie in einer charakteristischen Pose weit nach außen vor, so dass sich eine T-Form ergibt. Sobald ein potenzieller Wirt sie berührt, halten sie sich an diesem fest. Zu den Lauerern gehört z. B. der Gemeine Holzbock.
- Jäger bewegen sich aktiv auf der Suche nach Wirtsorganismen vorwärts. Sie sind mit 5–8 Metern pro Stunde schneller als Weinbergschnecken (4,2 Meter pro Stunde).[6]
Zur Wirtsfindung dienen ihnen verschiedene chemische Sinne, vor allem Kohlendioxid-Sensoren, die in einem speziellen Organ am letzten Beinglied (Haller-Organ) sitzen. Die Braune Hundezecke ist ein Beispiel für einen Jäger.
Bei den Männchen dauert eine Blutmahlzeit in der Regel nur wenige Tage, da sie nur für ihre eigene Ernährung Blut benötigen. Sie können beim Warten auf ein Weibchen mehrere Male Blut saugen. Die Weibchen sind nicht nur zur eigenen Ernährung auf Blut angewiesen, sondern auch zur Eibildung und brauchen daher eine wesentlich größere Blutmenge. Ihre Blutmahlzeit kann ungestört Wochen andauern.
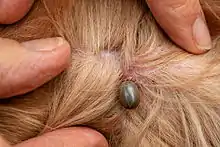
Zum Auffinden des Nahrungsopfers ist den Zecken ihr Haller-Organ behilflich. Dieser grubenförmige Chemorezeptor, der mit Sinnesborsten ausgestattet ist, befindet sich am letzten Beinelement (dem Tarsus) des ersten Beinpaares und kann Stoffe wie Ammoniak, Kohlendioxid, Milchsäure und vor allem Buttersäure erkennen, die von den jeweiligen Wirtstieren durch Atem und Schweiß abgegeben werden. In der Lauerstellung (das vordere Beinpaar wird leicht schwenkend nach vorne gestreckt, mit den hinteren drei Beinpaaren umklammern sie ihren Ansitz) wird dieses Organ vorgestreckt, damit die Zecken die Sinnesreize besser empfangen können. Die wartenden Zecken wechseln sofort von der Wartestellung (die eingefalteten Vorderbeine liegen nahe am Körper) in die Lauerstellung, wenn sie durch Geruchsreize, Lichtveränderung – besonders von hell zu dunkel – oder durch Vibrationen bemerken, dass sich möglicherweise ein Wirt nähert. Sie hängen sich anschließend an alles, was ihren jeweiligen Aufenthaltsort streift und krabbeln dann oft bei Tier und Menschen bis zu mehreren Stunden lang am Körper umher, bis sie eine passende Einstichstelle gefunden haben. Zecken sind dabei sehr wählerisch und bevorzugen etwas feuchte, warme und gut durchblutete, dünne Haut. Beim Menschen sind besonders die Kniekehlen, der Haaransatz, die Leistenbeuge und die feine Haut hinter den Ohren ein beliebtes Ziel.
Nach Beendigung der Blutmahlzeit lassen sie sich von ihrem Wirt abfallen und die Weibchen suchen anschließend eine geschützte Stelle am Boden, um alsbald Eier abzulegen. Eine Eiablage kann mehrere Tage dauern, wobei etwa alle zehn Minuten ein Ei abgelegt wird. Nachdem ein solches aus der Bauchöffnung ausgetreten ist, wird es mit den Mundwerkzeugen an einer Drüse vorbeigeführt und dabei mit einer Schutzschicht versehen, die das frische Ei vor dem Vertrocknen schützt. Bei einer Eiablage der Schildzecken werden tausende Eier produziert (bis 20.000 in den Gattungen Hyalomma und Amblyomma), wonach das Weibchen stirbt.
Lederzecken-Arten, die viel öfter an ihren Wirten saugen müssen als Schildzecken, findet man deshalb beinahe ausschließlich in Nestern, Bauten oder Schlupfwinkeln ihrer Wirte (wenige tropische Arten sind aktive Jäger). Im Gegensatz zu den Schildzecken nimmt hier das Weibchen mehrere Male hintereinander Blutmahlzeiten auf und legt anschließend jedes Mal Eier (bis zu sieben Mal). Die Eizahl ist dafür aber jedes Mal geringer. Sie ziehen sich nach jeder Blutmahlzeit in Spalten und Winkel zurück und warten anschließend ab, bis wieder ein Wirt in Reichweite kommt. Arten der großen Gattung Ornithodoros, die Zugvögel befallen, können die Zeit während der Abwesenheit ihres Wirtes im Nest abwarten. Es wird berichtet, dass Lederzecken viele Jahre ohne Nahrungsaufnahme wartend überleben können. Den Rekord hält Ornithodoros papillipes mit elf Jahren.[7] Dies kann bei gebäudebewohnenden Arten wie der Taubenzecke auch für den Menschen zu großen Problemen führen.
Lebenszyklus
Zecken durchlaufen nach dem Schlüpfen wie alle Milben stets drei Entwicklungsstadien und zwei Häutungsprozesse: Larve (mit sechs Beinen), Nymphe (mit acht Beinen) und Adulte (die erwachsenen Männchen und Weibchen). Die Geschlechtsmerkmale bilden sich erst in der adulten Phase aus.
Die Argasidae (Lederzecken) haben mehrere, von zwei bis zu acht Nymphenstadien. Jede Larve und Nymphe ist auf Blut eines Wirtes angewiesen. Dabei wird häufig dieselbe Wirtsart in allen Stadien befallen. Bei den Lederzecken findet die Befruchtung des Weibchens abseits des Wirts in der Umgebung (meist im Bau oder Nest des Wirts) statt. Die Tiere finden sich gegenseitig durch Signalstoffe (Pheromone). Diese wirken häufig schon auf ältere Nymphen. Eine als Pheromon wirksame Substanz ist das im Kot enthaltene Guanin.
.jpg.webp)
| Larven (6 Beine) |
Nymphe (8 Beine) |
Adult (m. oder w.) (8 Beine) |
vollgesogener Adult (8 Beine) |
|---|---|---|---|
 |
 |
 |
 |
| 0,5 mm × 0,4 mm | 1,2 mm × 0,85 mm | 3,8 mm × 2,6 mm | 13,2 mm × 10,2 mm |
Bei den Ixodidae (Schildzecken) kommt nur ein Nymphenstadium vor. Bei vielen Arten wechseln die Tiere zwischen den verschiedenen Stadien die Wirtsart, häufig mit Größenzunahme. Es kommen aber Arten vor, bei denen die Häutung von der Larve zur Nymphe auf dem Wirt erfolgt, manchmal sogar beide Häutungen, so dass nur das reife Weibchen den Wirt verlässt (Zwei- und Ein-Wirt-Arten, z. B. Gattung Rhipicephalus). Bei vielen Arten bleiben Larven und Nymphen im Bau oder im Lager des Wirtes. Seltener sind alle drei Stadien freilebend. Beim Gemeinen Holzbock schlüpft z. B. aus dem Ei die sechsbeinige Larve. Diese sucht sich schon nach wenigen Tagen einen geeigneten Zwischenwirt (Nagetier), saugt sich dort fest und nimmt innerhalb von zwei bis drei Tagen Blut auf. Nach dem Saugen lässt sie sich abfallen und häutet sich nach einigen Monaten zur ersten achtbeinigen, rund 1,5 bis 2 mm großen Nymphe. Diese sucht sich nun abermals einen größeren Wirt (zweiter Zwischenwirt – Katze) und saugt dort ebenfalls Blut. Unter mitteleuropäischen Klimabedingungen suchen die meisten Nymphen, die sich im Sommer oder Herbst gehäutet haben, jedoch nicht sofort einen neuen Wirt für eine Blutmahlzeit, sondern treten bei Temperaturen unter 7[8] bis 8 °C[9] zunächst bis zum nächsten Frühjahr in ein Ruhestadium ein (kann in besonders milden Wintern auch ausfallen).[10] Erst nach dieser Pause suchen sie sich einen Wirt und anschließend findet eine weitere Häutung zum adulten Tier statt. Das ausgewachsene Tier befällt danach den Endwirt (Mensch, Rind). Auf dem Wirt findet die Paarung statt, wonach das Männchen stirbt. Kommt es nicht sofort zur Paarung, verbleibt das Weibchen im halb vollgesogenem Zustand auf dem Wirt und wartet so auf ein Männchen.[11] Das Weibchen lässt sich nach dieser letzten Blutmahlzeit fallen und legt kurz darauf seine Eier ab.
Zecken als Krankheitsüberträger
| Erkrankung | Erreger | Überträger |
|---|---|---|
| Lyme-Borreliose | Bakterien des Borrelia burgdorferi s. l. -Komplexes: B. burgdorferi sensu strictu, B. garinii, B. afzelii, B. bavariensis, B. mayonii, B. spielmanii | Ixodes ricinus (Europa) Ixodes scapularis (Nordamerika) Ixodes pacificus (Nordamerika) Ixodes persulcatus (Asien) |
| Borrelia-Minamotei-Erkrankung | Borrelia miyamotoi | Ixodes-Zecken |
| Frühsommer- Meningoenzephalitis (FSME) | FSME-Virus | Ixodes ricinus (Europa) Ixodes persulcatus (Asien) |
| Tularämie | Francisella tularensis | verschiedene |
| Rickettsiosen | Diverse Rickettsienarten: R. prowazekii, R. typhi, R. felis, R. akari, R. australis | verschiedene |
| Humane granulozytäre Anaplasmose | Anaplasma phagocytophilum | Ixodes scapularis (Nordamerika) Ixodes pacificus (Nordamerika) |
| Humane monozytäre Ehrlichiose | Ehrlichia chaffeensis | Amblyomma americanum (Nordamerika) |
| Neoehrlichiose | Candidatus neoehrlichia mikurensis | Ixodes ricinus |
| Babesiose | Babesia microti (v. a. Nordamerika) Babesia divergens (v. a. Europa) | Ixodes-Arten |
Zecken übertragen beim Zeckenstich aufgrund ihrer Lebensweise häufig Krankheitserreger zwischen den Wirten, ohne jedoch selbst zu erkranken. Es handelt sich dabei um mehr Arten von Krankheitserregern als bei jeder anderen parasitischen Tiergruppe. Auch Menschen sind durch Erkrankungen wie Borreliose, Frühsommer-Meningoenzephalitis (FSME), Babesiose, Ehrlichiose, Rickettsiosen oder Neoehrlichiose[13] betroffen.
Wichtigste Überträger[14] in Mitteleuropa sind die Arten der Gattung Ixodes mit der häufigsten einheimischen Art, dem Gemeinen Holzbock (Ixodes ricinus), daneben auch die Gattungen Rhipicephalus, Dermacentor, Haemaphysalis, Amblyomma und aus der Familie der Lederzecken die Gattungen Argas und Ornithodorus.[15] Während Zecken in der Vergangenheit nur im Sommerhalbjahr eine Gefahr darstellten, da sie in den Wintermonaten Winterruhe hielten, sind sie mittlerweile – bedingt durch die globale Erwärmung – in milden Wintern ganzjährig aktiv.[16]
Für weitere ausführliche Informationen diesbezüglich siehe Zeckenstich.
 Warnhinweis in einem Waldgebiet in Mecklenburg-Vorpommern
Warnhinweis in einem Waldgebiet in Mecklenburg-Vorpommern Saugende Hirschzecke an menschlichem Bein
Saugende Hirschzecke an menschlichem Bein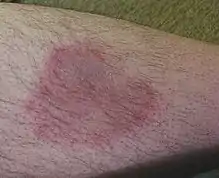 Wanderröte als Folge eines Zeckenstichs mit Borrelioseinfektion
Wanderröte als Folge eines Zeckenstichs mit Borrelioseinfektion
Natürliche Feinde und Einschränkungen des Lebensraums
Als natürliche Feinde der Zecken sind bisher festgestellt worden:
- Einige Pilzarten (zum Beispiel Metarhizium anisopliae)[17][18]
- Fadenwürmer (Nematoden), von denen sie befallen werden können. Ein solcher Befall ist für die Zecke tödlich.[19]
- Vogelarten, die gerne Zecken fressen.
- parasitische Erzwespen wie Ixodiphagus hookeri und andere Vertreter der Gattung Ixodiphagus. Sie legen ihre Eier in die Larven oder Nymphen der Zecken und die geschlüpften Wespenlarven fressen die Zecken von innen her auf, wodurch diese getötet werden.[20]
Die ökologischen Ansprüche der verschiedenen Zeckenarten und demgemäß auch ihr Lebensraum sind sehr unterschiedlich. Viele Arten, z. B. der Gemeine Holzbock, sind sehr luftfeuchtebedürftig und vertrocknen bei direkter Sonneneinstrahlung rasch. Obwohl Zecken auch starke Fröste unbeschadet überstehen können, wirken sich vor allem lang andauernde Kälteperioden für viele Arten letal aus und begrenzen das Verbreitungsgebiet nach Norden. Einzelne Jahre mit abweichenden Wetterbedingungen, z. B. milde Winter, können sich stark auf die Populationsgröße auswirken.
Zurzeit wird diskutiert, wie sich der derzeitige Klimawandel auf die Verbreitung der Zecken in Mitteleuropa[21] oder Nordamerika auswirkt. Einige Zeckenarten haben nachweisbar ihr Verbreitungsgebiet nach Norden ausdehnen können (z. B. Ixodes ricinus in Skandinavien), bei anderen sind die Auswirkungen umstritten. Dabei sind stets umfangreiche Wechselbeziehungen, z. B. zwischen Temperatur und Luftfeuchte, in Rechnung zu stellen.
Systematik
Schwestergruppe der Zecken sind vermutlich Milben der Ordnung Holothyrida.[22] Diese saugen tote Tiere (vor allem Arthropoden) aus.
Die Zecken selbst werden in drei Familien eingeteilt und es gibt insgesamt weltweit mehr als 850 Arten.[23]
- Lederzecken (Argasidae)
- Argas, 58 Arten
- Taubenzecke (Argas reflexus)
- Ornithodorus (auch Ornothodoros oder Ornithodoros geschrieben)
- Nothoaspis
- Otobius
- Ohrenzecke (Otobius megnini)
- Argas, 58 Arten
- Schildzecken (Ixodidae) (etwa 80 Prozent der Arten)
- Ixodes, 243 Arten
- Gemeiner Holzbock (Ixodes ricinus)
- Hirschzecke (Ixodes scapularis)
- Igelzecke (Ixodes hexagonus)
- Fuchszecke (Ixodes canisuga)
- Taigazecke (Ixodes persulcatus)
- Rhipicephalus, etwa 75 Arten
- Braune Hundezecke (Rhipicephalus sanguineus)
- Buntzecken (Dermacentor), 35 Arten
- Schafzecke (Dermacentor marginatus)
- Auwaldzecke (Dermacentor reticulatus)
- Amerikanische Hundezecke (Dermacentor variabilis)
- Haemaphysalis, 166 Arten
- Reliktzecke (Haemaphysalis concinna)
- Hyalomma, 27 Arten
- Amblyomma, 105 Arten
- Amblyomma americanum (englisch Lone Star Tick)
- Margaropus, 3 Arten
- Ixodes, 243 Arten
- Nuttalliellidae
- Nuttalliella, 1 Art
- Nuttalliella namaqua Bedford – einzige bekannte Art dieser Familie.
- Nuttalliella, 1 Art
Fossile Belege
Fossile Belege sind äußerst selten. Nahezu alle fossilen Zecken wurden in kreidezeitlichem und tertiärem Bernstein gefunden. Die ältesten Funde sind rund 100 Millionen Jahre alt (Birmit und New-Jersey-Bernstein). Bei den kreidezeitlichen Fossilien handelt es sich um Larven; alle bisher gefundenen adulten Zecken stammen aus Bernstein tertiärer Lagerstätten (eozäner Baltischer Bernstein, miozäner Dominikanischer Bernstein). In der Forschung zur Evolution der Zecken herrscht Einigkeit, dass deren Entwicklung deutlich früher begann als die ältesten Fossilien andeuten. Uneinigkeit hingegen besteht in der Frage, ob dies schon im Devon oder erst in der Trias der Fall war und ob die ersten Wirte Amphibien oder Reptilien waren.[24][25]
Literatur
- Krankheitsüberträger Zecke – Lyme-Borreliose und FSME, BgVV, Verl. Im Kilian, Marburg 1997
- Hans-Peter Wirtz: Zecken als Krankheitsüberträger: Was tun bei einem Stich? In: Biologie in unserer Zeit. Bd. 31, Nr. 4, 2001, ISSN 0045-205X, S. 229–238.
- Johannes Eckert, Karl Theodor Friedhoff, Horst Zahner, Peter Deplazes: Lehrbuch der Parasitologie für die Tiermedizin. Enke, Stuttgart 2008, ISBN 3-8304-1032-8.
Weblinks
- Wie man sich vor Zecken schützt – Deutsches Ärzteblatt
Einzelnachweise
- Systematik von Zecken aus: S. C. Barker, A. Murrell: Systematics and evolution of ticks with a list of valid genus and species names (Memento vom 8. November 2011 im Internet Archive). In: Parasitology. Nr. 129, 2004, S. 15–36, PMID 15938503.
- Martin Kaltenrieder: Scototaxis and target perception in the camel tick Hyalomma dromedarii. In: Experimental and Applied Acarology. 1990, Bd. 9, Nr. 3–4, S. 267–278, doi:10.1007/BF01193433.
- Übersicht in: I. M. Francischetti, A. Sa-Nunes, B. J. Mans, I. M. Santos, J. M. Ribeiro: The role of saliva in tick feeding. In: Frontiers in Bioscience. 2009, Nr. 14, S. 2051–2088, PMID 19273185.
- Albin Fontaine, Ibrahima Diouf, Nawal Bakkali u. a.: Implication of haematophagous arthropod salivary proteins in host-vector interactions. In: Parasites & Vectors. 2011, Nr. 4, S. 187 (open access).
- S. K. Wikel, R. N. Ramachandra, D. K. Bergman, T. R. Burkot, J. Piesman: Infestation with pathogen-free nymphs of the tick Ixodes scapularis induces host resistance to transmission of Borrelia burgdorferi by ticks. In: Infection and Immunity. 1997, Bd. 65, Nr. 1, S. 335–338.
- Angeln ist sooo schön – aber Sie sollten etwas über Zecken wissen (Memento vom 24. April 2014 im Internet Archive) Verhaltenstipps zu Zecken.
- Y. S. Balashov: Interaction between blood-sucking arthropods and their hosts, and its influence on vector potential. In: Annual Revue of Entomology. 1984, Nr. 29, S. 137–156.
- Zecken. In: Schutzgemeinschaft Deutscher Wald. Abgerufen am 31. Oktober 2019.
- Antworten auf häufig gestellte Fragen zu Zecken, Zeckenstich, Infektion. In: Robert Koch-Institut. 12. August 2019, abgerufen am 31. Oktober 2019.
- Hans Dautel, Cornelia Dippel, Daniel Kämmer, Anita Werkhaus, Olaf Kahl: Winter acitivy of Ixodes ricinus in a Berlin forest area. Vortragsskript der Umweltbundesamts-Tagung Vector-Borne Diseases: Impact of Climate Change on Vectors and Rodent Reservoirs. Berlin, 27 & 28 September 2007.
- W. Reuben Kaufman: Gluttony and sex in female ixodid ticks: How do they compare to other blood-sucking arthropods? In: Journal of Insect Physiology. 2007, Bd. 53, Nr. 3, S. 264–273, doi:10.1016/j.jinsphys.2006.10.004.
- V. Fingerle, A. Sing: Zecken und die von ihnen übertragenen Krankheiten. In: MMW Fortschr Med. 163 (S1), 2021, S. 62–72.
- Universität Zürich: Neue Zeckenerkrankung in der Schweiz. (Memento vom 11. Juli 2014 im Internet Archive) Medienmitteilung vom 31. Oktober 2012 Auf: mediadesk.uzh.ch; zuletzt abgerufen am 12. Juni 2014.
- Übersicht in: Augustin Estrada-Pena, Frans Jongjean: Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. In: Experimental and Applied Acarology. September 1999, Bd. 23, Nr. 9, S. 685–715, PMID 10581710.
- Welche Gefahren durch Parasiten lauern wo in Europa? Auf: parasitenfrei.de; zuletzt abgerufen am 12. Juni 2014.
- Peter Berthold: Bienenfresser in Island, Silberreiher in Sibirien. Wie Vögel weltweit auf den Klimawandel reagieren. In: Jochem Marotzke, Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 23–34, S. 33f.
- DGMEA e.V. Tagungen: Bericht über die 13. Tagung des Arbeitskreises für Medizinische Arachno-Entomologie (AMAE e.V.) in Stuttgart/Hohenheim am 29.-30.9.2005.
- Deutschlandfunk: Mit Parasiten gegen Blutsauger, vom 27. März 2018, geladen am 15. Juli 2019
- Kathrin Hartelt et al.: Biological control of the tick Ixodes ricinus with entomopathogenic fungi and nematodes: Preliminary results from laboratory experiments. In: International Journal of Medical Microbiology 2008, Band 298, Supplement 1, S. 314–320, doi:10.1016/j.ijmm.2007.10.003.
- Keiji Takasu und Satoshi Nakamura: Life history of the tick parasitoid Ixodiphagus hookeri (Hymenoptera: Encyrtidae) in Kenya. In: Biological Control 2008, Band 46, Nr. 2, S. 114–121, doi:10.1016/j.biocontrol.2008.04.013.
- J. S. Gray, H. Dautel, A. Estrada-Pena, O. Kahl, E. Lindgren: Effects of Climate Change on Ticks and Tick-Borne Diseases in Europe. In: Interdisciplinary Perspectives on Infectious Diseases. 2009, Bd. 2009, Article ID: 593232, doi:10.1155/2009/593232.
- J. S. H. Klompen, W. C. Black, J. E. Keirans, D. E. Norris: Systematics and biogeography of hard ticks, a total evidence approach. In: Cladistics. 2000, Nr. 16, S. 79–102, doi:10.1111/j.1096-0031.2000.tb00349.x.
- G. W. Krantz, David Evans Walter (Hrsg.): A Manual of Acarology. Third edition, Texas Tech University Press, Lubbock (Texas) 2009, ISBN 978-0-89672-620-8, S. 111–117.
- Nave, Guglielmone, Mangold: An overview of systematics and evolution of ticks. - In: Frontiers in Bioscience 14(8):2857-77, Irvine (USA) 2009.
- Gröhn: Einschlüsse im Baltischen Bernstein. Kiel 2015.