C4-Pflanze
C4-Pflanzen nutzen einen Stoffwechselweg, um Kohlenstoffdioxid für die Photosynthese zunächst vorzufixieren und erst dann wie C3-Pflanzen im Calvin-Zyklus zu Kohlenhydraten aufzubauen (C4-Photosynthese). Der Name C4 leitet sich vom ersten Fixierungsprodukt ab, welches durch die Assimilation von Kohlenstoffdioxid entsteht. Während dies bei C3-Pflanzen eine Kohlenstoffverbindung mit drei C-Atomen ist (D-3-Phosphoglycerat), findet man in C4-Pflanzen als erstes Oxalacetat, eine Verbindung mit vier C-Atomen.
| Namensgebende C4-Moleküle mit blau markierter Kette aus vier Kohlenstoffatomen |
_Structure_V.1.png.webp) |
_Formula_V.1.png.webp) |
Die Kohlenstoffdioxid-Assimilation und der Calvin-Zyklus erfolgen in C4-Pflanzen räumlich voneinander getrennt. Durch Aufbringung von Energie wird dadurch Kohlenstoffdioxid aktiv angereichert, was zu einer höheren Photosyntheserate – besonders unter Wassermangel und der daraus resultierenden Verengung der Spaltöffnungen – führt. Daher sind C4-Pflanzen den C3-Pflanzen ökophysiologisch unter ariden Bedingungen überlegen. Durch die aktive Anreicherung findet die Photorespiration deutlich seltener statt. Typische C4-Pflanzen sind insbesondere Gräser, darunter auch bekannte Nutzpflanzen wie Mais, Zuckerrohr und Hirse, aber auch andere Arten, wie Amarant.
Pflanzen mit einem Crassulaceen-Säurestoffwechsel (CAM-Pflanzen) verfahren ähnlich wie C4-Pflanzen, bei ihnen sind Vorfixierung und der Calvin-Zyklus indes zeitlich voneinander getrennt.
Vorkommen der C4-Photosynthese im Pflanzenreich

Etwa 3 % der Bedecktsamer betreiben C4-Photosynthese. Die meisten (ca. 80 %[1]) gehören zu den Gräsern, insbesondere den Süßgräsern,[2] gefolgt von Seggen. Der Großteil der schnell wachsenden Agrarpflanzen sind C4-Pflanzen, jedoch fallen auch viele der als sehr hartnäckig eingestuften Unkräuter (z. B. Hühnerhirse, Blutrote Fingerhirse[1] oder Knolliges Zypergras[1]) darunter.[3] Doch auch bei einer Reihe von Zweikeimblättrigen gibt es diesen Stoffwechselweg, insbesondere bei den Fuchsschwanzgewächsen und anderen Nelkenartigen, bei Wolfsmilchgewächsen und vereinzelt bei Windengewächsen und Korbblütlern. Bei den Fuchsschwanzgewächsen (Amaranthaceae) gibt es in der Gattung Melden sowohl C3- als auch C4-Arten. Bekannte C4-Pflanzen sind Amarant, Hirse, Mais, Zuckerrohr und Riesen-Chinaschilf.
Da die C4-Photosynthese mindestens 65-mal unabhängig voneinander in 19 verschiedenen Familien entstanden ist (Stand 2017[1]), spricht man von einem polyphyletischen Merkmal.
Gegenüber C3-Pflanzen zeichnen sich C4-Pflanzen bei Wasserknappheit, hohen Temperaturen und Sonneneinstrahlung aus.[4] Daher sind sie gegenüber anderen Pflanzenarten in ebendiesen Klimazonen im Vorteil. So betreiben etwa 70 % aller im Death-Valley-Nationalpark lebenden Arten eine C4-Photosynthese.[5] Allgemein wächst der Großteil aller C4-Gräser in Regionen mit weniger als 30 Grad geographischer Breite.[6] Sie sind seltener in kalten Regionen zu finden, beispielsweise in der borealen Zone zwischen dem 50. und 65. Breitengrad und in großen Höhenlagen. Eine Ausnahme stellt die baumlose Tundra der alpinen Zone dar, wo es trocken ist. Auch in Tibet wurde in einer Höhenlage von etwa 5200 Metern die C4-Grasart Orinus thoroldii entdeckt. Allgemein kommen sie in polaren und subpolaren Gegenden (jenseits des 65. Breitengrades) nicht vor.
Es gibt einige kältetolerante C4-Pflanzen, die Frost sowie winterliche Temperaturen (−20 °C) überstehen können, beispielsweise C4-Gräser in den Anden. Auch in kühlen Regionen wie der Küste Neuseelands, den atlantischen Küsten Kanadas und Großbritanniens oder manchen Sumpfgegenden wachsen C4-Pflanzen. Bei Nacktsamern, Moosen oder Kryptogamen wurden keine C4-Pflanzen identifiziert.[1] Es ist noch nicht bekannt, warum es – bis auf ein paar wenige Ausnahmen – keine Bäume mit einer C4-Photosynthese gibt.[1] So wurden auf Hawaii nur ein paar seltene Arten der Gattung Euphorbia entdeckt, beispielsweise Euphorbia olowaluana oder E. herbstii (früher als E. forbesii bezeichnet).[1] Phylogenetische Untersuchungen weisen darauf hin, dass der Vorgänger dieser C4-Bäume ursprünglich ein C4-Kraut war, das sich erst danach durch sekundäres Dickenwachstum zu einer Baumart entwickelt hatte.[7]
C4-Pflanzen stellen heute zwar weltweit nur etwa 5 % der Biomasse und 3 % der Pflanzenarten,[8] sind aber für 23 % der Fixierung von Kohlenstoffdioxid verantwortlich.[9] In den letzten dreißig Jahren ist eine Ausbreitung von C4-Pflanzen auch auf warmen, sonnigen Standorten in Mitteleuropa zu beobachten. Zumeist handelt es sich um hirseartige Gräser und Fuchsschwanzarten. Deren Ausbreitung wird zumindest bisher nicht als Gefahr für die heimische Flora gewertet.[10]
Identifizierung
Um C3- von C4-Pflanzen unterscheiden zu können, bedient man sich verschiedener Verfahren:[2] So gibt die Blattanatomie (vgl. Abschnitt unten) bereits erste Hinweise. Darüber hinaus kann durch radioaktive Isotope (14C) das primäre Photosyntheseprodukt identifiziert werden (Kurzzeit-14CO2-Fixierung). Der CO2-Kompensationspunkt lässt ebenfalls Rückschlüsse auf den Stoffwechseltyp zu. C4-Pflanzen zeichnen sich über eine sehr geringe oder nicht messbare Photorespiration aus. Schließlich kann durch das 13C/12C-Isotopenverhältnis im Kohlenstoff der Pflanze auf eine C3- von C4-Photosynthese geschlossen werden (vgl. Abschnitt unten).
Entdeckung
Unabhängig von der Bedeutung des zugrundeliegenden Stoffwechselweges wurden morphologische und pflanzenanatomische Besonderheiten von C4-Pflanzen Ende des 19. Jahrhunderts und Anfang des 20. Jahrhunderts beobachtet. So identifizierte Gottlieb Haberlandt die Kranzanatomie (vgl. Abschnitt unten) in verschiedenen Gräsern. Die in den Bündelscheidenzellen stattfindende Bildung und Anreichung von Stärke wurde 1944 in der Literatur beschrieben.[11] Unterschiedlich ausgeprägte Chloroplasten in den Bündelscheidenzellen bzw. Mesophyllzellen (dimorphologische/dimorphogene Chloroplasten) lieferten dann 1955[12] einen Hinweis auf eine tatsächlich unterschiedliche Spezialisierung im Stoffwechselweg.
Die ersten biochemischen Untersuchungen an einer C4-Pflanze wurden durch Hugo Kortschak durchgeführt. Anfang der 1950er Jahre identifizierte er an einem Zuckerrohr-Forschungsinstitut in Hawaii durch radioaktive Markierung mittels 14CO2 als erstes CO2-Fixierungsprodukt L-Malat und L-Aspartat. Diese sind C4-Verbindungen und standen damit in Widerspruch zu den Befunden von Melvin Calvin, Andrew Benson und James Bassham. Sie hatten nämlich gezeigt, dass das erste Stoffwechselprodukt bei der CO2-Fixierung in der Dunkelreaktion eine C3-Verbindung, 3-Phosphoglycerat, ist. Die Ergebnisse Kortschaks wurden zunächst 1954 unreferenziert im Jahresbericht des Instituts veröffentlicht und fanden erst 1957 und 1962 nach weiteren Untersuchungen in der wissenschaftlichen Literatur Erwähnung.[13] Die weitere Aufklärung wurde aber nicht weiter vorangetrieben, da die Forschergruppe zum einen nicht über das notwendige biochemisch-enzymologische Können und Wissen für weitere Arbeiten verfügte. Zum anderen standen Kortschaks Ergebnisse im Widerspruch zum allgemein akzeptierten Dogma der (C3-)Photosynthese durch die Arbeit von Melvin Calvin, so dass Kortschak selbst nach Kontakt mit der Forschergruppe um Calvin eingeschüchtert war. Erst 1965[14] wurden die Ergebnisse dann in einem öffentlich zugänglicheren Fachmagazin publiziert.[11]
Unabhängig von Kortschak entdeckte 1960 auch der Russe Yuri Karpilov bei Mais, dass das erste Fixierungsprodukt eine C4-Verbindung ist, was jedoch erst in den späten 1960er-Jahren bekannt wurde.[11] Auch der australische Pflanzenforscher Barry Osmond gelangte durch Markierungsexperimente bei Pflanzen der Gattung Melden (insbesondere Atriplex spongiosa[1]) zu dem Schluss, dass das erste Fixierungsprodukt Malat sei. Wegen Zweifel aus der Fachwelt wurden diese Ergebnisse erst 1967[15] publiziert.[11]
Erst die australischen Forscher Marshall Davidson Hatch und Charles Roger Slack konnten mit jenen Ergebnissen und eigenen Untersuchungen die Biochemie des Stoffwechselweges entschlüsseln. Zunächst wurde 1966 ein erstes Modell vorgeschlagen, in dem eine C3-Verbindung (Pyruvat oder Phosphoenolpyruvat) zu einer C4-Dicarbonsäure carboxyliert wurde. Das vierte Kohlenstoffatom dieser neu entstandenen Dicarbonsäure werde dann zu einem Akzeptor transferiert, so dass daraus 3-Phosphoglycerat entsteht. Dabei werde die ursprüngliche C3-Verbindung wieder regeneriert. In den Folgejahren wurden weitere Kenntnisse gewonnen, beispielsweise wurden das primäre carboxylierende Enzym (PEP-Carboxylase) sowie weitere inter- bzw. intrazelluläre Schlüsselenzyme des neuen Stoffwechselweges identifiziert. Mit diesen Daten konnten die Forscher 1971 ein detailliertes Schema aufstellen.[16] Infolgedessen wird der C4-Stoffwechsel nach seinen Entdeckern auch als Hatch-Slack-Weg bzw. Hatch-Slack-Zyklus bezeichnet. Hatch und Slack dagegen bezeichneten den Stoffwechselweg als C4-Dicarbonsäureweg.[13]
Anatomie
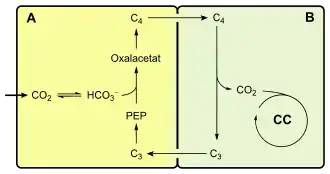
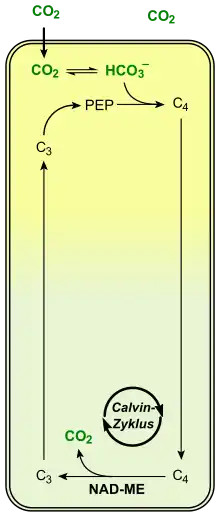
1. CO2 wird vorfixiert (A).
2. Die daraus gebildete C4-Verbindung wird in das benachbarte Kompartiment transportiert (B)
3. Dort wird CO2 freigesetzt und im Calvin-Zyklus verbraucht.
4. Der übrige C3-Körper wird wieder zurücktransportiert und für einen weiteren Zyklus regeneriert.
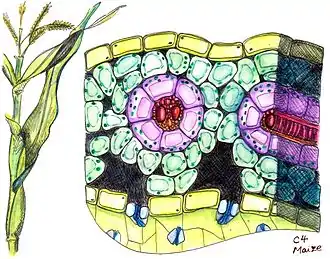
C4-Pflanzen lassen sich häufig aufgrund einer charakteristischen Anatomie des Blattes identifizieren. Hierbei sind die Leitbündel in einem ersten Ring von den Bündelscheidenzellen kranzförmig eingebettet. Die Bündelscheidenzellen sind dann wiederum von den Mesophyllzellen in einem zweiten Ring umgeben (vgl. Abbildung). Durch die zahlreichen Leitbündel liegen Mesophyll und Bündelscheide etwa in einem Verhältnis von 1:1 vor.[17] Dieser besondere Aufbau wird auch als „Kranzanatomie“ oder nach den vom Gottlieb Haberlandt 1896 geprägten Begriff „Kranztyp“[18] bezeichnet. Für das Ausbilden der Kranzanatomie von C4-Pflanzen spielt das Wurzelgen SCARECROW eine wichtige Rolle, was Experimente an Maispflanzen zeigen.[19] Das die Bündelscheiden umgebende Mesophyll ist nicht in ein C3-typisches Schwamm- bzw. Palisadenparenchym differenziert.[20]
Durch diese besondere Anordnung erklärt sich auch das Prinzip des C4-Stoffwechselweges, der sich meistens über zwei benachbarte Zelltypen erstreckt, die ein hohes Maß an Funktionalisierung aufweisen. Hierbei wird CO2 zunächst in Mesophyllzellen in eine C4-Verbindung vorfixiert. Mesophyllzellen enthalten kein RuBisCO. Das in Form von jener C4-Verbindung gebundene CO2 wird über besonders zahlreiche Plasmodesmen in Bündelscheidenzellen transportiert und dort freigesetzt. Diese können aufgrund ihrer Enzymausstattung den Calvin-Zyklus ausführen. Die Zellwände der Bündelscheidenzellen sind häufig suberinisiert, wodurch das frei werdende CO2 kaum aus der Zelle diffundieren kann. Es sammelt sich in der Zelle an, so dass eine hohe CO2-Konzentration (etwa 10-mal höher als in der Außenluft[21]) für die RuBisCO herrscht, die es zur Assimilation in den Calvin-Zyklus einführt. Die bei der Freisetzung entstehende C3-Verbindung wird wieder in die Mesophyllzelle zurücktransportiert. Die CO2-Vorfixierung (in Mesophyllzellen) und die eigentliche Kohlenstoffassimilation im Calvin-Zyklus (in Bündelscheidenzellen) sind damit räumlich voneinander getrennt und finden damit in unterschiedlichen Reaktionsräumen statt.
Durch diese Funktionstrennung unterscheiden sich auch die Chloroplasten der Mesophyll- und Bündelscheidenzellen mancher C4-Pflanzen.[22] So erhalten die Chloroplasten der Bündelscheidenzellen viel Stärke und es fehlen die Grana. Man spricht von einem Chloroplastendimorphismus[20] bzw. dimorphogene Chloroplasten. Dieser ist für den Ablauf der C4-Photosynthese indes nicht unbedingt erforderlich.[22]
Biochemie
Abgrenzung zu C3- und CAM-Pflanzen
Zum Aufbau von Kohlenhydraten betreiben alle grünen Pflanzen Photosynthese. Dabei wird in der „Dunkelreaktion“ Kohlenstoffdioxid (CO2) fixiert und zu Kohlenhydraten aufgebaut. Die meisten Pflanzen (C3-Pflanzen) betreiben einen als C3-Stoffwechsel beschriebenen Mechanismus, bei dem Kohlenstoffdioxid passiv durch die Stomata in die Zellen gelangt und während des Tages im Calvin-Zyklus als Substrat fixiert wird. Diese passive Diffusion von Kohlenstoffdioxid in die Zellen hat einen Nachteil bei hohen Umgebungstemperaturen. Pflanzen müssen unter diesen Bedingungen ihre Stomata schließen, um den Wasserverlust durch Transpiration in Grenzen zu halten und nicht auszutrocknen. Durch den Verschluss der Stomata wird allerdings auch der Gasaustausch und damit die Aufnahme von CO2 für die Photosynthese erschwert. Ein zusätzliches Problem ist, dass das Enzym RuBisCo (welches die CO2-Fixierung im Calvin-Zyklus durchführt) neben seiner Carboxylasefunktion auch eine Oxygenasefunktion besitzt. Ein niedriger CO2-Partialdruck, ein hoher O2-Partialdruck und hohe Temperaturen begünstigen die Oxygenasefunktion der RuBisCO. Bei der unerwünschten Oxidation wird Ribulose-1,5-bisphosphat verbraucht und muss über die sogenannte Photorespiration aufwendig regeneriert werden.
C4-Pflanzen begegnen dem Problem der Kohlenstoffdioxidbereitstellung durch einen besonderen Mechanismus. Aktiv und damit unter Energieverbrauch wird die CO2-Konzentration für die Fixierung erhöht. Hierbei findet eine räumliche Trennung (zwei Zelltypen: Mesophyllzellen und Leitbündelscheidenzellen) für die Vorfixierung und Metabolisierung von Kohlenstoffdioxid statt. Dies erlaubt den Pflanzen, ihre Spaltöffnungen teilweise zu schließen, da sie im Gegensatz zu C3-Pflanzen nicht durch die einfache Diffusion von Kohlenstoffdioxid in die Zellen eingeschränkt werden. Die nachgeschaltete CO2-Fixierung im Calvin-Zyklus entspricht jedoch derjenigen von C3-Pflanzen („Dunkelreaktion“). Die Arbeitsteilung beider Reaktionsräume setzt voraus, dass beide Gewebe über eine unterschiedliche Ausstattung beteiligter Enzyme verfügen.
Das vorfixierende Enzym PEP-Carboxylase besitzt eine viel höhere Affinität für CO2 als RuBisCO, die hier erst die sekundäre Fixierung durchführt. Da das erste fassbare Fixierungsprodukt ein C4-Körper ist, das Oxalacetat, wurde diese Bezeichnung zur Unterscheidung von den Pflanzen mit „normalem“ C3-Photosynthesestoffwechsel gewählt.
Die Vorfixierung der C4-Pflanzen ähnelt der der CAM-Pflanzen. Allerdings handelt es sich bei den letztgenannten um eine zeitliche Trennung von Vorfixierung und Calvin-Zyklus, während C4-Pflanzen eine räumliche Trennung durchführen.
Biochemie in der Mesophyllzelle
Der C4-Stoffwechsel funktioniert vom Prinzip her als vorgeschaltete CO2-Pumpe, die mit der Fixierung von CO2 in Form von Bicarbonat (HCO3−) in der Mesophyllzelle beginnt. Die Bildung von HCO3− aus CO2 wird durch eine Carboanhydrase katalysiert und vollzieht sich im Cytosol.
Eine Phosphoenolpyruvatcarboxylase (PEPC) katalysiert die irreversible Kondensation eines Moleküls Phosphoenolpyruvat (PEP) mit HCO3−, so dass neben Phosphat Oxalacetat entsteht. PEPC weist eine sehr hohe Affinität gegenüber PEP auf. Oxalacetat wird in L-Malat („Malatbildner“), bei manchen C4-Pflanzen auch in L-Aspartat umgesetzt. Das Kohlenstoffdioxid steht im Gleichgewicht mit dem CO2 des intrazellulären Raumes und damit schließlich zur Außenluft. Da es bereits in der Bündelscheidenzelle dem Gleichgewicht entzogen wird, erleichtert dies die Nachdiffusion. Zudem wird PEPC nicht durch Sauerstoff inhibiert.[4]
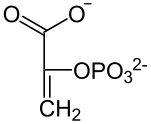 | HCO3−Pi PEP-C | 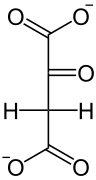 |
| Phosphoenolpyruvat (PEP) | Oxalacetat |
In die Mesophyllzelle zurücktransportiertes Pyruvat gelangt durch einen spezifischen Translokator in den Chloroplasten, hierbei werden Protonen oder Natriumionen mittransportiert.[23] Dort setzt eine Pyruvat-Phosphat-Dikinase Pyruvat zu PEP um. Bei dieser ungewöhnlichen Reaktion wird sowohl ATP als auch anorganisches Phosphat verbraucht. Tatsächlich wird das mittlere Phosphat aus ATP (Pβ) in Pyruvat eingebaut.
Das bei der Reaktion freigesetzte Pyrophosphat (PPi) wird durch eine Pyrophosphatase hydrolysiert, und damit thermodynamisch dem Gleichgewichts entzogen. Daher verläuft diese Katalyse irreversibel. PEP gelangt wiederum durch einen spezifischen Antiporter im Gegentausch mit anorganischem Phosphat (PEP-Phosphat-Translokator) ins Cytosol und kann damit wieder mit Bicarbonat kondensieren.[24]
Reaktionen in der Bündelscheidenzelle
Wie nun das Kohlenstoffdioxid wieder freigesetzt und in den Calvin-Zyklus eingespeist wird, ist bei C4-Pflanzen unterschiedlich. Es wurden bisher drei Grundtypen der C4-Photosynthese identifiziert, die sich zur Bereitstellung von CO2 während der Decarboxylierung in der Bündelscheidenzelle unterscheiden:[2][21]
- NADP+-Malatenzym-Typ (NADP-ME): Malat wird oxidativ in den Chloroplasten decarboxyliert, was ein NADP+-abhängiges Malatenzym katalysiert, dabei wird NADPH freigesetzt. Typische Vertreter sind Mais, Zuckerrohr oder Sorghumhirse.
- NAD+-Malatenzym-Typ (NAD-ME): Hier wird Malat in den Mitochondrien decarboxyliert, was ein NAD+-abhängiges Malatenzym unter Verbrauch von NAD+ katalysiert. Das freigesetzte Kohlenstoffdioxid diffundiert dabei in die Chloroplasten. Zurückgebogener Amarant, Rispenhirse oder Portulak betrieben diese Art der CO2-Freisetzung.
- PEP-Carboxykinase-Typ (PEPCK): Zwei Kreisläufe laufen hier parallel ab. Einmal wird Malat wie beim NAD-Typ in den Mitochondrien umgesetzt. Überwiegend wird Oxalacetat im Cytosol unter ATP-Verbrauch durch eine namensgebende PEP-Carboxykinase decarboxyliert. Dieser C4-Stoffwechseltyp findet sich in schnellwachsenden tropischen Gräsern wie beispielsweise in Guineagras (Megathyrsus maximus) oder Chloris gayana.
Während alle drei Typen viele Enzymreaktionen in der Mesophyllzelle gemeinsam haben (beispielsweise der Weg zu Oxalacetat und die Regeneration von PEP in den Chloroplasten), unterscheiden sie sich in der Freisetzung von CO2 in der Bündelscheidenzelle.
Nach der Freisetzung des CO2 werden Phosphoenolpyruvat (PEP) bzw. Pyruvat durch Plasmodesmen wieder zurück in die Mesophyllzelle transportiert. Bei Pflanzen mit dem NAD-Malat-Enzymtyp wird Pyruvat vorher durch Transaminierung zu L-Alanin umgewandelt und dieses dann transportiert.
Durch die Suberinschicht wird ein diffusionsverursachtes Zurückströmen von Kohlenstoffdioxid eingedämmt. Sollte CO2 doch in die Mesophyllzelle zurückgelangen, wird dieses durch die Carboanhydraseaktivität wieder eingefangen.
Der bidirektionale Stofftransport erfolgt über Diffusion. Dies setzt voraus, dass es einen ausreichend hohen Konzentrationsgradienten zwischen beiden Zellen geschaffen und aufrechterhalten wird.[25] Da die Übergangsmetabolite (z. B. Malat, Pyruvat) am Ort ihrer Bestimmung schnell verbraucht werden, kann dieser Konzentrationsgradient verwirklicht werden.
NADP-Malatenzym-Typ (NADP-ME)
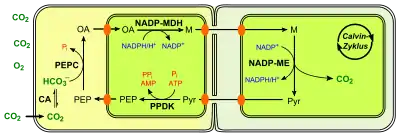
Der NADP-Malatenzym-Typ ist von allen drei Typen der einfachste. Nachdem Oxalacetat im Cytosol der Mesophyllzelle gebildet wurde, wird dieses durch einen spezifischen Translokator (Oxalacetat/Malat-Antiporter[23]) in die Chloroplasten gebracht. Dort setzt eine NADP+-abhängige Malatdehydrogenase (EC 1.1.1.82) Oxalacetat unter Verbrauch von NADP zu L-Malat um. Nachdem es wieder aus den Chloroplasten gelangt ist, passiert es die Plasmodesmen zu den Bündelscheidenzellen und wird in die Chloroplasten transportiert. Dort decarboxyliert das namensgebende NADP+-abhängige Malatenzym Malat zu Pyruvat, wobei NADP+ reduziert wird. Über einen spezifischen Translokator verlässt Pyruvat den Chloroplasten und gelangt durch die Plasmodesmen zurück in die Mesophyllzelle. In den Chloroplasten wird dieses wie oben beschrieben zu PEP konvertiert und der Kreislauf geschlossen.
Bei Pflanzen mit dem NADP-abhängigen Malatenzym finden sich in deren Bündelscheidenzellen oft relativ große Chloroplasten[24] und kaum Mitochondrien.[26] Darüber hinaus variiert die Menge an Granastapel von nicht vorhanden (z. B. bei Zuckerrohr und Hirse) bis halb so viele im Vergleich zur Mesophyllzelle (Fuchsschwanzgewächse); Stromalamellen sind aber vorhanden. Dementsprechend ist bei ihnen das Photosystem II (PS II) kaum aktiv, welches normalerweise in den Granamembranen der Thylakoide lokalisiert ist. Zum einen wird dadurch kaum Sauerstoff durch die Photosynthese erzeugt, was das Risiko der Photorespiration weiter senkt. Zum anderen fehlt die Möglichkeit zum linearen Elektronen-Transport der Lichtreaktion der Photosynthese, der normalerweise das im Calvin-Zyklus benötigte NADPH erzeugt. Mit nur einem aktiven Photosystem (Photosystem I) wird in erster Linie zyklische Photophosphorylierung betrieben, so dass ATP erzeugt wird.[27] NADPH muss daher aus der Mesophyllzelle durch die Lichtreaktion der Photosynthese bereitgestellt werden. Es wird aber nicht direkt in die Bündelscheidenzelle transportiert. Stattdessen wird es (zusammen mit ATP) über einen Triosephosphat-3-Phosphoglycerat-Shuttle indirekt in die Chloroplasten der Bündelscheidenzellen transferiert. Hierbei dient in der Regel Dihydroxyacetonphosphat.[28] Alternativ entsteht NADPH im Zuge des C4-Stoffwechsels, wenn Malat in der Bündelscheidenzelle zu Pyruvat decarboxyliert wird.
NAD-Malatenzym-Typ (NAD-ME)
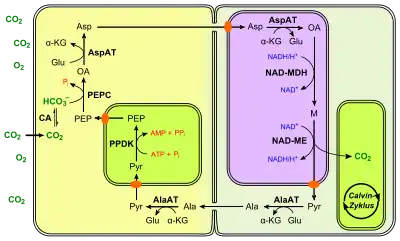
Dieser Typ ist etwas komplizierter als der NADP-ME-Weg. In den Mesophyllzellen setzt hierbei eine cytosolische Aspartat-Aminotransferase Oxalacetat zu L-Aspartat um. Dafür wird die Aminogruppe von L-Glutamat genutzt, so dass daraus α-Ketoglutarat wird. Anstatt Malat dient also Aspartat als Vehikel für den Kohlenstofftransport. Das gebildete Aspartat gelangt über die Plasmodesmen in die Bündelscheidenzelle und wird dort in die Mitochondrien transportiert. Dort wird es zunächst durch ein mitochondrielles Isoenzym zu Oxalacetat zurückverwandelt, wobei gleichzeitig α-Ketoglutarat zu L-Glutamat reagiert. Anschließend wird Oxalacetat durch eine mitochondrielle NAD+-abhängige Malatdehydrogenase unter Verbrauch von NADH zu Malat reduziert. Schließlich erfolgt die Freisetzung von CO2 durch das namensgebende NAD+-abhängige Malatenzym (EC 1.1.1.39) und diffundiert die in enger Nachbarschaft befindlichen Chloroplasten. Das bei dieser Reaktion gewonnene NADH steht dadurch für die Oxidation von Oxalacetat wieder zur Verfügung. Im Gegensatz zum NADP-ME-Typ wird das erzeugte Pyruvat nicht direkt über Plasmodesmen zurück in die Mesophyllzelle gebracht, sondern als L-Alanin. Dieses wird in beiden Zellen durch eine Alanin-Aminotransferase wechselseitig umgewandelt, wobei hier ebenfalls L-Glutamat als Aminodonor fungiert. Pyruvat wird wie vorher beschrieben schließlich zu PEP regeneriert. Durch die unterschiedlichen Konzentrationsgefälle erfolgt eine gerichtete Diffusion in die Mesophyllzelle.
Die Chloroplasten der Bündelscheidenzellen weisen im Gegensatz zum NADP-Typ eine hohe PS II-Aktivität auf.[29] Außerdem sind viel mehr und öfters auch größere Mitochondrien enthalten.[26]
PEP-Carboxykinase-Typ (PEPCK)
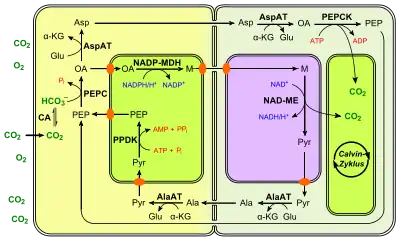
Der PEPCK-Weg ist der komplexeste von allen drei Wegen, da hier zwei Zyklen parallel ablaufen.
Der eine weitaus stärker betriebene Kreislauf beruht auf einen Transport von L-Aspartat. Dieses entsteht durch eine cytosolische Aspartat-Aminotransferase aus Oxalacetat ähnlich wie beim NAD-ME-Typ. L-Aspartat wird über die Plasmodesmen in die Bündelscheidenzelle transportiert und dort zunächst zu Oxalacetat umgesetzt (ebenfalls durch eine cytosolische Aspartat-Aminotransferase). Der diesem Subtyp zugrunde liegende Name beruht auf eine Reaktion, bei der Oxalacetat zu PEP decarboxyliert wird. Dies wird nämlich durch eine PEP-Carboxykinase (EC 4.1.1.49) unter ATP-Verbrauch katalysiert. PEP diffundiert ohne weitere Reaktion zurück in die Mesophyllzelle und schließt dort den Kreislauf.
Der zweite betriebene Weg ähnelt dem NADP-ME-Weg. Cytosolisch erzeugtes Oxalacetat wird in den Chloroplasten der Mesophyllzelle zu L-Malat umgesetzt, was eine NADP+-abhängige Malatdehydrogenase unter NADPH-Verbrauch katalysiert. Dieses gelangt über die Plasmodesmen in die Bündelscheidenzelle, wird aber im Gegensatz zum NADP-ME-Weg in die Mitochondrien transportiert. Dort setzt ein NAD+-abhängiges Malatenzym Kohlenstoffdioxid frei (analog wie beim NAD-ME-Weg). Beim PEPCK-Typ ist der ATP-Bedarf der Bündelscheidenzellen durch die PEPCK-Reaktion erhöht. Um diesen zu decken, nutzen die Mitochondrien das freigesetzte NADH für die Atmungskette zur ATP-Synthese.[24] Aus den Mitochondrien gebrachtes Pyruvat passiert nicht direkt die Plasmodesmen zurück in die Mesophyllzelle, sondern über Alanin. Dieses wird – wie beim NAD-ME-Weg – über die wechselseitige Umsetzung durch eine Alanin-Aminotransferase umgewandelt.
Die Grana in den Chloroplasten von Mesophyll- und Bündelscheidenzelle sind etwas gleich stark ausgeprägt.[26]
Regulation
Drei für die Arbeitsteilung notwendige Schlüsselenzyme werden durch Licht reguliert, so dass der zugrunde liegende C4-Stoffwechsel nur am Tag durchgeführt wird.[30]
- So liegt die PEP-Carboxylase (PEPC) während der Nacht in einer inaktiven Form vor. Gegenüber seinem Substrat PEP ist die Affinität stark herabgesetzt. Außerdem wird PEPC effektiv durch Malat gehemmt. Dies soll verhindern, dass PEP unnötigerweise irreversibel verbraucht wird. Die Enzymaktivität wird jedoch – analog wie bei CAM-Pflanzen – zusätzlich durch reversible Phosphorylierung an einem Serinrest reguliert. Am Tag wird hierbei eine Protein-Serin-Kinase aktiviert, die ihrerseits Phosphatgruppen auf PEPC überträgt. Dies hat zur Folge, dass unter Belichtung PEPC in seine katalytische aktive Form überführt wird. Die aktive, phosphorylierte Form ist auch wesentlich unempfindlicher gegenüber Malat. In der Dunkelheit dephosphoryliert eine zuständige Phosphatase PEPC und inaktiviert sie damit.
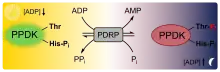
- Die Pyruvat-Phosphat-Dikinase (PPDK) wird ebenfalls über eine Phosphorylierung durch Licht reguliert. Dies erfolgt durch eine bifunktionelle Serin/Threoninkinase – dem Regulatorprotein (PDRP oder kurz RP[31]). Es katalysiert sowohl die Übertragung einer Phosphatgruppe auf ein Threoninrest der PPDK (Kinasefunktion) als auch deren Entfernung (Phosphatasefunktion). Interessanterweise verwendet das Regulatorprotein im Gegensatz zu den meisten Kinasen nicht ATP, sondern ADP als P-Donor. Darüber hinaus erfolgt die Dephosphorylierung nicht wie bei den meisten Phosphatasen mittels Wassers, sondern durch anorganisches Phosphat.[32] Die phosphorylierte Form von PPDK ist – im Gegensatz zu PEPC – inaktiv. ADP, das Substrat für die Kinase, ist gleichzeitig ein starker kompetitiver Inhibitor der Phosphatase. Daher wird PDRP durch den ADP-Level des Stroma reguliert: Unter Belichtung ist die ADP-Konzentration gering, im Dunkeln dagegen hoch. Infolgedessen wird PPDK unter Licht dephosphoryliert und damit eingeschaltet. Im Dunkeln passiert es andersherum, PDRP phosphoryliert PPDK, dieses wird dadurch inaktiviert.[31]
- Ein anderer Kontrollmechanismus findet sich bei der NADP-Malatdehydrogenase. Ähnlich wie andere chloroplastidäre Enzyme (z. B. Ribulosephosphatkinase oder Fructose-1,6-bisphosphatase) wird diese lichtabhängig durch den Redoxzustand reguliert. Hierbei vermittelt reduziertes Thioredoxin deren Aktivierung, indem eine Disulfidbrücke (–S–S–) an der Außenseite des jeweiligen Proteins jeweils zu Cystein (–SH) reduziert wird. Jenes Thioredoxin selbst wird durch Ferredoxin gebildet, was eine Ferredoxin-Thioredoxin-Reduktase katalysiert. Ferredoxine werden nur unter Belichtung im Photosystem I erzeugt.
Besondere Formen der C4-Photosynthese
C4-Photosynthese ohne Kranz-Anatomie
Es wurden Landpflanzen entdeckt, die zwar eine C4-Photosynthese betreiben, jedoch keine Kranz-Anatomie wie die meisten C4-Pflanzen aufweisen. Vier Arten, die zur Familie der Gänsefußgewächse gehören, Bienertia sinuspersici, Bienertia cycloptera, Suaeda aralocaspica und Bienertia kavirense, vollführen diesen Stoffwechselweg innerhalb einer Zelle.[26][33]
Diese Pflanzen wachsen in Wüstengegenden: Bienertia sinuspersici in Ländern um den persischen Golf, Bienertia cycloptera in der Region Türkei, Afghanistan und Iran, Bienertia kavirense in der iranischen Salzwüste (Dascht-e Kawir) und Suaeda aralocaspica, eine Salzpflanze, in Zentralasien.
Die C4-Photosynthese wird wie bei C4-Pflanzen mit Kranzanatomie durch eine räumliche Aufteilung von CO2-Vorfixierung und eigentlicher Endfixierung im Calvin-Zyklus erreicht, wobei dies hier intrazellulär erfolgt. Bei den oben genannten Pflanzen liegt eine C4-Photosynthese des Typs NAD-ME vor.
In Suaeda aralocaspica findet man lange Palisadenparenchymzellen, bei denen der nach außen gelegene (distale) Bereich zur CO2-Vorfixierung dient und bei der der nach innen gelegene (proximale) Bereich zur Fixierung im Calvin-Zyklus. Eine große Vakuole trennt beide Reaktionsräume.[23] Die Bienertia-Arten zeigen einen anderen Aufbau. Dort gibt es ein dünnes cytosolisches Kompartiment am Rand und ein ungewöhnliches zentrales Kompartiment mit vielen Chloroplasten in der Mitte. Auch hier erfolgt eine der Kranzanatomie analoge räumliche Aufteilung zwischen Vorfixierung durch PEP und Fixierung durch RuBisCO.
Bei der innerhalb einer Zelle stattfindenden C4-Photosynthese gibt es zwei verschiedene Arten von Chloroplasten („dimorphogene Chloroplasten“), die sich in ihrer Biochemie, dem Speichern von Stärke und in der Ultrastruktur unterscheiden. So sind die Grana bei den nach außen liegenden Chloroplasten schlechter entwickelt, sie speichern kaum Stärke und das Enzym PPDK ist dort zum Aufbau von PEP aktiv. Die anderen, nach „innen“ liegenden Chloroplasten, verfügen über RuBisCO, gut entwickelten Grana und speichern Stärke. Diese Unterschiede sind analog derer wie bei den jeweiligen Chloroplasten in Mesophyllzellen und Bündelscheidenzellen. Das Zytoskelett gewährleistet die Trennung dieser funktionell unterschiedlichen Chloroplasten innerhalb der Zelle.
Mit den „inneren“ Chloroplasten sind auch Mitochondrien und Peroxisomen vergesellschaftet. Damit wird bei der Decarboxylierung von Malat das freiwerdende Kohlenstoffdioxid in unmittelbare Nähe zu RuBisCO gebracht. Außerdem erhöht sich die Wahrscheinlichkeit, dass das während des photorespiratorischen Stoffwechselweges freigesetzte Kohlenstoffdioxid gleich refixiert wird.
Vermutlich führen auch die marine Makroalge Udotea flabellum und die einzellige Kieselalge Thalassiosira weissflogii eine C4-Photosynthese innerhalb derselben Zelle durch.
Fakultative C4-Photosynthese

In der Grundnessel, eine Süßwasserpflanze, wurde eine C4-Photosynthese identifiziert, obwohl sie keine Kranzanatomie aufweist. Wenn der CO2-Gehalt des Wassers hoch ist, findet eine C3-Photosynthese statt. Die Grundnessel schaltet bei sinkenden CO2-Konzentrationen auf einen C4-Stoffwechsel um, so dass man hier von einer fakultativen C4-Pflanze spricht.[34]
Obwohl HCO3− in Gewässern in höherer Konzentration vorliegt als CO2, nimmt die Pflanze Kohlenstoffdioxid auf. Dies liegt daran, dass ihre adaxialen Wände einen niedrigen pH-Wert haben, womit sich das Gleichgewicht von HCO3− und CO2 zugunsten CO2 verschoben wird. CO2 wird vorfixiert und in einem C4-Stoffwechsel des NADP-ME-Typs in den Chloroplasten gebracht und dort angereichert.
Bei hohen Temperaturen hat der CO2-konzentrierende C4-Stoffwechsel der Grundnessel Vorteile gegenüber anderen C3-Süßwasserpflanzen. Während des Tages steigt der O2-Gehalt des Wassers an, während der CO2-Gehalt sinkt. Zudem kann CO2 nicht so schnell in Wasser diffundieren wie in der Luft, die Verluste durch Photorespiration steigen. Die Grundnessel vermag trotzdem eine effiziente Photosynthese zu betreiben.
Ein weiterer Vertreter ist beispielsweise die Regenschirmsimse (Eleocharis vivipara), eine zu den Sumpfbinsen gehörige Wasserpflanze. Im untergetauchten Zustand betreibt sie eine C3-Photosynthese. Sie schaltet aber auf C4 um, sobald sie am Land wächst. Auch einzelne Halme oberhalb der Wasseroberfläche können auf eine C4-Photosynthese umschalten.[35]
C4-CAM-Intermediäre

Der Crassulaceen-Säurestoffwechsel (CAM) ist wie die C4-Photosynthese eine CO2-Anreicherungspumpe. Die Vor- und Endfixierung von CO2 jedoch erfolgen nicht räumlich wie bei C4-Pflanzen, sondern beide Vorgänge sind bei zeitlich voneinander getrennt. Dabei betreiben CAM-Pflanzen parallel auch eine klassische C3-Photosynthese. Dies geschieht beispielsweise in Phase II und IV obligater CAM-Pflanzen. Alternativ wurden C3-CAM-Arten entdeckt, die erst nach einem induzierten Schlüsselreiz wie Trockenheit oder Salinität in den CAM-Modus wechseln. In allen Fällen betreibt dieselbe Pflanzenzelle sowohl CAM als auch einen C3-Stoffwechsel.
Für C4-Pflanzen gibt es im Gegensatz dazu nur sehr wenige Beispiele, dass CAM und C4-Stoffwechsel innerhalb derselben Pflanze durchgeführt werden. Der Großteil der C4-Pflanzen sind Gräser, bei denen kein CAM auftritt, während man bei typischen CAM-Pflanzen wie Orchideen oder Bromeliengewächse nie eine C4-Photosynthese nachgewiesen hat. So hat man nur in der Familie der Portulakgewächse wenige Arten entdeckt, die beide Stoffwechselwege nutzen können, beispielsweise Portulakröschen, Sommer-Portulak oder Portulaca mundula.[36] CAM läuft dabei in den sukkulenten Zellen im Inneren von Stamm und Blatt ab, während die C4-Photosynthese in den nach außen liegenden Blattzellen dominiert. Daher werden beide Stoffwechselwege nicht innerhalb derselben Zelle betrieben, was darauf hinweist, dass CAM und C4-Photosynthese inkompatibel sind.[37]
Hierfür werden mehrere Gründe genannt. So ist es biochemisch schwierig, beide Stoffwechselwege gerade aufgrund ihrer Ähnlichkeit zu regulieren. Darüber hinaus liegen für beide Wege unterschiedliche anatomische Charakteristika und Transportmechanismen zugrunde. Diese Spezialisierungen sind für die Funktion essentiell, lassen sich aber nicht kombinieren. Schließlich ergeben zwei gleichzeitige CO2-Konzentrierungsmaßnahmen innerhalb eines Blattes keinen ökologischen Vorteil. Außerdem verlaufen die ersten evolutionären Entwicklungsschritte aus C3-Pflanzen grundverschieden.
„C3-C4-intermediäre Pflanzen“
Eine Reihe von C3-Pflanzen teilen grundlegende Eigenschaften einer C4-Pflanze. So weisen sie eine C4-typische anatomische Organisation der Blätter mit grünem Mesophyll- und Bündelscheidengewebe auf und konzentrieren Kohlenstoffdioxid tatsächlich auch in den Bündelscheiden. Darüber hinaus liegt ihr CO2-Kompensationspunkt zwischen C3- und C4-Pflanzen.[38] Auf der anderen Seite betreiben diese keinen charakteristischen Transport von C4-Dicarbonsäuren wie alle C4-Pflanzen.
Fälschlicherweise wurden solche Pflanzen aufgrund ihrer anatomischen Ähnlichkeit als „C3-C4-(intermediäre) Pflanzen“ oder C3-C4-Mischformen bezeichnet, dies ist jedoch aufgrund der biochemischen Unterschiede und des grundverschieden gearteten CO2-Konzentrierungsmechanismus nicht angemessen.[39]
Biochemische Grundlage dieser Pflanzen ist die sogenannte C2-Photosynthese, die auf photorespiratorische Vorgänge beruht. Wenn RuBisCO Sauerstoff anstatt Kohlenstoffdioxid als Substrat verwendet, entsteht 2-Phosphoglycerat, das in einem aufwendigen Prozess regeneriert wird. Im Zuge der Photorespiration werden u. a. zwei Moleküle Glycin zu Serin und CO2 durch den Glycin-Decarboxylase-Komplex (GDC) umgesetzt. In Pflanzen mit C2-(und C4-)Photosynthese ist GDC nur in den Bündelscheidenzellen lokalisiert und aktiv, so dass das aus den Mesophyllzellen transportierte Glycin dort decarboxyliert und um die Chloroplasten angereichert wird. Durch diesen Shuttletransport von Glycin, einer C2-Verbindung, hat man diese besondere Form des Stoffwechsels als „C2-Photosynthese“ bezeichnet. Der Vorteil dieses C2-Shuttles ist die Tatsache, dass – sollte CO2 doch freigesetzt werden – es einen sehr weiten Diffusionsweg durch mehrere Zellen zum Blattäußeren hätte. Dies erhöht die Chance für ein Wiedereinfangen erheblich. Darüber hinaus wird CO2 durch die GDC-Aktivität in der Bündelscheidenzelle lokal konzentriert, so dass dort die Photorespiration signifikant reduziert wird.
C2-Pflanzen wurden beispielsweise in den Gattungen der Salzkräuter, Sonnenwenden, Rispenhirsen, Flaveria sowie Moricandia entdeckt. Der überwiegende untersuchte Teil sind Eudikotyledonen, obwohl die meisten C4-Pflanzen zu den Monokotyledonen zählen.[40]
Nach neuerer Definition werden unter C3-C4-intermediäre Pflanzen nicht nur Pflanzen angesehen, die eine C2-Photosynthese betreiben. Sondern es werden darunter auch Pflanzen aufgeführt, die phylogenetisch generell zwischen reinen C3- und C4-Pflanzen stehen.[41]
Bedeutung
Ökophysiologische Aspekte
Die Evolution des C4-Stoffwechsels ist eine biochemische Anpassung auf die sinkende CO2-Konzentration der Atmosphäre. Durch den C4-Stoffwechsel mit seiner aktiven CO2-Pumpe genießt die Pflanze damit mehrere ökologische Vorteile gegenüber C3-Pflanzen, da unter Energieverbrauch die Kohlenstoffdioxidkonzentration um RuBisCO stark erhöht wird. Dies mindert zum einen erheblich photorespiratorische Verluste. Während C3-Pflanzen mindestens 30 % des photosynthetisch gewonnenen Kohlenstoffdioxids verlieren, können C4-Pflanzen die Photorespiration selbst unter steigenden Temperaturen vermeiden. Dieser ökophysiologische Vorteil kommt besonders bei Temperaturen über 25 °C zum Tragen, so dass C4-Pflanzen in heißen Klimazonen große Verbreitung finden.[42] Bei steigender Temperatur löst sich Sauerstoff besser im Vergleich zu CO2, so dass es bei C3-Pflanzen zu größeren Verlusten durch Photorespiration aufgrund der Oxygenaseaktivität der RuBisCO kommt, die bei C4-Pflanzen reduziert bis vollständig unterdrückt werden kann. In diesen Gegenden beginnen die negativen Auswirkungen der Photorespiration von C3-Pflanzen damit am stärksten zu wirken. Auch innerhalb eines Jahres verursachen trockene und heiße Sommer einen Wechsel von C3- auf C4-Gräsern auf beispielsweise Rasenflächen: Im kühlen Frühjahr dominiert das Wiesen-Rispengras oder das Rote Straußgras, die aber bei hohen Sommertemperaturen von C4-Gräsern wie der Blutrote Fingerhirse überwachsen werden.[4]
Darüber hinaus begünstigt der C4-Stoffwechsel unter natürlichen Wachstumsbedingungen den Stickstoffbedarf. Für C4-Pflanzen ist er niedriger, da sie weniger RuBisCO benötigen.[4] Diese kann nämlich aufgrund der höheren CO2-Sättigung (70 µmol/Liter) effizienter arbeiten, Verluste durch Photorespiration sind minimal. Das RuBisCO der C3-Pflanzen dagegen muss mit rund 10-mal niedrigeren CO2-Konzentrationen auskommen, so dass das Enzym weit unterhalb der maximalen Reaktionsgeschwindigkeit arbeitet.[42] Sie versuchen dies auszugleichen, indem sie in ihren Chloroplasten hohe Mengen des Enzyms anhäufen. Man hat berechnet, dass bei 30 °C ein C4-Blatt etwa 13–20 % der Menge an RubisCO eines C3-Blattes benötigt, um dieselbe Photosyntheserate (bei gesättigter Lichtstärke) zu erreichen.[43] Es muss dabei aber angemerkt werden, dass typische C4-Enzyme – wie die PPDK und PEPC – einen erhöhten Stickstoffbedarf nach sich ziehen. Insgesamt schätzt man, dass die sogenannte Stickstoffnutzungseffizienz (NUE, nitrogen use efficiency) in C4-Pflanzen mindestens doppelt so hoch ist wie in C3-Pflanzen. Wachsende Aufmerksamkeit gewinnen auch tropische C4-Futtergräser, die mit stickstofffixierenden Bakterien vergesellschaftet sind und somit kaum einer zusätzlichen Düngung bedürfen.
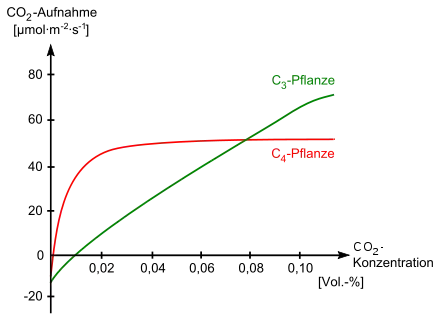
Die aktive Erhöhung des Kohlenstoffdioxids wirkt sich auf die CO2-Sättingungskurve und dem CO2-Kompensationspunkt aus. Letzterer ist bei C4-Pflanzen mit 0,0005 Volumen-% oder geringer weitaus niedriger als bei C3-Pflanzen mit 0,0100 Volumen-%. Sinkende CO2-Konzentrationen begünstigen daher C4-Pflanzen; zieht man beispielsweise in einem geschlossenen Behälter eine C3- und eine C4-Pflanze unter Dauerlicht an, konkurrieren zwar beide um Kohlenstoffdioxid. Dies gelingt der C4-Pflanze besser, so dass sie die C3-Pflanze tatsächlich zum Absterben bringt. Dagegen lässt sich mit einer Erhöhung der CO2-Konzentration keine Steigerung der Photosyntheseleistung von C4-Pflanzen beobachten. Steigende CO2-Werte in der Atmosphäre begünstigen vielmehr C3-Pflanzen.[44] Dies liegt daran, dass im Gegensatz zum C4-Stoffwechsel der C3-Stoffwechsel immer abhängig von der Diffusionsgeschwindigkeit des Kohlenstoffdioxids ist. Amaranthus palmeri hat weltweit die höchste Photosyntheserate, diese beträgt 80 µmol CO2·m−2·s−1 bei einer Kohlenstoffdioxidkonzentration von 325 µmol·mol−1 CO2 (im Vergleich weist Mais eine von 60 µmol·m−2·s−1 auf, bei Weizen und Reis liegen diese bei 35 µmol·m−2·s−1).[1]
C4-Pflanzen sind den meisten C3-Pflanzen dadurch überlegen, dass sie durch ihre Kohlenstoffdioxidanreicherung Wasser ökonomischer nutzen können (WUE, water use efficiency, dt.: Wassernutzungseffizienz): Die optimale Wachstumstemperatur liegt zwischen 30 und 40 °C, für C3-Pflanzen dagegen bei 20 bis 30 °C.[6] Die im Death Valley vorkommende krautige C4-Pflanze Tidestromia oblongifolia erreicht ihr Photosynthesemaximum bei Temperaturen von 45 bis 50 °C.[45] C4-Pflanzen können ihre Stomata über einen längeren Zeitpunkt weitgehend, aber nicht vollständig schließen, um damit den Wasserverlust ohne Gefährdung der Kohlenstoffbilanz zu senken. Während C4-Pflanzen zur Bildung von 1 g Trockenmasse 230 bis 250 ml Wasser benötigen, liegt der Bedarf für C3-Pflanzen zwei- bis dreimal so hoch.
Aufgrund der CO2-Pumpe ist der Energiebedarf von C4-Pflanzen höher als bei C3-Pflanzen. So beträgt er beim NADP-ME-Typ und NAD-ME-Typ 5 ATP und 2 NADPH pro fixiertem CO2-Molekül. C3-Pflanzen benötigen 3 ATP und 2 NADPH pro fixiertem CO2-Molekül, wobei diese Werte die photorespiratorischen Verluste außer Acht lassen. C4-Pflanzen des PEPCK-Typs benötigen 3,6 ATP und 2,3 NADPH pro fixiertem CO2-Molekül.[26] Durch verstärkte zyklische Photophosphorylierung (Photosystem I) können aber auch leicht ATP zur Verfügung gestellt werden.[17] Aufgrund des erhöhten Energiebedarfs benötigen C4-Pflanzen im Vergleich zu C3-Pflanzen mehr Licht. Dies erklärt, warum man sie in stark besonnten Standorten bevorzugt findet. Auch der Lichtkompensationspunkt ist im Vergleich zu C3-Pflanzen höher, jedoch findet keine Sättigung unter natürlichen Lichtbedingungen statt.
In kühlen und kalten Klimazonen treten dagegen sehr wenige C4-Pflanzen auf und sind anscheinend den C3-Pflanzen unterlegen.[6] Zunächst wurde postuliert, dass der C4-Stoffwechsel an Kälte schlecht angepasst sei, während er bei hohen Temperaturen Vorteile zeigt. Hierfür wurden zunächst physiologische Gründe aufgeführt, beispielsweise wegen einer Labilität der am C4-Stoffwechsel beteiligten Enzyme. Eine andere Theorie geht davon aus, dass alle C4-Pflanzen ursprünglich von C3-Pflanzen entstanden sind, die sich an heiße und trockene Klimazonen angepasst haben. Daher konnten die daraus entstandenen Pflanzen sich nicht mehr in kalten Regionen ausbreiten. Da einige C4-Pflanzen dennoch eine gewisse Kältetoleranz entwickelt haben, ist Kälte an sich anscheinend keine unüberwindbare Barriere. Jene Pflanzen benötigen aber trotzdem warme oder saline Mikrohabitate, beispielsweise südliche alpine Hänge, die während des Tages ausreichend besonnt werden und somit warm genug sind.
Ökonomische Aspekte
C4-Pflanzen können zur Produktion von Biomasse für die Energiegewinnung genutzt werden. Chinaschilf erreicht Erträge von 15 bis 25 Tonnen Trockenmasse je Hektar und Jahr.[46] In den USA dient Mais, in Brasilien hauptsächlich Zuckerrohr als Grundlage für Biokraftstoff. Alternativ werden kältetolerante C4-Gräser wie Rutenhirse zur Herstellung von Cellulose-Ethanol diskutiert.[43] Unter künstlich optimierten Bedingungen, beispielsweise durch ausreichende Bewässerung, lassen sich generell die Produktivitätsraten von C4-Pflanzen steigern. So zählen Mais- oder Zuckerrohrplantagen, falls ausreichend gedüngt und bewässert, zu den produktivsten landwirtschaftlichen Ökosystemen.[47]
Ein Problem der wachsenden Weltbevölkerung (Überbevölkerung) ist die Verknappung der Lebensmittelvorräte, zumal immer weniger Land für eine landwirtschaftliche Nutzung verfügbar sein wird. Eine Möglichkeit, um die Ernteerträge zu steigern, könnte durch die C4-Photosynthese realisiert werden. Insbesondere in wärmeren Regionen der Welt ist sie von Vorteil, da dort C3-Pflanzen, wie beispielsweise Reis, C4-Pflanzen immer in ihrer Photosytheseproduktivität unterlegen sind. Ein Ansatz hierfür liegt darin, bereits in der Natur vorhandene, jedoch nicht landwirtschaftlich nutzbare C4-Pflanzen wie Hühnerhirse zu Reis-ähnlichen Getreide zu züchten.[48] Hühnerhirse nutzt eine C4-Photosynthese des Types PEPCK.
Alternativ gibt es Überlegungen und Versuche, bei C3-Pflanzen die Photosyntheserate durch Einbringen verschiedener Gene aus C4-Pflanzen zu erhöhen, beispielsweise beim Reis („C4-Reis“[49]). Bisher waren sie wenig erfolgversprechend.[48] Ein Grund, warum Reis oder nahe Verwandte keine C4-Photosynthese ausbilden konnten, liegt darin, dass es nur ein einziges C4-verwandtes PEPC-Enzym gibt. Dieses ist aber spezifisch an der Ammoniumassimilation im Chloroplasten beteiligt, so dass es schlecht für eine andere Aufgabe genutzt werden kann. Dies behindert auch ein evolutionären Ausprägung in Richtung C4-Photosynthese.[50]
Prinzipiell sind zwei Wege möglich, um eine C3-Pflanze in eine C4-Pflanze zu transformieren und damit die Produktivität zu steigern:
- Entweder geht man von einem Einzellenmodell aus, bei der die C4-Photosynthese nicht wie üblich in zwei verschiedenen Zellen stattfindet, sondern innerhalb derselben Zelle. Auch in der Natur gibt es Pflanzen, die die räumliche Trennung zwischen CO2-Vorfixierung und Calvin-Zyklus in ein und derselben Zelle bewerkstelligen (siehe Abschnitt oben). Für die Umwandlung müsste man verschiedene Schritte durchführen, um C4-spezifische Eigenschaften in die Zelle zu bringen. So soll u. a. das Carboxylierungsenzym PEPC im Cytosol vorliegen, die Carboanhydrase-Aktivität von Chloroplasten ins Cytosol verlegt, effiziente Transporter in der Chloroplastenmembran eingeführt und eine räumliche Trennung von PEPC und RuBisCO erreichen werden.
- Oder man geht von einem Zweizellenmodell aus, bei dem versucht wird, eine anatomische Spezialisierung mit Kranz-Anatomie wie bei den meisten C4-Pflanzen zu erreichen. Hierfür wären aber sehr viel mehr genetische Eingriffe als beim Einzellenmodell erforderlich, zumal auch ein neuer spezialisierter Zelltyp gebildet werden müsste.
Isotopendiskriminierung
C4-Pflanzen lassen sich durch das Verhältnis der beiden Kohlenstoffisotope 12C und 13C erkennen. Die beiden Isotope kommen in der Erdatmosphäre mit 98,89 % und 1,11 % vor[51] (das radioaktive Isotop 14C spielt in diesem Zusammenhang keine Rolle[52]). Obwohl sich die chemischen Eigenschaften von 12CO2 und 13CO2 gleichen, reagiert RuBisCO mit dem leichteren Kohlenstoffisotop schneller. Der Grund ist zum einen, dass das schwerere 13CO2 langsamer diffundiert. Zum anderen hat RuBisCO einen intrinsischen Diskriminierungswert gegenüber 13CO2.[53] In C3-Pflanzen ist durch diese Isotopendiskriminierung das 12C/13C Verhältnis höher als in der Atmosphäre.
Das Verhältnis wird durch einen Quotienten, den δ-13C-Wert, ausgedrückt:
Als Standard ist ein bestimmtes Kalkgestein definiert (Pee Dee Belemnite), der Wert in der Probe wird massenspektrometrisch bestimmt. Produkte der C3-Photosynthese besitzen δ-13C-Werte von durchschnittlich −28 ‰.
Die PEP-Carboxylase präferiert 12CO2 weniger stark als RubisCO, in C4-Pflanzen wird jedoch fast das gesamte CO2 durch die PEP-Carboxylase vorfixiert. Durch die hohe interne CO2-Konzentration in den Bündelscheidenzellen kommt auch die Diskriminierung der RubisCO nicht zum Tragen. Daraus ergibt sich für C4-Pflanzen ein δ-13C-Wert von durchschnittlich −14 ‰.
Durch Bestimmung des δ-13C-Wertes mittels Massenspektrometrie kann man daher die Photosyntheseprodukte aus C3- und C4-Pflanzen unterscheiden, was vielfach genutzt wird. In der Lebensmittelanalyse kann damit die Herkunft des Zuckers (Saccharose) bestimmt werden, beispielsweise, ob Zucker aus der Zuckerrübe (C3) oder aus Zuckerrohr (C4) stammt oder Honig mittels Rohrzucker „gestreckt“ wurde.[54] Durch Analyse der (fossilen) Proben aus Fett, Knochen oder Zähnen von Tieren können Rückschlüsse daraus gezogen werden, ob und wann sie Weidegründe mit beispielsweise C4-Pflanzen genutzt haben. Dies lässt sich auch mit Untersuchungen aus Bodenproben kombinieren, so dass historische Vegetationsänderungen, wie beispielsweise ein Wechsel von C3- zu C4-Gräsern, belegt werden können.[55]
Vergleich zwischen C3-, C4- und CAM-Pflanzen
| Merkmal | C3 | C4 | CAM |
|---|---|---|---|
| Transpirationsquotient [ml (H2O) pro g (C)] | 450–900 | 250–350 | 18–100 (während der Nacht) bzw. 150–600 (während des Tages) |
| Wassernutzungseffizienz (erzeugtes Trockengewicht in g pro g Wasserverlust) | 1,05–2,22 | 2,85–4,00 | 8,0–55,0 |
| maximale Photosyntheserate [µmol fixiertes CO2 / Blattfläche m2 · Sekunde] | 20–40 | 30–60 | 5–12 (im Licht) bzw. 6–10 (im Dunkeln) |
| Temperaturoptimum | 15–25 °C | 30–47 °C | 35 °C |
| Zugewinn an Trockenmasse ([Tonnen / Hektar · Jahr]) | 10–25 | 40–80 | 6–10 |
| δ-13C-Werte | −32 bis −20 ‰ | −17 bis −9 ‰ | −17 bis −9 ‰ (Trockenheit) bzw. −32 bis −20 ‰ (gut versorgt mit H2O) |
Evolution
Auftreten und Ausbreitung erster C4-Pflanzen
Das erste Auftreten von C4-Pflanzen ist noch Gegenstand der Forschung. Für die Datierung werden verschiedene Techniken wie DNA-Analysen (phylogenetische Studien), geochemische Signale (z. B. das Isotopenverhältnis von 12C und 13C), Fossile und Mikrofossile (Pollen, Phytolithe) genutzt. Der C4-Metabolismus ist in 19 Pflanzenfamilien bis zu 61 Mal unabhängig voneinander entstanden.[58]
Es gibt immer mehr Hinweise darauf, dass der Ursprung der C4-Photosynthese während des Oligozäns vor etwa 30 Millionen Jahren liegt.[59] Sinkende Temperaturen und Kohlenstoffdioxidkonzentrationen (von etwa 1000 ppm auf unter 500 ppm) kennzeichnen diese Periode.[60] Vor 10 Millionen Jahren sank die Kohlenstoffdioxidkonzentration weiter auf unter 300 ppm.[60] Darüber hinaus stieg die atmosphärische O2-Konzentration von 18 % auf die heutigen 21 %. Das dadurch vorherrschende für die C3-Photosynthese ungünstige Verhältnis von Sauerstoff zu Kohlenstoffdioxid (hohe Photorespiration) wird als primärer evolutionären Schrittmacher für die Entwicklung CO2-konzentrierender Maßnahmen in Pflanzen gesehen, was die Entstehung des C4-Metabolismus und CAM begünstigte.[60] Vermutlich herrschte zunächst bei Wasserpflanzen ein hoher Selektionsdruck, die zu einem C4-Stoffwechsel oder CAM geführt hatten.[61] Darüber hinaus führten die klimatischen Änderungen dazu, dass gerade wärmere Gegenden arider wurden, was die Selektion für C4- und CAM-Pflanzen noch weiter begünstigt haben müsste.
Von etwa 8.100 C4-Pflanzenarten aus 19 Familien der Angiospermen sind etwa 80 % Gräser und Sauergrasgewächse (Stand 2017).[1] Unter den ca. 5.000 Gräsern kommen sowohl älteste C4-Pflanzen (Chloridoideae) vor, es sind aber auch phylogenetisch sehr junge Arten darunter wie beispielsweise bei Neurachne. Knapp 1.300 Arten zählen zu den Sauergrasgewächsen, die sich aus sechs Kladen entwickelt haben. Die restlichen C4-Pflanzen zählen zu den Eudikotyledonen (etwa 1.800 Arten aus 16 Familien).[1] C4-Gräser sind jedoch nicht notwendigerweise vor den C4-Eudikotyledonen entstanden, da sich in beiden Gruppen sehr alte und sehr neue Abstammungslinien finden.[62]
Sinkende CO2-Konzentrationen werden als ein evolutionärer Auslöser und allgemeine Grundvoraussetzung für die Entstehung von C4-Pflanzen betrachtet.[63] Da die C4-Photosynthese auch während der 30 Millionen Jahre nach dem ersten Evolutionsschub entstanden sind, müssen weitere, lokal vorherrschende Faktoren eine große Rolle gespielt haben. Es gibt sechs globale Zentren, die als Keimzelle für viele C4-Eudikotyledonen und manche Gräser angesehen werden: (südwestliches) Nord- und (zentrales) Südamerika, Südafrika, Nordostafrika und Arabien, Vorder- und Zentralasien sowie Australien.[41] Diese Regionen sind in der Regel warm und trocken bis halbtrocken, erfahren aber regelmäßige Niederschläge während des Sommers. Auch salide, sandige oder trockene Böden begünstigen die Entstehung und Ausbreitung von C4-Pflanzen, da sie die Wasserverfügbarkeit senken. Dies würde erklären, warum C4-Pflanzen dagegen in feuchten, beschatteten Wäldern kaum vorkommen. Ein weiterer Faktor sind Standorte mit hohem Lichteinfall, da der C4-Metabolismus mehr Energie benötigt.[63] Etwa vor 23 Millionen Jahre waren C4-Pflanzen bereits in der Neuen Welt, Afrika und Südasien verbreitet. Die Ausbreitung erfolgte allmählich, besonders in niederen und mittleren Breiten. Eine zweite evolutionäre Entstehungsphase von C4-Pflanzen wird auf frühe Miozän verortet, bei dem ein weiteres Absinken der CO2-Konzentration erfolgt ist.
Eine globale, ökologische Bedeutung erfolgte durch eine sehr starke Ausbreitung von C4-Gräsern, und damit eine Ausweitung der von C4-Pflanzen dominierenden Ökosystemen in Graslandschaften und Savannengebieten.[63][64] Diese fand zum Ende des Miozäns und Beginn des Pliozäns vor 2 bis 8 Millionen Jahren statt.[65] Die Verdrängung von C3-Gräsern und Baumlandschaften durch C4-Graslandschaften wurde durch steigende Aridität und Koevolution großer Weidetiere (Nordamerika) bzw. durch regionale Trockenperioden und Buschbrände gefördert (Afrika, Südasien). Dies spiegelt den Wettbewerb zwischen C4-Gräsern und heranwachsenden (C3-)Bäumen wider, denn die Setzlinge dieser Bäume würden ohne wiederkehrende „Störungen“ (beispielsweise ein Buschbrand) irgendwann die C4-Gräser überwachsen und damit beschatten.[1] Nach einem Brand gelingt es aber C4-Gräser sich gerade in ariden Regionen schneller als C3-Pflanzen zu erholen. Zudem fördert das schnelle Heranwachsen vieler Gräser weitere Brände. Daher dominieren C4-Gräser in Gegenden, die regelmäßige Trockenperioden und Buschbrände aufweisen, während Baumlandschaften in feuchten Gebieten überwiegen.
Ob bereits eine C4-Photosynthese sehr viel früher stattgefunden hat, kann bisher nicht eindeutig geschlussfolgert werden. Beispielsweise können Isotopenwerte aus marinen Sedimenten im heutigen Afrika so gedeutet werden, dass erste C4-Pflanzen bereits vor 90 Millionen Jahre existierten. Ein hypothetisch noch früherer möglicher Zeitpunkt wäre der Übergang vom späten Karbon zum frühen Perm vor etwa 300 Millionen Jahren, da sich durch das vorherrschende Verhältnis von Sauerstoff zu Kohlenstoffdioxid die Photorespiration spürbar bemerkbar gemacht hatte. Wahrscheinlich entstanden in dieser Periode die kohlenstoffdioxidkonzentrierenden Mechanismen in Algen, um den stark sinkenden CO2-Konzentrationen (2500 ppm auf etwa 1000 ppm) und steigenden O2-Konzentration (etwa 30 %) zu begegnen.[59]
Entwicklung des C4-Stoffwechsels
Durch phylogenetische Untersuchungen von C3- und C4-Pflanzen sowie C3–C4-Zwischenstufen hat man ein Modell erarbeitet, dass den Übergang von C3- zur C4-Photosynthese beschreibt. Dies umfasst mehrere biochemische und anatomische Veränderungen und kann in folgende, übergeordnete Entwicklungsschritte zusammengefasst werden:[17][29]
- Genetische Voraussetzungen
- Ausbildung einer (Proto)-Kranzanatomie
- Etablierung einer C2-Photosynthese
- Entwicklung des vollständigen C4-Dicarbonsäurestoffwechsels
- weitere Optimierungen
Jeder der dabei vorkommenden Schritte bietet selbst einen evolutionären Vorteil gegenüber der letzten Entwicklungsstufe. Dies würde auch erklären, warum die Entwicklung aus verschiedenen und voneinander unabhängigen Arten stattfinden konnte. Der C4-Stoffwechsel ist weder aus einem spezifischen biochemischen Weg noch aus einer bestimmten anatomischen Struktur heraus entstanden (nur die CA- und PEPC-Reaktion haben alle C4-Pflanzen gemeinsam). Es ist das Resultat einer Kombination von Merkmalen, deren gemeinsames Auftreten einen bestimmten Zustand – die C4-Photosynthese – anzeigt.[29] Daher verwenden manche Autoren in der Literatur auch die Bezeichnung „C4-Syndrom“.[17][29]
Genetische Grundvoraussetzungen
Erleichtert wird die Evolution von C3- zu C4-Stoffwechsel deswegen, weil viele biochemische Reaktionen bereits in C3-Pflanzen in ähnlicher Form vorkommen.[61] Jedoch nehmen die dabei beteiligten Enzyme an Reaktionen teil, die nicht notwendigerweise in photosynthetisch aktivem Gewebe ablaufen.[50]
Tatsächlich stammen alle an der C4-Photosynthese beteiligten Enzyme ursprünglich von nicht-photosynthetischen Isoformen ab und sind an anderen Aufgaben beteiligt.[17] Auch die für die neue Funktion erforderliche Regulation des Enzyms ändert sich. Dies ist mit PEPC am besten dokumentiert. Im Gegensatz zu nicht-photosynthetischer PEPC zeigt die „C4“-PEPC eine verringerte Affinität zu PEP, aber eine erhöhte zu Bicarbonat. Die allosterische Hemmung durch Aspartat und Malat ist geringer, die gegenüber Glucose-6-phosphat und Glycin höher.[17] Alle Änderungen basieren nur auf geringe genetische Unterschiede.
Eine Grundvoraussetzung für die Umfunktionierung von am C4-Stoffwechsel beteiligter Enzyme ist das Vorhandensein redundanter Gene im Genom, beispielsweise als Folge von Genduplikationen.[29] Dadurch können Genkopien jener Enzyme verschiedenen Mutationen ausgesetzt sein, ohne dass sich diese gleich letal für die Pflanze auswirkt. Diese Mutationen umfassen ein zellspezifisches Ausschalten bzw. eine Anpassung an die katalytischen Eigenschaften und Kinetiken der korrespondierenden Enzyme oder der Entstehung einer Kranzanatomie, die für einen C4-Stoffwechsel notwendig ist. Auch eine damit einhergehende neuartige Enzymregulation ist erforderlich. Bei Gräsern könnte daher die vor etwa 70 Millionen Jahre stattgefundene Genomduplikation das mehrfache Entstehen der C4-Photosynthese begünstigt haben.[29]
Proto-Kranzanatomie
Als erster Schritt wird die Entwicklung der entscheidenden anatomischen Grundlage des C4-Stoffwechsels angesehen: die Kranzanatomie.[29][17] Dadurch kann gewährleistet werden, dass der Transport von vorfixierten Kohlenstoffdioxid aus den Mesophyllzellen (M) in die Bündelscheidenzellen (BS) so schnell wie möglich erfolgen kann. Idealerweise stehen also beide Zelltypen in unmittelbaren Kontakt zueinander. Ein Schritt in diese Richtung ist die Erhöhung der Leitbündelzahl in einem (planaren) Blatt, was auch die strukturelle Integrität des Blattes erhöht. Darauf folgt im zweiten Schritt eine „Aktivierung“ der BS-Zellen.[17] Normalerweise sind die BS-Zellen einer typischen C3-Pflanze photosynthetisch wenig aktiv. Zudem ist die Anzahl seiner Zellorganellen gering, da die Photosynthese in Mesophyll abläuft. Durch die anatomischen Veränderungen Richtung C4-Photosynthese werden die BS-Zellen vergrößert und weisen eine größere Anzahl an Zellorganellen auf, die mit einer vermehrten photosynthetischen Aktivität einhergehen (mehr Chloroplasten) und mit den stärker werdenden photorespiratorischen Effekten auch mehr Mitochondrien und Peroxisomen bilden.
Der C2-Stoffwechsel (photorespiratorische CO2-Pumpe)
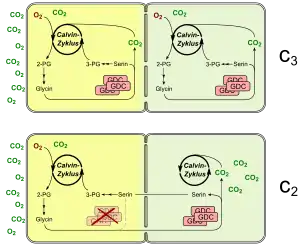
Ein dritter Schritt in Richtung C4 ist die Ausbildung einer C2-Photosynthese (vgl. auch Abschnitt oben).[17] Für die Ausbildung der C2-Photosynthese ist es erforderlich, die Aktivität der GDC in den M-Zellen zu reduzieren oder ganz abzuschalten. Dies geschieht in der Regel durch Inaktivierung einer seiner vier Untereinheiten. So hat man bei der Acker-Morikandie (Moricandia arvensis) nachgewiesen, dass die P-Untereinheit des GDC-Komplexes in den M-Zellen fehlt.[17] Infolgedessen ist der GDC-Komplex dort inaktiv. Im C3-Vorgänger Moricandia moricandioides dagegen finden sich funktionale GDC-Komplexe sowohl in den M- als auch in den BS-Zellen.[41] Generell werden in C2-Pflanzen die Gene für alle GDC-Untereinheiten spezifisch oder zumindest bevorzugt in BS-Zellen abgelesen. Mit dem Ausbilden einer C2-Photosynthese schritt wahrscheinlich auch die Differenzierung von BS-Zellen weiter voran (weitere Erhöhung der Organellenzahl). Die Verlagerung der GDC-Aktivität in die BS wird als Schlüsselschritt in der C4-Evolution gesehen.[29] Ferner würde bei diesem Entwicklungszustand die Photorespiration nicht mehr pauschal von Nachteil sein, da nun in dessen Zuge das in die BS-Zellen transportierte Glycin dort eine wichtige Quelle an CO2 darstellt.[29] Daher würden weitere Anpassungen (mehr Organellen in den BS-Zellen, Optimierungen der Blattanatomie) die Nutzung dieser internen CO2-Quelle noch weiter steigern.
Neben der photorespiratorischen CO2-Pumpe könnte der nächste Schritt in Richtung C4-Photosynthese ist das verstärkte Auftreten der Carboanhydrase (CA) und PEPC im Cytosol der M-Zellen sein.[17] In Flaveria bidentis wurde die ursprüngliche Isoform in die Chloroplasten transportiert, durch eine Mutation an einem Transitprotein verbleibt sie aber im Cytosol. CA und PEPC haben für die CO2-Vorfixierung eine Schlüsselfunktion. Ein günstiger Nebeneffekt ist auch das erleichterte Wiedereinfangen freigesetzten CO2 aus den benachbarten BS-Zellen. Für eine C4-Photosynthese muss die Aktivität weiterer an dem Stoffwechselweg beteiligten Enzyme, wie z. B. das decarboxylierende Malatenzym NAD(P)-ME, verstärkt in die BS-Zellen verlagert werden.[17] Im Gegenzug muss die PPDK, das PEP aus Pyruvat regeneriert, vermehrt in den Chloroplasten der M-Zellen auftreten. Manche C2-Pflanzen zeigen tatsächlich eine erhöhte Aktivität dieser Enzyme gegenüber anderen C2- und C3-Pflanzen (Faktor 2-5) – bei reinen C4-Pflanzen liegt der Faktor bei etwa 10-50.[29]
Etablierung eines C4-Dicarbonsäurewegs und Optimierung
In der letzten Phase der Entwicklung zu C4-Pflanzen wird die RuBisCO-Aktivität der M-Zellen heruntergefahren, da sonst PEPC und RuBisCO um das Substrat CO2 konkurrieren.[17] Darüber hinaus finden in der letzten Phase weitere Optimierungen statt. Es werden Enzyme weiter kompartimentiert, die Lichtreaktion der Photosynthese angepasst, die Carboanhydraseaktivität in den M-Zellen stark erhöht und die zellspezifische Genexpression in den BS und M vorangetrieben.[29] So wird für das Enzym PPDK eine Modifikation des Genpromotors als wichtiger Schritt für eine C4-Evolution angesehen, da dadurch das Gen für PPDK speziell in den M-Zellen abgelesen wird.[32]
Die Regulation und Kinetiken mancher Enzyme, wie PEPC, muss optimiert werden. So ist für die Diffusion von Malat in die BS-Zellen eine hohe Konzentration in der Mesophyllzelle nötig. Da jedoch Malat auch die „ursprüngliche“ PEPC inhibiert, muss die Sensitivität der C4-PEPC gegenüber Malat herabgesetzt werden.[29]
Da viele Metabolite zwischen zwei benachbarten Zellen transportiert werden, erfordert die Ausbildung einer C4-Photosynthese auch die notwendige Transportkapazität.[17] All dies ermöglicht einen effizienten Transport von CO2 von der Mesophyll- in die Bündelscheidenzelle.
Rückverwandlung von C4 zu C3-Photosynthese
Eine evolutionäre Rückverwandlung von C4- zur ursprünglichen C3-Photosynthese wurde bisher nicht nachgewiesen.[50] Ein möglicher Grund wäre, dass dies mindestens genauso viele evolutionäre Schritte erfordert wie der umgekehrte Weg, jedoch keinen Selektionsvorteil mehr verspricht. Denn eine so rückverwandelte C3-Pflanze hätte nur in jenen Habitaten einen Vorteil gegenüber C4-Pflanzen, in denen ja bereits andere C3-Pflanzen dominieren. Gegenüber vorliegenden C3-Mitbewerbern könne sie sich dann nicht etablieren.
Weblinks
- Axel Brennicke: Die Evolution der C4-Photosynthese: Wie leicht abgewandelte C4-Wege fast 50 mal parallel entstehen konnten. In: BiuZ. 6/2011, S. 362–363.
- Herfried Kutzelnigg: Die Evolution der C4-Pflanzen. In: Studium Integrale Journal. 15. Jahrgang / Heft 1 – April 2008, abgerufen am 28. Oktober 2014.
Literatur
Übersichtsartikel und Allgemeines
- Agepati S. Raghavendra, Rowan F. Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (Reihe Advances in photosynthesis and respiration Band 32).
- Oula Ghannoum: C4 photosynthesis and water stress. In: Annals of Botany 103(4), 2009, S. 635–644, PMID 18552367, PMC 2707343 (freier Volltext, PDF).
- Donat-Peter Häder: Photosynthese. 1. Auflage, Thieme Verlag, Stuttgart 1999. ISBN 978-3-13-115021-9.
- Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, 2008, ISBN 978-3-8274-1961-3, S. 211 ff.
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1.
- Lincoln Taiz (Autor), Eduardo Zeiger (Autor) und B. Jarosch (Übersetzer): Plant Physiology: Das Original mit Übersetzungshilfen. 4. Auflage, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4.
Evolution
- Rowan F. Sage: A portrait of the C4 photosynthetic family on the 50th anniversary of its discovery: species number, evolutionary lineages, and Hall of Fame. In: Journal of Experimental Botany. Band 68, Nr. 2, 2017, S. e11–e28, doi:10.1093/jxb/erx005, PMID 28110278.
- R. F. Sage und Stata, M. (2014): Photosynthetic diversity meets biodiversity: The C4 plant example. In: J Plant Physiol. pii: S0176-1617(14)00236-3; PMID 25264020; doi:10.1016/j.jplph.2014.07.024.
- P. A. Christin und Osborne, CP. (2013): The recurrent assembly of C4 photosynthesis, an evolutionary tale. In: Photosynth Res. 117(1–3); S. 163–175; PMID 23703454; doi:10.1007/s11120-013-9852-z.
- R. F. Sage, T. L. Sage und Kocacinar, F. (2012): Photorespiration and the evolution of C4 photosynthesis. In: Annu Rev Plant Biol. 63; S. 19–47; PMID 22404472; doi:10.1146/annurev-arplant-042811-105511.
- U. Gowik und Westhoff, P. (2011): The path from C3 to C4 photosynthesis. In: Plant Physiol. 155(1); S. 56–63; PMID 20940348; doi:10.1104/pp.110.165308.
Einzelnachweise
- Rowan F. Sage: A portrait of the C4 photosynthetic family on the 50th anniversary of its discovery: species number, evolutionary lineages, and Hall of Fame. In: Journal of Experimental Botany. Band 68, Nr. 2, 2017, S. e11–e28, doi:10.1093/jxb/erx005, PMID 28110278.
- Andreas Bresinsky und andere: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag; Heidelberg 2008; ISBN 978-3-8274-1455-7, S. 312.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3, S. 226.
- Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin/New York 2006, ISBN 3-11-018531-8, S. 154.
- Andreas Bresinsky und andere: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag; Heidelberg 2008; ISBN 978-3-8274-1455-7, S. 311.
- Rowan F. Sage, Ferit Kocacinar, David S. Kubien: C4 photosynthesis and temperature. In: Raghavendra, Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. 2011, S. 161–195.
- Sophie N R Young, Lawren Sack, Margaret J Sporck-Koehler, Marjorie R Lundgren: Why is C4 photosynthesis so rare in trees? In: Journal of Experimental Botany. Band 71, Nr. 16, 6. August 2020, S. 4629–4638, doi:10.1093/jxb/eraa234, PMID 32409834, PMC 7410182 (freier Volltext).
- W. J. Bond, F. I. Woodward, G. F. Midgley,: The global distribution of ecosystems in a world without fire. In: New Phytologist. 165, Nr. 2, 2005, S. 525–538. doi:10.1111/j.1469-8137.2004.01252.x. PMID 15720663.
- Elizabeth A. Kellogg: C4 photosynthesis. In: Current Biology. 23, Nr. 14, Januar, S. R594–R599. doi:10.1016/j.cub.2013.04.066.
- Dietmar Brandes: Breiten sich die C4-Pflanzen in Mitteleuropa aus?, Schriftenreihe für Vegetationskunde 27 – Sukopp-Festschrift, 1995, S. 365–372.
- Robert T. Furbank: Walking the C 4 pathway: past, present, and future. In: J Exp Bot. 67, Nr. 14, Juli 2016, S. 4057–4066. doi:10.1093/jxb/erw161. PMID 27059273.
- Hodge, AJ, McLean, JD. und Mercer, FV.: Ultrastructure of the lamellae and grana in the chloroplasts of Zea mays. In: J Biophys Biochem Cytol.. 1, Nr. 6, November 1955, S. 605-614. PMID 19866553. PMC 2223833 (freier Volltext).
- Hatch, MD. (2002): C4 photosynthesis: discovery and resolution. In: Photosynth Res. 73(1–3); S. 251–256; PMID 16245128; doi:10.1023/A:1020471718805.
- Kortschak, HP., Hartt, CE. und Burr, GO.: Carbon Dioxide Fixation in Sugarcane Leaves. In: Plant Physiol.. 40, Nr. 2, März 1965, S. 209–213. PMID 16656075.
- Osmond, CB.: Beta-carboxylation during photosynthesis in Atriplex. In: Biochim Biophys Acta.. 141, Nr. 1, Juni 1967, S. 197–199. doi:10.1016/0304-4165(67)90264-4. PMID 6069308.
- Hatch, MD. (1971): Mechanism and function of C4 photosynthesis. In: M. D. Hatch, C. B. Osmond and Slatyer RO (eds): Photosynthesis and Photorespiration. Wiley-Interscience, New York, S. 139–152.
- U. Gowik und Westhoff, P. (2011): The path from C3 to C4 photosynthesis. In: Plant Physiol. 155(1); S. 56–63; PMID 20940348; doi:10.1104/pp.110.165308.
- Peter Schopfer und Axel Brennicke: Pflanzenphysiologie. 7. Auflage. Spektrum Akademischer Verlag; Heidelberg 2010; ISBN 978-3-8274-2351-1; S. 281.
- Wurzelgen kurbelt Photosynthese an, pflanzenforschung.de, abgerufen am 28. Oktober 2014.
- Andreas Bresinsky und andere: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag; Heidelberg 2008; ISBN 978-3-8274-1455-7, S. 308.
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 776–777.
- Donat-Peter Häder: Photosynthese. 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 205.
- Andrea Bräutigam und Andreas P.M. Weber: Transport Processes: Connecting the Reactions of C4 Photosynthesis: In: Agepati S. Raghavendra, Rowan F. Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (Reihe Advances in photosynthesis and respiration Band 32).
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3, S. 217 ff.
- Donat-Peter Häder: Photosynthese. 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 210.
- Gerald E. Edwards, Elena V. Voznesenskaya: C4 Photosynthesis: Kranz forms and single-cell C4 in terrestrial plants. In: Agepati S. Raghavendra, Rowan F. Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (Reihe Advances in photosynthesis and respiration Band 32), S. 29–61.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3, S. 220.
- Donat-Peter Häder: Photosynthese. 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 207.
- R. F. Sage, T. L. Sage und Kocacinar, F. (2012): Photorespiration and the evolution of C4 photosynthesis. In: Annu Rev Plant Biol. 63; S. 19–47; PMID 22404472; doi:10.1146/annurev-arplant-042811-105511.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3, S. 224–225.
- Chris J. Chastain: Structure, Function, and Post-translational Regulation of C4 Pyruvate Orthophosphate Dikinase. In: Agepati S. Raghavendra (Hrsg.) und Rowan F. Sage (Hrsg.): C4 Photosynthesis and Related CO2 Concentrated Mechanisms (Advances in Photosynthesis and Respiration). Springer Netherlands 2011; ISBN 978-90-481-9406-3; S. 301–315.
- Chris J. Chastain et al. (2011): Functional evolution of C4 pyruvate,orthophosphate dikinase. In: J Exp Bot 62; S. 3083–3091; doi:10.1093/jxb/err058.
- H. Akhani. et al. (2012): A new species of Bienertia (Chenopodiaceae) from Iranian salt deserts: a third species of the genus and discovery of a fourth terrestrial C4 plant without Kranz anatomy. In: Plant Biosystems 146: 550–559; doi:10.1080/11263504.2012.662921.
- George Bowes: Single-cell C4 photosynthesis in aquatic plants. In: Raghavendra, Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. 2011, S. 63–80.
- P. Wang, D. Vlad und Langdale JA (2016): Finding the genes to build C4 rice. Curr Opin Plant Biol. 31; 44–50. doi:10.1016/j.pbi.2016.03.012; PMID 27055266
- Hans Lambers, F. Stuart Chapin III. und Thijs L. Pons: Plant Physiological Ecology. 2. Auflage, Springer, Berlin 2008; ISBN 978-0-387-78340-6; S. 80.
- Sage, RF. (2002): Are crassulacean acid metabolism and C4 photosynthesis incompatible? In: Functional Plant Biology 29(6); S. 775–785; doi:10.1071/PP01217.
- Stanislav Kopriva: Nitrogen and Sulfur Metabolism in C4 Plants In: Agepati S. Raghavendra, Rowan F. Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (Reihe Advances in photosynthesis and respiration Band 32).
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 781–782.
- Roxana Khoshravesh, Matt Stata, Florian A. Busch, Montserrat Saladié, Joanne M. Castelli: The Evolutionary Origin of C4 Photosynthesis in the Grass Subtribe Neurachninae. In: Plant Physiology. Band 182, Nr. 1, Januar 2020, S. 566–583, doi:10.1104/pp.19.00925, PMID 31611421, PMC 6945869 (freier Volltext).
- Rowan F. Sage et al.: Some like it hot: the physiological ecology of C4 plant evolution. In: Oecologia. Band 187, Nr. 4, 2018, S. 941–966, doi:10.1007/s00442-018-4191-6, PMID 29955992.
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 785–786.
- Michael B. Jones: C4 species as energy crops. In: Raghavendra, Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. 2011, S. 379–397.
- Lincoln Taiz (Autor), Eduardo Zeiger (Autor) und B. Jarosch (Übersetzer): Plant Physiology: Das Original mit Übersetzungshilfen. 4. Auflage, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4, S. 215.
- Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin/New York 2006, ISBN 3-11-018531-8, S. 823.
- Kerstin Stolzenburg: Versuchsergebnisse Weiden, Pappeln und Miscanthus der LAP Forchheim. (PDF; 348 kB) 14. Dezember 2006, archiviert vom Original am 11. Dezember 2014; abgerufen am 8. August 2016.
- Donat-Peter Häder: Photosynthese. 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 214.
- James N. Burnell: Hurdles to engineering greater photosynthetic rates in crop plants: C4 rice. In: Raghavendra, Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. 2011, S. 361–378.
- Internetseite des C4 rice project (Memento des Originals vom 3. Februar 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., abgerufen am 3. Februar 2017
- P. A. Christin und Osborne, CP. (2013): The recurrent assembly of C4 photosynthesis, an evolutionary tale. In: Photosynth Res. 117(1–3); S. 163–175; PMID 23703454; doi:10.1007/s11120-013-9852-z.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3, S. 225.
- Lincoln Taiz (Autor), Eduardo Zeiger (Autor) und B. Jarosch (Übersetzer): Plant Physiology: Das Original mit Übersetzungshilfen. 4. Auflage, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4, S. 216–217.
- Lincoln Taiz (Autor), Eduardo Zeiger (Autor) und B. Jarosch (Übersetzer): Plant Physiology: Das Original mit Übersetzungshilfen. 4. Auflage, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4, S. 217.
- Peter Schopfer und Axel Brennicke: Pflanzenphysiologie. 7. Auflage, Spektrum Akademischer Verlag; Heidelberg 2010; ISBN 978-3-8274-2351-1, S. 295.
- Andreas Bresinsky und andere: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag; Heidelberg 2008; ISBN 978-3-8274-1455-7, S. 1012.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 485.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 136.
- Rowan F. Sage: The evolution of C4 photosynthesis. In: New Phytologist. 161, Nr. 2, 1. Februar 2004, ISSN 1469-8137, S. 341–370. doi:10.1111/j.1469-8137.2004.00974.x.
- R. F. Sage und Stata, M. (2014): Photosynthetic diversity meets biodiversity: The C4 plant example. In: J Plant Physiol. pii: S0176-1617(14)00236-3; PMID 25264020; doi:10.1016/j.jplph.2014.07.024.
- Jens Boenigk: Biodiversität und Erdgeschichte. Springer-Verlag, 2015, ISBN 978-3-642-55389-9, S. 144.
- Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 797.
- P. A. Christin. et al. (2011): C4 eudicots are not younger than C4 monocots In: J. Exp. Bot. 62(9): S. 3171–3181; doi:10.1093/jxb/err041.
- Hans Konrad Biesalski: Mikronährstoffe als Motor der Evolution. Springer-Verlag, 2015, ISBN 978-3-642-55397-4, S. 63.
- E. J. Edwards, S. A. Smith: Phylogenetic analyses reveal the shady history of C4 grasses. In: Proceedings of the National Academy of Sciences. Band 107, Nummer 6, Februar 2010, S. 2532–2537, doi:10.1073/pnas.0909672107, PMID 20142480, PMC 2823882 (freier Volltext).
- Colin P. Osborne: The geologic history of C4 plants. In: Raghavendra, Sage (Hrsg.): C4 photosynthesis and related CO2 concentrating mechanisms. 2011, S. 339–357.