Waldelefant
Der Waldelefant (Loxodonta cyclotis), teilweise auch Afrikanischer Waldelefant, ist eine Art aus der Gattung der Afrikanischen Elefanten (Loxodonta). Das Verbreitungsgebiet umfasst die tropischen Regenwälder des zentralen und westlichen Teils Afrikas. Es handelt sich um den kleineren der beiden Vertreter aus der Familie der Elefanten auf dem Kontinent. Äußerlich ähnelt er weitgehend seinem größeren Verwandten, dem Afrikanischen Elefanten, weist aber einige Abweichungen im Detail auf. Dazu gehören die eher gerundeten Ohren, die deutlich gerade verlaufenden Stoßzähne und der weniger eingedellte Rücken. Auch in der Verhaltensweise stimmen beide Arten in vielen Bereichen überein. Die Tiere leben in sozialen Verbänden, die aus näher miteinander verwandten Kühen und dem Nachwuchs bestehen. Die Bullen treten dagegen als Einzelgänger auf. Im Gegensatz zum Afrikanischen Elefanten sind die Herdenverbände aber kleiner und weniger stabil. Eine große Bedeutung haben Waldlichtungen, die wichtige soziale Kontaktpunkte verschiedener Gruppen des Waldelefanten bilden. Die Ernährung basiert weitgehend auf weicher Pflanzenkost. Ein Großteil des Tagespensums wird mit der Suche nach Nahrung verbracht. Die Fortpflanzung erfolgt ganzjährig, hat aber einen Höhepunkt in den Trockenzeiten. Der Nachwuchs besteht in der Regel aus einem Kalb, das bis zu fünf Jahre gesäugt wird.
| Waldelefant | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Waldelefant (Loxodonta cyclotis) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Loxodonta cyclotis | ||||||||||||
| (Matschie, 1900) |
Die wissenschaftliche Erstbeschreibung des Waldelefanten erfolgte im Jahr 1900. Überwiegend in der zweiten Hälfte des 20. Jahrhunderts galt der Elefantenvertreter als Unterart des Afrikanischen Elefanten. Erst verschiedene anatomische und molekulargenetische Studien im Übergang zum 21. Jahrhundert führten zu einer Diskussion des eigenständigen Artcharakters des Waldelefanten. Problematisch hierbei ist ein mehr oder weniger breiter Korridor entlang der nördlichen Verbreitungsgrenze, in dem es zur Hybridisierung mit dem Afrikanischen Elefanten kommt. Anfang des 20. Jahrhunderts wurde eine weitere kleine Elefantenform aus dem zentralen Afrika beschrieben und als „Zwergelefant“ bezeichnet. Hier zeigen ebenfalls verschiedene Studien, dass der „Zwergelefant“ mit dem Waldelefanten identisch ist. Die Bestände sind aufgrund von Wilderei und der Zerstörung der Regenwälder stark geschrumpft; der internationale kommerzielle Handel mit den Tieren ist durch die Vereinbarungen im Washingtoner Artenschutzübereinkommen verboten.
Merkmale
Habitus
Der Waldelefant ist kleiner als der Afrikanische Elefant (Loxodonta africana). Die Schulterhöhe männlicher Tiere variiert von 214 bis 290 cm (durchschnittlich 244 cm), bei weiblichen liegt sie zwischen 176 und 234 cm (durchschnittlich 198 cm). Untersuchungen an Tieren im Dzanga-Schutzgebiet in der Zentralafrikanischen Republik ergaben eine maximale Höhe von 280 cm.[1] Dagegen waren Tiere aus dem Nationalpark Loango in Gabun mit maximal 216 cm deutlich kleiner.[2] Das Gewicht ist kaum bekannt, schwankt aber möglicherweise zwischen 2 und 4 t.[3] Andere Autoren geben rund 1,7 t im Mittel an.[4]
Äußerlich ähnelt der Waldelefant seinem größeren afrikanischen Verwandten, er ist aber kompakter gebaut und seine Rückenlinie verläuft eher gerade und nicht so deutlich eingedellt. Die Ohren sind zumeist rundlicher und kleiner als beim Afrikanischen Elefanten, allerdings ist die Form individuell verschieden. Die Unterkanten der Ohren können bis unter die Kinnlinie reichen. Die Hautfarbe erscheint generell grau; infolge von Schlammbädern tendiert sie aber oft zu gelblich bis rötlichbraun. Die Körperbehaarung ist spärlich, Ausnahmen bilden Neugeborene mit einem dichteren schwarzen Fell. Bei manchen weiblichen Tieren wächst ein leichter Bart am Kinn. Die Schwanzlänge unterscheidet sich bei einzelnen Individuen. So kann der Schwanz etwa nur die Hälfte der Rückenhöhe einnehmen oder mit der Spitze den Boden berühren. Er ist in eine dicke Haut eingehüllt und endet in einer asymmetrischen, breiten Spitze, die wiederum von einer Quaste aus 2 bis 20 cm langen Haaren bedeckt wird. Die Hände und Füße sind wie bei allen Elefanten jeweils fünfstrahlig. Im Unterschied zum Afrikanischen Elefanten kommen am Vorderfuß fünf und am Hinterfuß vier nagelartige Bildungen vor.[3][5][1]
Schädel- und Gebissmerkmale
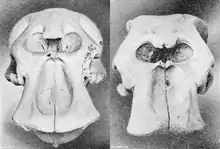
Der Schädel erreicht eine Länge von 47 bis 63 cm. Er ist wie der des Afrikanischen Elefanten massiv gebaut, wirkt aber insgesamt breiter sowohl am Schädeldach als auch an den Alveolen der Stoßzähne. Ein auffallendes Merkmal der Elefantenschädel sind die luftgefüllten Kammern des Stirnbeins, die eine an Bienenwaben erinnernde Konstruktion aufweisen. Beim Waldelefanten sind die Kammern nicht so deutlich ausgebildet wie beim Afrikanischen Elefanten. Der Unterkiefer besitzt eine lange und niedrige Gestalt. Im Vergleich zum Afrikanischen Elefanten ist die Symphyse absolut und relativ länger mit einer durchschnittlichen Länge von 18,5 cm. Das Gebiss besteht typisch für Elefanten aus 26 Zähnen mit folgender Zahnformel: . Die charakteristischen Stoßzähne werden aus dem jeweils zweiten oberen Schneidezahn gebildet. Sie sind lang und schlank, bei männlichen Tieren weisen sie einen basalen Durchmesser von 7,0 bis 15,5 cm auf, bei weiblichen Individuen werden sie mit 5,7 bis 8,3 cm deutlich schlanker. Gegenüber dem Afrikanischen Elefanten zeigen sie sich insgesamt graziler, außerdem ist ihr Verlauf auffallend gerade, während sie beim ersteren gekrümmt sind. Das Elfenbein ist härter und eher rosafarben. Ein untersuchtes Tier aus Dzanga trug bis zu 180 cm lange Stoßzähne. Die Backenzähne haben niedrigere Zahnkronen als beim Afrikanischen Elefanten. Typischerweise kommen drei Milchprämolaren und drei Molaren vor. Dauerhafte Prämolaren fehlen wie bei allen Elefanten. Die Prämolaren ähneln den Molaren, sind also deutlich molarisiert. Die Mahlzähne bestehen aus mehreren Schmelzfalten (teilweise als lamellodont bezeichnet), die durch Zahnzement miteinander verbunden sind. Der Zahnwechsel erfolgt horizontal und nicht vertikal wie bei den meisten anderen Säugetieren.[3][5][1]
Verbreitung
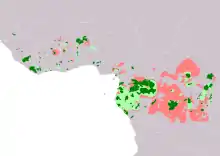
Die Verbreitung des Waldelefanten ist nur wenig untersucht. Generell kommt er in Zentralafrika vor und bewohnt das Kongobecken von Äquatorialguinea und Gabun im Westen über die Republik Kongo, den Süden Kameruns und der Zentralafrikanischen Republik bis in den Osten der Demokratischen Republik Kongo. Darüber hinaus ist die Art in Westafrika anwesend. Die Grenzen hier und im Norden Zentralafrikas sind unbekannt, da ein mehr oder weniger breiter Vermischungskorridor mit dem Afrikanischen Elefanten besteht und die beiden Elefantenvertreter dort teilweise hybridisieren.[6][7][8] Ein gemeinsames Auftreten dieser ist unter anderem im Nationalpark Fazao-Malfakassa in Togo dokumentiert.[9] Der Lebensraum des Waldelefanten umfasst überwiegend intakte und dichte tropische Regenwälder, teilweise besiedelt der Waldelefant aber auch die Übergangszonen zu den Savannengebieten. Durch die Zerstörung der Regenwälder ist das Verbreitungsgebiet weitgehend zersplittet. Im westlichen Afrika beschränkt sich das Auftreten der Art auf etwa drei Dutzend isolierte Waldfragmente von durchschnittlich 800 km² Größe. In der Regel nutzen die Tiere ungestörte Wälder und meiden Bereiche mit intensiver menschlicher Aktivität. Auch verschiedene landwirtschaftlich genutzte Flächen wie Plantagen werden selten aufgesucht.[10][11][12] Über die Populationsdichte liegen nur wenige Informationen vor, in der Regel wird sie über die Zählung von Dunghaufen bestimmt, untergeordnet auch über Zählungen von Individuen in Gebietsausschnitten oder über die Lautgebungen der Tiere. Für Gabun beträgt die Gesamtpopulation mit Stand 2021 etwa 95.000 Individuen und damit deutlich mehr als die angenommenen 50.000 bis 60.000.[13][14] Für die Demokratische Republik Kongo wohl immerhin 20.000, für Äquatorial-Guinea liegen Schätzungen bei etwa 1300 Tieren. Während einer 20-jährigen Untersuchung im rund 6.800 km² großen Dzanga-Schutzgebiet wurden mehr als 3100 Tiere beobachtet mit einer stabilen jährlichen Anzahl von 1660 bis 1860 Individuen.[15] Im Nationalpark Loango in Gabun beträgt die Populationsdichte etwa 2,57 Tiere je Quadratkilometer.[4] Zwei Waldfragmente in Ghana beherbergten dagegen etwa 0,04 beziehungsweise 0,64 Individuen je Quadratkilometer. Allgemein gelten mehrere Bestände im westlichen Afrika aufgrund der geringen Größe und der ungleichen Geschlechter- sowie Altersverteilung als wenig überlebensfähig.[5][1]
Lebensweise
Territorialverhalten
.jpg.webp)
.jpg.webp)
.jpg.webp)
Zahlreiche Informationen zur Lebensweise des Waldelefanten stammen von Tieren aus dem Dzanga-Schutzgebiet, wo entsprechende Studien im Jahr 1990 initiiert wurden.[16] Der Waldelefant ist wie der Afrikanische Elefant ein soziales Tier. Die grundlegende Einheit bildet die Herde, bestehend aus verschiedenen miteinander verwandten Kühen und deren Jungtieren. Durchschnittlich umfasst eine Herde drei Individuen.[17][18][19] Im Bereich von Waldlichtungen, die wichtige soziale Kontaktpunkte darstellen, können sich auch größere Herdenverbände aus 20 bis 100 Tieren zusammenschließen. Sie zerfallen jedoch wieder relativ schnell.[15] Dieses als „Trennen und Zusammengehen“ (fission-fusion) bezeichnete Sozialsystem findet sich auch beim Afrikanischen Elefanten der offenen Savannenlandschaften.[20][21][19] Im Gegensatz zu diesem sind die Verbände des Waldelefanten aber kleiner und weniger stabil, was mit der geringeren Verbreitung potentieller Fressfeinde in den dichten Wäldern zusammenhängt. Die Größe der Familiengruppen kann je nach Habitat unterschiedlich ausfallen. So wurden im Nationalpark Odzala in der Republik Kongo an Minerallecken Herden mit durchschnittlich weniger Individuen als in offeneren Landschaften beobachtet.[17] Ebenfalls abweichend vom Afrikanischen Elefanten formen die Bullen des Waldelefanten nur selten Junggesellengruppen, jüngere männliche Tiere finden sich aber manchmal in losen Gemeinschaften zusammen. Vor allem an den Lichtungen tragen Bullen ihre sozialen Wettstreite und Dominanzkämpfe aus. Daneben gibt es noch Einzeltiere beider Geschlechter und nahezu aller Altersklassen.[5][1]
Prinzipiell ist der Waldelefant tagsüber aktiv, er ruht etwa vier Stunden täglich. Eine kürzere Ruhephase findet tagsüber statt, eine längere nachts. Die größten Aktivitäten entfalten sich nach Beobachtungen im Dzanga-Schutzgebiet zwischen 12.00 und 21.00 Uhr.[22] Anhand von Rufaufzeichnungen lassen sich aber auch gewisse nächtliche Aktivitäten annehmen.[23] Der hauptsächliche Tagesrhythmus besteht in der Nahrungssuche und der Wanderung zu den verschiedenen Aktivitätszonen. Einzelne Tiere überwinden dabei innerhalb von 48 Stunden bis zu 25 km, insgesamt sind die Wanderungsbewegungen aber nicht so langanhaltend wie beim Afrikanischen Elefanten. Bei seinen Wanderungen legt der Waldelefant Pfade an, die sich über mehrere Kilometer Länge erstrecken und die einzelnen Aktivitätspunkte miteinander verbinden. Viel begangene Wege können über 1 m breit sein.[24] Die einzelnen Herden und Individuen nutzen Aktionsräume, die nach verschiedenen Angaben eine Ausdehnung von 500 km² und mehr einnehmen. Eine Kuh im Dzanga-Schutzgebiet nutzte in einem Zeitraum von mehreren Wochen ein Areal von rund 880 km² mit maximalen Distanzen von 60 km zueinander.[22] Nach Untersuchungen im Nationalpark Loango variiert die Größe der einzelnen Territorien dort zwischen 11 und 105 km², was die bisher kleinsten Aktionsräume aller Elefantenvertreter darstellt. Eine stärkere Überlappung an den Grenzen wie es beim Afrikanischen Elefanten bekannt ist, wurde hier nicht festgestellt.[25] Dem gegenüber beträgt die durchschnittliche Größe der Aktionsräume im Wonga Wongué Presidential Reserve in Gabun anhand von mehr als einem Dutzend untersuchter Individuen rund 713 km². Die Ausdehnung ist bei männlichen Tieren mit gut 965 km² fast dreimal so groß wie bei den weiblichen mit 354 km², die Größe der Kerngebiete unterscheidet sich aber kaum zwischen den Geschlechtern. Die Tiere wechseln in der hier vorherrschenden Mosaiklandschaft aus tropischen Regenwäldern und offenen Grasländern täglich zwischen den einzelnen Vegetationstypen. Dadurch legen sie etwa 7 bis 8 km innerhalb von 24 Stunden zurück, was einer jährlichen Wanderungsbewegung von 2840 km entspricht. Auf das Jahr bezogen verbringen sie zwei Drittel ihrer Zeit in den tropischen Regenwäldern, die sie damit häufiger nutzen als die offenen Grasgebiete. Die Wälder werden vor allem tagsüber während der Zeit intensiver Sonneneinstrahlung aufgesucht, aus diesem Grund wählen die Tiere auch zumeist Areale mit einer hohen Dichte an Bäumen und Gestrüpp. Ebenso konnte für die lange Trockenzeit ein häufigerer Aufenthalt in Waldgebieten festgestellt werden. Allerdings bevorzugt der Waldelefant vor allem während der kurzen Regenzeit die Grasländer und profitiert so von der Erneuerung der Vegetationsdecke in dieser Zeit.[26][5][1]
Die Kommunikation untereinander findet über verschiedene Lautgebungen statt. Der Waldelefant verfügt wie die anderen Elefanten auch über ein ausgezeichnetes Gehör und vermag niederfrequente Töne bis zu 5 Hz auszustoßen sowie wahrzunehmen. Hierbei handelt es sich vor allem um das soziale Grollen, das die bei Weitem häufigste Lautäußerung des Waldelefanten darstellt. Es dient besonders der Verständigung untereinander, der Lokalisierung von Herdenmitgliedern beziehungsweise der Koordinierung der gemeinsamen Wanderung. Geräusche im niederfrequenten Bereich unterstützen zudem eine Verständigung über lange Distanzen. Sie werden von den Tieren in Verbindung mit für den Menschen wahrnehmbaren Lauten häufig an Waldlichtungen ausgestoßen. Zu den Lauten im höheren Frequenzbereich gehören vor allem neben dem bekannten Trompeten auch ein Bellen, Röhren oder Schreien. In der Kombination der höher- und niederfrequenten Laute miteinander unterscheidet sich der Waldelefant ein wenig von den anderen Elefanten, da er im Gegensatz zu diesen keine Bevorzugung von höher-/niederfrequenten gegenüber nieder-/höherfrequenten akustischen Signalen zeigt. Ob dies mit dem eher geschlossenen Waldlandschaften im Verbreitungsgebiet des Waldelefanten zusammenhängt oder aus dem Sozialleben resultiert, ist unbekannt. Die meisten kombinierten Laute werden nachts ausgestoßen.[27][5][1]
Ernährungsweise
.jpg.webp)
Der Waldelefant ernährt sich von einer Vielzahl verschiedener Pflanzenteile. Dazu gehören etwa Blätter, Früchte und Rinde. Gräser, die in den Wäldern weitgehend nur auf den Lichtungen vorkommen, werden von den Tieren gelegentlich auch gefressen, sie machen aber nur einen geringen Anteil der Nahrung aus. Untersuchungen im westlichen Ghana zeigen, dass sich der Waldelefant hier von nahezu 140 verschiedenen Pflanzenarten ernährt, unter denen vor allem Lianen dominieren. Ebenso sind Früchte sehr häufig, darunter Fruchtstände von Sapoten-, Linden-, Maulbeer- und Pfeilwurzgewächsen. Es besteht aber ein regionaler Unterschied zwischen den Trocken- und den Regenzeiten, da in Zentralafrika in ersterer der Anteil der Früchte zugunsten von Rinden und Blättern zurückgeht. In Westafrika wiederum sind Früchte während der Trockenzeit besser verfügbar. Hier weicht der Waldelefant in früchtearmen Zeiten auf erntefrisches Ackerland aus. Häufig fressen die Tiere größere Früchte von 5 bis 18 cm Durchmesser, kleinere nehmen sie meist nur als „Beifang“ beim Verzehr von Blättern auf.[28][29][5][1]
Als Nahrungspflanzen dienen hauptsächlich Bäume, seltener Büsche. Bevorzugte Fressplätze finden sich auf Lichtungen und Waldrändern, die vor allem bei der Suche nach Blättern genutzt werden. Möglicherweise hält der Waldelefant durch seine regelmäßige Wiederkehr die Lichtungen dadurch auch offen. Früchte und Rinde konsumieren die Tiere dagegen verstärkt in den Wäldern. Für letzteres suchen sie aufgrund der größeren Häufigkeit an Früchten eher primäre Wälder auf.[30] In der Regel fressen sie Zweigenden oder streifen Blätter ab. Das Brechen von Ästen oder Umwerfen von Bäume, wie es beim Afrikanischen Elefanten geläufig ist, wurde beim Waldelefanten dagegen bisher nur selten beobachtet. Die Nahrungssuche erfolgt teilweise sehr selektiv, da beispielsweise Rinde nur von wenigen Bäumen gefressen wird.[28][5][1]
Daneben spielen Minerallecken und Salzsolen auf Waldlichtungen eine bedeutende Rolle, mitunter gräbt der Waldelefant mit seinen säulenartigen Beinen auch Löcher von bis zu 4 m Durchmesser auf der Suche nach mineralhaltigen Wasser aus. Unter Umständen verbringt er mehrere Stunden täglich mit der Aufnahme dieser zusätzlichen Nährstoffe. Sie helfen den Tieren unter anderem die in den Pflanzen enthaltenen, teils toxischen Komponenten zu neutralisieren.[31][32][5][1]
Fortpflanzung
.jpg.webp)
Die sexuelle Reife erreichen weibliche Tiere mit rund 12 bis 14 Jahren. Ähnliches wird für die Jungbullen angenommen, ihre Fortpflanzungsaktivitäten beginnen aber später. Die Brunft der weiblichen Tiere hält über das gesamte Jahr an, findet ihren jeweiligen Höhepunkt jedoch während der beiden Trockenzeiten von Dezember bis März und Juli bis August. Der Zyklus beansprucht mehrere Tage. Ebenso treten während dieser Zeit hauptsächlich die größten männlichen Individuen in die Musth ein, was mit Sekretbildungen der Schläfendrüsen und einem beständigen Urintropfen verbunden ist. Den Tieren haftet dadurch ein durchdringender Geruch an. Abweichend vom Afrikanischen Elefanten unternehmen Bullen des Waldelefanten in der Musth keine ausgedehnten Wanderungen auf der Suche nach paarungswilligen Kühen. Vielmehr ermöglichen bestimmte lokale Ressourcen wie beispielsweise Minerallecken auf Waldlichtungen einem dominanten männlichen Tier eine brünftige Kuh zu treffen. Er begleitet sie dann und erlaubt ihr Zugang. Dabei findet auch der Geschlechtsakt statt, wonach sich der Bulle wieder von der Kuh trennt und eine neue Paarungsmöglichkeit auskundschaftet. Lediglich weniger durchsetzungsstarke Bullen gehen auf längere Wanderschaften.[5][1]
Die Tragzeit dauert wahrscheinlich ähnlich wie beim Afrikanischen Elefanten rund 660 Tage. Nach Beobachtungen im Dzanga-Schutzgebiet kommt in der Regel ein einzelnes Neugeborenes zur Welt. Dieses ist unmittelbar befähigt zu laufen und steht im engen Kontakt zum Muttertier und anderen Herdenmitgliedern. Das Neugeborene erreicht stehend etwa die Hälfte der Beinlänge des Muttertiers. Nach rund einem Jahr kann es noch unter dem Körper der Mutter hindurchlaufen, erst nach rund vier Jahren ist es etwa halb so groß wie ein ausgewachsenes Tier. Die Stoßzähne brechen mit etwa anderthalb Jahren durch, sie sind schon bei männlichen Jungtieren deutlich dicker als bei weiblichen. Die Mutter säugt das Jungtier bis zu fünf Jahre. Dann beginnt sich auch das Verhalten der Jungtiere nach Geschlechtern zu unterscheiden. Weibliche Jungtiere passen auf jüngere Kälber auf, männliche sammeln sich und fangen an, spielerische Kämpfe auszutragen. Der weibliche Nachwuchs verbleibt ab einem Alter von acht bis zehn Jahren meist in der Herde, der männliche wird unabhängig. Mit rund 25 Jahren sind die Tiere ausgewachsen, sie erscheinen dann aber noch relativ schlank, da der Körper sich erst im Laufe der Zeit füllt.[33] Die Überlebenschance für Neugeborene liegt bei 97 %. Ab einem Alter von rund dreizehn Jahren sinkt sie bei männlichen Tieren deutlich ab verglichen mit den weiblichen. Möglicherweise spielt hier die Jagd des Menschen auf die Stoßzähne eine wichtige Rolle.[16] Die natürliche Lebenserwartung beträgt etwa 50 bis 60 Jahre.[5][1]
Weibliche Tiere sind bis ins hohe Lebensalter fortpflanzungsfähig. Die älteste Kuh mit Nachwuchs im Dzanga-Schutzgebiet wurde auf 59 Jahre geschätzt, das jüngste trächtige Tier war zehn Jahre alt. Die größte Produktivität erreichen Kühe zwischen 25 und 39 Jahren. Der Abstand zwischen zwei Geburten liegt bei rund fünf Jahren, er ist damit durchschnittlich etwas länger als beim Afrikanischen Elefanten. Mit dem steigenden Lebensalter vergrößert sich der Geburtenabstand zusätzlich, so dass er bei älteren Kühen noch einmal 14 Monate länger währt. Die Generationlänge wird mit rund 31 Jahren angenommen.[16]
Fressfeinde, Parasiten und Ökologische Bedeutung
Der Waldelefant hat kaum natürliche Feinde. Gelegentlich erlegt der Leopard ein neugeborenes Kalb. Generell ist die Mortalitätsrate der Jungtiere mit 3 % eher gering. Tiere über zwei Jahre überleben auch allein oder verwaist. Über Parasiten liegen kaum Informationen vor. Aus den Kotresten des Waldelefanten wurden Saugwürmer wie Protofasciola oder Bivitellobilharzia und Fadenwürmer, etwa Mammomonagamus, Quilonia, Decrusia und Murshidia isoliert. Zudem treten Wimperntierchen, unter anderem Triplumaria, und Prototapirella sowie Zweiflügler, so Cobboldia, als innere Parasiten auf.[34] Im Gegensatz zum Afrikanischen Elefanten sind Erkrankungen an Milzbrand beim Waldelefanten kaum belegt.[1]
Vergleichbar den anderen Elefantenarten nimmt auch der Waldelefant eine bedeutende Rolle im ökologischen Netzwerk ein. So haben die Tiere eine wichtige Funktion als Verbreiter von Samen einer Vielzahl von Bäumen in ihrem Lebensraum. Allein im westlichen Afrika transportiert der Waldelefant über seinen Kot die Samen von nahezu 70 Arten über eine Distanz von 5 bis 12 km. Berechnungen zufolge verteilt ein einzelnes Tier auf diese Weise rund 350 Samen täglich über eine Fläche von gut einem Quadratkilometer.[29][35] Nach detaillierten Analysen in Ghana sind zwar nur wenige Pflanzen direkt abhängig vom Waldelefanten, was Keimung und ähnliches betrifft. Manche Pflanzen jedoch, wie etwa Vertreter der Gattungen Balanites und Panda, profitieren relativ deutlich. Indirekt führen auch das Entrinden oder Umknicken von Bäumen und damit das Öffnen geschlossener Waldlandschaften zur Ansiedlung von Pionierpflanzen.[36][5][1]
Systematik
Allgemein
Innere Systematik der heutigen Elefanten nach Meyer et al. 2017[37]
|
Der Waldelefant ist eine Art aus der Gattung der Afrikanischen Elefanten (Loxodonta). Innerhalb der Gattung wird zusätzlich noch der Afrikanische Elefant (Loxodonta africana) als weiterer Vertreter geführt. Die Gattung Loxodonta bildet die Schwestergruppe der Gattung Elephas mit dem Asiatischen Elefanten (Elephas maximus) als einzigem Mitglied. Beide Gattungen stehen innerhalb der Familie der Elefanten (Elephantidae) und der Ordnung der Rüsseltiere (Proboscidea). Die Rüsseltiere stellen eine sehr alte Gruppe originär afrikanischer Tiere dar, deren Ursprünge rund 60 Millionen Jahre in die Vergangenheit reichen. Sie waren einst sehr vielfältig mit Anpassungen an zahlreiche Biotope und Klimaregionen. Dabei besiedelten die Rüsseltiere weite Teile Eurasiens und Amerikas. Gegenüber der langen Stammesgeschichte der Rüsseltiere, sind die Elefanten als relativ junge Entwicklungslinie anzusehen, die sich erstmals im ausgehenden Miozän formierte. Vorläufer der heutigen Vertreter sind fossil vor rund 7 Millionen Jahren fassbar.[38] Übereinstimmend damit trennten sich die afrikanischen und die asiatischen Elefanten molekulargenetischen Untersuchungen zufolge vor 7,6 Millionen Jahren voneinander ab. Die Linien der beiden heutigen Angehörigen der Afrikanischen Elefanten differenzierten sich vor 5,6 bis 2,6 Millionen Jahren heraus.[39][40]
.JPG.webp)
Innerhalb der Art werden keine Unterarten unterschieden. Allerdings zeigen sich die Populationen des westlichen und des zentralen Afrikas als deutlich in ihrer mitochondrialen DNA differenziert, wofür möglicherweise die Trockenlandschaften des Dahomey Gap verantwortlich sind. Ihre Abspaltung voneinander reicht in das Mittelpleistozän vor etwa 609.000 bis 463.000 Jahren zurück. Einige Wissenschaftler plädieren daher für eine Trennung der beiden Gruppen auf unterartlicher oder artlicher Ebene.[5][41] Die entsprechenden Ergebnisse bei der Untersuchung der Kern-DNA sind dagegen weniger eindeutig. Möglicherweise überdecken hier die Wanderungen einzelner Bullen den genetischen Befund.[42]
Die wissenschaftliche Erstbeschreibung geht auf Paul Matschie aus dem Jahr 1900 zurück. Sie basiert auf einem männlichen Tier, das zur Zeit der Beschreibung im Zoo Berlin gehalten wurde. Ursprünglich stammte es aus Yaoundé im südlichen Kamerun, der Typuslokalität der Art. Matschie führte den Waldelefanten unter der Bezeichnung Elephas cyclotis, schlug aber gleichzeitig auch die Unterartbezeichnung Elephas capensis cyclotis vor. Das Artepitheton wählte er aufgrund der Gestaltung der Ohren und leitete es von den griechischen Wörtern κύκλος (kyklos) für „Kreis“ und οὖς (ous) für „Ohr“ ab, was so viel wie „rundohrig“ bedeutet.[43] Darauf verweist auch der hauptsächlich in älterer deutschsprachiger Literatur verwendete Trivialname „Rundohrelefant“.[44]
Einstufung als Art
Aus der Erstbeschreibung des Waldelefanten geht nicht eindeutig hervor, ob die neue Form auf Art- oder Unterartniveau eingestuft werden sollte. Einige Autoren wie Glover M. Allen führten ihn in den 1930er Jahren als eigenständige Art.[45] In einer Studie aus dem Jahr 1958 wies Dieter Backhaus den Waldelefanten als spezielle Form des Afrikanischen Elefanten aus, so dass beide einer Art angehörten. Zu dem Schluss kam Backhaus nach der Untersuchung von Tieren aus dem Nationalpark Garamba im Nordosten der heutigen Demokratischen Republik Kongo, die zahlreiche Mischmerkmale beider Elefantenformen aufzeigten (die dortige Population gilt heute als Hybridform[46]).[47] Nachfolgende Autoren übernahmen in der zweiten Hälfte des 20. Jahrhunderts zunehmend diese Meinung. Allerdings sprachen sich in der Wende vom 20. zum 21. Jahrhundert wiederum einzelne Wissenschaftler gegen die Vereinigung der beiden Elefantenvertreter aus und begründeten dies wiederum mit Abweichungen im Körper- und Schädelbau.[3] Eine erste DNA-Analyse aus dem Jahr 1999 ergab dann einen großen genetischen Abstand zwischen dem Wald- und dem Afrikanischen Elefanten. Nach Meinung der Autoren sollte daher der Waldelefant einen eigenständigen Artstatus erhalten.[48] Weitere molekulargenetische Untersuchungen konnten die vorhergehenden Ergebnisse bestätigen. Dabei ließ sich ein genetischer Abstand zwischen den beiden afrikanischen Elefantenformen ermitteln, der rund 58 % des Abstands zwischen den Gattungen Loxodonta und Elephas beträgt.[6][49][39][40] Unter Einbeziehung von fossilem DNA-Material zeigte sich dann, dass der Waldelefant möglicherweise dem ausgestorbenen Europäischen Waldelefanten (Palaeoloxodon antiquus) näher steht als dem Afrikanischen Elefanten (die Bezeichnung „Europäischer Waldelefant“ beruht allerdings nicht auf einem angenommenen näheren Verwandtschaftsverhältnis zum afrikanischen Waldelefanten, sondern auf seinem überwiegenden Auftreten in den waldreichen Warmzeiten des Pleistozäns). Ein besonders enges Verhältnis zeigt die Fossilform dabei zu der westlichen Population des Waldelefanten. Es ließen sich aber auch Übereinstimmungen mit dem Afrikanischen Elefanten nachweisen, was auf eine stärkere Vermischung der einzelnen Formen während der Frühphase ihrer Stammesgeschichte zurückgeführt wird.[37][41]
Die Ansicht einer artlichen Trennung des Wald- vom Afrikanischen Elefanten blieb nicht unwidersprochen. Im Jahr 2003 wurde basierend auf genetischen Befunden eine dritte Elefantenart im westlichen Afrika postuliert, die weder mit dem Wald- noch dem Afrikanischen Elefanten identisch sei.[50] Andere Studien unterschieden bis zu vier taxonomische Einheiten innerhalb der Gattung Loxodonta.[51] Analysen vor allem an der mitochondrialer DNA konnten aufzeigen, dass sich der Wald- und der Afrikanische Elefant einzelne Haplotypen teilen. Demnach besteht unter anderem im Kontaktbereich der Verbreitungsgebiete der beiden afrikanischen Elefantenformen, so im westlichen und zentralen Bereich des Kontinents, ein mehr oder weniger breiter Hybridisierungskorridor.[7][52][46] Die Vermischung von Wald- und Afrikanischem Elefant ist nicht nur genetisch feststellbar, sondern lässt sich dort auch an morphologischen Merkmalen belegen.[53] Von manchen Forschern wird diese Hybridbildung als Argument gegen die Eigenständigkeit des Waldelefanten angeführt, da eine Vermischung nicht mit dem biologischen Artkonzept vereinbar wäre. Dadurch entstehen innerhalb der Gattung Loxodonta komplexe phylogeographische und verwandtschaftliche Verhältnisse, welche die Existenz von zwei oder gar drei Arten nicht unterstützen.[7] Allerdings zeigen sich unter Vernachlässigung der west- und zentralafrikanischen Hybridpopulation innerhalb der Gattung Loxodonta zwei genetisch deutlich unterscheidbare Linien, so dass der Wald- und der Afrikanische Elefant trotz des bestehenden Genaustauschs jeweils als eigenständige Arten angesehen werden können.[54][52][8]
Zur Problematik des „Zwergelefanten“
Im Jahr 1906 stellte Theophil Noack ein sehr kleines, weibliches Individuum von nur 120 cm Schulterhöhe aus dem Gebiet der heutigen Republik Kongo vor, das sich zu dem Zeitpunkt im Hamburger Zoo befand. Er verwies dieses zu der Form Elephas africanus pumilio, die er als „Zwergelefant“ ansah. Neben der geringen Körpergröße gab Noack unter anderem die abweichende Gestaltung der Ohren, die wesentlich glattere Haut sowie die seitlich abstehenden Stoßzähne als besondere Merkmale an.[55] Eine ebenfalls sehr kleine Form führte Henri Schouteden nur sieben Jahre später anhand eines Tieres vom Mai-Ndombe-See ein und benannte sie mit Elephas africanus fransseni. Schouteden postulierte eine aquatische Lebensweise für die neue Unterart (l’éléphant d’eau, etwa „Wasserelefant“).[56] Später wurde L. fransseni mit L. pumilio gleichgesetzt.[44] Die Existenz des „Zwergelefanten“ war lange Zeit umstritten. Sie wurde aber teilweise durch die Sichtung einzeln auftretender, kleiner Individuen mit weniger als 200 cm Schulterhöhe und ausgebildeten Stoßzähnen unterstützt. Im weiteren Verlauf sollten noch einzelne zusätzliche Merkmale herausgearbeitet werden, etwa in der Rüsselspitze, die beim „Zwergelefant“ über einen deutlich breiteren unteren Finger verfügte als beim Waldelefanten.[57] Verschiedene Forscher befürworteten eine Abtrennung des „Zwergelefanten“ vom Waldelefanten, wobei ersterer variierend den Status als eigenständige Art oder als Unterart besaß.[44][58][59] Andere wiederum lehnten dies ab und verwiesen unter anderem auf die Tatsache, dass das Typusexemplar von L. pumilio nach seinem Transfer nach New York noch bis 1915 unter dem Namen „Congo“ lebte und zwischenzeitlich kräftig bis auf über 200 cm Schulterhöhe gewachsen war.[60][61] Anatomische Studien aus dem Jahr 2000 an Schädelmaterial von L. pumilio und L. cyclotis konnten keine Unterschiede zwischen beiden Formen feststellen.[62] Zu einem ähnlichen Schluss kamen wenig später vorgenommene genetische Studien, bei denen sich der „Zwergelefant“ nicht vom Waldelefanten differenzieren ließ. Heute gehen Wissenschaftler daher davon aus, dass es sich bei den Sichtungen vermeintlicher „Zwergelefanten“ um isolierte Jungtiere oder um krankheitsbedingt verzwergte Individuen des Waldelefanten handelt.[63][5][1]
Bedrohung und Schutz
Die IUCN stuft den Waldelefant als „vom Aussterben bedroht“ (Critically Endangered) ein. Der Bestand ist in den letzten 90 Jahren um über 80 % zurückgegangen.[64] Das Washingtoner Artenschutzübereinkommen (CITES) listet ihn ebenso gemeinsam mit dem Afrikanischen Elefanten im Anhang I, der den internationalen kommerziellen Handel mit den Tieren verbietet.[65] Generell ist der Waldelefant von der Vernichtung der tropischen Regenwälder durch Rodung sowie Straßenbau betroffen. Da der Waldelefant Bereiche mit starker menschlicher Beeinflussung oder Aktivität meidet, unter anderem Verkehrswege, führt dies zur Zersplitterung der Lebensräume und lokalen Bestände. Ein weiterer großer Einflussfaktor ist die Wilderei, hauptsächlich die Jagd nach Elfenbein. Besonders in der zweiten Hälfte des 20. Jahrhunderts setzten beide Faktoren dem Bestand erheblich zu. Sein Rückgang blieb aber weitgehend durch den dichten Wald verborgen. Mit der Auflistung der afrikanischen Elefanten in der CITES änderte sich dies nicht grundlegend, da die örtlichen Behörden häufig ineffektiv in der Bekämpfung der Wilderei und illegalen Abholzung sind. Allein zwischen 2002 und 2011 nahm die Populationsgröße im zentralen Afrika schätzungsweise um 62 % ab und erreichte nur noch 10 % des möglichen Bestandsumfangs. Auch besiedelte der Waldelefant zu diesem Zeitpunkt nur noch etwa ein Viertel der potenziell habituablen Landschaft. Allein 2011 verlor der Waldelefant durch illegale Jagd weiteren Schätzungen zufolge wohl 3 % seines Gesamtbestandes, was etwa 40.000 getöteten Tieren entspricht.[66][67] Nach einem Wildtierzensus des WWF in Kamerun, der Republik Kongo, der Zentralafrikanischen Republik und Gabun ging zwischen 2005 und 2016 der Bestand in einzelnen Schutzgebieten der Region um lokal 51 bis 90 % zurück.[68] Gleiches kann zum Vorkommen in der Elfenbeinküste gesagt werden, wo die Art zwischen den Jahren 1991 und 2017 aus 21 von 25 Schutzgebieten verschwand. Die größte verbliebene Population mit knapp 190 Tieren besteht im Nationalpark Taï, in den übrigen Schutzgebieten leben schätzungsweise jeweils zwischen 5 und 16 Individuen.[69] Zu den bedeutendsten Nationalparks in Afrika, in denen der Waldelefant präsent ist, gehören unter anderem der Dzanga-Ndoki-Nationalpark im umfassenderen Dzanga-Schutzgebiet in der Zentralafrikanischen Republik, der Nationalpark Loango und der Nationalpark Lopé in Gabun, der Nationalpark Odzala in der Republik Kongo sowie das Okapi-Wildtierreservat in der Demokratischen Republik Kongo.[5][1]
Literatur
- Andrea Turkalo und Richard Barnes: Loxodonta cyclotis Forest Elephant. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 195–200.
- Don E. Wilson und DeenAnn M. Reeder: Mammal Species of the World. A taxonomic and geographic reference. Johns Hopkins University Press, Baltimore MD 2005, ISBN 0-8018-8221-4.
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 50–79 (S. 77–78).
Einzelnachweise
- Andrea Turkalo und Richard Barnes: Loxodonta cyclotis Forest Elephant. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 195–200.
- Bethan J. Morgan und P. C. Lee: Forest elephant (Loxodonta africana cyclotis) stature in the Réserve de Faune du Petit Loango, Gabon. Journal of Zoology 259, 2003, S. 337–344.
- Peter Grubb, Colin P. Groves, Joseph P. Dudley und Jeheskel Shoshani: Living African elephants belong to two species: Loxodonta africana (Blumenbach, 1797) and Loxodonta cyclotis (Matschie, 1900). Elephant 2 (4), 2000, S. 1–4.
- Bethan J. Morgan: Group size, density and biomass of large mammals in the Réserve de Faune du Petit Loango, Gabon. African Journal of Ecology 45, 2007, S. 508–518.
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 50–79 (S. 77–78).
- Alfred L. Roca, Nicholas Georgiadis, Jill Pecon-Slattery, und Stephen J. O'Brien: Genetic evidence for two species of elephant in Africa. Science 293 (5534), 2001, S. 1473–1477.
- Régis Debruyne: A case study of apparent conflict between molecular phylogenies: the interrelationships of African elephants. Cladistics 21, 2005, S. 31–50.
- Yasuko Ishida, Taras K. Oleksyk, Nicholas J. Georgiadis, Victor A. David, Kai Zhao, Robert M. Stephens, Sergios-Orestis Kolokotronis und Alfred L. Roca: Reconciling Apparent Conflicts between Mitochondrial and Nuclear Phylogenies in African Elephants. PloS ONE 6 (6), 2011, S. e20642, doi:10.1371/journal.pone.0020642.
- Délagnon Assou, Neil D'Cruze, Hannah Kirkland, Mark Auliya, David W. Macdonald und Gabriel H. Segniagbeto: Camera trap survey of mammals in the Fazao‐Malfakassa National Park, Togo, West Africa. African Journal of Ecology, 2021, doi:10.1111/aje.12856.
- Jörn Theuerkauf, Hermann Ellenberg, Wolf Ekkehard Waitkuwait und Michael Mühlenberg: Forest elephant distribution and habitat use in the Bossematié Forest Reserve, Ivory Coast. Pachyderm 30, 2001, S. 37–43.
- Ralph Buij, William J. McShea, Patrick Campbell, Michelle E. Lee, Francisco Dallmeier, Sylvain Guimondou, Loïc Mackaga, Nicaise Guisseougou, Serge Mboumba, James E. Hines, James D. Nichols und Alfonso Alonso: Patch-occupancy models indicate human activity as major determinant of forest elephant Loxodonta cyclotis seasonal distribution in an industrial corridor in Gabon. Biological Conservation 135, 2007, S. 189–201.
- Stephen Blake, Sharon L. Deem, Samantha Strindberg, Fiona Maisels, Ludovic Momont, Inogwabini-Bila Isia, Iain Douglas-Hamilton, William B. Karesh und Michael D. Kock: Roadless Wilderness Area Determines Forest Elephant Movements in the Congo Basin. PLoS ONE 3 (10), 2008, S. e3546, doi:10.1371/journal.pone.0003546.
- A. Laguardia, K. S. Gobush, S. Bourgeois, S. Strindberg, G. Abitsi, F. Ebouta, J. M. Fay, A. M. Gopalaswamy, F. Maiselsa, R. Ogden, L. J. T. Whitec und E. J. Stokes: Assessing the feasibility of density estimation methodologies for African forest elephant at large spatial scales. Global Ecology and Conservation 27, 2021, S. e01550, doi:10.1016/j.gecco.2021.e01550.
- A. Laguardia, S. Bourgeois, S. Strindberg, K. S. Gobush, G. Abitsi, H. G. Bikang Bi Ateme, F. Ebouta, J. M. Fay, A. M. Gopalaswamy, F. Maisels, E. L. F. Simira Banga Daouda, L. J. T. White und E.J.Stokes: Nationwide abundance and distribution of African forest elephants across Gabon using non-invasive SNP genotyping. Global Ecology and Conservation, 2021, S. e01894, doi:10.1016/j.gecco.2021.e01894.
- Andrea K. Turkalo, Peter H. Wrege und George Wittemyer: Long-term monitoring of Dzanga Bai forest elephants: forest clearing use patterns. PLoS ONE 8 (12), 2013, S. e85154, doi:10.1371/journal.pone.0085154.
- Andrea K. Turkalo, Peter H. Wrege und George Wittemyer: Demography of a forest elephant population. PLoS ONE 13 (2), 2018, S. e0192777, doi:10.1371/journal.pone.0192777.
- C. Marechal, C. Maurois und C. Chamberlan: Size (and structure) of forest elephants groups (Loxodonta africana cyclotis Matschie, 1900) in the Odzala National Park, Republic of Congo: Mammalia 62 (2), 1998, S. 297–300.
- Bethan J. Morgan und P. C. Lee: Forest elephant group composition, frugivory and coastal use in the Réserve de Faune du Petit Loango, Gabon. African Journal of Ecology 45, 2007, S. 519–526.
- Stephanie G. Schuttler, Alden Whittaker, Kathryn J. Jeffery und Lori S. Eggert: African forest elephant social networks: fission-fusion dynamics, but fewer associations. Endangered Species Research 25, 2014, S. 165–173.
- Vicki Fishlock, Phyllis C. Lee undThomas Breuer: Quantifying forest elephant social structure in Central African bai environments. Pachyderm 44, 2008, S. 19–28.
- Vicki Fishlock und Phyllis C. Lee: Forest elephants: fission-fusion and social arenas. Animal Behaviour 85, 2013, S. 357–363.
- S. Blake, I. Douglas-Hamilton und W. B. Karesh: GPS telemetry of forest elephants: results of a preliminary study. African Journal of Ecology 39, 2001, S. 178–186.
- Peter H. Wrege, Elizabeth D. Rowland, Nicolas Bout und Modeste Doukaga: Opening a larger window onto forest elephant ecology. African Journal of Ecology 50, 2011, S. 176–183.
- Stephen Blake und Clement Inkamba-Nkulu: Fruit, Minerals, and Forest Elephant Trails: Do All Roads Lead to Rome? Biotropica 36 (3), 2004, S. 392–401.
- Stephanie G. Schuttler, Stephen Blake und Lori S. Eggert: Movement Patterns and Spatial Relationships Among African Forest Elephants. Biotropica 44 (4), 2012, S. 445–448.
- Emily C. Mills, John R. Poulsen, J. Michael Fay, Peter Morkel, Connie J. Clark, Amelia Meier, Christopher Beirne und Lee J. T. White: Forest elephant movement and habitat use in a tropical forest-grassland mosaic in Gabon. PLoS ONE 13 (7), 2018, S. e0199387 doi:10.1371/journal.pone.0199387.
- Michael A. Pardo, Joyce H. Poole, Angela S. Stoeger, Peter H. Wrege, Caitlin E. O’Connell-Rodwell, Udaha Kapugedara Padmalal und Shermin de Silva: Differences in combinatorial calls among the 3 elephant species cannot be explained by phylogeny. Behavioral Ecology 30 (3), 2019, S. 809–820, doi:10.1093/beheco/arz018.
- Jeff Short: Diet and feeding behaviour of the forest elephant. Mammalia 45 (2), 1918, S. 177–185.
- J. Theuerkauf, W. E. Waitkuwatt, Y. Guiro, H. Ellenberg und S. Porembski: Diet of forest elephants and their role in seed dispersal in the Bossematie Forest Reserve, Ivory Coast. Mammalia 64 (4), 2000, S. 447–460.
- Günter Merz: Recherches sur la biologie de nutrition et les habitats preférés de l'éléphant de forêt, Loxodonta africana cyclotis Matschie, 1900. Mammalia 45 (3), 1981, S. 299–312.
- Gregor Klaus, Corinne Klaus-Hugi und Bernhard Schmid: Geophagy by large mammals at natural licks in the rain forest of Dzanga National Park, Central African Republic. Journal of Tropical Ecology 14 (6), 1998, S. 829–839.
- D. C. Houston, J. D. Gilardi und A. J. Hall: Soil consumption by elephants might help to minimize the toxic effect of plant secondary compounds in forest browse. Mammal Review 31 (3/4), 2001, S. 249–254.
- Andrea K. Turkalo: Estimating forest elephant age. African Journal of Ecology 51, 2013, S. 501–505.
- John M. Kinsella, Sharon L. Deem, Stephen Blake und Andrea S. Freeman: Endoparasites of African Forest Elephants (Loxodonta africana cyclotis) from the Republic of Congo and Central African Republic. Comparative Parasitology 71 (2), 2004, S. 104–110.
- Ahimsa Campos-Arceiz und Steve Blake: Megagardeners of the forest – the role of elephants in seed dispersal. Acta Oecologia 37, 2011, S. 542–553
- William D. Hawthorne und Marc P. E. Parren: How important are forest elephants to the survival of woody plant species in Upper Guinean forests? Journal of Tropical Ecology 16, 2000, S. 133–150.
- Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro und Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. eLife 6, 2017, S. e25413, doi:10.7554/eLife.25413.
- Jeheskel Shoshani und Pascal Tassy: Family Elephantidae Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 176–178.
- Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus und Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. PLoS Biology 5 (8), 2007, S. e207, doi:10.1371/journal.pbio.0050207.
- Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca und Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biology 8 (12), 2010, S. e1000564, doi:10.1371/journal.pbio.1000564.
- Eleftheria Palkopoulou, Mark Lipson, Swapan Mallick, Svend Nielsen, Nadin Rohland, Sina Baleka, Emil Karpinski, Atma M. Ivancevic, Thu-Hien To, R. Daniel Kortschak, Joy M. Raison, Zhipeng Qu, Tat-Jun Chin, Kurt W. Alt, Stefan Claesson, Love Dalén, Ross D. E. MacPhee, Harald Meller, Alfred L. Roca, Oliver A. Ryder, David Heiman, Sarah Young, Matthew Breen, Christina Williams, Bronwen L. Aken, Magali Ruffier, Elinor Karlsson, Jeremy Johnson, Federica Di Palma, Jessica Alfoldi, David L. Adelson, Thomas Mailund, Kasper Munch, Kerstin Lindblad-Toh, Michael Hofreiter, Hendrik Poinar und David Reich: A comprehensive genomic history of extinct and living elephants. PNAS 115 (11), 2018, S. E2566–E2574, doi:10.1073/pnas.1720554115.
- Yasuko Ishida, Natalie A. Gugala, Nicholas J. Georgiadis und Alfred L. Roca: Evolutionary and demographic processes shaping geographic patterns of genetic diversity in a keystone species, the African forest elephant (Loxodonta cyclotis). Ecology and Evolution 8, 2018, S. 4919–4931.
- Paul Matschie: Geographische Abarten des afrikanischen Elefanten. Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin 1900, S. 189–197 (S. 194), (online).
- Hermann Pohle: Notizen über afrikanische Elefanten. Zeitschrift für Säugetierkunde 1, 1926, S. 58–64 (online).
- Glover M. Allen: Zoological results of the George Vanderbilt African Expedition of 1934. Part II: The forest elephant of Africa. Proceedings of the Academy of Natural Sciences of Philadelphia 88, 1936, S. 15–44.
- Samrat Mondol, Ida Moltke, John Hart, Michael Keigwin, Lisa Brown, Matthew Stephens und Samuel K. Wasser: New evidence for hybrid zones of forest and savanna elephants in Central and West Africa. Molecular Ecology 24, 2015, S. 6134–6147.
- Dieter Backhaus: Zur Variabilität der äußeren systematischen Merkmale des afrikanischen Elefanten (Loxodonta Cuvier, 1825). Säugetierkundliche Mitteilungen 6 (4), 1958, S. 166–173.
- Véronique Barriela, Estelle Thuet und Pascal Tassy: Molecular phylogeny of Elephantidae. Extreme divergence of the extant forest African elephant. Comptes Rendus de l’Académie des Sciences 322, 1999, S. 447–454.
- Kenine E. Comstock, Nicholas Georgiadis, Jill Pecon-Slattery, Alfred L. Roca, Elaine A. Ostrander, Stephen J. O’Brien und Samuel K. Wasser: Patterns of molecular genetic variation among African elephant populations. Molecular Ecology 11 (12), 2002, S. 2489–2498.
- Lori S. Eggert, Caylor A. Rasner und David S. Woodruff: The evolution and phylogeography of the African elephant inferred from mitochondrial DNA sequence and nuclear microsatellite markers. Proceedings of the Royal Society of London B 269, 2002, S. 1993–2006.
- Mireille B. Johnson, Stephen L. Clifford, Benoît Goossens, Silvester Nyakaana, Bryan Curran, Lee J. T. White, E. Jean Wickings und Michael W. Bruford: Complex phylogeographic history of central African forest elephants and its implications for taxonomy. BMC Evolutionary Biology 7, 2007, S. 244, doi:10.1186/1471-2148-7-244.
- Yumie Murata, Takahiro Yonezawa, Ichiro Kihara, Toshihide Kashiwamura, Yuji Sugihara, Masato Nikaidoa, Norihiro Okada, Hideki Endo und Masami Hasegawa: Chronology of the extant African elephant species and case study of the species identification of the small African elephant with the molecular phylogenetic method. Gene 441, 2009, S. 176–186.
- Colin P. Groves und Peter Grubb: Do Loxodonta cyclotis and L. africana interbred? Elephant 2 (4), 2000, S. 4–7.
- Alfred L. Roca, Nicholas Georgiadis und Stephen J. O’Brien: Cyto-nuclear genomic dissociation and the African elephant species question. Quaternary International 169/170, 2007, S. 4–16.
- Theophil Noack: A dwarf form of the African elephant. Annals and Magazine of Natural History 17, 1906, S. 501–503 (online).
- Henri Schouteden: L’éléphant nain du lac Léopold-II (Congo). Revue Zoologique africaine 3, 1913, S. 391–397 (online).
- Chalmers Mitchell: Exhibition of, and remarks upon, some photographs of a young male African elephant in the New York Zoological Garden. Proceedings of the Zoological Society 1907, S. 447–448 (online).
- E. Bourdelle und F. Petter: Note relative à un éléphant nain du Gabon. Mammalia 13, 1950, S. 144–153.
- L. Blancou: A propos des formes naines de l’éléphant d’Afrique. Mammalia 26, 1962, S. 343–361.
- T. C. S. Morrison-Scott: A revision of the knowledge of African elephants' teeth, with notes on Forrest and "Pygmy" elephants. Proceedings of the Zoological Society 117, 1948, S. 505–527.
- Pierre Pfeffer: Sur la validité de formes naines de l’éléphant d’Afrique. Mammalia 24, 1960, S. 556–576.
- Colin P. Groves und Peter Grubb: Are there pygmy elephants? Elephant 2 (4), 2000, S. 8–10.
- Régis Debruyne, Arnaud Van Holt, Véronique Barriel und Pascal Tassy: Status of the so-called African pygmy elephant (Loxodonta pumilio (NOACK 1906)): phylogeny of cytochrome b and mitochondrial control region sequences. Comptes Rendus Biologies 326, 2003, S. 687–697.
- K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour und R. D. Taylor: Loxodonta cyclotis. The IUCN Red List of Threatened Species 2021. e.T181007989A181019888 (); zuletzt abgerufen am 26. März 2021.
- CITES: Loxodonta africana. (online); zuletzt abgerufen am 24. Juni 2018.
- Fiona Maisels, Samantha Strindberg, Stephen Blake, George Wittemyer, John Hart, Elizabeth A. Williamson, Rostand Aba’a, Gaspard Abitsi, Ruffin D. Ambahe, Fidèl Amsini, Parfait C. Bakabana, Thurston Cleveland Hicks, Rosine E. Bayogo, Martha Bechem, Rene L. Beyers, Anicet N. Bezangoye, Patrick Boundja, Nicolas Bout, Marc Ella Akou, Lambert Bene Bene, Bernard Fosso, Elizabeth Greengrass, Falk Grossmann, Clement Ikamba-Nkulu, Omari Ilambu, Bila-Isia Inogwabini, Fortune Iyenguet, Franck Kiminou, Max Kokangoye, Deo Kujirakwinja, Stephanie Latour, Innocent Liengola, Quevain Mackaya, Jacob Madidi, Bola Madzoke, Calixte Makoumbou, Guy-Aimé Malanda, Richard Malonga, Olivier Mbani, Valentin A. Mbendzo, Edgar Ambassa, Albert Ekinde, Yves Mihindou, Bethan J. Morgan, Prosper Motsaba, Gabin Moukala, Anselme Mounguengui, Brice S. Mowawa, Christian Ndzai, Stuart Nixon, Pele Nkumu, Fabian Nzolani, Lilian Pintea, Andrew Plumptre, Hugo Rainey, Bruno Bokoto de Semboli, Adeline Serckx, Emma Stokes, Andrea Turkalo, Hilde Vanleeuwe, Ashley Vosper und Ymke Warren: Devastating decline in forest elephants in Central Africa. PLoS ONE 8 (3), 2013, S. e59469, doi:10.1371/journal.pone.0059469.
- George Wittemyer, Joseph M. Northrup, Julian Blanc, Iain Douglas-Hamilton, Patrick Omondi und Kenneth P. Burnham: Illegal killing for ivory drives global decline in African elephants. PNAS 111 (36), 2014, S. 13117–13121, 2014.
- N’Goran Kouame Paul, Nzooh Dongmo Zacharie Laurent und Le-Duc Yeno Stephane: WWF Biomonitoring activities from 2014 to 2016. Status of Forest Elephant and Great Apes in Central Africa Priority Sites. WWF, 2017, S. 1–47 (online als PDF).
- Jean-Louis Kouakou, Sery Gonedelé Bi, Eloi Anderson Bitty, Célestin Kouakou, Alphonse Kouassi Yao, Kouadio Bénoîtype Kassé und Soulemane Ouattara: Ivory Coast without ivory: Massive extinction of African forest elephants in Côte d’Ivoire. PLoS ONE 15 (10), 2020, S. e0232993, doi:doi.org/10.1371/journal.pone.0232993.
Weblinks
- Loxodonta cyclotis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour & R. D. Taylor, 2020. Abgerufen am 26. März 2021.
- Fotos und Informationen auf arkive.org (Memento vom 27. Juni 2018 im Internet Archive).