Afrikanischer Elefant
Der Afrikanische Elefant (Loxodonta africana), auch Afrikanischer Steppenelefant oder Afrikanischer Buschelefant, ist eine Säugetierart aus der Familie der Elefanten. Er ist das größte rezente landbewohnende Tier der Erde. Herausragende Kennzeichen sind neben den Stoßzähnen und dem markanten Rüssel die großen Ohren und die säulenförmigen Beine. In zahlreichen morphologischen und anatomischen Merkmalen unterscheidet sich der Afrikanische Elefant von seinen etwas kleineren Verwandten, dem Waldelefanten und dem Asiatischen Elefanten. Das Verbreitungsgebiet umfasst heute große Teile von Afrika südlich der Sahara. Die Tiere haben sich dort an zahlreiche unterschiedliche Lebensräume angepasst, die von geschlossenen Wäldern über offene Savannenlandschaften bis hin zu Sumpfgebieten und wüstenartigen Regionen reichen. Insgesamt ist das Vorkommen aber stark fragmentiert.
| Afrikanischer Elefant | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Afrikanischer Elefant (Loxodonta africana) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Loxodonta africana | ||||||||||||
| (Blumenbach, 1797) |
Die Lebensweise des Afrikanischen Elefanten ist durch intensive Studien gut erforscht. Sie wird durch einen stark sozialen Charakter geprägt. Weibliche Tiere und ihr Nachwuchs leben in Familienverbänden (Herden). Diese formieren sich wiederum zu einem enger verwandten Clan. Die einzelnen Herden treffen sich zu bestimmten Gelegenheiten und trennen sich danach wieder. Die männlichen Tiere bilden Junggesellengruppen. Die verschiedenen Verbände nutzen Aktionsräume, in denen sie teils im Jahreszyklus herumwandern. Für die Kommunikation untereinander nutzen die Tiere verschiedene Töne im niedrigen Frequenzbereich. Anhand der Lautgebung, aber auch durch bestimmte chemische Signale können sich die einzelnen Individuen untereinander erkennen. Darüber hinaus besteht ein umfangreiches Repertoire an Gesten. Hervorzuheben sind auch die kognitiven Fähigkeiten des Afrikanischen Elefanten.
Die Nahrung besteht sowohl aus weicher wie auch harter Pflanzenkost. Die Zusammensetzung variiert dabei regional und jahreszeitlich. Generell verbringt der Afrikanische Elefant einen großen Teil seiner Tagesaktivitäten mit der Nahrungsaufnahme. Die Fortpflanzung erfolgt ganzjährig, regional gibt es Tendenzen zu einer stärkeren Saisonalisierung. Bullen kommen einmal jährlich in die Musth, während deren sie auf Wanderung zur Suche nach fortpflanzungswilligen Kühen gehen. Während der Musth ist die Aggressivität gesteigert, es finden dann auch Rivalenkämpfe statt. Der Sexualzyklus der Kühe dauert vergleichsweise lange und weist einen für Säugetiere untypischen Verlauf auf. Nach erfolgter Geburt setzt er in der Regel mehrere Jahre aus. Zumeist wird nach fast zweijähriger Tragzeit ein Jungtier geboren, das in der mütterlichen Herde aufwächst. Junge weibliche Tiere verbleiben später in der Herde, die jungen männlichen verlassen diese.
Die wissenschaftliche Erstbeschreibung des Afrikanischen Elefanten erfolgte im Jahr 1797 mit einer formalen artlichen Trennung des Afrikanischen vom Asiatischen Elefanten. Der heute gebräuchliche Gattungsname Loxodonta wurde offiziell erst dreißig Jahre später eingeführt. Die Bezeichnung bezieht sich auf markante Zahnunterschiede zwischen den asiatischen und den afrikanischen Elefanten. Im Verlauf des 20. Jahrhunderts wurden mehrere Unterarten unterschieden, darunter auch der Waldelefant des zentralen Afrikas. Letzterer gilt heute genetischen Untersuchungen zufolge als eigenständige Art, die weiteren Unterarten sind nicht anerkannt. Stammesgeschichtlich lässt sich der Afrikanische Elefant erstmals im beginnenden Mittleren Pleistozän belegen. Der Gesamtbestand gilt als stark gefährdet. Ursachen hierfür sind hauptsächlich die Jagd nach Elfenbein und Lebensraumverlust durch die zunehmend wachsende menschliche Bevölkerung. Der Afrikanische Elefant zählt zu den sogenannten „Big Five“ von Großwildjagd und Safari.
Merkmale
Habitus
Der Afrikanische Elefant ist das größte lebende Landsäugetier und relativ leicht am Rüssel, an den Stoßzähnen, den großen Ohren und den säulenförmigen Beinen erkennbar. Die Kopf-Rumpf-Länge beträgt 600 bis 750 cm, der Schwanz wird noch einmal 100 bis 150 cm lang.[1] Ein ausgewachsener Bulle besitzt nach Untersuchungen im Amboseli-Nationalpark eine Schulterhöhe von 290 bis 370 cm. Kühe sind mit Maßen von 250 bis 300 cm durchschnittlich kleiner. Für den Kruger-Nationalpark liegen die Größenwerte für männliche Tiere bei maximal 345 cm, für weibliche bei 274 cm, wobei 255 cm selten überschritten werden. Maximalgewichte für Bullen werden mit 6048 kg, für Kühe mit 3232 kg angegeben. Ein besonders großes Individuum wog 6569 kg. Das größte wissenschaftlich vermessene Exemplar, ein Tier aus Fenykoevi in Angola, wies eine Schulterhöhe von 400 cm und ein Gewicht von rund 10 t auf, es ist heute im Smithsonian Institution in Washington, D.C. ausgestellt.[2][3]
Der Kopf ist massiv und groß, bei ausgewachsenen Bullen breiter als bei Kühen und jüngeren Individuen. Im Gegensatz zur hochgewölbten, zweihöckerigen Stirn des Asiatischen Elefanten (Elephas maximus) hat der Afrikanische Elefant eine flache, fliehende Stirnpartie. Die charakteristischen großen Ohren messen etwa 120 cm in der Breite und bis zu 200 cm in der Höhe. Ihr Umriss erinnert ein wenig an die Konturen des afrikanischen Kontinents. Sie sind im Vergleich zum Asiatischen Elefanten deutlich größer. Der Rüssel endet in zwei „Fingern“, der Asiatische Elefant weist nur einen auf. Ein weiterer Unterschied zum Asiatischen Elefanten findet sich im Rückenverlauf, der beim Afrikanischen Elefanten eher eingesattelt ist, so dass der höchste Punkt an den Schultern erreicht wird. Beim Asiatischen Elefanten tritt ein charakteristischer Buckelrücken auf, der höchste Körperpunkt findet sich zudem an der Stirn. Der Waldelefant (Loxodonta cyclotis) wiederum weist eine eher gerade verlaufende Rückenlinie auf. Die generelle Hautfärbung entspricht einem fahlen Grau- bis Braunton, in seltenen Fällen sind helle, pigmentfreie Flecken erkennbar. Die Dicke der Haut erreicht an den Beinen, dem Vorderkopf und am Rücken bis zu 40 mm, sie zeigt sich generell gerunzelt. Die Körperbehaarung ist spärlich über den Körper verteilt. Jungtiere besitzen aber häufig ein lockeres, rötlichbraunes Fell. Längere Haare sind bei ausgewachsenen Tieren in der Regel nur am Kinn und am Rüssel ausgebildet, sie weisen Längen von rund 40 mm auf. Zusätzlich befindet sich am Schwanzende ein Büschel aus bis zu 50 cm langen, teils schwärzlich glänzenden Haaren. Die Vorder- und Hinterfüße weisen jeweils fünf Zehen auf. Äußerlich sind vorn vier bis fünf und hinten drei bis fünf hufartige Nägel ausgebildet. Die Sohle ist weich und rissig sowie individuell gestaltet. Sie hinterlässt charakteristische rundliche Spuren. Die der Vorderfüße übertreffen generell die der Hinterfüße. Die Länge der Hinterfüße variiert von 34 bis 54 cm, sie verhält sich proportional zur Schulterhöhe eines Tieres.[4][1][3]
Schädel- und Gebissmerkmale

Der Schädel ist allgemein groß gebaut, ein vermessenes Exemplar besaß eine Länge von 92 cm und an den Jochbögen eine Breite von 73 cm.[5] Im Vergleich zum Asiatischen Elefanten zeigt sich der Schädel des Afrikanischen Elefanten deutlich gerundeter und weniger hoch. Die Stirnlinie ist in der Vorderansicht bei den afrikanischen Tieren eher gerade oder gewölbt verlaufend und nicht so markant eingedellt wie bei den asiatischen. Typisch für Elefantenschädel sind die ausgedehnten luftgefüllten Kammern in der Schädeldecke, die an Bienenwaben erinnern. Sie reduzieren einerseits das Gewicht des Schädels, vergrößern andererseits aber auch die Oberfläche, wodurch mehr Ansatzflächen für die massive Nacken- und Kaumuskulatur zur Verfügung stehen. Durch die extremen Pneumatisierungen kann die Schädeldecke bis 30 oder 40 cm dick sein. Der Gesichtsbereich des Schädels wird aus den Nasenbeinen, dem Oberkiefer, dem Jochbein und dem Mittelkieferknochen gebildet. Das Nasenbein zeigt sich aufgrund der Rüsselbildung klein, die Nasenöffnung liegt auf der Höhe der Orbita und damit niedriger als beim Asiatischen Elefanten. Der Mittelkieferknochen formt die Außenhülle der Alveolen der Stoßzähne. Beim Afrikanischen Elefanten stehen die Alveolen seitlich auseinander und ragen leicht nach vorn gekrümmt, beim Asiatischen Elefanten dagegen sind sie direkt nach unten gerichtet. Als generelles Kennzeichen der Tethytheria fusioniert der Mittelkieferknochen unter anderem mit dem Stirnbein. Das Stirnbein selbst ist beim Afrikanischen Elefanten sehr breit und gerundet gestaltet, beim Asiatischen Elefanten hingegen schmal, da es oberhalb der Nasenöffnung einzieht. Die Scheitelbeine stellen die größten Schädelknochen dar. Auf ihnen verläuft eine kleine Furche nach unten, die beim Asiatischen Elefanten markanter ausgeprägt ist. Am Hinterhauptsbein zeigen die Gelenkflächen zur Artikulation mit der Halswirbelsäule deutlich nach hinten. Sie liegen ebenfalls auf Höhe der Orbita und damit niedriger als beim asiatischen Gegenstück. Der äußere Gehörgang befindet sich unmittelbar in der Nähe der Hinterhauptsgelenke, während er beim Asiatischen Elefanten niedriger positioniert ist.[6][7][8]
Der Unterkiefer weist einen eher grazilen Bau auf mit einem langen und niedrigen horizontalen Knochenkörper. Er weicht damit vom breiten und geschwollenen Unterkiefer des Asiatischen Elefanten ab. In der Aufsicht von oben zeigt er sich V-förmig, während der des Asiatischen Elefanten mehr U-förmig wirkt. Insgesamt besteht der Unterkiefer aus massiven, kompakten Knochen. Die Symphyse am vorderen Unterkiefer zur Verbindung der beiden Kieferbögen zieht nach vorn in einem langen und schmalen Fortsatz aus. Die Knochenverbindung selbst ist mit durchschnittlich 17 cm Länge relativ und absolut kürzer als beim kleineren Waldelefanten.[9] An der Außenseite sind mehrere Öffnungen ausgebildet, die als seitliche und mittleres Foramen mentale bezeichnet werden. Das hintere Ende des Unterkiefers wirkt durch den geschwungenen Winkelfortsatz gerundet. Der aufsteigende Ast ist breit, der Kronenfortsatz erhebt sich nur wenig über die Kauebene und liegt etwa auf der Hälfte der gesamten Unterkieferlänge. Er ist gerade geformt im Gegensatz zum gerundeten Kronenfortsatz des Asiatischen Elefanten. Der Gelenkfortsatz wiederum verläuft gerade nach oben und nicht nach innen eingewinkelt wie beim asiatischen Verwandten. Auf der Innenseite des aufsteigenden Astes öffnet sich ein großes Foramen mandibulae. Die Außenseite birgt dagegen die flach eingedellte Fossa masseterica, die nicht so tief ausgeprägt ist wie beim Asiatischen Elefanten.[6][7][8]
Das Gebiss setzt sich aus 26 Zähnen zusammen, die sich zu folgender Zahnformel gruppieren: . Charakteristisch sind die Stoßzähne, die nur im oberen Gebiss ausgebildet werden und aus den jeweils hypertrophierten zweiten Schneidezähnen bestehen. Sie kommen beim Afrikanischen Elefanten im Gegensatz zum Asiatischen Elefanten in aller Regel sowohl bei den männlichen als auch den weiblichen Tieren vor. Die Stoßzähne haben einen deutlich gekrümmten und teils nach außen gebogenen Verlauf, abweichend von denen des Waldelefanten mit ihrer eher geraden Form. Rekordmaße reichen bis zu 345 cm. Ein extrem großes Stoßzahnpaar stammt von einem Individuum vom Kilimandscharo mit Längen von 319 beziehungsweise 311 cm und einem Gewicht von 97 beziehungsweise 102 kg, Im Kruger-Nationalpark wog der bisher schwerste Stoßzahn einer Kuh etwa 11 kg, Gewichte über 7 kg werden aber selten erreicht. Bei alten Bullen betrug das größte bisher registrierte Gewicht hier 73,5 beziehungsweise 69 kg. Der basale Durchmesser der Stoßzähne männlicher Tiere variiert insgesamt zwischen 15,5 bis 19,6 cm, der weiblicher Tiere zwischen 8 bis 11,9 cm. Beim Bullen wachsen sie ein Leben lang sowohl in die Länge als auch in die Breite. Im Gegensatz dazu entwickeln sich die Stoßzähne der Kuh nach dem 15. Lebensjahr nur noch in der Länge und dies mit einer sehr viel geringeren Geschwindigkeit als beim Bullen; sie wirken daher schlanker als die der männlichen Tiere.[9][1][3] Häufig tritt eine Größendiskrepanz zwischen dem linken und dem rechten Stoßzahn eines Individuums auf, was jeweils auf eine intensivere Nutzung von einem der beiden Stoßzähne zurückzuführen ist. Dieser unterschiedliche Gebrauch verweist auf eine gewisse „Stoßzahnigkeit“ (im Sinne von Händigkeit) beim Afrikanischen Elefanten.[10] Die Stoßzähne werden bereits als „Hauer“ im Embryoalstadium angelegt, kommen aber nicht zum Durchbruch. Später ersetzen dann die dauerhaften Stoßzähne die „Hauer“.[11][12] In einzelnen Regionen treten verstärkt auch Tiere ohne Stoßzähne auf. Hierbei fördert die Mutation eines Gens Anomalien in der Stoßzahnentwicklung bei männlichen Individuen. Ausgelöst wurde dies durch einen Selektionsdruck infolge verstärkter Wilderei und ist etwa im südwestlichen Afrika zu beobachten. Vergleichbare Befunde liegen auch beim Asiatischen Elefanten vor.[13]

Wie bei allen heutigen Elefanten besteht das hintere Gebiss aus je drei Prämolaren und drei Molaren pro Kieferhälfte. Der Zahnwechsel findet horizontal statt, indem sich ein neuer Zahn von hinten herausschiebt, wenn der vorangehende weitgehend abgekaut ist. Dadurch wechselt der Afrikanische Elefant (wie auch der Asiatische Elefant) seine Zähne nach dem Durchbruch des ersten Zahns (Prämolar dP2) insgesamt fünf Mal. In der Regel ist der erste Zahn schon mit der Geburt funktionsfähig und fällt mit 1 bis 2 Jahren aus. Der Durchbruch der weiteren Zähne erfolgt für die Prämolaren mit 1,5 (Prämolar dP3) und 2 Jahren (Prämolar dP4) sowie für die Molaren mit 5 (Molar M1), 15 (Molar M2) und 23 Jahren (Molar M3). Der entsprechende Verlust findet mit 3 bis 4 (dP3), 9 bis 10 (dP4), 19 bis 25 (M1), 43 (M2) und rund 65 (M3) Jahren statt. Es gibt hier allerdings eine hohe individuelle Spannweite. Der horizontale Zahnwechsel hat zusätzlich den Effekt, dass je Kieferhälfte nur ein bis maximal anderthalb Zähne gleichzeitig in Benutzung sind.[14][15] Im gesamten Zahnbau stellt der Afrikanische Elefant gegenüber dem Asiatischen Elefanten die konservativere Form dar. So haben die Zähne generell niedrigere Zahnkronen im Vergleich zum asiatischen Vetter. Wie bei allen Vertretern der Elefanten bestehen sowohl die Prämolaren als auch die Molaren aus mehreren lamellenartigen Schmelzfalten. Die Anzahl variiert zwischen den Zähnen, der zweite Prämolar besteht aus fünf Schmelzfalten, der dritte Molar aus durchschnittlich 13 mit Schwankungen zwischen 14 und 16. Die Lamellenfrequenz liegt damit bei durchschnittlich 5,5 (Anzahl der Lamellen auf 10 cm Zahnlänge). Beide Merkmale fallen deutlich geringer aus als beim Asiatischen Elefanten. Dem gegenüber ist der Zahnschmelz einer jeden Leiste mit 2 bis 5 mm markant dicker. In der Aufsicht auf die Kauoberfläche wölbt sich der Zahnschmelz etwa in der Mitte jeder Schmelzfalte rautenförmig nach außen, während er beim Asiatischen Elefanten weitgehend parallel verläuft. Der letzte Molar ist der größte Mahlzahn im Gebiss. Er kann bis zu 21 cm lang werden und ein Gewicht von rund 3,7 kg erreichen. Der erste Prämolar ist dagegen nur 2,4 cm lang und wiegt knapp 10 g.[16][6][4][17][8]
Verbreitung
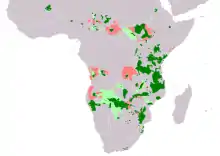
Das ursprüngliche Verbreitungsgebiet des Afrikanischen Elefanten umfasste den gesamten afrikanischen Kontinent und schloss einst auch das nördliche Afrika bis zur Mittelmeerküste sowie das südliche Afrika bis zum Kap der Guten Hoffnung ein. Hinweise darauf geben unter anderem verschiedene Felsmalereien und althistorische Berichte. Klimatische Schwankungen im Verlauf des Holozäns verdrängten die Art aber aus den extrem trockenen Landschaften. Die nördlichen Populationen verschwanden schließlich bereits in den ersten Jahrhunderten der heutigen Zeitrechnung. Das heutige Vorkommen beschränkt sich auf das Afrika südlich der Sahara. Schätzungen zufolge bewohnen die afrikanischen Elefanten heute eine Fläche von knapp 5,2 Millionen Quadratkilometer, von denen etwas mehr als die Hälfte auf Zentral- und Westafrika entfällt, wo zusätzlich auch der Waldelefant vorkommt. Dadurch nimmt das heutige Verbreitungsgebiet der afrikanischen Elefanten nur etwa 20 % des einstigen Lebensraumes ein. Die besiedelten Landschaften sind stark zersplittert und fleckenhaft, einzelne Gebiete werden nur selten vom Afrikanischen Elefanten aufgesucht.[18] Der Rückgang der Verbreitung des Afrikanischen Elefanten ist vor allem der Elfenbeinwilderei und Lebensraumzerstörung geschuldet. Dies betrifft unter anderem die Gebiete in West- und Südafrika. In Mali nahe Gourma hält sich eine kleine Population von rund dreihundert wüstenbewohnender Elefanten, eine mit über 3000 Individuen größere Gruppe findet sich im WAP-Nationalparkkomplex.[19] Weitere nördliche Populationen finden sich im Tschad, was gleichzeitig die Nordgrenze der heutigen Verbreitung repräsentiert. Im angrenzenden Zentralafrika und im südlicheren Westafrika wird der Afrikanische Elefant durch den kleineren Waldelefanten ersetzt. Hier besteht unter anderem ein mehr oder weniger breiter Korridor, in dem die beiden Arten miteinander hybridisieren.[20] Vergleichsweise häufig kommt der Afrikanische Elefant in Ostafrika vor, er tritt hier in zahlreichen fragmentierten Habitaten in Äthiopien, Uganda, Ruanda, Kenia und Tansania auf. Die größte zusammenhängende Population findet sich im nördlichen Teil des südlichen Afrikas und erstreckt sich von Namibia und Angola im Westen ostwärts über Botswana, Sambia und Simbabwe. Aus dem südlichen Teil des südlichen Afrikas ist der Afrikanische Elefant weitgehend verschwunden. Er wurde jedoch an verschiedenen Stellen durch Tiere aus dem Kruger-Nationalpark wieder angesiedelt.[1][3]

Der Afrikanische Elefant hat sich an eine Vielzahl von Lebensräumen angepasst. Diese bestehen aus Halbwüsten, offenen Gras- und Savannenlandschaften, Überflutungsflächen oder Sümpfen sowie aus einer Vielzahl verschiedener Waldbiotope wie Galeriewälder, Bergwälder oder tropische Tieflandregenwälder. Voraussetzungen für die Anwesenheit des Afrikanischen Elefanten sind genügend Wasser und Futter. Auch Schatten oder Rückzugsgebiete für Schutz spielen für die Verbreitung eine wichtige Rolle. In Wüsten leben Elefanten gewöhnlich nicht. Ausnahmen bilden die bereits erwähnten Populationen der südlichen Sahara in Mali und die Grenzgebiete zur Namib, etwa Kaokoveld und Damaraland, in Namibia, in der es ebenfalls einige Bestände von „Wüstenelefanten“ gibt.[21] Im Gebirge findet man den Afrikanischen Elefanten gelegentlich in Höhen bis zu 4875 m wie etwa am Kilimandscharo;[22] sein bevorzugter Lebensraum liegt allerdings im Flachland.[1][3]
Das stark fragmentierte Verbreitungsgebiet des Afrikanischen Elefanten bedingt unterschiedliche Populationsgrößen und -dichten. In offenen Graslandschaften beträgt die Anzahl an Tieren etwa 0,5 bis 2 Individuen je Quadratkilometer; sie kann in Gebieten mit Waldland mit reichhaltigem Nahrungsangebot wie im Lake-Manyara-Nationalpark auf etwa 5 je Quadratkilometer ansteigen. Aus ökologischen Gründen ist eine derart hohe Populationsdichte aber über einen längeren Zeitraum als eher instabil anzusehen. Dichte Wälder oder Wüsten tragen dagegen in der Regel nur einen geringen Bestand an Tieren. Schätzungen der Gesamtindividuenanzahl in Afrika sind schwierig, da sie zumindest für die Länder mit einem gleichzeitigen Vorkommen des Waldelefanten und/oder Hybriden zwischen beiden Arten eine eindeutige Trennung voraussetzen. Für das Jahr 2007 lagen die Zahlen bei etwa 496.000 Individuen im westlichen, östlichen und südlichen Afrika,[3] für das Jahr 1991 wurde von grob 267.000 bis 372.000 ausgegangen.[18] Der Great Elephant Census erbrachte für das Jahr 2014 insgesamt 352.000 Tiere in 18 Ländern, was gegenüber 2007 einen Rückgang um 30 % ergibt. Die größten Bestände sind demnach im nördlichen Teil des südlichen Afrikas, also dem Gebiet mit der größten zusammenhängenden Population, zu finden, wo etwa 234.000 Tiere leben, gefolgt vom östlichen Afrika mit rund 73.000 Tieren.[23]
Lebensweise
Allgemein und Aktivitäten
Die Lebensweise des Afrikanischen Elefanten wurde intensiv erforscht, hervorgehoben seien hier die Studien im Amboseli-Nationalpark über einen Zeitraum von 35 Jahren. Die Tiere sind sowohl tag- als auch nachtaktiv. Den Großteil von 75 % ihrer Aktivitätsphase verbringen sie dabei mit der Nahrungsaufnahme. Häufig gibt es, wie Beobachtungen im Ruwenzori-Nationalpark in Uganda zeigen, drei Fressperioden, die sich auf den Morgen, auf den späten Nachmittag und die Zeit um Mitternacht verteilen. Der größere Anteil wird aber tagsüber verzehrt. Wanderungen unternimmt der Afrikanische Elefant zumeist während der Dämmerungsphase und damit im kühleren Tagesabschnitt. Bei hohen äußeren Startemperaturen fallen die Unternehmungen häufig kürzer aus als bei niedrigeren.[24] Im Durchschnitt uriniert und defäziert ein Tier etwa ein Dutzend Mal am Tag.[25] Größere Unterschiede im vorhandenen Zeitbudget zwischen männlichen und weiblichen Tieren sind nicht vorhanden.[26] Die durchschnittliche Schlafdauer beträgt nach Untersuchungen im Chobe-Nationalpark in Botswana etwa 2,2 bis 2,5 Stunden innerhalb eines Tages, bei Tieren im Ruwenzori-Gebirge beansprucht sie etwas über drei Stunden. In der Regel schlafen die Tiere nach Mitternacht zwischen 02:00 und 06:00 Uhr. Unter Umständen, etwa bei Störungen, sind sie auch durchgehend zwei Tage wach. Damit gehört der Afrikanische Elefant zu den Säugetieren mit der kürzesten Schlafphase. Häufig steht er beim Schlafen, wodurch nur selten die REM-Phase erreicht wird. Nur alle drei bis vier Tage begibt er sich in eine liegende Position, was aber nur etwas länger als eine halbe Stunde anhält. In der Regel wählt ein Tier täglich neue Schlaf- und Ruheplätze. Die Intensität der Tagesaktivität hat Beobachtungen zufolge keinen Einfluss auf die Schlafdauer.[25][27]

Auch ergibt sich kein Einfluss der Aktivitäten auf die Körpertemperatur. Der Afrikanische Elefant weist gegenüber großen Huftieren des gleichen Lebensraumes eine vergleichsweise niedrige Körpertemperatur mit Werten um 36 °C auf. Die Tagesvariationen sind relativ gering in Bezug auf die teils erheblich differierenden äußeren Bedingungen. Das Maximum der Körpertemperatur im täglichen Schwankungsrhythmus stellt sich erst relativ spät, gegen 22:00 Uhr, ein.[28] Im Gegensatz zum Asiatischen Elefanten scheint mit der flukturierenden Körpertemperatur aber kein Mechanismus zur Thermoregulation zu bestehen.[29] Der Afrikanische Elefant bewohnt eine Vielzahl von Landschaften mit teils starken Klimaextremen. Zur Kontrolle des Wärmehaushaltes setzen die Tiere unter anderem die Ohren ein, welche durch Wedeln sowohl kühlende als auch wärmende Effekte erzeugen und so das größte temperaturregulierende Organ in der Tierwelt darstellen.[30][31][32] Allerdings hat das Ohrwedeln auch eine wichtige soziale Funktion beziehungsweise drückt individuelle Bedürfnisse und Befindlichkeiten aus. Als weitere Möglichkeit zur Aufrechterhaltung der Körpertemperatur ist die Verdunstung von Wasser an der Körperoberfläche anzusehen.[33] Dabei wirkt sich die im Gegensatz zum Asiatischen Elefanten stark rissige und dadurch deutlich ornamentierte Haut förderlich aus. Das Wasser wird in den Furchen und Spalten fünf- bis zehnmal länger gespeichert als direkt an der Oberfläche. Die Ornamentierungen entstehen bei ausgewachsenen Tieren durch die Verhornung und permanente Verdickung der Haut, welche dann durch Biegebeanspruchung in der oberen Epidermis aufreißt.[34]
Soziale Organisation und Raumnutzung

Das Sozialverhalten des Afrikanischen Elefanten ist komplex. Es gibt hierbei deutliche Unterschiede zwischen männlichen und weiblichen Individuen. Bei weiblichen Tieren sind insgesamt vier soziale Einheiten bekannt. Die Basis und niedrigste Stufe (erste Ebene) besteht aus dem Muttertier und einem oder mehreren Jungtieren. Mehrere dieser kleinen Mutter-Jungtier-Einheiten schließen sich zur Familiengruppe beziehungsweise Herde zusammen (zweite Ebene). Die Familiengruppe stellt die stabile Einheit in der Sozialgemeinschaft des Afrikanischen Elefanten dar, sie wird nicht durch jahreszeitliche Bedingungen und Ressourcen beeinflusst. Sie setzt sich gemäß Untersuchungen im Samburu-Nationalreservat aus 2 bis 16 Individuen zusammen. Allgemein kann gesagt werden, dass Familiengruppen in geschlosseneren Landschaften kleiner sind als in offenen, ebenso übertreffen die Familiengruppen älterer Kühe jene von jüngeren an Individuenanzahl. Die Mitglieder sind in der Regel miteinander verwandt. Einzelne Herden, unter anderem solche in Gebieten mit stark durch den Menschen beeinflussten Populationen, umfassen aber nicht zwangsläufig untereinander genetisch verwandte Tiere.[35][36] An der Spitze der Herde steht eine reife, meist ältere und große Leitkuh, die die anderen Mitglieder nicht nur dominiert, sondern auch wichtige Entscheidungen in kritischen Situationen fällt. Ihre Erfahrungen sind somit essentiell für die Familiengruppe.[37] Die Hierarchie innerhalb der Herde ist linear organisiert, wodurch Konflikte in der Herde minimiert und Verwundungen bedingt durch Rangkämpfe verhindert werden.[38][39] Daher übernimmt nach dem Tod der Leitkuh zumeist eine hochrangige Tochter die Herde. Größere Familiengruppen können sich dann auch in einzelne Tochtergemeinschaften aufspalten.[40] Mit seiner hierarchisch gegliederten Herdenstruktur unterscheidet sich der Afrikanische Elefant deutlich vom Asiatischen Elefanten, bei dem die Rangabfolge wesentlich flacher ist und eine Leitkuh keine tragende Rolle spielt.[41][42] Mehrere Familiengruppen zusammen formen einen Familienverband oder eine Verwandtschaftsgruppe (dritte Ebene). Im Samburu-Nationalreservat bilden durchschnittlich zweieinhalb Familiengruppen einen größeren Familienverband, er schließt 14 bis 48 Individuen ein und kann bis zu vier verschiedene Generationen umspannen. Auch hier sind Größe und Umfang abhängig vom Ertragsreichtum einer Landschaft mit kleineren Verwandtschaftsgruppen in waldreicheren Regionen gegenüber größeren in trockeneren Gebieten. Die höchste Organisationseinheit ist der lockere Clan (vierte Ebene). Ein Clan wird dadurch charakterisiert, dass die einzelnen Herden ähnliche Aktionsräume nutzen. Die höheren Sozialorganisationsstufen oberhalb der Herde sind nicht stabil. Die einzelnen Herden treffen sich zu bestimmten Gegebenheiten und trennen sich wiederum, häufig je nach örtlicher Gegebenheit und verfügbaren Nahrungsquellen. In vielen Fällen erfolgt der Zusammenschluss während der Regenzeit, wenn das Nahrungsangebot steigt. Die Aufsplittung findet dann während der Trockenzeit mit schwindenden Nahrungsressourcen und steigender Konkurrenz untereinander statt. Allerdings können auch lokale Faktoren wie die Dichte potentieller Beutegreifer oder möglicherweise auch der soziale wie auch ökologische Informationsaustausch solche Zusammenschlüsse beeinflussen. Eine derartige Sozialgemeinschaft wird als fission-fusion-Sozialgemeinschaft („Trennen und Zusammengehen“) bezeichnet.[43][44] Die Angehörigen der Clans vermögen nach enger und entfernter verwandten Tieren zu unterscheiden, was sich beispielsweise in unterschiedlichen Begrüßungsritualen ausdrückt.[45]

Die Bullen zeigen gegenüber den Kühen ein abweichendes Verhalten. Sie verlassen im Alter von rund neun Jahren die mütterliche Herde. Anfangs schließen sie sich anderen Familienverbänden an, in der Regel in der Nähe ihres Geburtsortes. Zum Teil wechseln sie den Verband häufiger. Später im vollständig geschlechtsreifen Alter bilden die einzelnen Individuen Junggesellengruppen. Hier verbleiben sie zumeist während der sexuell inaktiven Phasen. Nach Beobachtungen im Makgadikgadi-Salzpfannen in Botswana übernehmen hier häufig ältere Bullen die Führung und besetzen somit eine ähnliche Funktion wie Leitkühe in Familiengruppen.[46] Während der Musth, der sexuell aktiven Zeit, wandern Bullen als Einzelgänger auf der Suche nach paarungsbereiten Kühen umher.[47][48][1][3]
Prinzipiell ist der Afrikanische Elefant nicht territorial. Die Familiengruppen nutzen Aktionsräume, die je nach Habitat unterschiedlich groß sein können.[49] In feuchteren Landschaften wie im Lake-Manyara-Nationalpark in Tansania wurden Größen von 15 bis 52 km² bestimmt, in trockeneren Landschaften wie im Tsavo-East- und Tsavo-West-Nationalpark in Kenia erreichen die Aktionsräume Ausdehnungen von 350 bis 1580 km², im Kruger-Nationalpark in Südafrika zwischen 1600 und 4000 km². Die größten Aktionsräume haben Tiere in wüstenartigen Landschaften wie im Zakouma-Nationalpark im Tschad mit einer Fläche von knapp 4700 km², im Etosha-Nationalpark in Namibia mit 5800 bis 8900 km² oder in der Kunene-Region, ebenfalls Namibia, mit bis zu 12.800 km².[50][51][52] Die Junggesellengruppen der Bullen haben durchschnittlich größerer Aktivitätsgebiete als die Familiengruppen der Kühe, in den absoluten Ausmaßen gibt es aber kaum Unterschiede zwischen den Geschlechtern. Des Weiteren variiert die Ausdehnung mit der Jahreszeit, so dass die Aufenthaltsgebiete in der Regenzeit größer sind als in der Trockenzeit. Innerhalb der Aktionsräume bestehen verschiedene Zonen, die jahreszeitlich wechselnd genutzt werden. Die einzelnen Herden wandern im Jahreszyklus zwischen den Aufenthaltsgebieten und legen dabei täglich durchschnittlich 5 bis 13 km zurück mit kürzeren Distanzen während der Trockenzeit. Die Populationen aus der Gourma-Region in Mali bewältigen dadurch jährlich etwa 3900 km. Die Herden wandern in einem jährlichen kreisförmigen Zyklus, der sie in der Trockenzeit zu den Wasserstellen im Norden führt. Mit der herannahenden Regenzeit sind die Wanderungen dann wieder südwärts gerichtet, was mit der größeren verfügbaren Nahrungsmenge erklärbar ist.[53] Im südlichen Afrika wechseln die Herden jährlich zwischen dem Kruger-Nationalpark und dem angrenzenden Sabi Sand Reserve. In beiden Schutzgebieten nutzen sie Kernzonen in relativer Wassernähe, wobei die Tiere sich selten weiter als 3 km von der nächsten Wasserstelle aufhalten. Ihre täglichen Wanderungen belaufen sich im Minimum auf rund 4, im Maximum auf 44 km.[52][1][3]
Die größte Wanderungsgeschwindigkeit beträgt bei den Tieren in Mali rund 6,1 bis 6,4 km/h.[53] Im Gesamtdurchschnitt legt eine Herde aber zumeist nur knapp 0,5 km je Stunde zurück. Die Gehgeschwindigkeit nimmt in Landschaften mit starker menschlicher Beeinflussung zu.[54] Im Schnitt verbraucht ein Tier im niedrigen Geschwindigkeitsbereich etwa 3,2 Joule je Kilogramm Körpergewicht auf einem zurückgelegten Meter. Die energetischen Kosten reduzieren sich bei höherer Schrittfrequenz kontinuierlich. Die Nettoenergie im Ruhezustand beträgt etwa 0,8 Joule je Kilogramm Körpergewicht. Der Afrikanische Elefant gehört damit zu den Landsäugetieren mit dem niedrigsten Verbrauch. Er liegt deutlich unter dem im Vergleich zu einer Maus, der in Relation zur Körpergröße den 20- bis 40-fachen Wert erreichen kann.[55] Die einzelnen Tiere und kleineren Familiengruppen bewegen sich in den Aktionsräumen teils unabhängig voneinander, stimmen ihre Wanderungen aber durch niederfrequente Grolllaute untereinander ab.[35] Die bei den Wanderungen entstehenden Pfade sind oft über mehrere Kilometer in der Vegetation erkennbar und teilweise bis zu 1,3 m breit.[56][1][3]
Agonistisches Verhalten und Kommunikation


Mit einzelnen Ausnahmen verläuft das Zusammenleben des Afrikanischen Elefanten eher friedlich. Tiere wiedervereinter Herden führen ein Begrüßungsritual durch, das sich durch hochgehaltene Köpfe, gegenseitig umschlungene Rüssel, Einführen des Rüssels in das Maul des Gegenübers sowie Urinieren ausdrückt. Ähnliche Rituale bestehen auch in den Junggesellengruppen, zeigen sich aber weniger intensiv.[43] Auch die Beziehungen zu anderen Familiengruppen sind zumeist freundlich. Größere Konflikte entstehen häufig in Gebieten mit begrenzten oder unregelmäßig verteilten Ressourcen. Kämpfe zwischen einzelnen Tieren treten nur selten auf und verlaufen zumeist hochritualisiert. Teilweise erfolgen sie spielerisch bei Jungtieren, aber ebenso bei Kühen während der Verteidigung ihrer Herde. Dominantes Verhalten ist durch eine erhöhte Kopflage über den Schultern erkenntlich, so dass das entsprechende Individuum größer erscheint, unter Umständen verbunden mit dem Erklimmen eines umgefallenen Baumstammes oder eines Ameisenhügels. Demgegenüber senken unterlegene Tiere den Kopf weit nach unten. Häufige Anzeichen der Irritation beim Afrikanischen Elefanten sind ein Abspreizen der Ohren und ein beständiges Kopfschütteln, ersteres wird aber auch durch die visuelle Vergrößerung des signalgebenden Individuums bei Imponier- oder Drohgebärden eingesetzt. Den Gesten können verschiedenste Reaktionen folgen wie Scheinangriffe, Drücken oder Rammen. Anzeichen für erhöhte Aggressivität sind Kopfschütteln, das Werfen von Gegenständen mit dem Rüssel und Graben mit den Stoßzähnen. Eine ambivalente, besorgte oder unentschlossene Haltungen signalisieren unter anderem eingedrehte Rüssel oder schwingende Beine. Bei Bedrohung der gesamten Familiengruppe formen die Mitglieder einen engen Haufen mit den Jungtieren in der Mitte. Ausnahmen von diesen ritualisierten Handlungen bilden Bullen in der Musth, die eine hohe Aggressivität aufweisen. Hier kommt es zu Kämpfen, die nicht einem vorgegebenen Muster folgen. Durch den Einsatz der Stoßzähne haben sie mitunter einen tödlichen Ausgang. Daneben stehen noch verschiedene andere optische Reizsignale zur Kommunikation untereinander zur Verfügung, die bestimmte Körper- und Beinpositionen sowie die Haltung von Rüssel und Ohren beinhalten. Sie können sowohl sehr offensichtlich als auch extrem subtil sein und sich vielfach kombinieren.[57][58] Ein Merkmal intensiver sozialer Kontakte ist das Spiel, das nicht nur bei Jungtieren, sondern auch bei ausgewachsenen Tieren bis ins hohe Alter vorkommt und sowohl gemeinsam als auch allein und/oder mit den verschiedensten Objekten getätigt wird.[59][1][3]
Neben den optischen Signalgebern bestehen beim Afrikanische Elefant weitere Kommunikationsformen. Unter anderem hat der Geruchssinn eine hohe Bedeutung. Er kommt etwa bei der zwischengeschlechtlichen Kommunikation zum Einsatz wie der Partnersuche der Bullen während der Paarungszeit. Zudem wirken chemische Signale innerhalb der Geschlechtergemeinschaft, beispielsweise bei der Musth, da die Sekrete der Temporaldrüsen individuell leicht variierende Zusammensetzungen besitzen.[60] Weibliche Tiere wiederum unterscheiden anhand des Geruchs bis zu 30 Familienmitglieder.[61] Informationsträger bilden des Weiteren die verschiedenen Sekrete der Zwischenzehendrüsen, der Ohren und Augen sowie Urin und Kot aus dem Anogenitaltrakt.[62][63] Essentiell ist der Geruchssinn darüber hinaus in der Mutter-Jungtier-Beziehung. Verstärkt wird diese in hohem Maße durch den Tastsinn, bei dem der Rüssel eine zentrale Funktion einnimmt.[4][1][3]

Die akustische Kommunikation des Afrikanischen Elefanten ist äußerst komplex. Die Tiere vermögen Laute im Bereich von 9 bis 9000 Hz zu erzeugen. Das Repertoire an Lautgebungen reicht von einem niederfrequenten, dumpfen Grollen bis hin zu einem höherfrequenten und damit auch für Menschen wahrnehmbaren Trompeten, Schreien, Krächzen, Schnauben, Bellen und Röhren.[64] Vor allem das soziale Grollen ist sehr häufig. Es wirkt als Kontaktruf bei der Wiedervereinigung von Herdenmitgliedern innerhalb des fission-fusion-Netzwerkes und koordiniert gleichzeitig die Bewegungen der Herde. Nach Untersuchungen an den Familiengruppen im Amboseli-Nationalpark unterscheiden die einzelnen Tiere anhand der Kontaktrufe verschiedene Individuen. Sie erkennen dadurch die Herdenmitglieder der Herde, vermögen aber auch fremde Individuen herauszufiltern. Ein einzelnes Tier einer bestimmten Familiengruppe kann dadurch rund 100 Individuen von bis zu 14 verschiedenen Herden in der Umgebung auseinanderhalten. Auch erinnert es sich über mehrere Monate und Jahre an die Rufe teils verstorbener oder abgewanderter Herdenmitglieder. Die Unterscheidungen sind bis in Abständen von rund 2,5 km zueinander möglich.[45][65][66] Unter Umständen, wie im Etosha-Nationalpark, tragen besondere atmosphärische Bedingungen des Nachts die Laute bis zu 10 km weit, wodurch sich die Kommunikationsdistanz um ein Vielfaches erhöht.[67][68] Die Töne im niedrigen Frequenzbereich entstehen durch selbsterhaltende Vibrationen der Stimmbänder vergleichbar der menschlichen Sprache und Gesänge und nicht durch neuronal kontrolliertes Muskelzucken wie etwa beim Schnurren der Hauskatze.[69] Allerdings können die Tiere zwei unterschiedliche Grolllaute hervorbringen: einen nasalen und einen oralen. Ersterer ertönt zumeist bei der Kontaktsuche, letzterer ist wichtig im Verband. Beide unterscheiden sich in der Länge des Erzeugungsweges. Dieser ist beim nasalen Grollen durch den Rüssel, der als eine um 3 m verlängerte Resonanzkammer fungiert, mehr als doppelt so lang wie beim oralen. Durchschnittlich erreicht das nasale Grollen mit etwa 19,7 Hz eine tiefere Frequenz als das orale mit 26,9 Hz.[70][71]
Weitere Studien zeigen, dass auch Bullen das soziale Grollen recht häufig verwenden. Es bestehen aber Abweichungen zu den Lauten der Kühe, die unter anderem den Umfang und die benutzte Frequenz betreffen. Männliche Tiere modulieren häufig in einem tieferen Bereich von 10 bis 13 Hz als weibliche, deren Laute 14 bis 18 Hz erreichen. Unter den Bullen allein liegen die Laute älterer und größerer, also somit dominanterer Individuen, durchschnittlich tiefer als bei jüngeren und kleineren Tieren. Dadurch übertragen männliche Tiere auf diese Weise wichtige Informationen über ihr Alter und ihre Größe.[72][73][74] Prinzipiell zeigt sich, dass Bullen über eine vergleichbar umfangreiche Lautgebung verfügen wie Kühe. Ähnlich verhält es sich mit Jungtieren. Hier gibt es anfänglich kaum Unterschiede zwischen den Geschlechtern. Erst mit fortschreitender Individualentwicklung formen sich die Differenzen zwischen männlichen und weiblichen Tieren heraus.[75] Warn- und Alarmrufe erreichen in der Regel einen höheren Frequenzbereich. Hierzu gehören das bereits genannte Trompeten, Schnauben, Krächzen und ähnliche Laute. Trompetenrufe erschallen in einem Frequenzbereich von 300 bis 3000 Hz und dauern bis zu fünf Sekunden an, Schnaub- und Krächzlaute erreichen nur rund 1000 Hz. Erstere sind mit einer Sekunde eher kurz, letztere werden bis zu zehn Sekunden gehalten.[76] Dabei variieren Alarmrufe je nach Art der Bedrohung. So stößt der Afrikanische Elefant in Anwesenheit von Menschen oder wilden Bienen jeweils unterschiedliche und spezifische Rufe aus, die zusätzlich noch mit abweichenden optischen Signalen verbunden sind.[77][1][3][71] In einem untergeordneten Maß werden nieder- und höherfrequente Laute miteinander kombiniert.[78] Außerdem ist der Afrikanische Elefant befähigt, einzelne neue Laute zu erlernen und zu imitieren, wie es beispielsweise nur von wenigen Säugetieren, etwa von Walen, und von Vögeln bekannt ist. Es wird vermutet, dass diese Lernfähigkeit ebenfalls mit der komplexen fission-fusion-Sozialgemeinschaft in Verbindung steht und ihren Teil zum gegenseitigen Wiedererkennen beiträgt.[79]
Komfortverhalten und kognitive Fähigkeiten

Zum Komfortverhalten des Afrikanischen Elefanten gehören verschiedenste Bäder in Wasser, Schlamm und Staub. Dabei wälzen sich die Tiere entweder am Boden oder bespritzen sich selbst mit dem Rüssel. Danach reiben sie ihren Körper an lebenden oder toten Bäumen beziehungsweise an Ameisenhügeln. Die Prozedur, die mitunter täglich durchgeführt wird, schützt nicht nur vor erheblichen Wasserverlust des Körpers, sondern dient auch der Entfernung von Parasiten. Teilweise verwendet der Afrikanische Elefant dabei Äste oder Stöcke, die mit dem Rüssel gehalten werden. Manchmal vertreibt er damit auch lästige Insekten. Des Weiteren vollführt ein Tier verschiedenste Bewegungen mit dem Rüssel, zumeist um Juckreiz zu unterdrücken. Markant ist das Wedeln mit den Ohren als Teil der Thermoregulation.[4][1][3]
In seinem Verhaltensrepertoir zeigt der Afrikanische Elefant ein hohes Maß an ungewöhnlichen kognitiven Fähigkeiten. Sein Langzeitgedächtnis befähigt ihn, sich an geographische Lokalitäten, Ereignisse oder Individuen zu erinnern und über lange Distanzen zu wandern.[14][80] Außerdem vermögen die Tiere quantitativ abweichende Mengen zu unterscheiden.[81] Die verschiedenen Individuen einer Familiengruppe können die Position von räumlich nicht sichtbaren Herdenmitgliedern lokalisieren und zu ihrer eigenen ins Verhältnis setzen.[61] Des Weiteren zeigt der Afrikanische Elefant ein gewisses empathisches Empfinden. Es schließt unter anderem das generell kooperative Miteinander innerhalb einer Familiengruppe oder einer Junggesellengruppe ein. So helfen Tiere beispielsweise verletzten Mitgliedern, entfernen Fremdkörper aus den Körpern von Angehörigen, verjagen gemeinsam Beutegreifer oder bilden Bündnisse untereinander. In vielen Fällen zielt das Verhalten auf den Nachwuchs ab, etwa werden entlaufene Jungtiere in die Herde zurückgebracht oder mutterlose jüngere beschützt. Demnach ist der Afrikanische Elefant sensitiv gegenüber den Bedürfnissen anderer Individuen und vermag deren individuelle Bedürfnisse zu erkennen, darüber hinaus hat er auch die Befähigung vorausschauend bestimmte Stresssituationen zu vermeiden. Dies bezieht sich nicht nur auf die unmittelbare Verwandtschaft, sondern kann unter Umständen auch fremde Individuen betreffen.[82][83] Andere Formen kognitiver Befähigung finden sich in dem Anlernen junger Tiere. Beispielsweise täuschen ältere Kühe eine Brunft vor, um jüngere bei ihrem ersten Sexualzyklus zu unterstützen.[84] Auch ergaben Studien, dass der Afrikanische Elefant Traumata erleiden kann, deren Ursprung unter Umständen bis in das Fötalstadium reicht. Häufig entstehen diese aus Stresssituationen in Verbindung mit menschenverursachten Habitatverlusten, Wilderei oder Keulungen zur Populationskontrolle. Beispielsweise zeigten Tiere umgesiedelter Familiengruppen bis zu sechs Jahre nach der Aussetzung erhöhte Stresssymptome.[85][86][3] In Verbindung damit steht auch die Befähigung des Afrikanischen Elefanten, zwischen verschiedenen Menschengruppen nach Ethnie, Geschlecht und Alter unterscheiden zu können, die die Tiere dann je nach individueller Erfahrung gewissen Gefahrenkategorien zuordnen.[87]
Als ein bemerkenswertes Verhalten beim Afrikanischen Elefanten kann ein gewisses Interesse für verstorbene Artgenossen angesehen werden. Ausgedrückt wird dieses durch das Berühren von und Spielen mit Knochen. Experimenten zufolge stehen besonders Stoßzähne und Schädel im Mittelpunkt. Im Gegensatz zur häufig wiedergegebenen Ansicht richtet sich dieses Interesse nicht speziell auf Familienangehörige, sondern allgemein auf Vertreter der eigenen Art. Es ist aber möglich, dass die Tiere auf ihren Wanderungen durch ihren Aktionsraum Plätze aufsuchen, an denen Angehörige gestorben sind. Nach Beobachtungen im Samburu-Nationalreservat zeigen die Tiere in Umfeld eines toten Artgenossens teils erhöhten Sekretfluss aus den Temporaldrüsen. Außerdem kommt es zu stärkeren sozialen Interaktionen. Ein ähnliches Verhalten im Umgang mit Verstorbenen ist bei anderen Säugetieren mit Ausnahme des Menschen unbekannt. Lediglich der Schimpanse beschäftigt sich einige Zeit mit toten Angehörigen, er verliert aber bei stärkerer Zersetzung des Kadavers das Interesse.[88][89][90][3]
Ernährung


Der Afrikanische Elefant ist primär ein Pflanzenfresser und ernährt sich von Gräsern, Wurzeln, Blättern, Zweigen, Baumrinden, Holz und verschiedenen Früchten. Die Nahrung besteht somit aus gemischter Pflanzenkost, die tatsächliche Zusammensetzung variiert aber nach Region. Sie kann in offenen Savannenlandschaften aus bis zu 70 % Gräsern und in geschlossenen Wäldern fast vollständig aus weichen Pflanzen bestehen. In gemischten Landschaften wechseln die Tiere abhängig vom jahreszeitlichen Angebot zwischen harter Grasnahrung und weichen Bestandteilen, je nachdem was gegenwärtig den größten Anteil an Nährstoffen und Fasern bietet. Dadurch kommt es zu einem saisonal bedingten Wechsel der Nahrung. Im Hwange-Nationalpark in Simbabwe bezieht der Afrikanische Elefant seine Nahrung von 87 Baum- und Gebüscharten, 42 Grasarten und 36 Arten an Kräutern.[91] Tiere aus dem Amboseli-Nationalpark in Kenia ernähren sich von 29 verschiedenen Baum- und Gebüscharten, 22 Grasarten und 40 Arten an Kräutern.[92] Untersuchungen im Kruger-Nationalpark in Südafrika ergaben, dass die Tiere im feuchteren Süden während der Trockenzeit zu 10 % Gräser vertilgen, in der Regenzeit aber zu 50 %. Im trockeneren Nordteil des Nationalparks hingegen ist der Anteil an Gräsern in der Regenzeit ähnlich hoch, die Menge fällt aber in der Trockenzeit nur wenig auf 40 % ab. Vermutlich spielen hier die Gegebenheiten der Landschaften eine wichtige Rolle. Im Norden dominieren Mopane-Wälder, die nährstoffreich sind und vor allem in der Regenzeit eine wichtige Nahrungsquelle darstellen. Im Süden fehlen diese, die dort wachsenden Pflanzengesellschaften sind zwar artenreicher, jedoch potentiell nährstoffärmer. Dadurch können und müssen die Tiere auf andere Nahrungspflanzen ausweichen.[93] Im Atherstone Collaborative Nature Reserve, ebenfalls Südafrika, besteht die Nahrung in der späten Regenzeit zu rund 60 % aus Gräsern und zu etwa 40 % aus weicher Kost. Die weicheren Pflanzenbestandteile nehmen dann zur Trockenzeit hin zu und machen hier zum Höhepunkt der Jahreszeit 100 % aus. Auch in der frühen Regenzeit ist ihr Anteil mit mehr als 60 % noch sehr hoch.[94] Besonders stark ist der Wechsel von weicher zu harter Pflanzennahrung in den wüstenartigen Gebieten des südwestlichen Afrikas. Hier stellen sich die Tiere nach Regenfällen oder während der Regenzeit vollständig auf Gräser als Nahrung ein und gehen in der Trockenzeit graduell wieder zur Blattkost über.[95][1][3]
Vor allem in der feuchteren Jahreszeit frisst der Afrikanische Elefant frisch wachsende Rispenhirsen, Hundszahn-, Rohrkolben, Zyper- und Urochloa-Gräser. Ebenso bilden dann die Früchte des Manketti- und des Marulabaums attraktive Nahrungsquellen,[91][92][96] allerdings fressen die Tiere nicht in jedem Fall Früchte.[94] Des Weiteren zeigten Analysen an Afrikanischen Elefanten im Chobe-Nationalpark in Botswana ein teils starkes selektives Vorgehen in der Nahrungsauswahl. Demnach bevorzugen die Tiere in der Regenzeit nur 30 % der 27 häufigeren Baumarten dort. Der Anteil steigt in der Trockenzeit auf bis zu 50 % an.[96] Ebenso kommt es zu einem Wechsel von bevorzugten Knospen und frisch sprießenden Blättern in der Regenzeit hin zu Ästen, Rinden oder Wurzelteilen in der Trockenzeit.[96] Der Afrikanische Elefant raspelt dabei mit den Stoßzähnen häufig Rinde von den Bäumen ab. Bevorzugt werden hier verschiedene Akazien wie die Schirmakazie und die Süßdornakazie, aber auch der Marulabaum. Die Rinde dieser Bäume ist besonders dick und sehr faserhaltig. Aufgrund der großen Körperausmaße und des rapiden Metabolismus benötigt der Afrikanische Elefant eine Nahrungsmenge von etwa 1 bis 2 % seines Körpergewichts, was etwa 34 bis 78 kg Trockenmasse entspricht (oder etwa 115 bis 300 kg Feuchtmasse). Dafür investiert ein Tier mehr 60 % seines täglichen Zeitbudgets beziehungsweise bis zu 17 Stunden täglich.[92] Dauer und Häufigkeit der Nahrungsaufnahme nehmen mit der besseren Qualität der Pflanzen während der Regenzeit zu. Die Nahrungsaufnahme erfolgt mit dem flexiblen Rüssel, mit dem ein Tier präzise einzelne Nahrungspflanzen ergreifen kann.[1][3]

Extrem wichtig für den Afrikanischen Elefanten ist Wasser, von dem er täglich bis zu 160 l benötigt. Die Abhängigkeit von Wasser kann ihn vor allem in der Trockenzeit auch in weniger gut geeignete bis hin zu degradierten Landschaften führen. Höchstwahrscheinlich ist dies ein Grund für die teils weiten, jahreszeitlich bedingten Wanderungen bei einigen Populationen. Unter Umständen trinken die Tiere bei Nichtverfügbarkeit von frischem Wasser auch Brackwasser, das aber gesundheitsschädlich sein kann. Die wüstenbewohnenden Vertreter, aber ebenso die anderer Regionen, graben mit ihren Füßen und mit dem Rüssel Löcher von bis zu 1 m Tiefe, um an oberflächennahes Wasser zu gelangen. Dies geschieht teilweise auch in unmittelbarerer Nähe zu Frischwasser. Die Wasserlöcher ziehen wiederum andere Tiere der Umgebung an. Mitunter nutzt der Afrikanische Elefant künstliche Wasserreservoirs und kann dabei die vom Menschen angelegte Infrastruktur zur Wasserversorgung zerstören.[97] Daneben spielen Salzlecken und mineralhaltige Böden eine wichtige Rolle. Diese dienen teilweise dazu, um toxische Bestandteile in Pflanzen zu neutralisieren.[98] Darüber hinaus gleichen die Tiere damit natriumarme Pflanzenkost aus, die unter anderem in trockenen Gebieten oder während der Trockenzeit hauptsächlich zur Verfügung steht. Dabei nutzen dies gemäß Untersuchungen im Hwange-Nationalpark Kühe intensiver als Bullen und verbringen so einen größeren Teil ihres aktiven Zeitbudgets. Die verstärkte Geophagie bei weiblichen Tieren hängt hauptsächlich mit den höheren energetischen Kosten beim Austragen des Nachwuchses zusammen.[99][100] Teilweise bricht der Afrikanische Elefant Termitenhügel auf, um an mineralhaltiges Bodenmaterial zu gelangen.[101][1][3]
Brunft und Paarung


Die Paarungszeit ist ganzjährig, es gibt aber Unterschiede zwischen den einzelnen Populationen in differierenden Landschaften. Teilweise lässt sich eine gewisse Saisonalität feststellen mit einer erhöhten Anzahl an Geburten in der Regenzeit. So entfielen von rund 1030 registrierten Geburten im Amboseli-Nationalpark etwa 81 % auf den Zeitraum von November bis Mai.[102] Die jahreszeitliche Beschränkung wird stärker, je trockener eine Landschaft ist. Im südlichen Afrika fällt die Fortpflanzungsphase ausschließlich in die Regenzeit.[91][1][3]
Auffälligstes Kennzeichen für fortpflanzungswillige Bullen ist die Musth.[103] Sie tritt bei Jungbullen erstmals mit rund 29 Jahren auf, ihre Dauer nimmt mit dem Lebensalter zu. Anfänglich währt sie nur wenige Tage und dehnt sich dann auf bis zu vier Monate aus. Der Eintritt in die Musth ist individuell verschieden und verläuft nicht synchron, allerdings teils überschneidend, wodurch ein deutlicher Unterschied zur meist saisonalen Brunftzeit der Huftiere besteht. Als typisches Kennzeichen gilt das Anschwellen der Temporaldrüsen und das Ausscheiden von Sekreten an diesen. Des Weiteren gehört auch der auffällige „Musth-Gang“ mit erhobenem Kopf und verstecktem Kinn sowie abgespreizten Ohren dazu. Dabei wird der Kopf in kontrollierter Weise geschwungen. Es tritt zusätzlich ein übermäßiges Urinieren auf mit bis zu 400 l je Tag. Die während der Musth veränderte chemische Zusammensetzung des Urins wird von anderen männlichen Tieren wahrgenommen.[104] Außerdem stoßen die Tiere zahlreiche niederfrequente Laute im Bereich um 14 Hz aus, die als „Musth-Grollen“ bekannt sind. Die Musth zeichnet sich durch eine höhere sexuelle und aggressive Aktivität der Bullen aus, verbunden mit einem erhöhten Testosteron-Spiegel. Dieser kann eine Konzentration von über 50 ng/ml Blut erreichen, im Extremfall auch über 100 ng/ml. Bei männlichen Tieren außerhalb der Musth wie auch bei weiblichen liegt er häufig bei unter 1 ng/ml Blut und übersteigt einen Wert von 2 ng/ml zumeist nicht.[105][62][63] Bullen in der Musth stehen generell höher in der Rangstufe. Es kommt dann auch häufig zu Dominanzkämpfen unter Musth-Bullen oder aber zu Auseinandersetzungen mit anderen männlichen Tieren. Dabei dominieren unter Umständen physisch schwächere Individuen in der Musth körperlich überlegene Tiere außerhalb der Musth.[47][48][106][1][3]
Kühe bringen etwa alle 4,5 Jahre ein Kalb zur Welt. Ihr Sexualzyklus ist mit durchschnittlich 13 Wochen ausgesprochen lang. Er besteht aus einer lutealen Phase von rund 9 Wochen Dauer und einer kürzeren follikularen Phase. Beide Abschnitte werden von einer nonlutealen Phase abgetrennt, die 19 bis 22 Tage währt. Während dieser kommt es zu einer zweifachen erhöhten Produktion an luteinisierenden Hormonen, wobei lediglich der zweite Anstieg auch eine Ovulation hervorruft. Die Funktion des ersten Hormonanstiegs ist bisher ungeklärt. Aufgrund des langen Sexualzyklus sind Kühe, die nicht gerade ein Kalb aufziehen, in der Regel nur drei bis viermal empfangsbereit pro Jahr.[107][108] Deutliche Anzeichen für eine Brunft sind unter anderem Vorsicht und Alarmbereitschaft mit hochgehaltenem Kopf sowie der „Brunftlauf“, bei dem das weibliche Tier die Herde verlässt und den ihm folgenden Bullen beobachtet. Zum Höhepunkt des Sexualzyklus wird die Kuh von einem zumeist starken Bullen begleitet. Freilandbeobachtungen im Amboseli-Nationalpark zeigten, dass sich Kühe aber auch in mehr als zwei Drittel aller Fälle für ältere Bullen in der Musth entscheiden. Gründe für die Wahl älterer männlicher Tiere könnten übergeordnet in einer gesicherten Befruchtung sowie in einer höheren Wahrscheinlichkeit des langfristigen Überlebens des Nachwuchses liegen, untergeordnet aber auch in der Vermeidung einer aufdringlichen Verfolgung durch jüngere Individuen.[109][110] Jüngere Bullen versuchen Kühe trotzdem – meist erfolglos – in den Phasen vor und nach dem Brunfthöhepunkt zu besteigen. Ebenso können sich jüngere Kühe während der Brunft häufig nicht gegen dominantere Familienmitglieder durchsetzen.[109][111][102][1][3]

Der lange Zeitraum zwischen zwei Sexualzyklen einer Kuh und die kurze Phase der Brunft selbst führen dazu, dass innerhalb einer Population fortpflanzungsbereite Kühe selten sind. Zum Aufspüren brünftiger Kühe setzen Bullen in der Musth verschiedene Strategien ein. Sie verlassen ihren angestammten Aktionsraum und wandern über lange Strecken. Die dabei zurückgelegten Entfernungen sind im Vergleich zu sexuell nicht aktiven Tieren deutlich umfangreicher. Oft gesellen sich die Bullen in der Musth zu verschiedenen Familienclans, hierbei bevorzugen sie größere Herden um ihren Fortpflanzungserfolg zu erhöhen. Außerdem lauschen sie verstärkt den Rufen der Weibchen. Sie sind befähigt, zwischen den Rufen ungebundener und gebundener weiblicher Tiere zu unterscheiden.[112][113] Ihre eigenen Rufe, das „Musth-Grollen“, wirkt nicht nur anziehend auf brünftige Kühe, sondern wird auch häufig von einem weiblichen „Familienchor“ beantwortet. Um ihre Attraktivität bei Kühen zu steigern, markieren Bullen ihre Wanderpfade, Bäume und Büsche mit Urin und Kot.[114][48] Die Ausscheidungen der Kühe nutzen sie, um mit Hilfe der Duftspuren brünftige Individuen ausfindig zu machen. Anhand des Uringeruchs, der verschiedene Pheromone enthält, können sie die einzelnen Phasen der Brunft auseinanderhalten.[115] Andererseits signalisieren die Kühe auch durch Variationen in der Lautgebung, in welcher Phase des Paarungszyklus sie sich gerade befinden.[116][1][3]
Der Geschlechtsakt findet mehrmals täglich in einem Abstand von 10 bis 20 Minuten statt und dauert 45 bis 120 Sekunden. Die Kuh gibt dabei Grunzlaute im niedrigen Frequenzbereich von sich, die zwischen 18 und 35 Hz pendeln. Begleitet werden diese von Schreien, Trompetenrufen und Grollen sowie von Ablassen von Kot und Urin der Familienmitglieder, was als „Paarungspandemonium“ bekannt ist.[109][114][106][1][3]
Geburt und Individualentwicklung
Die Tragzeit beträgt rund 660 Tage. Das Muttertier bringt den Nachwuchs in der Regel innerhalb der Familiengruppe zur Welt, die Geburt kann aber auch an jedem beliebigen Ort stattfinden. Sie erfolgt häufig nachts. Typische Anzeichen der Niederkunft sind kniende, hockende oder liegende Positionen, Ausschlagen, Sekretionen der Vagina oder Urinieren. Zusätzlich steigert sich das Interesse der anderen Familienmitglieder. Die Geburt selbst verläuft relativ rasch. Zumeist ist das Junge noch von der Plazenta bedeckt, die von den anderen Tieren der Herde entfernt wird. Das Neugeborene kann mit Hilfe der anderen Herdenmitglieder innerhalb von rund 15 Minuten aufstehen. Der gesamte Geburtsprozess wird von einem bis zu 40-minütigen Trompeten, Brüllen und Grollen begleitet. Auch andere Jungtiere zeigen großes Interesse.[1][3]
_with_juvenile%252C_Daures%252C_Erongo%252C_Namibia.jpg.webp)
In den überwiegenden Fällen wird ein Jungtier geboren, Zwillinge kommen seltener zur Welt. Nach Untersuchungen im Amboseli-Nationalpark liegt der Anteil von Zwillingsgeburten bei 0,1 %,[3] im Etosha-Nationalpark erreicht er dagegen 10 %.[91] Neugeborene wiegen zwischen 75 und 120 kg, in seltenen Fällen bis 165 kg, und besitzen eine Schulterhöhe von 79 bis 92 cm. Dadurch können sie unter dem Leib des Muttertiers hindurchlaufen. Generell ist die Wachstumsrate der Jungtiere in den ersten fünf Jahren relativ hoch. Bereits nach dem zweiten Jahr verläuft sie zwischen männlichen und weiblichen Kälbern unterschiedlich. Zu diesem Zeitpunkt sind männliche Kälber bereits größer als weibliche. Hervorgerufen wird dies teilweise durch einen subtilen Unterschied zwischen männlichen und weiblichen Jungtieren. So erlaubt die Mutter ersteren meist immer Milch zu saugen, erscheint bei letzteren aber weniger tolerant. Darüber hinaus saugen männliche Kälber häufiger, dafür kürzer. Insgesamt nehmen sie dadurch mehr Milch zu sich im Vergleich zu den weiblichen Jungtieren. Die unterschiedliche Menge an zugeführter Milch seitens des Muttertiers führt dazu, dass diese mehr Energie in den männlichen Nachwuchs investiert. Erklärt wird dies unter anderem mit dem schnelleren Wachstum der männlichen Kälber gegenüber den weiblichen.[117][118] Regional treten teils deutliche Unterschiede im Wachstum auf. Im Amboseli-Nationalpark erreichen männliche Jungtiere mit zehn Jahren eine Schulterhöhe von 200 cm, weibliche mit etwa vierzehn. Die entsprechenden Angaben für den Kruger-Nationalpark liegen bei sieben und neun Jahren. Kühe erreichen mit rund 30 Jahren ihre volle Körpergröße, Bullen nehmen noch bis in ihre 50er Jahre an Größe und Gewicht zu. Als Ergebnis dieser lang anhaltenden Wachstumsphase übertreffen ältere männliche Tiere die weiblichen um 30 % an Höhe und teilweise um das Doppelte an Gewicht. Ursächlich verantwortlich dafür sind ein spätes Schließen der Epiphysenfugen der Röhrenknochen und das fehlende Verwachsen derartige Fugen an den Wirbeln und dem Schulterblatt.[91][1][3] Das generelle Wachstum der Jungtiere kann aber durch Dürre-Ereignisse oder durch junge, unerfahrene Muttertiere stark beeinflusst werden, vor allem in einem frühen Abschnitt der Saugphase. Dadurch verursachte Wachstumsverzögerungen resultieren in einer geringeren Körpergröße und höheren Sterblichkeit im Erwachsenenalter.[119]
Neugeborene sind rosafarben und deutlich dichter behaart als ausgewachsene Tiere. Außerdem ist das Augenlicht noch schwach entwickelt, so dass sich Neugeborene mit dem Rüssel tastend orientieren. In dieser Lebensphase besteht eine größere Bedrohung durch Beutegreifer für den Nachwuchs. Er verbleibt daher zumeist dicht beim Muttertier und bewegt sich selten mehr als einige Meter weg. Auch ist der Schutz durch die Herde zu diesem Zeitpunkt sehr groß. Die Distanz zum Muttertier erhöht sich allerdings mit dem Alter des Kalbes, wobei männliche Jungtiere durchschnittlich weiter vom Muttertier entfernt verweilen als weibliche. Allgemein geben Mütter nur ihrem eigenen Nachwuchs Milch. Die Jungen werden in der Regel etwa zwei Jahre gesäugt, die Entwöhnung kann je nach Region aber länger dauern. Häufig wird die Entwöhnung mit der Geburt des nächsten Kalbes verbunden.[117][118] Entwöhnte Kälber verbringen einen Großteil ihrer Tagesaktivität mit Fressen, Wandern und Ruhe. Daneben hat das Spiel mit anderen Kälbern eine hohe Bedeutung. Es besteht aus Jagen, gegenseitiges Besteigen, Rollen sowie aus Kämpfen mit dem Rüssel oder dem Kopf. Die Spielaktivitäten nehmen teilweise mit dem Alter zu. Hier suchen männliche Kälber zunehmend häufiger gleichgeschlechtliche Spielpartner aus nicht-verwandten Herden, während der weibliche Nachwuchs eher in der Familiengruppe verbleibt. Auf diese Weise ist das Spiel der weiblichen Tiere eher auf die Familiengruppe bezogen und dient dem sozialen Zusammenhalt, das der männlichen richtet sich aber nach außen zu familienfremden Mitgliedern.[59] Ältere weibliche Jungtiere kümmern sich zudem um den jüngeren Nachwuchs, was als „allomaternale Pflege“ bezeichnet wird. In vielen, aber nicht in allen Fällen handelt es sich dabei um Geschwister.[120] Die teils auffälligen geschlechtsbezogenen Unterschiede im Verhalten und in der Entwicklung des Nachwuchses spiegeln das spätere abweichende Fortpflanzungsverhalten der Kühe und Bullen im ausgewachsenen Alter wider.[117][118][91][1][3]
_drinking_(8291607694).jpg.webp)
Das Geburtsintervall liegt bei rund 3,5 bis 4,5 Jahren, unter schlechten Umweltbedingung verzögert sich die nächste Geburt auf bis zu über fünf Jahre. In Landschaften mit harschen Bedingungen wie etwa im Kaokoland können auch Abstände von über neun Jahren auftreten.[118][91] Ihr erstes Kalb bringen Kühe im Durchschnitt im 13. bis 15. Lebensjahr zur Welt, mitunter aber schon mit rund neun Jahren. Nach Untersuchungen von über 830 Kühen im Amboseli-Nationalpark erfolgt die erste Geburt mit durchschnittlich 13,8 Jahren, nur 5 % aller weiblichen Tiere bringen früher ein Kalb zur Welt. Muttertiere und gebährfähige Töchter können in Familiengruppen gleichzeitig reproduzieren, in sehr großen Familiengruppen sind mitunter drei weibliche Generationen im selben Zeitraum in die Fortpflanzung involviert.[121] Männliche Tiere leben ab etwa neun Jahren weitgehend unabhängig von ihrer Familie, mit rund 14 Jahren sind sie vollständig unabhängig. Zu diesem Zeitpunkt treten sie in die Pubertät ein, indiziert durch die erste Produktion von Sperma und durch eine kombinierte Größe der Hoden von 650 bis 700 g.[122] Eine quantitative Menge an Sperma wird aber erst einige Jahre später erreicht, was als sexuelle Reife gilt. Da die jungen männlichen Tiere zu diesem Zeitpunkt nur etwa die Hälfte ihres vollständigen Körpergewichts erreicht haben, können sie noch nicht mit älteren Bullen in einen Paarungswettstreit treten. Ein Sexualzyklus tritt erstmals Anfang der 20er Jahre ein. Ein Höhepunkt der Fruchtbarkeit zeichnet sich allgemein zwischen dem 16. und dem 40. Lebensjahr ab. Allerdings können sowohl weibliche als auch männliche Afrikanische Elefanten sich noch bis in die 60er Jahre fortpflanzen, auch wenn die Fortpflanzungsrate ab den 50er Jahren abnimmt. Das Höchstalter in freier Wildbahn ist unbekannt, es wird aber in der Regel mit 60 bis 65 Jahren für beide Geschlechter angenommen und ist individuell abhängig von der Nahrungsqualität und der Beanspruchung der Zähne. Die Lebenserwartung in ungestörten Populationen liegt bei durchschnittlich 54 Jahren für Kühe und 39 Jahre für Bullen. In Landschaften mit hohen Jagddruck seitens des Menschen sinkt sie rapide. Im Amboseli-Nationalpark beträgt sie dadurch 41 Jahre bei Kühen und 24 Jahre bei Bullen.[102] Die entsprechenden Werte im Samburu-Nationalreservat liegen bei nur 22 beziehungsweise 19 Jahren.[123] Generell sind männliche Tiere einer höheren Mortalitätsrate ausgesetzt. In menschlicher Gefangenschaft erreichten Tiere bisher maximal rund 55 Jahre.[1][3]
Fressfeinde und Interaktionen mit anderen Tierarten

Ein ausgewachsener Afrikanischer Elefant besitzt kaum natürliche Feinde. Kälber und Jungtiere bis 15 Jahre werden gelegentlich von Löwen und Tüpfelhyänen erbeutet. Der Einfluss der Raubtiere auf die lokalen Populationen des Afrikanischen Elefanten variiert mit den Jahreszeiten. Außerdem ist er abhängig von der Dichte des Raubtierbestandes und des Umfangs anderer potentieller Beutetiere. Im Hwange-Nationalpark in Simbabwe schließen etwa 22 % aller dokumentierten Beutezüge der Löwen Elefanten ein, wobei vor allem Jungtiere unter vier Jahren erlegt werden. Insgesamt erreichen Elefanten rund 16 % der erbeuteten Biomasse.[124] Nach Beobachtungen im Chobe-Nationalpark in Botswana verläuft fast jeder vierte Angriff von Löwen auf Elefanten erfolgreich. Häufig finden diese an Wasserstellen statt, die getöteten Tiere sind zwischen vier und elf Jahre alt.[125][126] Gemäß einzelnen Untersuchungen reagiert der Afrikanische Elefant negativ auf Gerüche von Löwenkot, was darauf hinweist, dass die Tiere den Beutegreifer als Fressfeind wahrnehmen.[127]
Es gibt ein reichhaltiges Spektrum an Interaktionen mit anderen Tierarten. Kälber und Jungtiere spielen häufig mit Vögeln, Affen, Warzenschweinen und Antilopen. Bei ausgewachsenen Individuen überwiegt weitgehend Konkurrenz, die in offenen Landschaften unter anderem zu den beiden afrikanischen Nashörnern, dem Flusspferd und dem Kaffernbüffel besteht.[4] Auch verjagt der Afrikanische Elefant Löwen und Hyänen von ihrer Beute oder aus der Umgebung der Familiengruppen. Er kann – unter anderem im Fall des Erschreckens – auch gezielt andere Tiere töten wie Vögel oder kleinere Säugetiere. Vor allem Jungbullen in ihrer ersten Musth zeigen teilweise extreme Aggression gegen andere größere Säugetiere. Allein im Hluhluwe-iMfolozi-Park in Südafrika töteten eingeführte Jungbullen zwischen den Jahren 1991 und 2001 fast 60 Breitmaul- und fünf Spitzmaulnashörner. Ebenso kamen im Pilanesberg-Nationalpark in den 1990er Jahren knapp 50 Breitmaulnashörner durch Elefanten ums Leben.[128][129] Zurückzuführen ist dies zumeist auf das Fehlen höherrangiger älterer Bullen, durch deren Anwesenheit die Musth der Jungbullen kontrolliert und geleitet werden kann.[130][3]
Des Weiteren reagiert der Afrikanische Elefant auf das summende Geräusch von wilden und aggressiven Bienen mit einer Flucht. Dies impliziert, dass die Tiere Bienen erkennen und ihr Fluggeräusch mit negativen Ereignissen aus der Vergangenheit in Verbindung bringen. Dabei kann ein Individuum selbst oder ein verwandtes Familienmitglied gestochen worden sein, die Erfahrung mag aber auch auf soziales Lernen zurückgehen.[131]
Parasiten und Krankheiten
Es sind zahlreiche Parasiten des Afrikanischen Elefanten dokumentiert. Zu den äußeren gehören allein über 20 Arten an Zecken, des Weiteren auch Läuse wie Haematomyzus oder Ohrmilben wie Loxonaetus und Otonaetus. Hinzu kommen noch verschiedenste Fliegen wie Dasselfliegen und Magendasseln. Hervorzuheben sind etwa Pharyngobolus, Pltycobboldia, Ruttenia und Cobboldia.[132] Innere Parasiten umfassen über 30 bekannte Arten, darunter Fadenwürmer wie Grammocephalus und Saugwürmer wie Protofasciola.[133] Untersuchungen an Kotproben aus dem Okavango-Delta zeigen, dass der Befall vor allem in der Regenzeit hoch ist. Außerdem sind die Familienclans stärker betroffen als die Junggesellengruppen.[134][4][3]
Einen größeren Einfluss auf die lokalen Populationen kann der Milzbrand haben. Im Etosha-Nationalpark wurden in den 1980er Jahren insgesamt drei Epidemien mit über 300 verendeten Afrikanischen Elefanten registriert.[135] Ebenfalls in einzelnen Fällen tödlich endet die Encephalomyocarditis, welche durch das Picornavirus hervorgerufen und durch Nagetiere übertagen wird. Der Krankheit fielen unter anderem im Kruger-Nationalpark während eines größeren Ausbruchs im Jahr 1994 über 60 Afrikanische Elefanten zum Opfer, der Großteil davon Bullen.[136] Des Weiteren wirken sich unter Umständen auch Blaualgen auf lokale Bestände aus, wie etwa bei einem Massensterben von Afrikanischen Elefanten in den Monaten Mai bis Juni des Jahres 2020 im Okavango-Delta. Dabei verendeten rund 350 Tiere durch die Aufnahme von Wasser an offenen Gewässerstellen, die durch eine Algenblüte vergiftet waren.[137][138] Weitgehend unerforscht ist das Floppy oder Flaccid trunk syndrome. Hierbei degenerieren die Nerven des Rüssels, was zu einer vollständigen Lähmung des Organs führen kann. Für betroffene Individuen kann dies tödlich enden, da eine Nahrungsaufnahme nicht mehr möglich ist. Eventuell wird die Erkrankung durch Pflanzengifte hervorgerufen.[139][3]
Ökologische Bedeutung

Der Afrikanische Elefant prägt in sehr starkem Maße seine Umwelt. Das Entrinden oder Umknicken von Bäumen vornehmlich oder häufig durch Bullen schädigt beispielsweise Waldland. Bei einer entsprechend hohen Dichte einer lokalen Population können so größere Areale ihres Baumbestandes beraubt werden und in Grasland übergehen. Verbunden damit ist ein Schwund des Artenreichtums der lokalen Flora und Fauna.[140][141] Derartige Veränderungen sind unter anderem aus dem Murchison-Falls-Nationalpark in Uganda, dem Tsavo-East-Nationalpark in Kenia oder dem Kruger-Nationalpark in Südafrika belegt. Über die langfristigen Auswirkungen liegen aber momentan kaum Daten vor. Sowohl Elefanten als auch Bäume sind langlebige Lebewesen, ihre Interaktionen wurden bisher nur wenig untersucht. Zahlreiche externe Faktoren wie Jagd oder Habitatverlust in einzelnen Regionen stören zusätzlich die Untersuchungen. Hinzu kommen andere, natürliche Ereignisse wie Feuer. Durch Buschbrände etwa können dichte Baumbestände aufgelöst werden, während im Nachfolgenden Elefanten die Landschaften weiter offen halten. Zum Einfluss des Afrikanischen Elefanten wurden daher verschiedene Modelle entwickelt, die von einem Gleichgewicht über stabile zyklische Vorgänge bis hin zu sich wiederholenden zyklischen Ereignissen reichen.[142][3]
Das Öffnen waldreicher Landschaften hat aber auch zur Folge, dass diese Bereiche für andere Tierarten der Savannen wie Nashörner zugänglich werden und diese die neuen Refugien auch nutzen.[143] Andererseits kann eine zunehmende lokale Population des Afrikanischen Elefanten dazu verhelfen, künstlich veränderte Landschaften wieder in einen eher natürlichen Zustand zurückzuverwandeln.[144] In einem kleineren Maßstab dienen die beim Entrinden der Bäume oder beim Abbrechen von Ästen geschaffenen Hohlräume als Rückzugsorte für Kleinwirbeltiere. Dies kann mitunter einen bedeutenden Einfluss auf deren Bestand ausüben, wie es beispielsweise bei Geckos der Gattung Lygodactylus belegt wurde.[145] Des Weiteren haben die vom Afrikanischen Elefanten bei seinen Wanderungen angelegten Pfade eine große Bedeutung für andere Tierarten.[56][3]
Einen größeren Anteil hat der Afrikanische Elefant auch an der Verbreitung von Pflanzensamen, die er mit seinem Dung ausscheidet. Zu den häufigeren Samen gehören solche von Akazien, aber auch des Marulabaums, von Mangos und Melonen und der Gattung Balanites. Letztere, bei der es sich um Trockenwaldbäume aus der Familie der Jochblattgewächse handelt, profitiert erheblich vom Afrikanischen Elefanten, da es nach Analysen in Uganda bei etwas mehr als der Hälfte der Samen nach der Passage durch den Magen-Darm-Trakt zur Keimung kommt. Bei Samen, die nicht das Verdauungssystem durchwanderten, sind es weniger als 1 %. Die Passage durch den Magen-Darm-Trakt dauert im Durchschnitt 24 bis 36 Stunden. Das Wanderungsverhalten der Tiere ermöglicht so einen Transport der Samen über Distanzen von rund 2,5 km, im Extremfall wurden bis zu 65 km beobachtet.[146][147][148]
Systematik
Innere Systematik der heutigen Elefanten nach Meyer et al. 2017[149]
|
Der Afrikanische Elefant ist eine Art aus der Gattung der Afrikanischen Elefanten (Loxodonta). Der Gattung gehört außerdem noch der Waldelefant (Loxodonta cyclotis) als weiterer Vertreter an. Loxodonta stellt die Schwestergruppe der Gattung Elephas mit dem Asiatischen Elefanten (Elephas maximus) als einzigem Mitglied dar. Beide Gattungen wiederum gehören zur Familie der Elefanten (Elephantidae) innerhalb der Ordnung der Rüsseltiere (Proboscidea). Die Rüsseltiere formen eine sehr alte Gruppe originär afrikanischer Tiere. Ihre Ursprünge reichen rund 60 Millionen Jahre in die Vergangenheit zurück. Im Verlauf ihrer Stammesgeschichte erwiesen sie sich als sehr vielfältig mit Anpassungen an zahlreiche Biotope und Klimaregionen. Dabei besiedelten die Rüsseltiere auch weite Teile Eurasiens und Amerikas. Im Vergleich zur langen Stammesgeschichte der Rüsseltiere können die Elefanten als relativ junge Entwicklungslinie angesehen werden. Die ersten Vertreter lassen sich im ausgehenden Miozän nachweisen. Vorläufer der heutigen Formen traten fossil vor rund 7 Millionen Jahren in Erscheinung.[150] Dies stimmt in etwa mit molekulargenetischen Untersuchungen überein, denen zufolge sich die afrikanischen und die asiatischen Elefanten vor 7,6 Millionen Jahren voneinander abtrennten. Die beiden heutigen Angehörigen der Afrikanischen Elefanten differenzierten sich vor 5,6 bis 2,6 Millionen Jahren heraus.[151][152]
Allgemein werden heute keine Unterarten des Afrikanischen Elefanten unterschieden. Dies sah in der forschungsgeschichtlichen Vergangenheit anders aus. Bis in die 1990er Jahre galten alle Elefanten des afrikanischen Kontinents als zu einer Art gehörig, innerhalb der teilweise bis zu sechs Unterarten anerkannt waren. Diese sechs Unterarten des Afrikanischen Elefanten im weiteren Sinne verteilten sich dabei auf zwei unterschiedliche Gruppen:[4]
- L. a. africana-Division
- L. a. africana (Blumenbach, 1797); südliches Afrika
- L. a. knochenhaueri (Matschie, 1900); östliches Afrika
- L. a. orleansi (Lydekker, 1906); nordöstliches Afrika
- L. a. oxyotis (Matschie, 1900); nördliches Afrika
- L. a. cyclotis-Division
- L. a. cyclotis (Matschie, 1900); westliches und zentrales Afrika
- L. a. pharaohensis Deraniyagala, 1948; nördliches Afrika; ausgestorben (Nordafrikanischer Elefant)
Der Waldelefant hatte somit im Verlauf des 20. Jahrhunderts lediglich die Stellung einer Waldvariante des Afrikanischen Elefanten inne. Erst verschiedene genetische[153][154][155] und anatomische[9] Studien im Übergang vom 20. zum 21. Jahrhundert führten zur Anerkennung des Waldelefanten als eigenständige Art. Beide Vertreter der Gattung Loxodonta hybridisieren aber im Kontaktbereich ihrer Verbreitungsgebiete,[156][157][20] ein sympatrisches Auftreten ist beispielsweise im Nationalpark Fazao-Malfakassa in Togo dokumentiert worden.[158] Die Aufteilung in die weiteren Unterarten wird heute weitgehend angezweifelt, zumal genetische Untersuchungen diese nicht nachvollziehen können.[159][156] Der Afrikanische Elefant ist daher als monotypisch anzusehen, auch wenn es zahlreiche Variationen in der Körpergröße und der Stoßzahnausprägung im gesamten Verbreitungsgebiet gibt.[1][3]
Stammesgeschichte
Die Gattung Loxodonta erschien erstmals im oberen Miozän vor rund 7 Mio. Jahren in Afrika. Sie entwickelte sich aus Primelephas, dem stammesgeschichtlich ältesten Vertreter der echten Elefanten. Einige Paläontologen gehen aber auch von einem Ursprung von Stegotetrabelodon aus. Es sind mehrere ausgestorbene Arten bekannt, die sich alle auf den afrikanischen Kontinent beschränken. Zu den fossilen Formen gehören etwa Loxodonta cookei als bisher älteste Form sowie Loxodonta adaurora, Loxodonta exoptata und Loxodonta atlantica. Der heutige Afrikanische Elefant lässt sich erstmals im Übergang vom Unteren zum Mittleren Pleistozän fassen, sein Vorgänger ist aber unbekannt. Die etwa zeitgleich im nördlichen und südlichen Afrika auftretende Form Loxodonta atlantica gilt als zu modern um in der direkten Linie des Afrikanischen Elefanten zu stehen. Ebenso kann die nur wenig ältere Art Loxodonta adaurora ausgeschlossen werden, die zwar im Schädelbau stark mit dem Afrikanischen Elefanten übereinstimmt, im Zahnbau aber markant abweicht. Gesicherte Funde vom Afrikanischen Elefanten dieser Zeitstellung liegen unter anderem vom Awash im Afar-Dreieck in Äthiopien vor. Möglicherweise können einige Zähne und ein Schädel eines Jungtiers aus Angamma-Yayo im Tschad das zeitliche Auftreten der Art bis in das beginnende Untere Pleistozän ausdehnen.[6] Andere frühe Funde stammen aus der Kibish-Formation am Omo, ebenfalls Äthiopien,[160] und aus Elandsfontein in Südafrika. Sie datieren aber bereits in das ausgehende Mittelpleistozän. Aus letzterer Fundstelle wurden auch deutlich jüngere Funde dokumentiert.[161][162][163]
Forschungsgeschichte

Kenntnisse über den Afrikanischen Elefanten in der westlichen Welt reichen bis in die Antike zurück. Diese stiegen dann vor allem zu Zeit der Kolonialisierung Afrikas an. Die Bezeichnung „Elfenbeinküste“ für einen Teil des westlichen Afrikas bezieht sich auf die große Mengen an Elfenbein, das von dort nach Europa verschifft wurde. Ein lebender Afrikanischer Elefant aus dieser Region erreichte den Hof von König Ludwig XIV. im Jahr 1668, er lebte in den Gärten von Versailles bis zu seinem Tod im Jahr 1681. Das Skelett des Tieres diente unter anderem Georges-Louis Leclerc de Buffon und Louis Jean-Marie Daubenton 1769 zu einer ausführlichen Beschreibung.[164] Auch Georges Cuvier verwendete es im Jahr 1806 zusammen mit einigen Exemplaren aus dem südlichen Afrika für eine eingehende Bearbeitung.[165] Für das Tier aus Westafrika, dessen Reste sich noch im Muséum national d’histoire naturelle in Paris befinden, ist aber eine Zuordnung zum Waldelefanten wahrscheinlich.[5][166]
Carl von Linné führte im Jahr 1754 nur den Asiatischen Elefanten unter der Bezeichnung Elephas indicus.[167] In der zehnten Auflage seines bedeutenden Werkes Systema naturae von 1758 hatte er sowohl den Asiatischen als auch den Afrikanischen Elefanten zusammengefasst und beide mit Elephas maximus benannt.[168] Eine formale Trennung der beiden Elefantenarten unternahm fast vierzig Jahre später, 1797, der deutsche Naturforscher Johann Friedrich Blumenbach in seinem „Handbuch der Naturgeschichte“. Er verwies den Afrikanischen Elefanten zur Art Elephas africanus und begründete diesen Schritt mit der im Gegensatz zum Asiatischen Elefanten rhombischen Lamellenstruktur der Backenzähne.[169] Blumenbach gilt daher als wissenschaftlicher Erstbeschreiber des Afrikanischen Elefanten. Der unterschiedliche Zahnaufbau veranlasste dann 1825 auch Frédéric Cuvier zur Definition der Gattung Loxodonta; er stellte die Bezeichnung innerhalb einer Monographie zur Naturgeschichte der Säugetiere vor, verzichtete hierin aber auf eine Latinisierung.[170] Erst im Jahr 1827 wurde der Gattungsname Loxodonta durch einen ungenannten Autoren in einer Rezension des entsprechenden Werkes korrekt wiedergegeben, so dass dieser heute als Erstbenenner der Gattung gilt.[171][172]
Das Fundmaterial, mit dem Blumenbach seine neue Art Elephas africanus aufstellte, befand sich in der Sammlung der Universität Göttingen und ist heute vermutlich verloren. Es kann angenommen werden, dass es ursprünglich – wie häufig bei forschungsgeschichtlich frühem Material – aus dem südlichen Afrika stammte. Hermann Pohle legte daher im Jahr 1926 das Gebiet um den Fluss Oranje als Typusgebiet fest.[173][166] Aus der gleichen Region hatte Georges Cuvier bereits ein Jahr nach Blumenbach und unabhängig von diesem dem Afrikanischen Elefanten die Bezeichnung Elephas capensis zugewiesen.[174] Die Bezeichnung gilt heute als synonym zu Loxodonta africana. Weitere Bezeichnungen wurden im Verlauf des 19. Jahrhunderts eingeführt. Allerdings kam es in diesem Zeitraum nie zu einer stärkeren Aufteilung der Art in verschiedene Unterarten. Erst Paul Matschie führte im Jahr 1900 mehrere Unterarten ein, darunter auch den Waldelefanten.[175] Nur wenig später versuchte sich Richard Lydekker 1907 an einer stärkeren Gliederung der Art anhand der Form der Ohren.[176] Das Vorgehen wurde später aufgrund der hohen Variabilität des Merkmals kritisiert.[5] Die von Matschie und Lydekker postulierten Unterarten sind mit Ausnahme des Waldelefanten als eigene Form heute nicht mehr anerkannt.[1][3]
Afrikanischer Elefant und Mensch
Lokale Kunst und Kultur

Der Afrikanische Elefant hatte für die lokale Bevölkerung seit Jahrtausenden eine hohe Bedeutung als Nahrungs- und Rohstoffquelle. Neben dem Fleisch fand vor allem die Haut und das Elfenbein der Stoßzähne Verwendung. Als eines der beeindruckendesten Tiere der afrikanischen Landschaften wurde er auch in der lokalen Kunst quer über den gesamten Kontinent dargestellt. Herausragend ist hier die Wandkunst der San im südlichen Afrika. Allein in der Gemeinde Cederberg in Südafrika existieren rund 200 Felsüberhänge mit Elefantendarstellungen. Sie sind teilweise intensiv rot ausgeführt. Als bemerkenswert kann die sehr realistische Wiedergabe der Tiere angesehen werden, was sowohl die Körperproportionen als auch die Lebensweise betrifft. So zeigen die Bilder unter anderem Familiengruppen bei ihren Wanderungen oder bei der Nahrungsaufnahme.[177]
Ein weiteres bedeutendes Zentrum der afrikanischen Felskunst findet sich in der Sahara im nördlichen Afrika. Die ältesten Felsbilder entstanden hier bereits in der Bubaluszeit, die den Übergang vom ausgehenden Pleistozän bis in das beginnende Holozän abdeckt und durch Darstellungen mit gekrümmten Linien und verzerrten Proportionen der sogenannten „Tazina-Schule“ gekennzeichnet ist. Als herausragend können etwa die Regionen des Messak oder des Tadrart Acacus von Libyen genannt werden. In ersterer finden sich unter anderem Zeichnungen riesiger Tiere mit winzigen Menschen, die gebogene Gegenstände, wohl Bumerangs, an die Rüssel halten, letztere sticht beispielsweise mit einer Abbildung einer Herde hervor, deren hinterstes Individuum scheinbar defäziert.[178][179] Jünger sind die Tiermotive aus dem Wadi al-Ajal im südwestlichen Libyen, die mit einem Alter von etwa 6300 bis 1000 v. Chr. der Rinderzeit angehören. Der Stil dieser Phase wird durch subnaturalistische, gepunzte Bilder charakterisiert. Im Wadi al-Ajal bilden gut 3,1 % aller Darstellungen den Afrikanischen Elefanten ab, was numerisch 37 Individuen entspricht. Angemerkt sei hier eine Eingravierung eines Bullen in der Musth.[180] Im südlichen Marokko in der Region um Akka macht der Afrikanische Elefant wiederum rund 2,6 % aller Darstellungen der Bubalus- und Rinderzeit aus. Recht häufig kommen Gruppen vor, bei denen die unterschiedlichen Größenausprägungen der Individuen an Mutter-Jungtier-Verbände denken lassen. Gelegentlich treten Darstellungen von Elefanten gemeinsam mit solchen von Menschen auf.[181][182] Auch nachfolgend kommen immer wieder Bildmotive des Afrikanischen Elefanten vor, so etwa in Marokko. Darüber hinaus liegen aus dem westlichen und östlichen Afrika ebenfalls Elefantendarstellungen vor.[183]
Zähmung
.jpg.webp)
Anders als der Asiatische Elefant ist der Afrikanische Elefant wahrscheinlich selten domestiziert worden. Versuche reichen aber bis in die ptolemäische Zeit des 4. und 3. Jahrhunderts v. Chr. zurück. Die Grundlage für die Zähmung legte Ptolemaios II. um 270 v. Chr., der neue Tiere für seine ursprünglich aus Asien stammenden Kriegselefanten benötigte. Diese beschaffte er aus der Region südlich von Ägypten, was in der Gründung mehrerer Städte entlang des Roten Meeres mündete, etwa Ptolemais Theron und Berenike. Über diese verschifften die Ptolemäer die eingefangenen Tiere nach Ägypten.[184] Die Bemühungen gipfelten letztendlich in der Schlacht von Raphia im Jahr 217 v. Chr., in der sich afrikanische und asiatische Elefanten gegenüberstanden (sie wird daher auch „Schlacht der Elefanten“ genannt).[185] In der Forschung ist allerdings umstritten, ob es sich hierbei um den Afrikanischen Elefanten oder den kleineren Waldelefanten handelte. Getragen wird diese Debatte durch antike Schriftzeugnisse, die den Elefanten der Ptolemäer eine geringere Körpergröße als den asiatischen Elefanten zuschreiben, keine Turmaufbauten trugen und den gegnerischen Tieren unterlegen gewesen sein sollen. DNA-Analysen an Elefanten aus Eritrea, der wahrscheinlichen Ursprungsregion der Tiere der Ptolemäer, ergaben im Jahr 2013 eine eindeutige Verwandtschaft mit dem größeren Afrikanischen Elefanten.[186] Eine ähnliche Diskussion besteht zu den Tieren, die Hannibal während des Zweiten Punischen Krieges um 218 v. Chr. bei seiner Alpenüberquerung mit sich führte.[187][185][188]
Bedrohung und Schutz

Die Jagd nach Elfenbein und die Wilderei haben dazu beigetragen, die Population des Afrikanischen Elefanten in vielen Teilen Afrikas schwinden zu lassen. Weitere Gefährdungen finden sich in den Habitatverlusten durch die ansteigende menschliche Bevölkerung und daraus resultierenden Konflikten mit den lokalen Bewohnern. In einzelnen Bereichen des westlichen, östlichen und südlichen Afrikas starb er ganz aus, so in Gambia 1913, in Eswatini, 1920, in Burundi in den 1970er und in Mauretanien in den 1980er Jahren. Zu den rezenten Verlusten gehört Sierra Leone 2010, während die Art möglicherweise auch aus Guinea-Bissau und dem Senegal verschwunden ist. In Südafrika stand der Afrikanische Elefant im Übergang vom 19. zum 20. Jahrhundert kurz vor der Ausrottung. Die Gründung einzelner Schutzgebiete wie der Addo-Elefanten-Nationalpark 1931 oder der Kruger-Nationalpark 1926 führten zu einem Anstieg der Population auf gegenwärtig rund 18.000 Individuen.[1][3][189]
Nachdem 1989 der Elfenbeinhandel weltweit verboten wurde, gab es in Ostafrika und vor allem in den Staaten des südlichen Afrikas eine stetige Bestandszunahme. Die Entscheidung wurde kontrovers diskutiert und es gab seit 1997 Überlegungen, den Handel wieder teilweise zu öffnen und kontrolliert zuzulassen. Dies führte auch zur Einrichtung des Programms MIKE (Monitoring of Illegal Killing of Elephants, zu deutsch etwa „Beobachtung der illegalen Tötung von Elephanten“). Der Erlös des seit dem Jahr 2008 wieder zugelassenen Handels vorrätiger oder gelagerter Stoßzähne fließt seitdem in Schutzprogramme für den Afrikanischen Elefanten. Die IUCN, die den Afrikanischen Elefanten von 1996 bis 2003 als „stark gefährdete“ (endangered) Tierart aufgelistet hatte, stufte ihn 2004 in den niedrigeren Rang „gefährdet“ (vulnerable) zurück. Seit dem Jahr 2021 gilt er wieder als „stark gefährdet“ (endangered).[189] Gleichzeitig mit dem weltweiten Handelsverbot wurde die Art auf den Anhang I des CITES-Abkommens gesetzt. Inzwischen wurde der Afrikanische Elefant für Botswana, Namibia, Simbabwe und Südafrika in den Anhang II zurückgestuft, Elfenbein-Lagerbestände dieser Länder werden legal versteigert. Seither ist in zahlreichen Herkunftsländern ein Anstieg der Wilderei zu verzeichnen.[190]
Der Afrikanische Elefant kommt in insgesamt 37 Ländern des Afrika südlich der Sahara vor und ist dort in zahlreichen Schutzgebieten präsent. Annahmen zufolge liegt das Gesamtverbreitungsgebiet der Art aber zu 70 % und mehr außerhalb von Schutzgebieten. Zu den weiteren Schutzmaßnahmen gehören das Habitatmanagement, was notwendig ist, da sich ein übermäßiges Wachstum lokaler Bestände negativ auf die regionale Landschaft, andere Tierarten oder die Elefanten selbst auswirken kann. Großflächige Schlachtungen (Keulung) extrem dichter Bestände werden heute aber nicht mehr durchgeführt, vielmehr werden einzelne Herden umgesiedelt. Zur Stärkung der lokalen Landwirtschaft und Schutz vor Plünderungen der Felder durch den Afrikanischen Elefanten werden unter anderem Zäune mit Bienenstöcken errichtet, um die natürliche Angst der Tiere vor den Insekten auszunutzen. Gleiches gilt für Gerüche von Löwen, die der Afrikanische Elefant als negativen Reiz wahrnimmt. Andere Maßnahmen bestehen etwa aus dem Verbrennen von brikettierten scharfen Chilischoten, dem Erzeugen lauter Geräusche oder von hellen Lichtern, was lokal das Verhalten des Afrikanischen Elefanten ändern kann.[191][192][127] In einzelnen Ländern wie Südafrika, Tansania oder Sambia ist die Sportjagd erlaubt. Die daraus gewonnenen Einnahmen fließen teilweise in die lokalen Kommunen zurück und unterstützen die Toleranz der Bevölkerung gegenüber dem Afrikanischen Elefanten und mindern Konfliktsituationen. In Botswana, das mit rund 130.000 Elefanten die größte Population aufweist,[23] wurde die Jagd 2014 verboten mit negativen Auswirkungen für die Kommunen und einem Anstieg der Wilderei.[193] Darüber hinaus bestehen einzelne Abkommen zwischen benachbarten Staaten für gemeinsame Schutzmaßnahmen weit wandernder und damit grenzübergreifender Gruppenverbände des Afrikanischen Elefanten.[189][1][3] Nichtsdestotrotz bleibt Wilderei ein generelles Problem. Im Jahr 2009 wurde geschätzt, dass jährlich 38.000 Afrikanische Elefanten für den Elfenbeinhandel gewildert wurden.[194]
Literatur
- Larry Laursen und Marc Bekoff: Loxodonta africana. Mammalian Species 92, 1978, S. 1–8
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore (MD), 1999 ISBN 0-8018-5789-9
- Joyce Poole, Paula Kahumbu und Ian Whyte: Loxodonta africana Savanna Elephant (African Bush Elephant). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 181–194
- Ian Whyte: Loxodonta africana (Blumenbach1797) – African savanna elephant. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 51–59
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, S. 50–79 (S. 77) ISBN 978-84-96553-77-4
Einzelnachweise
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hoofed Mammals. Lynx Edicions, Barcelona 2011, S. 50–79 (S. 77) ISBN 978-84-96553-77-4
- Donald R. Prothero: Rhino giants: The palaeobiology of Indricotheres. Indiana University Press, 2013, S. 1–141 (S. 105) ISBN 978-0-253-00819-0
- Joyce Poole, Paula Kahumbu und Ian Whyte: Loxodonta africana Savanna Elephant (African Bush Elephant). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 181–194
- Larry Laursen und Marc Bekoff: Loxodonta africana. Mammalian Species 92, 1978, S. 1–8
- Glover M. Allen: Zoological results of the George Vanderbilt African Expedition of 1934. Part II: The forest elephant of Africa. Proceedings of the Academy of Natural Sciences of Philadelphia 88, 1936, S. 15–44
- Vincent J. Maglio: Origin and Evolution of the Elephantidae. Transactions of the American Philosophical Society 63 (3), 1973, S. 1–149 (S. 29–31)
- N. J. van der Merwe, A. J. Bezuidenhout und Christina D. Seegers: The skull and mandible of the African elephant (Loxodonta africana). Onderstepoort Journal of Veterinary Research 62, 1995, S. 245–260
- Nancy E. Todd: Qualitative Comparison of the Cranio-Dental Osteology of the Extant Elephants, Elephas Maximus (Asian Elephant) and Loxodonta africana (African Elephant). The Anatomical Record 293, 2010, S. 62–73
- Peter Grubb, Colin P. Groves, Joseph P. Dudley und Jeheskel Shoshani: Living African elephants belong to two species: Loxodonta africana (Blumenbach, 1797) and Loxodonta cyclotis (Matschie, 1900). Elephant 2 (4), 2000, S. 1–4
- C. Bielert, N. Costo und A. Gallup: Tuskedness in African elephants – an anatomical investigation of laterality. Journal of Zoology 304, 2018, S. 169–174
- E. J. Raubenheimer, W. F. P. van Heerden, P. J. van Niekerk, V. de Vos und M. J. Turner: Morphology of the deciduous tusk (tush) of the African elephant (Loxodonta africana). Archives of Oral Biology 40 (6), 1995; S. 571–576
- E. J. Raubenheimer: Early development of the tush and the tusk of the African elephant (Loxodonta africana). Archives of Oral Biology 45, 2000; S. 983–986
- Shane C. Cambell-Staton, Brian J. Arnold, Dominique Conçalves, Petter Granli, Joyce Poole, Ryan A. Long und Robert M. Pringle: Ivory poaching and the rapid evolution of tusklesness in African elephants. Science 374, 2021, S. 483–487, doi:10.1126/science.abe7389
- Jeheskel Shoshani: Understanding proboscidean evolution: a formidable task. Tree 13, 1998, S. 480–487
- William J. Sanders: Horizontal tooth displacement and premolar occurrence in elephants and other elephantiform proboscideans. Historical Biology 30 (1–2), 2018, S. 137–156, doi:10.1080/08912963.2017.1297436
- T. C. S. Morrison-Scott: A revision of the knowledge of African elephants' teeth, with notes on Forrest and „Pygmy“ elephants. Proceedings of the Zoological Society 117, 1948, S. 505–527
- Jeheskel Shoshani: Skeletal and other basic anatomical features of elephants. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 9–20
- Iain Douglas-Hamilton und Francis Michelmore: Loxodonta africana: range and distribution, past and present. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 321–326
- Phillipe Bouché, Iain Douglas-Hamilton, George Wittemyer, Aimé J. Nianogo, Jean-Louis Doucet, Philippe Lejeune und Cédric Vermeulen. Will Elephants Soon Disappear from West African Savannahs? PLoS ONE 6 (6), 2011, S. e20619, doi:10.1371/journal.pone.0020619
- Samrat Mondol, Ida Moltke, John Hart, Michael Keigwin, Lisa Brown, Matthew Stephens und Samuel K. Wasser: New evidence for hybrid zones of forest and savanna elephants in Central and West Africa. Molecular Ecology 24, 2015, S. 6134–6147
- Keith Leggett: Diurnal activities of the desert-dwelling elephants in northwestern Namibia. Pachyderm 45, 2008/2009, S. 20–33
- J. M. Grimshaw, N. J. Cordeiro und C. A. H. Foley: The Mammals of Kilimanjaro. Journal of East African Natural History 84 (2), 1995, S. 105–139
- Michael J. Chase, Scott Schlossberg, Curtice R. Griffin, Philippe J. C. Bouché, Sintayehu W. Djene, Paul W. Elkan, Sam Ferreira, Falk Grossman, Edward Mtarima Kohi, Kelly Landen, Patrick Omondi, Alexis Peltier, S. A. Jeanetta Selier und Robert Sutcliffe: Continent-wide survey reveals massive decline in African savannah elephants. PeerJ 4, 2016, S. e2354, doi:10.7717/peerj.2354
- David Rozen-Rechels, Hugo Valls-Fox, Cheryl Tinashe Mabika und Simon Chamaillé-Jammes: Temperature as a constraint on the timing and duration of African elephant foraging trips. Journal of Mammalogy 101 (6), 2020, S. 1670–1679, doi:10.1093/jmammal/gyaa129
- J. R. Wyatt und S. K. Eltringham: The daily activity of the elephants in the Ruwenzori National Park, Uganda. East African Wildlife Journal 12 (4), 1974, S. 273–289
- Graeme Shannon, Bruce R. Page, Robin L. Mackey, Kevin J. Duffy und Rob Slotow: Activity budgets and sexual segregation in African elephants (Loxodonta africana). Journal of Mammalogy 89 (2), 2008, S. 467–476
- Nadine Gravett, Adhil Bhagwandin, Robert Sutcliffe, Kelly Landen, Michael J. Chase, Oleg I. Lyamin, Jerome M. Siegel und Paul R. Manger: Inactivity/sleep in two wild free-roaming African elephant matriarchs – Does large body size make elephants the shortest mammalian sleepers? PLoS ONE 12 (3), 2017, S. e0171903, doi:10.1371/journal.pone.0171903
- A. A. Kinahan, R. Inge-Moller, P. W. Bateman, A. Kotze und M. Scantlebury: Body temperature daily rhythm adaptations in African savanna elephants (Loxodonta africana). Physiology & Behavior 92, 2007, S. 560–565
- Nicole M. Weissenböck, Walter Arnold und Thomas Ruf: Taking the heat: thermoregulation in Asian elephants under different climatic conditions. Journal of Comparative Physiology B 182 (2), 2012, S. 311–319, doi:10.1007/s00360-011-0609-8
- P. G. Wright: Why do elephants flap their ears? South African Journal of Zoology 19 (4), 1984, S. 266–269
- Polly K. Phillips und James Edward Heath: Heat exchange by the pinna of the African elephant (Loxodonta africana). Comparative Biochemy and Physiology 101 (4), 1992, S. 693–699
- Moise Koffi, Yiannis Andreopoulos und Latif M. Jiji: The Role of Pinnae Flapping Motion on Elephant Metabolic Heat Dissipation. Journal of Heat Transfer 136, 2014, S. 101101, doi:10.1115/1.4027864
- Robin C. Dunkin, Dinah Wilson, Nicolas Way, Kari Johnson und Terrie M. Williams: Climate influences thermal balance and water use in African and Asian elephants: physiology can predict drivers of elephant distribution. The Journal of Experimental Biology 216, 2013, S. 2939–2952
- António F. Martins, Nigel C. Bennett, Sylvie Clavel, Herman Groenewald, Sean Hensman, Stefan Hoby, Antoine Joris, Paul R. Manger und Michel C. Milinkovitch: Locally-curved geometry generates bending cracks in the African elephant skin. Nature Communications 9, 2018, S. 3865, doi:10.1038/s41467-018-06257-3
- Russell A. Charif, Rob Roy Ramey, William R. Langbauer, Katharine B. Payne, Rowan B. Martin und Laura M. Brown: Spatial relationships and matrilineal kinship in African savanna elephant (Loxodonta africana) clans. Behavioral Ecology and Sociobiology 57, 2005, S. 327–338
- Elizabeth A. Archie, Cynthia J. Moss und Susan C. Alberts: The ties that bind: genetic relatedness predicts the fission and fusion of social groups in wild African elephants. Proceedings of the Royal Society B 273, 2006, S. 513–522
- Karen McComb, Graeme Shannon, Sarah M. Durant, Katito Sayialel, Rob Slotow, Joyce Poole und Cynthia Moss: Leadership in elephants: the adaptive value of age. Proceedings of the Royal Society B 278, 2011, S. 3270–3276
- Elizabeth A. Archie, Thomas A. Morrison, Charles A. H. Foley, Cynthia J. Moss und Susan C. Alberts: Dominance rank relationships among wild female African elephants, Loxodonta africana. Animal Behaviour 71, 2006, S. 117–127
- George Wittemyer und W. M. Getz: Hierarchical dominance structure and social organization in African elephants, Loxodonta africana. Animal Behaviour 73, 2007, S. 671–681
- Phyllis C. Lee und Cynthia J. Moss: Wild Female African Elephants (Loxodonta africana) Exhibit Personality Traits of Leadership and Social Integration. Journal of Comparative Psychology 126 (3), 2012, S. 224–232
- Shermin de Silva und George Wittemyer: A Comparison of Social Organization in Asian Elephants and African Savannah Elephants. International Journal of Primatology 33 (5), 2012, S. 1125–1141
- Shermin de Silva, Volker Schmid und George Wittemyer: Fission–fusion processes weaken dominance networks of female Asian elephants in a productive habitat. Behavioral Ecology 28 (1), 2017, S. 243–252
- Cynthia J. Moss und Joyce H. Poole: Relationships and social structure in African elephants. In: R. A. Hinde (Hrsg.): Primate social relationships: An integrated approach. Oxford, 1983, S. 315–325
- George Wittemyer, I. Douglas-Hamilton und W. M. Getz: The socioecology of elephants: analysis of the processes creating multitiered social structures. Animal behaviour 69, 2005, S. 1357–1371
- Karen McComb, Cynthia Moss, Soila Sayialel und Lucy Baker: Unusually extensive networks of vocal recognition in African elephants. Animal Behaviour 59, 2000, S. 1103–1109
- Connie R. B. Allen, Lauren J. N. Brent, Thatayaone Motsentwa, Michael N. Weiss und Darren P. Croft: Importance of old bulls: leaders and followers in collective movements of all‑male groups in African savannah elephants (Loxodonta africana). Scientific Reports 10, 2020, S. 13996, doi:10.1038/s41598-020-70682-y
- Joyce H. Poole: Rutting behavior in African elephants: The phenomenon of musth. Behaviour 102 (3/4), 1987, S. 283–316
- Joyce H. Poole und Cynthia J. Moss: Elephant mate searching: group dynamics and vocal and olfactory communications. Zoological Symposium 61, 1989, S. 111–125
- K. D. Young, S. M. Ferreira und R. J. van Aarde: Elephant spatial use in wet and dry savannas of southern Africa. Journal of Zoology 278, 2009, S. 189–205
- Keith E. A. Leggett: Home range and seasonal movement of elephants in the Kunene Region, northwestern Namibia. African Zoology 41 (1), 2006, S. 17–36
- N. M. Dolmia, C. Calenge, D. Maillard und H. Planton: Preliminary observations of elephant (Loxodonta africana, Blumenbach) movements and home range in Zakouma National Park, Chad. African Journal of Ecology 45, 2007, S. 594–598
- Bindi Thomas, John D. Holland und Edward O. Minot: Seasonal home ranges of elephants (Loxodonta africana) and their movements between Sabi Sand Reserve and Kruger National Park. African Journal of Ecology 50, 2011, S. 131–139
- Jake Wall, George Wittemyer, Brian Klinkenberg, Valerie LeMay und Iain Douglas-Hamilton: Characterizing properties and drivers of long distance movements by elephants (Loxodonta africana) in the Gourma, Mali. Biological Conservation 157, 2013, S. 60–68
- M. D. Graham, I. Douglas-Hamilton, W. M. Adams und P. C. Lee: The movement of African elephants in a human-dominated land-use mosaic. Animal Conservation 12, 2009, S. 445–455
- V. A. Langman, T.J.Roberts, J.Black, G. M. O. Maloiy, N. C. Heglund, J. M. Weber, R. Kram und C. R. Taylor: Moving cheaply: Energetics of walking in the African elephant. The Journal of Experimental Biology 198, 1995, S. 629–632
- K. von Gerhardt, A. van Niekerk, M. Kidd, M. Samway und J. Hanks: The role of elephant Loxodonta africana pathways as a spatial variable in crop-raiding location. Oryx 48 (3), 2014, S. 436–444
- M. Philip Kahl und Billie D. Armstrong: Visual and tactile displays in African elephants, Loxodonta africana: a progress report (1991–1997). Elephant 2 (4), 2000, S. 19–21
- Joyce H. Poole und Petter Granli: Gestures, and Behavior of African Elephants. In: C. J. Moss, H. J. Croze und P. C. Lee (Hrsg.): The Amboseli elephants: a kong-term perspective on a long-lived mammal. University of Chicago Press, 2011, S. 109–124
- Phyllis C. Lee und Cynthia J. Moss: African Elephant Play, Competence and Social Complexity. Animal Bihavior and Cognition 1 (2), 2014, S. 144–156
- I. O. Buss, L. E. Rasmussen und G. L. Smuts: Role of stress and individual recognition in the function of the African elephants' temporal gland. Mammalia 40 (3), 1976, S. 437–451
- Lucy A. Bates, Katito N. Sayialel, Norah W. Njiraini, Joyce H. Poole, Cynthia J. Moss und Richard W. Byrne: African elephants have expectations about the locations of out-of-sight family members. Biology Letters 4, 2008, S. 34–36
- L. E. L. Rasmussen, Anthony J. Hall-Martin und David L. Hess: Chemical profiles of male African elephants, Loxodonta africana: Physiological and ecological implications. Journal of Mammalogy 77 (2), 1996, S. 422–439
- L. E. L. Rasmussen und B. A. Schulte: Chemical signals in the reproduction of Asian (Elephas maximus) and African (Loxodonta africana) elephants. Animal Reproduction Science 53, 1998, S. 19–34
- Joseph Soltis: Vocal Communication in African Elephants (Loxodonta africana). Zoo Biology 29, 2010, S. 192–209
- Karen McComb, David Reby, Lucy Baker, Cynthia Moss und Soila Sayialel: Long-distance communication of acoustic cues to social identity in African elephants. Animal Behaviour 65, 2003, S. 317–329
- Katherine A. Leighty, Joseph Soltis, Christine M. Wesolek und Anne Savage: Rumble vocalizations mediate interpartner distance in African elephants, Loxodonta africana. Animal Behaviour 76, 2008, S. 1601–1608
- Michael Garstang, David Larom, Richard Raspet und Malan Lindeque: Atmospheric controls on elephant communication. Journal of Experimental Biology 198, 1995, S. 939–951
- Michael Garstang: Long-distance, low-frequency elephant communication. Journal of Comparative Physiology 190, 2004, S. 791–805
- Christian T. Herbst, Angela S. Stoeger, Roland Frey, Jörg Lohscheller, Ingo R. Titze, Michaela Gumpenberger und W. Tecumseh Fitch: How Low Can You Go? Physical Production Mechanism of Elephant Infrasonic Vocalizations. Science 337 (6094), 2012, S. 595–599, doi:10.1126/science.1219712
- Angela S. Stoeger, Gunnar Heilmann, Matthias Zeppelzauer, André Ganswindt, Sean Hensman und Benjamin D. Charlton: Visualizing sound emission of elephant vocalizations: evidence for two rumble production types. PLoS ONE 7 (11), 2012, S. e48907, doi:10.1371/journal.pone.0048907
- Angela S. Stoeger und Shermin de Silva: African and Asian Elephant Vocal Communication: A Cross-Species Comparison. In: G. Witzany (Hrsg.): Biocommunication of Animals. Springer Science & Media Press, 2014, S. 21–39
- Angela S. Stoeger und Anton Baotic: Information content and acoustic structure of male African elephant social rumbles. Scientific Reports 6, 2016, S. 27585, doi:10.1038/srep27585
- Anton Baotic und Angela S. Stoeger: Sexual dimorphism in African elephant social rumbles. PLoS ONE 12 (5), 2017, S. e0177411, doi:10.1371/journal.pone.0177411
- Amy Morris-Drake und Hannah S. Mumby: Social associations and vocal communication in wild and captive male savannah elephants Loxodonta africana. Mammal Review 48, 2018, S. 24–36
- Angela S. Stoeger-Horwath, Simon Stoeger, Harald. M. Schwammer und Helmut Kratochvil: Call repertoire of infant African elephants: First insights into the early vocal ontogeny. Journal of the Acoustical Society of America 121 (6) 2007, S. 3922–3931
- K. M. Leong, A. Ortolani, K. D. Burks, J. D. Mellen, und A. Savage: Quantifying acoustic and temporal characteristics for a group of captive African elephants Loxodonta africana. Bioacoustics 13, 2003, S. 213–231
- Joseph Soltis, Luce E. King, Iain Douglas-Hamilton, Fritz Vollrath und Anne Savage: African elephant alarm calls distinguish between threats from humans and bees. PLoS ONE 9 (2), 2014, S. e89403, doi:10.1371/journal.pone.0089403
- Michael A. Pardo, Joyce H. Poole, Angela S. Stoeger, Peter H. Wrege, Caitlin E. O’Connell-Rodwell, Udaha Kapugedara Padmalal und Shermin de Silva: Differences in combinatorial calls among the 3 elephant species cannot be explained by phylogeny. Behavioral Ecology 30 (3), 2019, S. 809–820, doi:10.1093/beheco/arz018
- Joyce H. Poole, Peter L. Tyack, Angela S. Stoeger-Horwath und Stephanie Watwood: Elephants are capable of vocal learning. Nature 434, 2005, S. 455–456
- Atiya Y. Hakeem, Patrick R. Hof, Chet C. Sherwood, Robert C. Switzer III, L. E. L. Rasmussen und John M. Allman: Brain of the African Elephant (Loxodonta africana): Neuroanatomy From Magnetic Resonance Images. The Anatomical Record Part A 287A, 2005, S. 1117–1127
- Bonnie M. Perdue, Catherine F. Talbot, Adam M. Stone und Michael J. Beran: Putting the elephant back in the herd: elephant relative quantity judgments match those of other species. Animal Cognition 15, 2012, S. 955–961, doi:10.1007/s10071-012-0521-y
- Lucy A. Bates, Phyllis C. Lee, Norah Njiraini, Joyce H. Poole, Katito Sayialel, Soila Sayialel, Cynthia J. Moss und Richard W. Byrne: Do Elephants Show Empathy? Journal of Consciousness Studies 15 (10–11), 2008, S. 204–25
- Benjamin L. Hart, Lynette A. Hart und Noa Pinter-Wollman: Large brains and cognition: Where do elephants fit in? Neuroscience and Biobehavioral Reviews 32, 2008, S. 86–98
- Lucy A. Bates, Rosie Handford, Phyllis C. Lee, Norah Njiraini, Joyce H. Poole, Katito Sayialel, Soila Sayialel, Cynthia J. Moss und Richard W. Byrne: Why Do African Elephants (Loxodonta africana) Simulate Oestrus? An Analysis of Longitudinal Data. PLoS ONE 5 (4), 2010, S. e10052, doi:10.1371/journal.pone.0010052
- G. A. Bradshaw, Allan N. Schore, Janine L. Brown, Joyce H. Poole und Cynthia J. Moss: Elephant breakdown. Social trauma: early disruption of attachment can affect the physiology, behaviour and culture of animals and humans over generations. Nature 433, 2005, S. 807
- David S. Jachowski, Rob Slotow und Joshua J. Millspaugh: Physiological Stress and Refuge Behavior by African Elephants. PLoS ONE 7 (2), 2012, S. e31818, doi:10.1371/journal.pone.0031818
- Karen McComb, Graeme Shannon, Katito N. Sayialei und Cynthia Moss: ‘Elephants can determine ethnicity, gender, and age from acoustic cues in Human voices. PNAS 111 (14), 2014, S. 5433–5438
- Karen McComb, Lucy Baker und Cynthia Moss: African elephants show high levels of interest in the skulls and ivory of their own species. Biology Letters 2, 2006, S. 26–28
- Iain Douglas-Hamilton, Shivani Bhalla, George Wittemyer und Fritz Vollrath: Behavioural reactions of elephants towards a dying and deceased matriarch. Applied Animal Behaviour Science 100, 2006, S. 87–102
- Shifra Z. Goldenberg und George Wittemyer: Elephant behavior toward the dead: A review and insights from field observations. Primates 61 (1), 2020, S. 119–128, doi:10.1007/s10329-019-00766-5
- Ian Whyte: Loxodonta africana (Blumenbach1797) – African savanna elephant. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 51–59
- W. Keith Lindsay: Habitat use, diet choice, and nutritional status in female and male Amboseli elephants. In: C. J. Moss, H. J. Croze und P. C. Lee (Hrsg.): The Amboseli elephants: a long-term perspective on a long-lived mammal. University of Chicago Press, 2011, S. 51–73
- Jaqui Codron, Julia A. Lee-Thorp, Matt Sponheimer, Daryl Codron, Rina C. Grant und Darryl J. de Rutter: Elephant (Loxodonta africana) diets in Kruger National Park, South Africa: spatial and landscape differences. Journal of Mammalogy 87 (1), 2006, S. 27–34
- Makoshane Q. Seloana, Jorrie J. Jordaan, Martin J. Potgieter und Johan W. Kruger: Feeding patterns of elephants at the Atherstone Collaborative Nature Reserve. African Journal of Ecology 56 (3) 2018, S. 445–454, doi:10.1111/aje.12422
- P. J. Viljoen: The ecology of the desert-dwelling elephants, black rhinoceroses and giraffes of western Kaokoland and Damaraland, South-West Africa. Progress Report to Namibia Wildlife Trust 4, 1982, S. 1–7 ()
- Norman Owen-Smith und Jonas Chafota: Selective feeding by a megaherbivore, the African elephant (Loxodonta africana). Journal of Mammalogy 93 (3), 2012, S. 698–705
- Eva M. Ramey, Rob R. Ramey, Laura M. Brown und Scott T. Kelley : Desert-dwelling African elephants (Loxodonta africana) in Namibia dig wells to purify drinking water. Pachyderm 53, 2013, S. 66–72
- D. C. Houston, J. D. Gilardi und A. J. Hall: Soil consumption by elephants might help to minimize the toxic effect of plant secondary compounds in forest browse. Mammal Review 31 (3/4), 2001, S. 249–254
- Ricardo M. Holdø, Joseph P. Dudley und Lee R. McDowell: Geophagy in the African elephant in relation to dietary sodium. Journal of Mammalogy 83 (3), 2002, S. 652–664
- Fiona Sach, Ellen S. Dierenfeld, Simon C. Langley-Evans, Michael J. Watts und Lisa Yon: African savanna elephants (Loxodonta africana) as an example of a herbivore making movement choices based on nutritional needs. PeerJ 7, 2019, S. e6260, doi:10.7717/peerj.6260
- Richard G. Ruggiero und J. Michael Fay: Utilization of termitarium soils by éléphants and its ecological implications. African Journal of Ecology 32 (3), 1994, S. 222–232
- Cynthia J. Moss: The demography of an African elephant (Loxodonta africana) population in Amboseli, Kenya. Journal of Zoology 255 (2), 2001, S. 145–156
- Joyce H. Poole und Cynthia J. Moss: Musth in the African elephant, Loxodonta africana. Nature 292, 1981, S. 830–831
- Julie A. Hollister-Smith, Susan C. Alberts und L. E. L. Rasmussen: Do male African elephants, Loxodonta africana, signal musth via urine dribbling? Animal Behaviour 76, 2008, S. 1829–1841
- A. J. Hall-Martin und L. A. van der Walt: Plasma testosterone levels in relation to musth in the male African elephant. Koedoe 27, 1984, S. 147–149
- Joyce H. Poole: Announcing intent: the aggressive state of musth in African elephants. Animal Behaviour 37, 1989, S. 140–152
- J. D. Brannian, F. Griffin, H. Papkoff und P. F. Terranova: Short and long phases of progesterone secretion during the oestrous cycle of the African elephant (Loxodonta africana). Journal of Reproduction and Fertility 84, 1988, S. 357–365
- N. Kapustin, J. K. Critser, D. Olson und P. V. Malven: Nonluteal Estrous Cycles of 3-Week Duration Are Initiated by Anovulatory Luteinizing Hormone Peaks in African Elephants. Biology of Reproduction 55, 1996, S. 1147–1154
- Cynthia J. Moss: Oestreous behaviour and female choice in the African elephant. Behaviour 86 (3/4), 1983, S. 167–196
- Julie A. Hollister-Smith, Joyce H. Poole, Elizabeth A. Archie, Eric A. Vance, Nicholas J. Georgiadis, Cynthia J. Moss und Susan C. Alberts: Age, musth and paternity success in wild male African elephants, Loxodonta africana. Animal Behaviour 74, 2007, S. 287–296
- Joyce H. Poole: Mate guarding, reproductive success and female choice in African elephant. Animal Behaviour 37, 1989, S. 842–849
- Joyce H. Poole: Signals and assessment in African elephant: evidence from playback experiments. Animal Behaviour 58, 1999, S. 185–193
- Angela S. Stoeger und Anton Baotic: Male African elephants discriminate and prefer vocalizations of unfamiliar females. Scientific Reports 7, 2017, S. 46414, doi:10.1038/srep46414
- Joyce H. Poole, Katherine Payne, William R. Langbauer Jr. und Cynthia J. Moss: The social contexts of some very low frequency calls of African elephants. Behavioral Ecology and Sociobiology 22, 1988, S. 385–392
- Kathryn R. Bagley, Thomas E. Goodwin, L. E. L. Rasmussen und Bruce A. Schulte: Male African elephants, Loxodonta africana, can distinguish oestrous status via urinary signals. Animal Behaviour 71, 2006, S. 1439–1445
- K. M. Leong, A. Ortolani, L. H. Graham und A. Savage: The use of low-frequency vocalizations in African elephant (Loxodonta africana) reproductive strategies. Hormones and Behavior 43, 2003, S. 433–443
- Phyllis C. Lee: Early social development among African elephant calves. National Geographic Research 2, 1986, S. 388–400
- Phyllis C. Lee und Cynthia J. Moss: Early maternal investment in male and female African elephant calves. Behavioral Ecology and Sociobiology 18 (5), 1986, S. 353–361
- Phyllis C. Lee, Luc F. Bussière, C. Elizabeth Webber, Joyce H. Poole und Cynthia J. Moss: Enduring consequences of early experiences: 40 year effects on survival and success among African elephants (Loxodonta africana). Biology Letters 9, 2013, S. 20130011, doi:10.1098/rsbl.2013.0011
- Phyllis C. Lee: Allomothering among African elephants. Animal Behaviour 35 (1), 1987, S. 278–291
- Phyllis C. Lee, Victoria Fishlock, C. Elizabeth Webber und Cynthia J. Moss: The reproductive advantages of a long life: longevity and senescence in wild female African elephants. Behavioral Ecology and Sociobiology 70, 2016, S. 337–345
- J. Hanks: Reproduction of elephant, Loxodonta africana, in the Luangwa Valley, Zambia. Journal of Reproduction and Fertility 30, 1972, S. 13–26
- George Wittemyer, David Daballen und Iain Douglas-Hamilton: Comparative Demography of an At-Risk African Elephant Population. PLoS ONE 8 (1), 2013, S. e53726, doi:10.1371/journal.pone.0053726
- A. J. Loveridge, J. E. Hunt, F. Murindagomo und D. W. Macdonald: Influence of drought on predation of elephant (Loxodonta africana) calves by lions (Panthera leo) in an African wooded savannah. Journal of Zoology 270 (3), 2006, S. 523–530
- Dereck Joubert: Hunting behaviour of lions (Panthera leo) on elephants (Loxodonta africana) in the Chobe National Park, Botswana. African Journal of Ecology 44 (2), 2006, S. 279–281
- R. John Power und R. X. Shem Compion: Lion Predation on Elephants in the Savuti, Chobe National Park, Botswana. African Zoology 44 (1), 2009, S. 36–44
- Kim Valenta, Melissa H. Schmitt, Manfred Ayasse und Omer Nevo: The sensory ecology of fear: African elephants show aversion to olfactory predator signals. Conservation Science and Practice 3 (2), 2021, S. e306, doi:10.1111/csp2.306
- Rob Slotow und Gus van Dyk: Role of delinquent young 'orphan' male elephants in high mortality of white rhinoceros in Pilanesberg National Park, South Africa. Koedoe 44 (1), 2001, S. 84–94
- Rob Slotow, Dave Balfour und Owen Howison: Killing of black and white rhinoceroses by African elephants in Hluhluwe-Umfolozi Park, South Africa. Pachyderm 31, 2001, S. 14–20
- Rob Slotow, Gus van Dyk, Joyce Poole, Bruce Page und Andre Klocke: Older bull elephants control young males. Nature 408, 2000, S. 425–426
- Lucy E. King, Iain Douglas-Hamilton und Fritz Vollrath: African elephants run from the sound of disturbed bees. Current Biology 17 (19), 2007, S. R832–R833, doi:10.1016/j.cub.2007.07.038
- F. Zumpt und H. Wetzel: Fly parasites (Diptera: Oestridae and Gasterophilidae) of the African elephant Loxodonta africana (Blumenbach) and their problems. Koedoe 13, 1970, S. 109–121
- V. Obanda, T. Iwaki, N. M. Mutinda und F. Gakuya: Gastrointestinal parasites and associated pathological lesions in starving free-ranging African elephants. South African Journal of Wildlife Research 41 (2), 2011, S. 167–172
- Lydia Baines, Eric R. Morgan, Mphoeng Ofthilea und Kate Evans: Occurrence and seasonality of internal parasite infection in elephants, Loxodonta africana, in the Okavango Delta, Botswana. International Journal for Parasitology: Parasites and Wildlife, 4, 2015, S. 43–48
- P. M. Lindeque und P. C. B. Turnbull: Ecology and epidemiology of anthrax in the Etosha National Park, Namibia. Journal of Veterinary Research 61, 1994, S. 71–83
- D. G. Grobler, J. P. Raath, L. E. Braack, D. F. Keet, G. H. Gerdes, B. J. Barnard, N. P. Kriek, J. Jardine und R. Swanepoel: An outbreak of encephalomyocarditis-virus infection in free-ranging African elephants in the Kruger National Park. Journal of Veterinary Research 62 (2), 1995, S. 97–108
- Shahan Azeem, Roy Bengis, Rudi van Aarde und Armanda D. S. Bastos: Mass die-off of African elephants in Botswana: pathogen, poison or a perfect storm? African Journal of Wildlife Research 50, 2020, S. 149–165, doi:10.3957/056.050.0149
- Sello Motseta: 330 elephants in Botswana may have died from toxic algae. PhysOrg, 21. September 2020 ()
- N. D. Kock, S. A. Goedegebuure, E. P. Lane, V. Lucke, D. Tyrrell und M. D. Kock: Flaccid trunk paralysis in free-ranging elephants (Loxodonta africana) in Zimbabwe. Journal of Wildlife Diseases 30 (3), 1994, S. 432–435
- D. H. M. Cumming, M. B. Fenton, I. L. Rautenbach, R. D. Taylor, G. S. Cumming, M. S. Cumming, J. M. Dunlop, G. S. Ford, M. D. Hovorka, D. S. Johnston, M. C. Kalcounis, Z. Mahlanga und C.V. Portfors: Elephants, woodlands and biodiversity in miombo woodland in southern Africa. South African Journal of Science 93, 1997, S. 231–236
- Ian J. Whyte, Rudi J. van Aarde und Stuart L. Pimm: Kruger's Elephant Population: Its Size and Consequences for Ecosystem Ieterogeneity. In: Johan du Toit, Harry Biggs und Kevin Rogers (Hrsg.): The Kruger experience: ecology and management of savanna heterogeneity. Washington D.C., 2003, S. 332–348
- Holly T. Dublin, A. R. E. Sinclair und J. McGlade: Elephants and Fire as Causes of Multiple Stable States in the Serengeti-Mara Woodlands. Journal of Animal Ecology 59 (3), 1990, S. 1147–1164
- Rudolf Schenkel und Ernst M. Lang: Das Verhalten der Nashörner. Handbuch für Zoologie 8 (46), 1969, S. 1–56
- Christina Skarpe, Per Arild Aarrestad, Harry P. Andreassen, Shivcharn S. Dhillion, Thatayaone Dimakatso, Johan T. du Toit, Duncan, J. Halley, Håkan Hytteborn, Shimane Makhabu, Moses Mari, Wilson Marokane, Gaseitsiwe Masunga, Ditshoswane Modise, Stein R. Moe, Rapelang Mojaphoko, David Mosugelo, Sekgowa Motsumi, Gosiame Neo-Mahupeleng, Mpho Ramotadima, Lucas Rutina, Lettie Sechele, Thato B. Sejoe, Sigbjørn Stokke, Jon E. Swenson, Cyril Taolo, Mark Vandewalle und Per Wegge: The Return of the Giants: Ecological Effects of an Increasing Elephant Population. Ambio 33 (6), 2004, S. 276–282
- Robert M. Pringle: Elephants as agents of habitat creation for small vertebrates at the patch scale. Ecology 89 (1), 2008, S. 26–33
- Lauren J. Chapman, Colin A. Chapman und Richard W. Wrangham: Balanites wilsoniana – elephant dependent dispersal? Journal of Tropical Ecology 8, 1992, S. 275–283
- Joseph P. Dudley: Seed Dispersal by Elephants in Semiarid Woodland Habitats of Hwange National Park, Zimbabwe. Biotropica 32 (3), 2000, S. 556–561
- Katherine Bunney, William J. Bond und Michelle Henley: Seed dispersal kernel of the largest surviving megaherbivore – the African savanna elephant. Biotropica 49 (3), 2017, S. 395–401
- Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro und Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. eLife 6, 2017, S. e25413, doi:10.7554/eLife.25413
- Jeheskel Shoshani und Pascal Tassy: Family Elephantidae Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 176–178
- Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus und Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. PLoS Biology 5 (8), 2007, S. e207, doi:10.1371/journal.pbio.0050207
- Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca und Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biology 8 (12), 2010, S. e1000564, doi:10.1371/journal.pbio.1000564
- Véronique Barriela, Estelle Thuet und Pascal Tassy: Molecular phylogeny of Elephantidae. Extreme divergence of the extant forest African elephant. Comptes Rendus de l’Académie des Sciences 322, 1999, S. 447–454
- Alfred L. Roca, Nicholas Georgiadis, Jill Pecon-Slattery, und Stephen J. O'Brien: Genetic evidence for two species of elephant in Africa. Science 293 (5534), 2001, S. 1473–1477
- Kenine E. Comstock, Nicholas Georgiadis, Jill Pecon-Slattery, Alfred L. Roca, Elaine A. Ostrander, Stephen J. O’Brien und Samuel K. Wasser: Patterns of molecular genetic variation among African elephant populations. Molecular Ecology 11 (12), 2002, S. 2489–2498
- Régis Debruyne: A case study of apparent conflict between molecular phylogenies: the interrelationships of African elephants. Cladistics 21, 2005, S. 31–50
- Yumie Murata, Takahiro Yonezawa, Ichiro Kihara, Toshihide Kashiwamura, Yuji Sugihara, Masato Nikaidoa, Norihiro Okada, Hideki Endo und Masami Hasegawa: Chronology of the extant African elephant species and case study of the species identification of the small African elephant with the molecular phylogenetic method. Gene 441, 2009, S. 176–186
- Délagnon Assou, Neil D'Cruze, Hannah Kirkland, Mark Auliya, David W. Macdonald und Gabriel H. Segniagbeto: Camera trap survey of mammals in the Fazao‐Malfakassa National Park, Togo, West Africa. African Journal of Ecology, 2021, doi:10.1111/aje.12856
- Lori S. Eggert, Caylor A. Rasner und David S. Woodruff: The evolution and phylogeography of the African elephant inferred from mitochondrial DNA sequence and nuclear microsatellite markers. Proceedings of the Royal Society of London B 269, 2002, S. 1993–2006
- Zelalem Assefa, Solomon Yirga und Kaye E. Reed: The large-mammal fauna from the Kibish Formation. Journal of Human Evolution 55, 2008, S. 501–512
- Richard G. Klein, Graham Avery, Kathryn Cruz-Uribe und Teresa E. Steele: The mammalian fauna associated with an archaic hominin skullcap and later Acheulean artifacts at Elandsfontein, Western Cape Province, South Africa. Journal of Human Evolution 52, 2007, S. 164–186
- Jan van der Made: The evolution of the elephants and their relatives in the context of a changing climate and geography. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale, 2010, S. 340–360
- William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Saegusa und Cyrille Delmer: Proboscidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 161–251
- Georges Louis Leclerc Buffon, Bernard Germain Lacépède und Louis Jean-Marie Daubenton: Histoire naturelle, générale et particulière, avec la description du Cabinet du roy. Tome 11. Paris, 1763, S. 1–173 ()
- Georges Cuvier: Sur les éléphans vivans et fossiles. Annales du Muséum d’histoire naturell 8, 1806, S. 1–58 ()
- Glover M. Allen: A checklist of African mammals. Bulletin of the Museum of Comparative Zoology at Harvard College 83, 1939, S. 1–763 (S. 523–524) ()
- Alain Dubois, André Nemésio und Roger Bour: Primary, secondary and tertiary syntypes and virtual lectotype designation in zoological nomenclature, with comments on the recent designation of a lectotype for Elephas maximus Linnaeus, 1758. Bionomina 7, 2014, S. 45–64
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 33 ()
- Johann Friedrich Blumenbach: Handbuch der Naturgeschichte. Göttingen, 1797, S. 1–714 (S. 125) ()
- Fréderic Cuvier: Eléphant d’Afrique. In: Étienne Geoffroy Saint-Hilaire und Fréderic Cuvier (Hrsg.): Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans. Tome sixième. Paris, 1825 ()
- Anonym: Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans; &c. par MM. Geoffroy Saint-Hilare et F. Cuvier. Livraisons 52de et 53eme. The Zoological Journal 3, 1827, S. 140–142 ()
- Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 361 (Appendix C)
- Hermann Pohle: Notizen über afrikanische Elefanten. Zeitschrift für Säugetierkunde 1, 1926, S. 58–64 ()
- Georges Cuvier: Tableau élémentaire de l’histoire naturelle des animaux. Paris, 1798, S. 1–710 (S. 149) ()
- Paul Matschie: Geographische Abarten des afrikanischen Elefanten. Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin 1900, S. 189–197 (S. 194), ()
- Richard Lydekker: The ears as a race-character in the African elephant. Proceedings of the zoological Society 1907, S. 380–403 ()
- Andrew Paterson und John Parkington: Observing and Painting Elephants: San Rock Art of the Cederberg Region South Africa. A Symbiotic, Symbolic and Spiritual Relationship. Hommage à Norbert Aujoulat. Les Eyzies: Musée Nationale de Préhistoire, 2016
- David Coulson und Alec Campbell: Afrikanische Felsenbilder. Malereien und Gravuren auf Stein. Weingarten, 2001, S. 1–256 (S. 180–181)
- Marina Gallinaro: Saharan Rock Art: Local Dynamics and Wider Perspectives. Arts 2, 2013, S. 350–382
- Maria Guagnin: Animal engravings in the central Sahara: A proxy of a proxy. Environmental Archaeology 20, 2015, S. 52–65
- Renate Heckendorf: „Bubalin“ und „Bovidien“ in Südmarokko. Forschungen zur Archäologie Außereuropäischer Kulturen 6, Wiesbaden, 2008, S. 1–331 (S. 229–230)
- Alain Rodrigue: L’art rupestre au maroc: Les sites principeau. L’harmattan, 2008, S. 1–191
- David Coulson und Alec Campbell: The dawn of imagination: rock art in Africa. TARA, 2010
- Lionel Casson: Ptolemy II and the hunting of African elephants. Transactions of the American Philological Association 123, 1993, S. 247–260
- Michael B. Charles: Elephant Size in Antiquity. DNA Evidence and the Battle of Raphia. Historia 65 (1), 2016, S. 54–65
- Adam L. Brandt, Yohannes Hagos, Yohannes Yacob, Victor A. David, NichoLas J. Georgiadis, Jeheskel Shoshani und Alfred L. Roca: The Elephants of Gash-Barka, Eritrea: Nuclear and Mitochondrial Genetic Patterns. Journal of Heredity 105, 2013, S. 82–90
- Michael B. Charles: African Forest elephants and turrets in the Ancient World. Phoenix 3/4, 2008, S. 338–362
- Pierre Schneider: Again on the elephants of Raphia: Re-examination of Polybius' factual accuracy and historical method in the light of a DNA survey. Histos 10, 2016, S. 132–148
- K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels und R. D. Taylor: Loxodonta africana. The IUCN Red List of Threatened Species 2021. e.T181008073A181022663 (); zuletzt abgerufen am 26. März 2021
- CITES: African elephant; zuletzt abgerufen am 7. September 2018
- Ciska P. J. Scheijen, Shane A. Richards, Josephine Smit, Trevor Jones und Katarzyna Nowak: Efficacy of beehive fences as barriers to African elephants: a case study in Tanzania. Oryx 53 (1), 2019, S. 92–99
- Rocío A. Pozo, Tim Coulson, Graham McCulloch, Amanda Stronza und Anna Songhurst: Select Chilli-briquettes modify the temporal behaviour of elephants, but not their numbers. Oryx 53 (1), 2019, S. 100–108
- Joseph E. Mbaiwa: Effects of the safari hunting tourism ban on rural livelihoods and wildlife conservation in Northern Botswana. South African Geographical Journal 100 (1), 2018, S. 41–61
- S. Wasser, B. Clark und C. Laurie: The Ivory Trail. Scientific American 301 (1), 2009, S. 68–74
Weblinks
- Loxodonta africana in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels & R. D. Taylor, 2021. Abgerufen am 26. März 2021.
- IUCN/SSC African Elephant Specialist Group Umfangreiche Material- und Linksammlung.
- Tobias Dornbusch: Jungbullengruppe in Kenia. Elefanten in Zoo und Circus 26, 2015; zuletzt aufgerufen am 12. Januar 2019