Schuppentiere
Die Schuppentiere oder Tannenzapfentiere (Manidae) sind eine Säugetierfamilie, die zudem eine eigene Ordnung, die Pholidota, bildet. Die Familie besteht aus drei rezenten Gattungen mit acht Arten, von denen vier in Ost-, Süd- und Südostasien und vier in Afrika südlich der Sahara leben. Es handelt sich um insektenfressende Tiere mit Spezialisierung auf Ameisen und Termiten, die durch Grabkrallen, eine röhrenförmige Schnauze mit zahnlosem Kiefer sowie eine lange Zunge an diese Ernährungsweise angepasst sind. Einzigartig unter den Säugetieren ist ihre Körperbedeckung mit großen, überlappenden Hornschuppen. Schuppentiere leben je nach Art am Boden oder auf Bäumen, meist sind sie nachtaktiv. Die genaue Lebensweise ist aber nur unzureichend erforscht. Sie bevorzugen sowohl Wälder als auch teils offene Landschaften in Tieflagen und mittleren Gebirgshöhen. Im Bedrohungsfall können sie sich zu einer Kugel einrollen. Auf diese Eigenschaft bezieht sich auch das ursprünglich malaiische Wort Peng-guling, dessen Abwandlung pangolin überwiegend im englischen und französischen Sprachraum als umgangssprachliche Bezeichnung für ein Schuppentier Verwendung findet.
| Schuppentiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Malaiisches Schuppentier (Manis javanica) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Ordnung | ||||||||||||
| Pholidota | ||||||||||||
| Weber, 1904 | ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Manidae | ||||||||||||
| J. E. Gray, 1821 |
Die heutige Familienbezeichnung Manidae wurde 1821 eingeführt. In der frühen Forschungsgeschichte des 19. und frühen 20. Jahrhunderts galten die Schuppentiere als nahe Verwandte der Ameisenbären und Gürteltiere. Mit ersteren teilen sie das zahnlose Maul und die lange Zunge. Dabei führte vor allem das Fehlen der Zähne zum Aufstellen eines Taxons namens Edentata, in dem alle drei Tiergruppen lange Zeit geführt wurden. Erst moderne molekulargenetische Untersuchungen erbrachten ab Mitte der 1980er Jahre, dass die Schuppentiere mit den Raubtieren näher verwandt sind. Die Ähnlichkeiten mit Ameisenbären und Gürteltieren beruhen demnach auf Konvergenz. Der Verlust der Zähne, aber auch die spezialisierte Lebensweise bewirkt weiterhin, dass Schuppentiere nur selten fossil nachgewiesen werden. Die frühesten Vertreter der Manidae sind aus dem Pliozän vor rund 5 Millionen Jahren bekannt, ihnen nahestehende Formen traten aber schon im Mittleren Eozän vor etwa 47 Millionen Jahren auf.
Alle acht heutigen Arten der Schuppentiere gelten in ihrem Bestand als mehr oder weniger bedroht und sind international geschützt. Hauptsächliche Ursachen für die Bedrohung sind der Verkauf des Fleisches als exotische Nahrungsspezialität einerseits und die Verwendung der Schuppen sowie anderer Körperteile in lokalen rituellen Bräuchen wie auch der Traditionellen Chinesischen Medizin andererseits. Dies führt dazu, dass die Schuppentiere nicht nur intensiv bejagt werden, sondern auch zu den am häufigsten illegal gehandelten Säugetieren weltweit gehören.
Merkmale
Äußerer Körperbau


Schuppentiere haben einen langgestreckten Körper mit kurzen Gliedmaßen, kleinem, zugespitztem Kopf und langem Schwanz. Die Kopf-Rumpf-Länge variiert je nach Art, bei kleineren Vertretern wie dem Weißbauch- (Phataginus tricuspis) und dem Langschwanzschuppentier (Phataginus tetradactyla) liegt sie zwischen 25 und 43 cm; die größte Art ist das Riesenschuppentier (Smutsia gigantea) mit 67 bis 81 cm. Der Schwanz wird noch einmal zwischen 25 und 70 cm lang. Bei den baumbewohnenden Schuppentieren übertrifft der Schwanz die restliche Körperlänge, bei den anderen ist er gleich lang oder kürzer. Das Gewicht variiert zwischen 1,6 und 33 kg, wobei die Männchen meist größer sind als die Weibchen. Fossil trat mit Manis palaeojavanica im Pleistozän Südostasiens eine Art auf, die rund 2,5 m Gesamtlänge erreichte und damit die bisher größte bekannte Schuppentierart repräsentiert.[1][2][3]
Der Kopf der Schuppentiere ist klein und konisch geformt. Die Augen sind ebenfalls klein und von wulstigen, drüsenfreien Lidern geschützt. Ohrmuscheln fehlen bei den afrikanischen Arten, bei den asiatischen ist oft nur ein verdickter Kamm vorhanden. Die Nase ist über eine Hautfalte (Plica alaris) verschließbar, was von Vorteil ist, wenn die Tiere ihre Schnauzen zur Nahrungsaufnahme in Insektenbauten stecken.[2][3]
Namensgebendes Merkmal stellt die unter Säugetieren einmalige Körperbedeckung aus großen Hornschuppen dar, die die Oberseite des Kopfes, den Rumpf, die Außenseiten der Gliedmaßen (bei manchen Arten ohne die Unterarme) und die Ober- und Unterseite des Schwanzes bedecken. Nur das Gesicht, der Bauch und die Innenseite der Gliedmaßen sind unbeschuppt und weisen eine graue, derbe Haut auf, die mit weißen, braunen oder schwarzen Haaren bedeckt ist. Bei afrikanischen Schuppentieren sind die Schuppen auf der Rückseite der Schwanzspitze irregulär oder paarig angeordnet, bei den asiatischen immer regulär in nur einer Reihe. Auf der Unterseite der Schwanzspitze hingegen besitzen baumlebende Schuppentiere eine freie, von horniger Haut bedeckte Fläche; bei bodenlebenden ist die Panzerung geschlossen. Zwischen den Schuppen der Rückenpanzerung wachsen nur bei asiatischen Arten einzelne Haare.[2][3]
Die Gliedmaßen erscheinen kurz und kräftig und enden in jeweils fünf Zehen (pentadactyl). Die Vorderbeine zeigen Anpassungen an eine grabende Lebensweise, indem die mittleren drei Finger mit langen, gebogenen Krallen versehen sind, von denen die mittlere noch einmal deutlich größer ist. Die Krallen des ersten und des fünften Fingers sind dagegen verkleinert und werden beim Graben nicht eingesetzt. Die Hinterbeine sind kräftiger und etwas länger, die fünf Zehen weisen ebenfalls Krallen auf. Allgemein sind die Vorderfußkrallen der bodenlebenden Schuppentiere länger und weniger stark gekrümmt als die der baumlebenden; letztere wiederum haben deutlich längere Hinterfußkrallen, die die Fortbewegung in den Bäumen unterstützen.[4][2][5]
Schädelmerkmale

Der Schädel erreicht Längen zwischen 6 und 16 cm. Er ist generell konisch geformt mit einem röhrenförmig gestalteten, nach vorn sich etwas verengenden und leicht verlängerten Rostrum. Da die Nahrung nicht gekaut wird, ist die Kaumuskulatur zurückgebildet, wodurch nur wenige Knochenerhebungen als Muskelansatzstellen ausgebildet sind. Dadurch wirkt der Schädel sehr glatt, er gehört damit zu den am einfachsten gebauten Schädeln innerhalb der Säugetiere.[6]
Ein auffälliges Kennzeichen ist der nicht vollständig ausgebildete Jochbogen, ein Merkmal, das die Schuppentiere mit den ebenfalls auf Ameisen und Termiten spezialisierten Ameisenbären Südamerikas teilen und häufig als Anpassung an diese Ernährungsweise gilt. Allerdings treten bei einigen Schuppentieren, etwa dem Chinesischen Schuppentier, manchmal geschlossene Jochbögen auf.[7] Weitere allgemeine Charakteristika finden sich in den lang ausgezogenen Nasenbeinen und den gegenüber den Scheitelbeinen großen Stirnbeinen.[8][9]
Zähne fehlen komplett, der Unterkiefer ist nur als eine einfache Knochenspange ausgebildet mit schwach entwickelten, nach hinten weisenden und kugelig geformten Gelenkenden, die nur wenig Raum für die Bewegung des Unterkiefers zulassen. Die Symphyse des Unterkiefers formt eine flache Oberfläche, über die die Zunge gleiten kann.[10][2] Allerdings tritt als Kennzeichen aller Schuppentiere am hinteren Ende der Symphyse ein Paar knöcherner, konisch spitzer Erhebungen auf, die Ähnlichkeiten zu einem Eckzahn aufweisen.[8][9]
Schuppenpanzer

Der Schuppenpanzer macht zusammen mit der restlichen Haut etwa ein Viertel bis ein Drittel des gesamten Körpergewichts aus. Er besteht aus 160 bis 290 Einzelschuppen, von denen knapp die Hälfte auf den Schwanz entfallen. Sie sind beweglich und überlappen einander dachziegelartig. Dabei sind sie in Reihen angeordnet, deren Anzahl am Rumpf zwischen 13 und 25 variiert. Die Färbung der Schuppen reicht von dunkelbraun über olivgrün bis gelblich. Sie sind von dreieckiger bis V-förmiger Gestalt; große Schuppen weisen Längen und Breiten von 7 bis 8 cm auf. Auf der Oberfläche finden sich längs gerichtete Rippeln, zudem sind sie mit scharfen Rändern ausgestattet. Die größten Schuppen befinden sich in der Regel auf dem Rücken mit nach hinten zeigender Spitze. Im zusammengerollten Zustand stehen die scharfen Enden ab ähnlich wie bei einem halb geöffneten Tannenzapfen. Der Schuppenpanzer schützt weniger vor Ameisen- oder Termitenbissen oder Hautparasiten als vielmehr vor Verletzungen, die durch größere Raubtiere oder beim unterirdischen Graben entstehen.[2][11]
Die Schuppen sind verhornte Bildungen der Epidermis, die auf nach hinten umgebogenen Ausstülpungen der Dermis sitzen. Im Querschnitt lassen sich drei Lagen unterscheiden: Die obere Dorsalplatte (Rückenplatte) nimmt etwa ein Sechstel der Dicke ein und besteht aus abgeplatteten, stark verhornten Zellen. Die Zwischenplatte, die den größten Raum beansprucht, wird aus weniger stark abgeplatteten, verhornten Zellen geformt. Die Ventralplatte (Bauchplatte) bildet die Unterseite der Schuppe und ist nur wenige Zellen stark. Alle drei Platten bilden sich aus unterschiedlichen epidermalen Keimgebieten. Die Abwesenheit von Filamenten zeigt auf, dass die Schuppen nicht, wie früher angenommen, verklebten Haaren entsprechen. Sie lassen sich von ihrer Struktur her vielmehr mit den Fingernägeln der Primaten vergleichen und wachsen wie diese beständig, was die Abnutzung ausgleicht. Dadurch unterscheiden sie sich auch von der Schuppenhaut der Schuppenkriechtiere, die mitunter jährlich gewechselt werden muss.[12]
Es wird vermutet, dass der Schuppenpanzer schon früh in der Entwicklung der Schuppentiere ausgebildet war – älteste Hinweise stammen mit Eomanis aus dem Mittleren Eozän vor rund 47 Millionen Jahren, gefunden in der Grube Messel in Hessen.[13] Möglicherweise bildete sich zuerst eine Beschuppung des Schwanzes, was als homologe Entwicklung zu einigen Vertretern der Nagetiere wie der Hausmaus beziehungsweise der Nutria oder auch der Spitzhörnchen anzusehen wäre, erst später erfolgte eine vollständige Panzerung des Körpers.[14]
Skelettmerkmale

Die Anzahl der Wirbel variiert von Art zu Art und reicht von 48 beim Steppenschuppentier (Smutsia temminckii) bis zu über 70 beim Langschwanzschuppentier.[15] Insgesamt besteht die Wirbelsäule je nach Art aus 7 Hals-, 12 bis 15 Brust-, 5 bis 6 Lenden-, 2 bis 4 Kreuz- und 21 bis 50 Schwanzwirbeln.[16][2] Die Tiere können sich gut einrollen, da das Becken sehr kurz und das Darmbein nach außen gebogen ist und die Lendenwirbel verlängert sind. Die Schwanzwirbel weisen an der Unterseite Chevronknochen auf, die als Ansatzfläche für die kräftige Schwanzmuskulatur dienen, da der Schwanz beim Einrollen schildartig um den Körper geschlungen wird.[17] Der Schwertfortsatz am hinteren Ende des Brustbeins ist bis in die Beckenregion vergrößert und dient als Ansatzstelle für die komplizierte Zungenmuskulatur.[18]
Vor allem der Oberarmknochen ist für die grabende und baumkletternde Lebensweise besonders kräftig ausgebildet. Er besitzt ein sehr breites Ellenbogengelenk und – typisch für Schuppentiere – eine kräftige Crista deltoidea, die als Knochenkamm den Schaft umgreift und als Ansatzstelle für die Schultermuskulatur fungiert.[19] Am Oberschenkelknochen ist der dritte Rollhügel (Trochanter tertius), eine weitere Muskelansatzstelle am Schaft, weit nach unten an die Gelenkenden versetzt und so kaum sichtbar. Bei sehr urtümlichen Pholidota befindet sich dieser deutlich höher und markant herausragend am Schaft.[20][21] Ein weiteres besonderes Kennzeichen sind die jeweiligen letzten Glieder der Zehen der Vorder- und Hinterfüße (jeweils Phalanx III), die eine langgestreckte Form aufweisen und am Ende tiefe Einkerbungen besitzen, in denen die Krallen einhaften.[9]
Innere Organe
Sehr charakteristisch ist die wurmförmige und mit klebrigem Speichel bedeckte Zunge, mit der die Nahrung aufgenommen wird. Sie kann beim Riesenschuppentier bis zu 70 cm lang sein und bis zu 25 cm ausgestreckt werden, beim Chinesischen Schuppentier wird sie bis zu 41 cm lang bei einem Durchmesser von bis zu 1,1 cm.[22] Ihre komplexe Muskulatur besteht aus längs und radial verlaufenden Muskelfasern. Im Ruhezustand liegt der vordere Teil der Zunge zusammengerollt im Mundraum, die Oberfläche ist im vorderen Bereich durch konische Papillen aufgeraut, an der Spitze befinden sich pilzförmige Geschmackspapillen. Die Zunge ist nicht wie bei anderen Säugetieren mit dem Zungenbein, sondern über ein äußeres Muskelsystem, das teilweise der Zungenbeinmuskulatur homolog entspricht, mit dem hinteren Teil des Brustbeins verbunden. Das Zungenbein besitzt bei den Schuppentieren eine andere Funktion: Mit ihm werden die an der Zunge klebenden Insekten am Eingang der Speiseröhre abgeschabt. Die Speicheldrüsen sind vergrößert und erstrecken sich bis in die Brust- und Achselregion.[18][23][24]
Der muskulöse Magen übernimmt das mechanische Zerkleinern der Insekten. Er ist mit verhorntem und geschichtetem Plattenepithel ausgestattet, was ihn vor den Bissen und dem Gift der Ameisen und Termiten schützt. Die stark vergrößerte Pförtnermuskulatur zermahlt die verschluckte Nahrung und ist dafür zur besseren Zerkleinerung mit verknöcherten Stacheln (Pylorusdornen) versehen – zusätzlich werden kleine Steinchen verschluckt. Die Magendrüsen sind sehr lang und schlauchförmig; sie bilden Drüsenpakete, die sich durch einen zentralen Gang zum Pförtner hin entleeren.[25][26] Der gesamte Darmtrakt erreicht beim Chinesischen Schuppentier eine Länge von 5,2 m und einen Durchmesser von rund 1 cm. Er ist schlauchförmig gewunden und zeigt keine Unterschiede zwischen Dünndarm und Dickdarm, nur bei einigen Individuen befindet sich eine leichte Verdickung oder gewundene Bildung im hinteren Bereich, die möglicherweise den Übergang vom Dünn- zum Dickdarm anzeigt. Ein Blinddarm ist nicht ausgebildet.[22] Schuppentiere haben Analdrüsen, deren Duftsekret zur Kommunikation und möglicherweise zur Verteidigung eingesetzt wird. Die Weibchen haben eine zweihörnige Gebärmutter (Uterus bicornis). Männchen haben einen kleinen Penis, aber keinen Hodensack – die Hoden liegen unter der Haut.[2][27]
Das Gehirn ist sehr einfach gebaut und klein, es macht etwa beim Malaiischen Schuppentier nur rund 0,2 bis 0,5 % des Körpergewichtes aus.[28] Einzig der Riechkolben ist gut entwickelt, dementsprechend spielt der Geruchssinn bei der Nahrungssuche und bei der Kommunikation mit Artgenossen eine wichtige Rolle. Dem Aufbau des Gehirns zufolge – hier hauptsächlich auf das Kleinhirn bezogen – sind asiatische Arten etwas urtümlicher als afrikanische.[29]
Verbreitung und Lebensraum
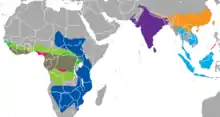
Arten in Asien
Arten in Afrika
Schuppentiere leben in Afrika südlich der Sahara sowie in Süd-, Südostasien und im südlichen Ostasien. In Afrika erstreckt sich ihr Verbreitungsgebiet von Senegal und dem Sudan bis Südafrika. In Asien sind sie von Pakistan und Nepal über Indien und die Indochinesische Halbinsel bis hin zum südlichen Festlandchina und von der Malaiischen Halbinsel bis nach Borneo und auf die Philippinen verbreitet. Die Schuppentiere bewohnen somit primär tropisch geprägte Regionen.[2]
Ihr Lebensraum umfasst eine Vielzahl von Landschaftstypen, wie Au- und Sumpfwälder, aber auch Regenwälder, offene Savannen und Buschländer sowie mosaikartig gestaltete Vegetationsgebiete. Weiterhin tolerieren sie auch vom Menschen genutzte Sekundärlandschaften wie Plantagen, Gartenlandschaften und Farmgebiete, die genug Schutz in Form von Bäumen oder Felsen und Baue enthalten müssen. Die Tiere meiden aber menschliche Siedlungsgebiete und Ackerland und reagieren sensibel auf Pestizide. Dabei nutzen die Schuppentiere Flach- und Hochländer, in den Nilgiri-Bergen in Indien ist das Vorderindische Schuppentier (Manis crassicaudata) bis in Höhenlagen um 2300 m nachgewiesen. Grundvoraussetzung für die Anwesenheit der Schuppentiere sind neben einer dichten Untergrundvegetation ausreichende Nahrungsgrundlagen an Ameisen und Termiten sowie Wasser.[2]
Aufgrund der vielfältig genutzten Landschaften und teilweise Spezialisierung auf unterschiedliche Nahrungsgruppen kommt es bei sympatrisch auftretenden Arten nur selten zum Überlappen der einzelnen genutzten ökologischen Nischen. In einzelnen Fällen findet aber auch eine verstärkte Nischenbildung statt. So nutzt das Langschwanzschuppentier verstärkt Gewässergebiete in Regionen mit dem gleichzeitig auftretenden Weißbauchschuppentier. Das Chinesische Schuppentier (Manis pentadactyla) lebt weiterhin im nördlichen Vietnam, wo auch das Malaiische Schuppentier (Manis javanica) verbreitet ist, prinzipiell in Höhen über 600 m. Auch mit anderen hochspezialisierten Insektenfressern, etwa dem afrikanischen Erdferkel (Orycteropus), kommt es aufgrund der starken Nischenbildung kaum zu Überschneidungen in den gleichen genutzten Landschaften.[2]
Lebensweise
Fortbewegung und Sozialverhalten


Generell ist die Lebensweise und das Sozialverhalten der Schuppentiere nur wenig erforscht. Sie leben meist einzelgängerisch, lediglich in der Paarungszeit kommt es kurzzeitig zu Paarbindungen. Die Hauptaktivität findet während der Dämmerung oder Nacht statt, vereinzelt können Tiere auch tagsüber beobachtet werden. Die einzelnen Individuen sind weitgehend ortsgebunden und nutzen Aktionsräume, die bei Männchen mit 30 bis 43 ha deutlich größer sind als bei Weibchen mit 3 bis 7 ha. Dabei überschneidet das Gebiet eines männlichen Tieres mehrere von weiblichen, bei einigen Arten kann auf eine gewisse Territorialität geschlossen werden, da die Männchen ihr Revier aktiv gegen Konkurrenten verteidigen. Für die Kommunikation unter Artgenossen spielt vermutlich das Sekret der Analdrüsen eine wichtige Rolle, ebenso wie bei der Kennzeichnung der Territorien.[2] Die bodenbewohnenden Arten ziehen sich zur Ruhe in Erdbaue zurück, die sie entweder selbst gegraben oder von anderen Tieren übernommen haben. Diese Baue befinden sich häufig in Ameisen- oder Termitenhügeln, zwischen Wurzeln oder in Vertiefungen, die durch umgefallene Bäume entstanden sind. Generell liegen sie in dichter Vegetation. Meist erstrecken sich die Baue mehrere Meter weit unter der Erde und enden in einer runden Kammer mit bis zu 2 Metern Durchmesser. Der Eingang des Baues wird mit Schlamm versperrt, wenn das Tier anwesend ist. Meist beziehen Schuppentiere einen Bau für mehrere Tage hintereinander und suchen oder graben einen neuen, wenn das Nahrungsangebot zurückgegangen ist. Die baumbewohnenden Arten nutzen dagegen Baumhöhlen. Weibliche Tiere entfernen sich in der Regel weniger weit von ihren Bauen als männliche, allgemein ist bei beiden Geschlechtern der Aktionsradius eher gering.[6][2]
Am Boden bewegen sich die Schuppentiere überwiegend langsam und behäbig fort, die Hand kann mit der Außenkante oder den Fingerknöcheln aufgesetzt werden. Charakteristisch ist das Hin- und Herschwingen des Kopfes im vierfüßigen Gang, wobei sich der Kopf zur dem Führungsbein gegenüberliegenden Seite bewegt. Dieses Schwingen entsteht dadurch, dass aufgrund der dichten Bedeckung der Vorderbeine durch den Schuppenpanzer die Schultermuskulatur anders angeordnet ist als bei ungepanzerten Säugetieren. Einzelne Muskeln überdecken das Schulterblatt vollständig und schränken so dessen Bewegungen ein, der schwingende Kopf führt dadurch einen Ausgleich herbei.[30] Bodenlebende Schuppentiere, speziell aber das Steppenschuppentier, können sich auch auf den Hinterbeinen fortbewegen und balancieren den Körper mit dem Schwanz aus, der dann den Boden nicht berührt. Generell sind Schuppentiere befähigt, auf Bäume zu klettern. Die eigentlich baumbewohnenden Arten bewegen sich dabei raupenartig zuerst mit den Vorder-, dann mit den Hinterbeinen fort, wobei der Rücken beständig gebeugt und gestreckt wird. Der Schwanz dient als Greiforgan und ist häufig um den Stamm oder einen Ast gewickelt, die Schuppen sind abgespreizt und verankern das Tier so an der Rinde. Teilweise wird er auch als Angel eingesetzt, wenn ein Schuppentier den Baum oder Ast wechselt. Weiterhin gelten Schuppentiere als gute Schwimmer, allen voran das Langschwanzschuppentier. Dazu nehmen sie extra Luft auf, so dass der Körper mit dem schweren Schuppenpanzer zur Hälfte aus dem Wasser ragt und führen seitwärts schlängelnde Bewegungen mit dem Schwanz aus.[6][2]
Ernährung
Die Nahrung der Schuppentiere besteht in erster Linie aus Ameisen und Termiten (Myrmecophagie), wobei sie äußerst selektiv vorgehen. Nur größere Arten wie das Riesenschuppentier oder das Vorderindische Schuppentier nehmen gelegentlich auch andere Insekten oder sonstige Wirbellose zu sich, etwa Käfer, Schaben oder Würmer. Dabei vertilgen die Tiere einen vergleichsweise großen Anteil an Biomasse, der bei 300 bis 400 g pro Tag für die kleinsten Vertreter und bei 2 kg für die größten liegt. Die Nahrung wird mit dem außergewöhnlich guten Geruchssinn aufgespürt, wobei der Boden ständig mit der Nase abgesucht wird, teilweise graben Tiere auch Tunnel, um Nester zu erreichen. Mit den Grabkrallen brechen die Schuppentiere Insektenbauten oder Baumrinde auf, und mit der klebrigen Zunge nehmen sie ihre Nahrung zu sich. Die Augen, Ohren und Nasenlöcher sind verschließbar und verhindern das Eindringen von Insekten während des Fressens. Insekten, die auf den Körper gelangen, werden abgeschüttelt. Beim Fressen erheben sie sich meist auf die Hinterbeine. In der Regel dauert der Fressvorgang mehrere Stunden, der Bau wird dabei nicht vollständig zerstört. Meist kehrt ein Tier mehrmals hintereinander über mehrere Tage hinweg zum selben Ameisen- oder Termitennest zurück, erst wenn die Beute deutlich rarer wird, sucht es sich einen anderen.[6][2]
Fortpflanzung

Über das Paarungsverhalten der Schuppentiere ist wenig bekannt. Es ist höchstwahrscheinlich nicht jahreszeitlich gebunden, möglicherweise mit Ausnahme des Chinesischen Schuppentiers. Bei dieser Art kämpfen mehrere Männchen im Spätsommer oder Herbst sehr aggressiv um das Paarungsvorrecht.[10] In der Regel durchstreifen männliche Tiere jede Nacht mehrere weibliche Territorien auf der Suche nach brunftigen Weibchen, was sie anhand der Duftspuren erkennen. Vor allem beim Weißbauch- und beim Langschwanzschuppentier wurden Paarungsrituale beobachtet. So unternehmen Männchen und Weibchen Scheinwettkämpfe mit Schlägen Brust gegen Brust, bis sich das weibliche Tier unterwirft. Meist klammert sich das Weibchen dann an den Schwanz des Männchens, der es zum Paarungsplatz zieht. Während der Paarung sind die Schwänze der Tiere miteinander verflochten. Paare teilen sich dann über mehrere Tage einen Rastplatz. Die Tragzeit liegt bei afrikanischen Schuppentieren bei 130–150 Tagen, bei asiatischen ist sie möglicherweise kürzer und dürfte zwei bis drei Monate dauern. In der Regel bringt das Weibchen ein einziges Neugeborenes zur Welt, das bei den meisten Arten sehr weit entwickelt ist. Das Geburtsgewicht liegt je nach Art zwischen 70 und 425 g, die Geburtslänge zwischen 15 und 30 cm. Die Neugeborenen haben geöffnete Augen, die Schuppen sind nicht überlappend und zunächst weich, sie härten in den ersten Lebenstagen aus. Weibchen haben ein Paar achselständige Zitzen, mit denen das Junge gesäugt wird.[6][2]
Bei den baumlebenden Arten verbleibt das Jungtier in der ersten Woche in einer Baumhöhle, erst dann klettert es auf die Schwanzwurzel des Muttertiers und kann so bis zur Entwöhnung getragen werden. Bei den bodenbewohnenden Arten kommen die Jungen unterirdisch zur Welt und bleiben dort etwa zwei bis vier Wochen, bis sie die Höhle an den Schwanz der Mutter geklammert erstmals verlassen. Bei Gefahr rutscht es in der Regel auf die Bauchseite und das Muttertier bedeckt es mit dem Schwanz. Nach zwei bis vier Wochen, spätestens aber nach drei Monaten nimmt das Jungtier erstmals feste Nahrung zu sich, oft wird es zunächst auf der Schwanzwurzel der Mutter zu den Nahrungsquellen getragen. Nach rund fünf Monaten erfolgt die Trennung von der Mutter, die Geschlechtsreife tritt mit ein bis zwei Jahren ein.[2][6] Das höchste bekannte Alter eines Schuppentieres in menschlicher Obhut betrug etwas mehr als 19 Jahre.[31]
Verteidigung

Schuppentiere sind eher scheue und vorsichtige Tiere. Im Bedrohungsfall versuchen sie zunächst, den schützenden Unterschlupf zu erreichen. Gelingt ihnen das nicht, können sie sich zu einer Kugel einrollen. Dabei wird der muskulöse Schwanz über den ungeschützten Bauch und das Gesicht gelegt, um diese Regionen vor Angriffen zu bewahren. In zusammengerolltem Zustand richten sie auch die Schuppen auf, deren scharfe Kanten einen zusätzlichen Schutz bieten. Kleinere Arten verzahnen außerdem die Schwanzschuppen mit denen des Nackens, so dass die Tiere kaum aufgerollt werden können.[2] Darüber hinaus können mit dem Schwanz rasche Verteidigungsschläge ausgeteilt werden, die dank der scharfen Schuppenkanten besonders effektiv sind. Es gibt einen Bericht aus Indonesien, wonach sich ein Schuppentier zu einer Kugel einrollte und einen Abhang hinunterrollte. Dabei legte es 30 Meter in 10 Sekunden zurück. Eine weitere Verteidigungsmethode ist das Versprühen eines übelriechenden Sekretes aus den Analdrüsen, ähnlich den Skunks. Die langen Krallen werden nicht zur Verteidigung eingesetzt.[6]
Systematik
Äußere Systematik
Innere Systematik der Laurasiatheria nach O'Leary et al. 2013[32]
|
Die Schuppentiere (Manidae) stellen die heute einzige Familie aus der Ordnung der Pholidota dar. Nach modernen molekularbiologischen Untersuchungen sind die Schuppentiere die nächsten lebenden Verwandten der Raubtiere (Carnivora), beide Ordnungen bilden gemeinsam das höhere Taxon der Ferae.[33] Sie sind damit Teil der Überordnung der Laurasiatheria, einer der vier Hauptlinien der Höheren Säugetiere.[34] Die Trennung der Raubtiere von den Schuppentieren fand genetischen Analysen zufolge möglicherweise schon in der Oberkreide vor mehr als 80 Millionen Jahren[35][36] oder aber im beginnenden Paläozän vor knapp 65 Millionen Jahren statt.[32]
Die Pholidota enthalten neben den heutigen Schuppentieren noch zwei nahe verwandte, allerdings ausgestorbene Familien, die Eomanidae und die Patriomanidae, letztere werden als die Schwestergruppe der Manidae angesehen. Die nächste verwandte Großgruppe bilden die Palaeanodonta. Diese ebenfalls ausgestorbene Säugetiergruppe ist aus dem Paläozän und Eozän vorwiegend aus Nordamerika, seltener aus Europa und Ostasien bekannt und wird in drei Familien unterteilt, die Escavadodontidae, die Epoicotheriidae und die Metacheiromyidae. Möglicherweise muss aber auch Ernanodon aus Ostasien in die Palaeanodonta eingeschlossen werden. Dieses bildete ursprünglich die monotypischen Ernanodonta, nach Analysen eines nahezu vollständigen Skeletts steht es aber Palaeanodon näher.[37] Die Palaeanodonta wiesen gleichfalls Anpassungen an eine grabende und insektenfressende Lebensweise auf, etwa kräftige Gliedmaßen mit großen Krallen sowie verkleinerte, wenig spezialisierte Zähne mit einer nur dünnen Schicht an Zahnschmelz. Aufgrund der teils noch urtümlichen Merkmale wie ausgebildete Zähne könnten sie auch die Vorläufer der Pholidota darstellen.[38] Die Ähnlichkeit ist so stark, dass die Palaeanodonta und die Pholidota heute zusammen in dem übergeordneten Taxon Pholidotamorpha zusammengefasst werden.[39]
Innere Systematik
|
Die Familie der Schuppentiere gliedert sich heute in acht Arten, die sich auf drei Gattungen verteilen. Die Gattung Manis umfasst dabei die asiatischen Arten sowie einige belegte fossile Formen aus dem eurasischen Raum. Smutsia hingegen stellt die afrikanischen Bodenschuppentiere, während Phataginus die afrikanischen baumbewohnenden Schuppentiere enthält. Diese Untergliederung in mehrere Gattungen kann auch morphologisch anhand einzelner Schädel- oder Fußskelettmerkmale untermauert werden. So findet sich ein genereller Unterschied zwischen asiatischen und afrikanischen Schuppentieren in der Länge des Rostrums, welches bei ersteren markant gestreckter ist als bei letzteren. Auch der vordere Jochbogenansatz zieht bei den asiatischen Schuppentieren länger aus als bei den afrikanischen.[41] Nach kladistischen Untersuchungen von Skelettmerkmalen unter Einbeziehung aller fossilen Formen der Pholidota stehen die asiatischen Schuppentiere als Schwestergruppe den afrikanischen gegenüber. Erstere werden als monophyletisch angesehen, letztere bilden wiederum zwei eigenständige Gruppen. Aus diesem Grund wurden die asiatischen Schuppentiere in die Unterfamilie der Maninae gestellt, die beiden afrikanischen Gattungen repräsentieren dagegen zwei Unterfamilien, die Smutsiinae und die Phatagininae.[39][42] Die anatomisch festgestellte grundlegende Zweiteilung der Schuppentiere in einen asiatischen und einen afrikanischen Strang sowie die Aufgliederung von letzterem finden ihre Entsprechungen in den seit den 2010er Jahren zunehmend durchgeführten genetischen Untersuchungen.[43][44][42][45] Diesen zufolge begann die stärkere Diversifizierung der Schuppentiere mit der Abspaltung der Linie der Maninae von der der afrikanischen Schuppentiere im Mittleren oder Oberen Eozän vor gut 46,9 bis 37,9 Millionen Jahren. Die afrikanische Gruppe wiederum spaltete sich möglicherweise im Verlauf des Oligozäns bis zum Übergang ins Miozän vor etwa 29,6 bis 22,9 Millionen Jahren auf.[36][42]
Innere Systematik der Manidae nach Gaubert et al. 2018[42]
|
Es gibt allerdings auch Ansätze, in denen die einzelnen Arten nur einer einzigen Gattung, in diesem Fall Manis, zugehören, wohingegen die anderen Gattungen nur den Status einer Untergattung besitzen.[46][47][2] Der Gliederungsversuch wird aber seit den genetischen Untersuchungen zunehmend abgelehnt.[44][42][45] Andere hingegen unterschieden nur die asiatischen (Manis) und afrikanische Formen (Phataginus), was morphologisch begründet wurde.[48] Daneben wurde auch die Ansicht geäußert, dass die afrikanischen Baumschuppentiere in zwei Gattungen aufgespalten werden können, in Phataginus und Uromanis, womit insgesamt vier Gattungen bestünden,[49] ein Modell, dass teilweise auch von der IUCN verfolgt wurde.[5] In der Vergangenheit gab es allerdings auch Vorschläge mit bis zu sechs Gattungen. Der Vorschlag einer Gliederung in drei Gattungen wurde erstmals Ende der 1990er Jahre gemacht[8][19] und konnte in der Folgezeit durch mehrere kladistische Untersuchungen untermauert werden.[39]
Überblick über die rezenten und fossilen Arten der Schuppentiere
Innerhalb der Familie der Manidae werden heute acht rezente und mehrere fossile Arten in drei Gattungen unterschieden:[39][42][50]
- Familie: Manidae Gray, 1821
- Unterfamilie: Maninae Gray, 1821
- Manis (= Pangolinus, Paramanis, Pholidotus) Linnaeus, 1758
- † Manis hungarica Kormos, 1934
- † Manis lydekkeri Dubois, 1908
- † Manis palaeojavanica Dubois, 1907
- Manis pentadactyla Linnaeus, 1758 (Chinesisches Schuppentier oder Ohrenschuppentier)
- Manis crassicaudata Geoffroy, 1803 (Vorderindisches Schuppentier)
- Manis javanica Desmarest, 1822 (Malaiisches Schuppentier)
- Manis culionensis (de Elera, 1915) (Palawan-Schuppentier)
- Unterfamilie: Smutsiinae Gray, 1873
- Smutsia Gray, 1865
- † Smutsia olteniensis Terhune, Gaudin, Curran & Petculescu, 2021
- Smutsia gigantea (Illinger, 1815) (Riesenschuppentier)
- Smutsia temminckii (Smuts, 1832) (Steppenschuppentier)
- Unterfamilie: Phatagininae Gaubert, 2017
- Phataginus (= Phatagin, Triglochinopolis, Uromanis) Rafinesque, 1821
- Phataginus tricuspis (Rafinesque, 1821) (Weißbauchschuppentier)
- Phataginus tetradactyla (Linnaeus, 1766) (Langschwanzschuppentier)
Genetische Daten weisen darauf hin, dass das Weißbauchschuppentier möglicherweise mehrere kryptische Arten enthält. Unterstützt wird dies auch durch schädelmorphologische Befunde. Einige Wissenschaftler gehen daher von mehr als einem Dutzend Arten an Schuppentieren aus.[51][52][42][41] Die Gültigkeit der ausgestorbenen Arten Manis hungarica und Manis lydekkeri wird teilweise angezweifelt, da ihre jeweiligen Beschreibungen lediglich auf isolierten Phalangen beruhen.[39]
Innerhalb der Ordnung Pholidota können zusätzlich noch folgende ausgestorbene Familien und Gattungen unterschieden werden:[39][53][54]
- Eurotamandua Storch, 1981
- Euromanis Gaudin, Emry & Wible, 2009
- Familie: Eomanidae Storch, 2003
- Eomanis Storch, 1978
- Familie: Patriomanidae Szalay & Schrenk, 1998
- Necromanis Filhol, 1893
- Patriomanis Emry, 1970
- Cryptomanis Gaudin, Emry & Pogue, 2006
Forschungsgeschichte
Taxonomie

Der Name der Familie der Schuppentiere, Manidae, wurde im Jahr 1821 von John Edward Gray eingeführt. Gray beschrieb die Merkmale der Maniden folgendermaßen:
Mouth very small: tongue very Iong, fili-form: body hairy or scaly: claw recurved, acute: tail long: ears short: caecum none: stomach simple
„Maul sehr klein: Zunge sehr lang, fadenförmig: Körper behaart oder schuppig: Klaue zurückgebogenen, spitz: Schwanz lang: Ohren kurz: Blinddarm fehlt: Magen einfach“
Die Beschreibung bezog sich damals aber neben den heutigen Schuppentieren auch auf die Ameisenbären, die Gray mit in die Manidae eingliederte,[55] vier Jahre später trennte er die Ameisenbären von den Schuppentieren, sah beide jedoch als Untergruppe der Gürteltiere an.[56] Für die Familienbezeichnung Manidae stand der Gattungsname Manis Pate. Dieser wurde 1758 von Linnaeus in seinem Werk Systema Naturae erstmals verwendet. Er erwähnte mit M. pentadactyla nur eine Art, von der er aufgrund der Angabe der präzisen Zehenanzahl ein Exemplar gesehen haben muss.[57] Die Bezeichnung Manis geht auf die Manen zurück (lateinisch manes), römische Totengeister, und bezieht sich dabei auf die nachtaktive und meist versteckte Lebensweise. Der vor allem umgangssprachlich im englischen Sprachraum häufig verwendete Begriff pangolin leitet sich aus dem Malaiischen her, wo Peng-guling so viel wie „Einroller“ bedeutet und einerseits die Befähigung sich einzurollen wiedergibt, andererseits auch die einfache Fangmöglichkeit durch Menschen hervorhebt.[2]
Die Edentata-Problematik – Zur systematischen Stellung der Schuppentiere
Ursprünglich wurden die Schuppentiere und teilweise die mit ihnen verwandten Gruppen (Palaeanodonta) aus anatomischen und morphologischen Gründen in ein nahes Verwandtschaftsverhältnis mit den Nebengelenktieren (Xenarthra) gestellt. So haben die Ameisenbären (Vermilingua) eine vergleichbar zahnlose, langgestreckte Schnauze mit verlängerter Zunge, einen reduzierten Jochbogen und Grabkrallen, während die Gürteltiere (Dasypoda) eine ähnliche Körperpanzerung besitzen und teilweise auch strikte Insectivoren darstellen. Im Gegensatz zu den wenig diversen Schuppentieren und ihren Vorgängern stellen die Xenarthra sowohl heute als auch in ihrer stammesgeschichtlichen Vergangenheit eine sehr formenreiche Gruppe dar, die jedoch weitgehend auf Südamerika beschränkt ist. Aufgrund des Auftretens der typischen xenarthrischen Gelenke (Xenarthrale oder Nebengelenke) an den hinteren Brustwirbeln und an den Lendenwirbeln galten sie schon lange als natürliche Gruppe. Tatsächlich war aber bis teilweise in die 1980er Jahre hinein die Vorstellung eines Taxons Edentata (Zahnlose) weit verbreitet. Die Edentata zeichneten sich dabei entweder durch den Verlust aller Zähne oder aber durch die Entwicklung eines homodonten Gebisses bei gleichzeitiger weitgehender Reduktion des Zahnschmelzes aus. Dadurch wichen die Edentata von den meisten Höheren Säugetiere mit ihrem charakteristisch heterodonten Gebissaufbau ab. Das Taxon Edentata geht auf Étienne Geoffroy Saint-Hilaire und Georges Cuvier zurück, die 1795 den Begriff eingeführt hatten[58] (beide verwendeten dabei die von Félix Vicq d’Azyr bereits 1792 gebrauchte Bezeichnung „Edentati“ erneut), und bestand ursprünglich aus den Schuppentieren, den Ameisenbären und den Gürteltieren, drei Jahre später fügte Cuvier noch die Faultiere und das afrikanische Erdferkel (Orycteropus) hinzu.[59] Vor der Etablierung der Edentata hatte bereits Gottlieb Conrad Christian Storr im Jahr 1780 die genannten Gruppen mit Ausnahme des Erdferkels unter der Bezeichnung Mutici vereint, während Linnaeus noch keine Beziehungen dieser untereinander erkannt hatte. Vielmehr sah Linnaeus in seinem Werk Systema Naturae aus dem Jahr 1758 die Gattung Manis, die heutigen asiatischen Schuppentiere, in der Nähe der Elefanten, aber auch der Ameisenbären und Faultiere, während er gleichzeitig die Gürteltiere an die Seite der Insektenfresser und Schweine stellte (das Erdferkel war zu seiner Zeit noch nicht bekannt).[46][9]
Bereits gegen Ende des 19. Jahrhunderts wurde erkannt, dass die einzelnen Mitglieder der Edentata keine natürliche Gruppe bildeten. Thomas Henry Huxley verwies 1872 das Erdferkel in eine eigene Ordnung, die Tubulidentata, ebenso wie die Schuppentiere.[60] Da sein favorisierter Name Squamata aber bereits durch die Schuppenkriechtiere präokkupiert war, gilt Max Wilhelm Carl Webers 1904 geprägter Begriff Pholidota heute als Bezeichnung für die Ordnung der Schuppentiere.[61] Im Jahr 1889 etablierte wiederum Edward Drinker Cope für die südamerikanischen Vertreter und damit der eigentlichen Kerngruppe der Edentata den Überbegriff Xenarthra.[62] Die Zusammensetzung und systematische Stellung der Edentata wurden im weiteren Verlauf der Forschungsgeschichte unterschiedlich bewertet. Vor allem William Diller Matthew brachte 1918 die Palaeanodonta in die Edentata ein. Er erkannte basierend auf anatomischen Merkmalen auch die nahe Verwandtschaft der Schuppentiere mit den Palaeanodonta und sah letztere als Vorfahren der ersteren an. George Gaylord Simpson gliederte in seiner Studie zur Klassifizierung der Säugetiere aus dem Jahr 1945 die Pholidota und damit die Schuppentiere (aber nicht die Palaeanodonta) aus den Edentata aus, er sah beide Gruppen zudem nicht in einem sehr engen Verwandtschaftsverhältnis, weiterhin plädierte er für die Gleichsetzung der Begriffe Edentata und Xenarthra.[46] Robert J. Emry wiederum vereinte im Jahr 1970 die Palaeanodonta mit den Schuppentieren unter den Pholidota und verwies dabei auf die bereits von Matthew vorgetragenen Argumente. Zudem betonte er, wie Simpson vor ihm, die unterschiedliche paläogeographische Verbreitung der Nebengelenktiere und der Pholidota, aufgrund dessen beide Gruppen keinen gemeinsamen stammesgeschichtlichen Vorfahren haben können.[20] Etwa im selben Zeitraum sah Malcolm C. McKenna die Edentata als synonym zu den Xenarthra und stellte sie als Schwestergruppe allen übrigen Höheren Säugetieren, die er als Epitheria zusammengefasste, gegenüber. Er bescheinigte außerdem den Pholidota (und den Tubulidentata) ein nur entferntes Verwandtschaftsverhältnis zu den Nebengelenktieren. Allerdings erneuerten Mitte der 1980er Jahre Wissenschaftler um Michael J. Novacek die enge Verwandtschaft der Xenarthra und Pholidota innerhalb der Edentata und sahen die Edentata in der gleichen Position wie McKenna vorher.[63] Andere Forscher wiederum betrachteten zu der Zeit die Edentata als synonym zu den Pholidota und dem Erdferkel und schlossen die Nebengelenktiere aus.[9][64]
Ebenfalls Mitte der 1980er Jahre ergaben Untersuchungen basierend auf immunologischen Eigenschaften erstmals eine nähere Verwandtschaft der Schuppentiere mit den Raubtieren, ein Ergebnis, das sich innerhalb der bisherigen anatomischen Analysen nicht widerspiegelte.[65] Nachfolgende Untersuchungen konnten dies bestätigen, woraufhin 1998 die Pholidota mit den Carnivora unter dem Taxon Ferae vereint wurden. Als eines der wenigen gemeinsamen morphologischen Merkmale konnte dabei ein verknöchertes Tentorium cerebelli zwischen dem Groß- und Kleinhirn herausgearbeitet werden.[66] Mehrere molekulargenetische Untersuchungen untermauerten weiterhin nicht nur die enge Beziehung zwischen Schuppentieren und Raubtieren, sondern führten auch zu einer neuen Gliederung der Höheren Säugetiere in vier Überordnungen, wobei die Ferae einen Platz in den Laurasiatheria neben den Paarhufern und Unpaarhufern erhielten.[34][67][68] Die Nebengelenktiere dagegen stehen an der Basis der Entwicklung der Höheren Säugetiere, ähnlich wie es McKenna Mitte der 1970er Jahre bereits prognostiziert hatte.[32] Nach dem heutigen Verständnis beruhen die Ähnlichkeiten zwischen Schuppen- und Nebengelenktieren somit auf Konvergenz und nicht auf Verwandtschaft und ergeben sich aus den ähnlichen Lebensweisen der beiden Gruppen. Das Taxon Edentata wird demzufolge heute nicht mehr geführt.[69][9] Gelegentlich wird der Begriff noch als informeller Terminus für zahnlose Tiere genutzt, zu denen innerhalb der Säugetiere neben den Ameisenbären und den Schuppentieren dann auch die Bartenwale und die Ameisenigel zu zählen sind.[26]
Stammesgeschichte


Fossile Reste der Schuppentiere sind allgemein sehr selten. Ursachen liegen unter anderem in der Ökologie der Tiere selbst, etwa der bevorzugte waldreiche Lebensraum, die einzelgängerische Lebensweise und die niedrige Populationsdichte. Erschwerend hinzu kommt der entwicklungsgeschichtlich frühe Verlust der Zähne, die am häufigsten erhaltenen Überreste von Säugetieren, die für die genaue Zuordnung von Fossilfunden meist unabdingbar sind. Dadurch werden manchmal einzelne Skelettelemente übersehen, obwohl an diversen Fundstellen Reste von Maniden präsent sein können.[40]
Die Pholidota stellen eine alte Ordnung dar, die ältesten unzweifelhaften Vertreter sind aus dem Mittleren Eozän vor etwa 47 Millionen Jahren aus der Grube Messel überliefert. Hierzu gehören mehrere vollständige Skelette, die den Gattungen Eomanis und Eurotamandua zugewiesen werden.[70][71] Im Körperbau mit ihren ausgeprägten Grabkrallen und dem zahnlosen Kiefer entsprachen diese frühen Vertreter den heutigen Schuppentieren schon sehr gut. Bei Eomanis, einem rund 50 cm langen Tier, gelang zudem auch der erste Fossilnachweis von Schuppen.[13] Stammesgeschichtlich stehen diese beiden Gattungen zusammen mit Euromanis, ebenfalls aus Messel, an der Basis der Entwicklung der Pholidota und repräsentieren die Gruppe der „Eomanidae“.[39][40] Deutlich näher verwandt mit den heutigen Schuppentieren sind dagegen die Patriomanidae, die aus dem Oberen Eozän von Nordamerika und Ostasien bekannt sind. Hierzu gehört unter anderem Patriomanis, von dem zwei nahezu vollständige Teilskelette und vier weitere Individuen aus der White-River-Formation von Wyoming und der Renova-Formation von Montana vorliegen; es stellt den einzigen bisher entdeckten Vertreter in Nordamerika dar.[20][7][54] Des Weiteren ist Cryptomanis zu nennen, das anhand eines schädellosen Skelettes aus der Shara-Murun-Formation der Inneren Mongolie in der Volksrepublik China beschrieben wurde.[72] In Europa war später Necromanis vom Oligozän bis zum Mittleren Miozän verbreitet. Von dieser Gattung sind wenigstens drei Arten benannt. Das gesamte Fundmaterial verteilt sich auf mehr als ein Dutzend Individuen, darunter ein nahezu vollständiges Skelett aus Saulcet im Allierbecken in Frankreich[73] und zwei Teilskelette aus einer Spaltenfüllung bei Petersbuch nahe Eichstätt in Süddeutschland.[74] Einige wenige Knochenreste stammen auch aus Solnhofen oder Weisenau bei Wiesbaden in Deutschland, von Dolnice bei Cheb in Tschechien[19] und aus El Papiol in Katalonien.[75] Zwei Endphalangen des Vorder- und Hinterfußes aus der Gebel-Qatrani-Formation des Fayyum in Ägypten, die die typischen Einkerbungen für die Krallen der heutigen Schuppentiere zeigen, gehören einem noch unbeschriebenen Vertreter der Schuppentiere aus dem Unteroligozän von Afrika an und werden auf rund 31 Millionen Jahre datiert.[76] Dem Fossilbericht zufolge entstanden die Pholidota demzufolge im nördlichen Bereich Eurasiens, möglicherweise in einem eher westlichen Areal, und erreichten später via Ostasien auch Nordamerika. Ein solcher Entstehungsraum ist auch konsistent mit der heutigen Zuweisung der Pholidota zu den Laurasiatheria, denen allgemein ein Ursprung auf eher nördlicher gelegenen Landmassen, die ursprünglich den Kontinent Laurasia bildeten, zugesprochen wird. Die bisher bekannten Fossilfundstellen mit Resten der frühesten Schuppentiere liegen dabei rund 1000 km nördlich der heutigen nördlichsten Verbreitungsgrenze der rezenten Vertreter.[72][40]
Die Manidae treten erstmals im Pliozän auf, doch auch hier sind Fossilfunde meist rar. In den Beginn des Pliozäns datiert ein nahezu vollständiges Skelett eines großen Schuppentieres aus der Varswater-Formation von Langebaanweg im südwestlichen Südafrika. Es zeigt einige pathologische Veränderungen, vor allem am Vorderbein, ähnelt aber in seinen Proportionen der Gliedmaßen deutlich dem Riesenschuppentier.[21] Der gleichen Art wird ein Radius aus der Warwire-Formation vom Albertsee in Uganda zugeschrieben, der aber etwas jünger ist. Beide Funde gehören Tieren an, die etwas kleiner waren als das heutige Riesenschuppentier.[40] Aus dem Oberpliozän stammt Manis hungarica, der einzige europäische Vertreter. Dieser wurde anhand einer 5 cm langen, allerdings fragmentierten Endphalanx des rechten Mittelfingers aus Villány im südlichen Ungarn beschrieben und mit den asiatischen Schuppentieren in Verbindung gebracht,[77] der Fund ist aber mittlerweile verloren.[78] Ein nahezu vollständiger Oberarmknochen ist von der Basis eines 1,5 m mächtigen siltigen Sandes im Tal von Valea Grăunceanului in Rumänien überliefert. Der Fund wurde zusammen mit dem Primaten Paradolichopithecus und dem giraffenartigen Tier Mitilanotherium dokumentiert und gehört in dem Übergang vom Pliozän zum Unteren Pleistozän, dem Mittleren Villafranchium. Im Jahr 2021 als Smutsia olteniensis beschrieben, stellt er den bisher jüngsten Beleg eines Schuppentiers in Europa und den einzigen Vertreter der Gattung Smutsia außerhalb Afrikas dar.[79][80][50] Bereits Anfang des 20. Jahrhunderts führte ein aus 28 Knochen bestehendes Teilskelett mit teils artikulierten Resten des Schädels und der Vorder- und Hinterbeine zur Beschreibung von Manis palaeojavanica, das im Mittelpleistozän in Südostasien lebte. Der Fund, der nur auf wenigen Quadratmetern streute, stellt ein Individuum einer Art dar, der mit bis zu 2,5 m Gesamtlänge die bisher größten bekannten Schuppentiere angehören; sie sind etwa ein Drittel größer als das Riesenschuppentier. Nachgewiesen wurde die Art erstmals in der frühmittelpleistozänen „Kedung-Brubus-Fauna“ der indonesischen Insel Java, von wo auch der Rest eines frühmenschlichen Schädels stammt,[1] Die Funde sind etwa 800.000 Jahre alt, auf ein ähnliches Alter wird auch die Fauna von Citarum im Westen Javas geschätzt, wo ein Fragment eines rechten Oberschenkelknochens von Manis palaeojavanica herstammt.[81] Weitere Funde dieser Art in Form einiger Fußknochen liegen auch in den wesentlich jüngeren, auf ein Alter von rund 40.000 Jahren angesetzten Faunenresten der Niah-Höhlen auf Borneo vor, wo sie zusammen mit dem deutlich kleineren Malaiischen Schuppentier auftrat.[82][83] Eine weitere fossile Form des Pleistozäns ist mit Manis lydekkeri aus den Carnul-Höhlen bei Madras in Indien berichtet worden. Hier liegt aber nur eine Phalanx vor, die wenig von denen den heutigen Schuppentieren abweicht.[20] In der Nelson Bay Cave in Südafrika kamen einige Reste zum Vorschein, die ursprünglich dem Steppenschuppentier zugewiesen wurden und welche mit einem Alter von 12.000 bis 18.000 Jahren in das Oberpleistozän gehören. Es ist aber fraglich, ob die Funde tatsächlich ein Schuppentier repräsentieren.[84][21][40]
Schuppentiere und Menschen
Bedrohung und Schutz

_(32575641040).jpg.webp)

Aufgrund ihrer Lebensweise haben Schuppentiere einen positiven ökologischen Nutzen, indem sie die Größe und Ausbreitung von Ameisen- und Termitenpopulationen regulieren, was auch dem Menschen zugutekommt. Allerdings unterliegen die Schuppentiere einem starken Jagddruck seitens des Menschen. In Afrika gilt das Fleisch der Tiere als Delikatesse und wird teilweise als Bushmeat genutzt. Vor allem im westlichen Afrika zählt Schuppentierfleisch zu den teuersten Spezialitäten und die Tiere werden meist lebend auf Märkten verkauft. Zusätzlich finden Schuppentiere Verwendung in der lokalen Medizin. Knochen und Schuppen dienen bei den Yoruba und den Awori in Westafrika unter anderem zur Linderung von Magenbeschwerden, aber auch zur Potenzsteigerung bei Männern und zur Regulierung des Menstruationszyklus bei Frauen. Vielfach werden den Tieren magische Eigenschaften nachgesagt, so dass einzelne Körperteile aus unterschiedlichsten Gründen als Talismane oder Glücksbringer eingesetzt werden.[85][86] In der Chinesischen Medizin im östlichen Asien spielen die Schuppen ebenfalls eine wichtige Rolle. Sie gelten dort als Aphrodisiakum und antiseptisches Mittel, wurden zur Behandlung von Geisteskrankheiten und Nervenleiden empfohlen[87] und kommen bei der Behandlung von Vergiftungen, Entzündungen, Rheuma, Asthma, Durchblutungsstörungen und in jüngerer Zeit auch gegen Brustkrebs zum Einsatz. Die Schuppen werden dabei in Stücken oder zu Pulver zermahlen gehandelt.[2][88]
Die Bestände der Schuppentiere sind rückläufig. Verantwortlich dafür ist in erster Linie die extensive Jagd. Alle Arten stehen unter lokalem Schutz, darüber hinaus sind sie im Washingtoner Artenschutz-Übereinkommen (CITES) seit 2016 in Anhang I gelistet, welcher die Arten mit dem höchsten Bedrohungsstatus beinhaltet.[89] Seit 2000 gilt zudem die zero annual export quota des CITES, eine Bestimmung, die jeden internationalen Handel mit Schuppentieren oder deren Körperteilen verbietet. Allerdings ist ein reger, teils weltweit operierender Schwarzmarkt vorhanden und immer wieder werden große Schmuggelmengen entdeckt,[90] allein im Februar und März 2008 wurden insgesamt 23 t an tiefgefrorenen Schuppentieren in Vietnam[91] und im gleichen Jahr weitere 14 t in Indonesien sichergestellt.[92] Mit geschätzt über einer Million gewilderter Tiere im Zeitraum zwischen 2004 und 2014 sind Schuppentiere laut IUCN die am meisten illegal gehandelten Säugetiere der Welt.[93] Im Juli 2017 gelang chinesischen Behörden in Shenzhen die mit einem Gesamtgewicht von 12 Tonnen landesweit bislang größte Konfiszierung von Schuppen.[94] Anfang Januar 2018 konfiszierte der Zoll in der taiwanischen Hafenstadt Kaohsiung einen Container aus Malaysia mit 13 Tonnen tiefgefrorener ausgenommener Schuppentiere (rund 4000 Individuen). Der Verkaufswert wurde auf 2.000 NT$ (etwa 55 Euro) pro Kilogramm geschätzt.[95] Der internationale Handel mit Schuppentieren ist seit Januar 2017 komplett verboten.[96]
Des Weiteren sind vor allem die Landschaftszerstörung durch Abholzung der Wälder und Verkehrsunfälle Bedrohungsfaktoren für die einzelnen Populationen, deren exakter Status aufgrund der versteckten Lebensweise nur schwer zu ermitteln ist. Dadurch ist es wahrscheinlich, dass einzelne lokale Bestände bereits erloschen sind, so etwa beim Riesenschuppentier in Ruanda oder beim Steppenschuppentier im Oranje-Freistaat Südafrikas, ebenso wie beim Vorderindischen Schuppentier in Bangladesch und beim Chinesischen Schuppentier auf der Insel Hainan.[2][88]
Als problematisch erweist sich darüber hinaus die Aufzucht von Schuppentieren in zoologischen Einrichtungen. Zwar wurden seit den 1870er Jahren Schuppentiere in zahlreichen Zoos weltweit gehalten, in der Regel starben die Tiere aber nach wenigen Jahren. Ursachen lagen meist in der nicht akzeptierten Nahrung. Zudem erzeugten sie kaum Nachwuchs. Zum Erfolg führte eine neue Nahrungsstrategie im Zoo von Taipeh, wo im November 1998 erstmals in diesem Zoo ein Chinesisches Schuppentier zur Welt kam.[31][97]
Die IUCN listet die vier afrikanischen Arten als „gefährdet“ (vulnerable), von den asiatischen Vertretern gelten das Palawan-Schuppentier und das Vorderindische Schuppentier als „stark gefährdet“ (endangered) und das Chinesische Schuppentier sowie das Malaiische Schuppentier als „vom Aussterben bedroht“ (critically endangered).[98] Zu den wichtigsten Maßnahmen zählt ein aktives Beobachtungsprogramm, um die genaue Verbreitung der einzelnen Schuppentierpopulationen zu studieren (monitoring), verbunden mit einer genaueren Untersuchung der ökologischen Bedürfnisse der Tiere in freier Wildbahn wie auch in zoologischen Einrichtungen. Darüber hinaus haben aber auch die Schulung und Sensibilisierung der örtlichen Bevölkerung sowie der Regierungsvertreter Vorrang zuzüglich der Erkundung der Mechanismen des weltweiten Handels.[88]
Schuppentiere als mögliche Krankheitsüberträger
Forscher vermuten, dass Schuppentiere als Zwischenwirt für das Corona-Virus in Frage kommen und somit an der Entstehung der COVID-19-Pandemie beteiligt waren. Die Übereinstimmungen im Genom des aus dem Malaiischen Schuppentier isolierten Pangolin-CoV mit dem beim Menschen wirkenden SARS-CoV-2 und dem bei Fledertieren als weiteren möglichen Zwischenwirt festgestellten Bat-CoV liegen bei jeweils rund 91 %.[99]
Literatur
- P. Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103
- Timothy J. Gaudin, Robert J. Emry und John R. Wible: The Phylogeny of Living and Extinct Pangolins (Mammalia, Pholidota) and Associated Taxa: A Morphology Based Analysis. Journal of Mammalian Evolution 16, 2009, S. 235–305
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore, 1999, S. 1–1936 (1239–1242)
Einzelnachweise
- Eugène Dubois: Manis Palaejavanica. the Giant Pangolin of the Kendeng Fauna. Proceedings of the Koninklijke Nederlandse Akademie van Wetenschappen Amsterdam 29, 1926, S. 1233–1243
- P. Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103
- Martha E. Heath: Family Manidae. Pangolins. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 187
- R. I. Pocock: The External Characters of the Pangolins (Manidae). Proceedings of the Zoological Society of London, 1924: 707–723
- IUCN-SSC Pangolin Specialist Group ()
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore, 1999, S. 1–1936 (1239–1242)
- Robert J. Emry: The Edentulous Skull of the North American Pangolin, Patriomanis americanus. Bulletin of the American Museum of Natural History 285, 2004, S. 130–138
- Timothy J. Gaudin und John R. Wible: The entotympanic of pangolins and the phylogeny of the Pholidota. Journal of Mammalian Evolution 6 (1), 1999, S. 39–65
- Kenneth D. Rose, Robert J. Emry, Timothy J. Gaudin und Gerhard Storch: Xenarthra und Pholidota. In: Kenneth D. Rose und J. David Archibald (Hrsg.): The Rise of Placental Mammals: Origins and Relationships of the Major Extant Clades. Johns Hopkins University Press, Baltimore, 2005, S. 1–259 (S. 106–126)
- Martha E. Heath: Manis pentadactyla. Mammalian Species 414, 1992, S. 1–6
- Nausheen Irshad, Tariq Mahmood und Muhammad Sajid Nadeem: Morpho-anatomical characteristics of Indian pangolin (Manis crassicaudata) from Potohar Plateau, Pakistan. Mammalia 80 (1), 2016, S. 103–110
- R. I. C. Spearman: On the structure of the horny scales of the pangolin. Journal of the Linnean Society (Zoology) 46 (310), 1967; S. 267–273
- Wighart von Koenigswald, Gotthart Richter und Gerhard Storch: Nachweis von Hornschuppen bei Eomanis waldi aus der „Grube Messel“ bei Darmstadt (Mammalia: Pholidota). Senckenbergiana lethaea 61 (3/6), 1981, S. 291–298
- W. Meyer, M. Liumsiricharoen, A. Suprasert, L. G. Fleischer und M. Hewicker-Trautwein: Immunohistochemical demonstration of keratins in the epidermal layers of the Malayan pangolin (Manis javanica), with remarks on the evolution of the integumental scale armour. European Journal of Histochemistry 57, 2013, S. e27, PMC 3794358 (freier Volltext)
- Martha E. Heath: Manis crassicaudata. Mammalian Species 513, 1992, S. 1–4
- F. A. Jentink: Revision of the Manidae in the Leyden Museum. Notes from the Leyden Museum 4, 1882, S. 193–209
- Gerhard Storch: Pholidota, Schuppentiere, Tannenzapfentiere. In: Wilfried Westheide und Reinhard Rieger (Hrsg.): Spezielle Zoologie Teil 2: Wirbel- oder Schädeltiere. Gustav Fischer Verlag, Stuttgart, Jena, New York 2003, ISBN 3-8274-0900-4, S. 510–514
- G. A. Doran und D. B. Allbrook: The Tongue and Associated Structures in Two Species of African Pangolins, Manis gigantea and Manis tricuspis. Journal of Mammalogy 54 (4), 1973, S. 887–899
- Wighart von Koenigswald: Order Pholidota. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 75–79
- Robert J. Emry: A North American Oligocene pangolin and other additions to the Pholidota. Bulletin of the American Museum of Natural History 142, 1970, S. 455–510
- Jennifer Botha und Timothy Gaudin: An Early Pliocene pangolin (Mammalia; Pholidota) from Langebaahnweg, South Africa. Journal of Vertebrate Paleontology 27 (2), 2007, S. 484–491
- Mei Fong Lin, Chi-Yen Chang, Ci Wen Yang und Ellen S. Dierenfeld: Aspects of Digestive Anatomy, Feed Intake and Digestion in the Chinese Pangolin (Manis Pentadactyla) at Taipei Zoo. Zoo Biology 34, 2015, S. 262–270
- Lap-Ki Chan: Extrinsic Lingual Musculature of Two Pangolins (Pholidota: Manidae). Journal of Mammalogy 76 (2), 1995, S. 472–480
- Teerasak Prapong, Maleewan Liumsiricharoen, Narong Chungsamarnyart, Sirirak Chantakru, Nantawan Yatbantoong, Kitipat Sujit, Pornchai Patumrattanathan, Pakawadee Pongket, Apuntree Duang-ngen und Apinun Suprasert: Macroscopic and Microscopic Anatomy of Pangolin’s Tongue (Manis javanica). Kasetsart Veterinarians 19 (1), 2009, S. 9–19
- C. Nisa’, S. Agungpriyono, N. Kitamura, M. Sasaki, J. Yamada und K. Sigit: Morphological Features of the Stomach of Malayan Pangolin, Manis javanica. Anatomia Histologia Embryologia 39, 2010, S. 432–439
- Tiphaine Davit-Béal, Abigail S. Tucker und Jean-Yves Sire: Loss of teeth and enamel in tetrapods: fossil record, genetic data and morphological adaptations. Journal of Anatomy 214, 2009, S. 477–501
- Martha E. Heath: Order Pholidota – Pangolins. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 384–386
- Max Weber: Beiträge zur Anatomie und Entwickelung des Genus Manis. Leiden, 1892, S. 1–116 (S. 86–87) ()
- Hans Hackethal: Morphologische Untersuchungen am Hirn der Schuppentiere (Mammalia, Pholidota) unter besonderer Berücksichtigung des Kleinhirns. Zoologischer Anzeiger 197 (5/6), 1976, S. 313–331
- Tomokazu Kawashima, Richard W. Thorington, Paula W. Bohaska, Yen-Jean Chenund Andfumi Sato: Anatomy of Shoulder Girdle Muscle Modifications and Walking Adaptation in the Scaly Chinese Pangolin (Manis Pentadactyla Pentadactyla: Pholidota) Compared with the Partially Osteoderm-Clad Armadillos (Dasypodidae). The Anatomical Record 298, 2015, S. 1217–1236
- Martha E. Heath: Biology, Husbandry, and Veterinary Care of Captive Chinese Pangolins (Manis pentadactyla). Zoo Biology 7, 1988, S. 293–312
- Maureen A. O’Leary, Jonathan I. Bloch, John J. Flynn, Timothy J. Gaudin, Andres Giallombardo, Norberto P. Giannini, Suzann L. Goldberg, Brian P. Kraatz, Zhe-Xi Luo, Jin Meng, Xijun Ni, Michael J. Novacek, Fernando A. Perini, Zachary S. Randall, Guillermo W. Rougier, Eric J. Sargis, Mary T. Silcox, Nancy B. Simmons, Michelle Spaulding, Paúl M. Velazco, Marcelo Weksler, John R. Wible und Andrea L. Cirranello: The Placental Mammal Ancestor and the Post–K-Pg Radiation of Placentals. Science 339, 2013, S. 662–667, doi:10.1126/science.1229237
- Robin M. D. Beck, Olaf R. P. Bininda-Emonds, Marcel Cardillo, Fu-Guo Robert Liu und Andy Purvis: A higher-level MRP supertree of placental mammals. BMC Evolutionary Biology 6, 2006, S. 93, PMC 1654192 (freier Volltext)
- William J. Murphy, Eduardo Eizirik, Stephen J. O’Brien, Ole Madsen, Mark Scally, Christophe J. Douady, Emma Teeling, Oliver A. Ryder, Michael J. Stanhope, Wilfried W. de Jong und Mark S. Springer: Resolution of the Early Placental Mammal Radiation Using Bayesian Phylogenetics. Science 294, 2001, S. 2348–2351
- Robert W. Meredith, Jan E. Janečka, John Gatesy, Oliver A. Ryder, Colleen A. Fisher, Emma C. Teeling, Alisha Goodbla, Eduardo Eizirik, Taiz L. L. Simão, Tanja Stadler, Daniel L. Rabosky, Rodney L. Honeycutt, John J. Flynn, Colleen M. Ingram, Cynthia Steiner, Tiffani L. Williams, Terence J. Robinson, Angela Burk-Herrick, Michael Westerman, Nadia A. Ayoub, Mark S. Springer und William J. Murphy: Impacts of the Cretaceous Terrestrial Revolution and KPg Extinction on Mammal Diversification. Science 334, 2011, S. 521–524
- Zelda Du Toit, J. Paul Grobler, Antoinette Kotzé, Raymond Jansen, Helene Brettschneider und Desiré L. Dalton: The complete mitochondrial genome of Temminck's ground pangolin (Smutsia temminckii; Smuts, 1832) and phylogenetic position of the Pholidota (Weber, 1904). Gene 551, 2014, S. 49–54
- Peter Kondrashov und Alexandre K. Agadjanian: A Nearly Complete Skeleton of Ernanodon (Mammalia, Palaeanodonta) from Mongolia: Morphofunctional Analysis. Journal of Vertebrate Paleontology 32 (5), 2013, S. 983–1001
- Kenneth D. Rose: The Beginning of the Age of Mammals. The Johns Hopkins University Press, Baltimore, 1997, S. 1–431 (S. 205–209)
- Timothy J. Gaudin, Robert J. Emry und John R. Wible: The Phylogeny of Living and Extinct Pangolins (Mammalia, Pholidota) and Associated Taxa: A Morphology Based Analysis. Journal of Mammalian Evolution 16, 2009, S. 235–305
- Timothy J. Gaudin: Pholidota. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 599–602
- Sérgio Ferreira-Cardoso, Guillaume Billet, Philippe Gaubert, Frédéric Delsuc und Lionel Hautier: Skull shape variation in extant pangolins (Pholidota: Manidae): allometric patterns and systematic, implications. Zoological Journal of the Linnean Society, 2019, doi:10.1093/zoolinnean/zlz096
- Philippe Gaubert, Agostinho Antunes, Hao Meng, Lin Miao, Stéphane Peigné, Fabienne Justy, Flobert Njiokou, Sylvain Dufour, Emmanuel Danquah, Jayanthi Alahakoon, Erik Verheyen, William T. Stanley, Stephen J. O’Brien, Warren E. Johnson und Shu-Jin Luo: The Complete Phylogeny of Pangolins: Scaling Up Resources for the Molecular Tracing of the Most Trafficked Mammals on Earth. Journal of Heredity 109, 2018, S. 347–359, doi:10.1093/jhered/esx097
- Philippe Gaubert und Agostinho Antunes: What's behind these scales? Comments to “The complete mitochondrial genome of Temminck's ground pangolin (Smutsia temminckii; Smuts, 1832) and phylogenetic position of the Pholidota (Weber, 1904)”. Gene 563, 2015, S. 106–108
- Zelda du Toit, Morné du Plessis, Desiré L. Dalton, Raymond Jansen, J. Paul Grobler und Antoinette Kotzé: Mitochondrial genomes of African pangolins and insights into evolutionary patterns and phylogeny of the family Manidae. BMC Genomics 18, 2017, S. 746, doi:10.1186/s12864-017-4140-5
- Ved Prakash Kumar, Ankita Rajpoot, Anupam Srivastav, Parag Nigam, Vinay Kumar, Madhanraj A. und Surendra Prakash Goyal: Phylogenetic relationship and molecular dating of Indian pangolin (Manis crassicaudata) with other extant pangolin species based on complete cytochrome b mitochondrial gene. Mitochondrial DNA Part A, 2018, doi:10.1080/24701394.2018.1445241
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 69, 75 und 190–192)
- Duane A. Schlitter: Pholidota. In: Don E. Wilson und D. M. Reeder (Hrsg.): Mammal Species of the World. 3. Auflage. Johns Hopkins University Press, Baltimore 2005, S. 530–531
- G. B. Corbet und J. E. Hill: A World List of Mammalian Species. 3. Auflage. Natural History Museum Publications/Oxford University Press, London/Oxford 1991
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 221–222)
- Claire E. Terhune, Timothy Gaudin, Sabrina Curran und Alexandru Petculescu: The youngest pangolin (Mammalia, Pholidota) from Europe. Journal of Vertebrate Paleontology, 2021, S. e1990075, doi:10.1080/02724634.2021.1990075
- Alexandre Hassanin, Jean-Pierre Hugot und Bettine Jansen van Vuuren: Comparison of mitochondrial genome sequences of pangolins (Mammalia, Pholidota). Comptes Rendus Biologies 338, 2015, S. 260–265
- Philippe Gaubert, Flobert Njiokou, Gabriel Ngua, Komlan Afiademanyo, Sylvain Dufour, Jean Malekani, Sery Gonedelé Bi, Christelle Tougard, Ayodeji Olayemi, Emmanuel Damquah, Chabi A. M. S. Djagoun, Prince Kaleme, Casimir Nebesse Mololo, William Stanley, Shu-Jin Luo und Agostinho Antunes: Phylogeography of the heavily poached African common pangolin (Pholidota, Manis tricuspis) reveals six cryptic lineages as traceable signatures of Pleistocene diversification. Molecular Ecology 25, 2016, S. 5975–5993
- Simone Hoffmann und Thomas Martin: Revised Phylogeny of Pholidota: Implications for Ferae. Journal of Vertebrate Paleontology 31 (Suppl.), 2011, S. 126A–127A
- Timothy J. Gaudin, Robert J. Emry und Jeremy Morris: Skeletal Anatomy of the North American Pangolin Patriomanis americana (Mammalia, Pholidota) from the Latest Eocene of Wyoming (USA). Smithsonian Contributions to Paleobiology 98, 2016, S. 1–102
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (S. 305) ()
- John Edward Gray: An outline of an attempt at the disposition of Mammalia into tribes and families, with a list of the genera apparently appertaining to each tribe. Annals of Philosophy NS 10, 1825, S. 337–344 (S. 343) ()
- Oldfield Thomas: The mammals of the tenth edition of Linnaeus; an attempt to fix the types of the genera and the exact bases and localities of the species. Proceedings of the Zoological Society of London 1911, S. 120–158
- Étienne Geoffroy Saint-Hilaire und Georges Cuvier: Memoire sur une nouvelle division des Mammiferes, et sur les principes qui doivent servir de base dans cette sorte de travail. Magasin Encyclopedique 2, 1795, S. 164–190 (S. 178–179, 188) ()
- Georges Cuvier: Tableau elementaire de l'histoire naturelle des animaux. Paris, Baudouin, 1798, S. 1–710 (S. 142–146) ()
- Thomas Henry Huxley: A manual of the anatomy of vertebrated animals. Appleton, New York, 1872, S. 1–431 (S. 288) ()
- Max Wilhelm Carl Weber: Die Säugetiere. Einführung in die Anatomie und Systematik der recenten und fossilen Mammalia. Jena, 1904, S. 1–866 (S. 420–430) ()
- Edward Drinker Cope: The Edentata of North America. The American Naturalist 23, 1889, S. 657–664 ()
- Michael J. Novacek, A. R. Wyss und Malcolm C. McKenna: The major groups of eutherian mammals. In: M. J. Benton (Hrsg.): Phylogeny of the tetrapods. Oxford Univ. Press, 1988, Bd. 2, S. 31–71
- Frédéric Delsuc und Emmanuel J. P. Douzery: Recent advances and future prospects in xenarthran molecular phylogenetics. In: Sergio F. Vizcaíno und W. J. Loughry: The Biology of the Xenarthra. University Press of Florida, 2008, S. 11–23
- Jeheskel Shoshani: Mammalian Phylogeny: Comparison of Morphological and Molecular Results. Molecular Biology and Evolution 3 (3), 1986, S. 222–242
- Jeheskel Shoshani und Malcolm C. McKenna: Higher Taxonomic Relationships among Extant Mammals Based on Morphology, with Selected Comparisons of Results from Molecular Data. Molecular Phylogenetics and Evolution 9 (3), 1998, S. 572–584
- Ulfur Arnason, Joseph A. Adegoke, Kristina Bodin, Erik W. Born, Yuzine B. Esa, Anette Gullberg, Maria Nilsson, Roger V. Short, Xiufeng Xu und Axel Janke: Mammalian mitogenomic relationships and the root of the eutherian tree. PNAS 99 (12), 2002, S. 8151–8156
- Frédéric Delsuc, Mark Scally, Ole Madsen, Michael J. Stanhope, Wilfried W. de Jong, François M. Catzeflis, Mark S. Springer und Emmanuel J. P. Douzery: Molecular Phylogeny of Living Xenarthrans and the Impact of Character and Taxon Sampling on the Placental Tree Rooting. Molecular Biology and Evolution 19 (10), 2002, S. 1656–1671
- Kenneth D. Rose und Robert J. Emry: Relationships of Xenarthra, Pholidota, and fossil „edentates“: the morphological evidence. In: F. S. Szalay, Michael J. Novacek und Malcolm C. McKenna (Hrsg.): Mammal Phylogeny. Bd. 2. Placentals. Springer Verlag, New York 1993, S. 81–102
- Gerhard Storch: Eomanis waldi, ein Schuppentier aus dem Mittel-Eozän der „Grube Messel“ bei Darmstadt (Mammalia: Pholidota). Senckenbergiana lethaea 59 (4/6), 1978, S. 503–529
- Gerhard Storch: Eurotamandua joresi, ein Myrmecophagide aus dem Eozän der „Grube Messel“ bei Darmstadt (Mammalia, Xenarthra). Senckenbergiana lethaea 61 (3/6), 1981, S. 247–289
- Timothy J. Gaudin, Robert J. Emry und Brandon Pogue: A new genus and species of pangolin (Mammalia, Pholidota) from the Late Eocene of Inner Mongolia, China. Journal of Vertebrate Paleontology 26 (1), 2006, S. 146–159
- Wighart von Koenigswald und Thomas Martin: Ein Skelett von Necromanis franconica, einem Schuppentier (Pholidota, Mammalia) aus dem Aquitan von Saulcet im Allier-Becken (Frankreich). Eclogae Geologicae Helvetiae 83 (3), 1990, S. 845–864
- Simone Hoffmann, Thomas Martin, Gerhard Storch und Michael Rummel: Skeletal Reconstruction of a Miocene Pangolin from Southern Germany. Journal of Vertebrate Paleontology 29 (Suppl.), 2009, S. 115A–116A
- David M. Alba, Ashley S. Hammond, Víctor Vinuesa und Isaac Casanovas-Vilar: First Record of a Miocene Pangolin (Pholidota, Manoidea) from the Iberian Peninsula. Journal of Vertebrate Paleontology 38 (1), 2018, S. e1424716, doi:10.1080/02724634.2017.1424716
- Daniel L. Gebo und D. Tab Rasmussen: The Earliest Fossil Pangolin (Pholidota: Manidae) from Africa. Journal of Mammalogy 66 (3), 1985, S. 538–541
- Th. Kormos: Manis hungarica n. sp., das erste Schuppentier aus dem europäischen Oberpliozän. Folia Zoologica et Hydrobiologica 6, 1934, S. 87–94
- Jan Wagner, Stanislac Čermák und Ivan Horáček: The presence of Ursus ex gr. Minimus-thibetanus in the Late Villányian and ist position among the Pliocene and Pleistocene black bears in Europe. Quaternaire, Hors-série 4, 2011, S. 39–58
- Constantin Radulescu und Petre-Mihai Samson: The Plio-Pleistocene mammalian succession of the Oltet Valley, Dacic Basin, Romania. Quartärpaläontologie 8, 1990, S. 225–232
- Constantin Radulescu, Petre-Mihai Samson, Alexandru Petculescu und Emanoil Stiucã: Pliocene large mammals of Romania. Coloquios de Paleontologia, volume extra 1, 2003, S. 549–558
- Fachroel Aziz und John de Vos: The fossil faunas from the Citarum Area, West Java, Indonesia. Deinsea 7, 1999, S. 21–32
- Dirk Albert Hooijer: Some Paleontological Results from Excavations at Niah Caves, Sarawak. Borneo Research Bulletin 8 (2), 1976, S. 73–77
- Tom Harrisson, Dirk Albert Hooijer und Lord Medway: An extinct giant pangolin and associated mammals from Niah cave, Sarawak. Nature 189, 1961, S. 166
- Richard G. Klein: The Late Quaternary Mammalian Fauna of Nelson Bay Cave (Cape Province, South Africa): Its Implications for Megafaunal Extinctions and Environmental and Cultural Change. Quaternary Research 2, 1972, S. 135–142
- Durojaye A. Soewu und Ibukun A Ayodele: Utilisation of Pangolin (Manis sps) in traditional Yorubic medicine in Ijebu province, Ogun State, Nigeria. Journal of Ethnobiology and Ethnomedicine 5, 2009, S. 39 ()
- Durojaye A. Soewu und Temilolu A Adekanola: Traditional-Medical Knowledge and Perception of Pangolins (Manis sps) among the Awori People, Southwestern Nigeria. Journal of Ethnobiology and Ethnomedicine 7, 2011, S. 25 ()
- ohne Autor: Chinese Medicine and the Pangolin. Nature 141, 1938, S. 72 ()
- IUCN SSC Pangolin Specialist Group: Scaling up pangolin conservation. IUCN SSC Pangolin Specialist Group Conservation Action Plan. Juli 2014 ()
- CITES: Implementation of CITES Decisions 17.239 b) and 17.240 on Pangolins (Manis spp.)
- WWF: Amoured but endangered. Artikel des WWF vom 16. September 2004 ()
- Traffic: 23 tonnes of pangolins seized in a week. Traffic-Bericht vom 17. März 2008 ()
- Daniel W.S. Challender: Asian Pangolins: Increasing affluence driving hunting pressure. Traffic 23 (3), 2011, S. 92–93 ()
- IUCN: Eating pangolins to extinction. IUCN-Bericht vom 29. Juli 2014 ()
- Anonym: China confiscates 12 tonnes of endangered pangolin scales. South China Morning Post vom 30. November 2017 (), zuletzt abgerufen am 2. Februar 2018
- Hung Chen-hung und Jake Chung: Thousands of disemboweled pangolins found. Taipei Times vom 2. Februar 2018 (), zuletzt abgerufen am 7. Februar 2018
- IUCN: What does the new trade ban mean for pangolin conservation? (, zuletzt abgerufen am 28. Dezember 2017
- Ci Wen Yang, Suming Chen, Chi-Yen Chang, Mei Fong Lin, Erik Block, Ronald Lorentsen, Jason S. C. Chin und Ellen S. Dierenfeld: History and Dietary Husbandry of Pangolins in Captivity. Zoo Biology 26, 2007, S. 223–230
- Gefährdungsgrad der einzelnen Arten in der Roten Liste gefährdeter Arten der IUCN.
- Tao Zhang, Qunfu Wu und Zhigang Zhang: Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak. Current Biology 30, 2020, S. 1346–1351, doi:10.1016/j.cub.2020.03.022