Faultiere
Die Faultiere (Folivora, auch Tardigrada oder Phyllophaga) bilden eine Unterordnung der zahnarmen Säugetiere (Pilosa) und sind mit den Ameisenbären und den Gürteltieren verwandt (Nebengelenktiere). Die drei verfügbaren wissenschaftlichen Bezeichnungen finden in Fachveröffentlichungen rege Verwendung, die beiden letztgenannten sind aber auch durch andere Tiergruppen belegt. Es bestehen sechs rezente Arten, die sich auf die beiden Gattungen der Zweifinger-Faultiere (Choloepus) und der Dreifinger-Faultiere (Bradypus) verteilen. Bei diesen heute lebenden Arten handelt es sich um eher kleine Tiere der Unterordnung, die durchschnittlich 50 cm lang und etwa 5 kg schwer werden. Sie bewohnen zumeist tropische Regenwälder in Süd- und Mittelamerika, wo sie sich bevorzugt in den Baumkronen aufhalten und sich von blatthaltiger Pflanzenkost ernähren. Bekannt sind die Faultiere vor allem durch ihre – mit dem Rücken nach unten – im Geäst hängende Lebensweise, ihre sehr langsamen Bewegungen und die langen Ruhephasen. Die beiden letztgenannten Eigenschaften werden durch einen extrem niedrigen Stoffwechsel hervorgerufen, der aus der energiearmen Blattnahrung resultiert.
| Faultiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Hoffmann-Zweifingerfaultier (Choloepus hoffmanni), ein Vertreter der Zweifinger-Faultiere | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Folivora | ||||||||||||
| Delsuc, Catzeflis, Stanhope & Douzery, 2001 |
Neben den beiden heute existierenden Gattungen sind – einschließlich ausgestorbener Arten – noch wenigstens 90 weitere bekannt, womit die Faultiere eine der formenreichsten Gruppen der Nebengelenktiere darstellen. Diese Gattungen umfassten häufig weitaus größere als die heute lebenden Vertreter, darunter auch Riesenfaultiere von 4 bis 6 t Körpergewicht. Ein überwiegender Teil der ausgestorbenen Faultiere lebte weitgehend am Boden – allerdings nutzten sie recht vielfältige Lebensräume, neben Wäldern etwa offene Landschaften bis hin zu wüstenartigen Gebieten, hohen Gebirgslagen und Küstengebieten. Auch die Ernährung war deutlich variantenreicher. Der Ursprung der Faultiere reicht bis in das Oligozän vor über 30 Millionen Jahren zurück. Im Übergang vom Pleistozän zum Holozän vor rund 10.000 Jahren starben die meisten der großen Faultierarten aber aus.
Die Erforschung der Faultiere begann bereits im ausgehenden 18. Jahrhundert. In dieser Zeit wurden die ersten rezenten Arten beschrieben und nur wenige Jahre später auch die ersten fossilen Vertreter nachgewiesen. Eine erste Hochphase der Forschung fand in der ersten Hälfte des 19. Jahrhunderts statt, als Charles Darwin auf seiner Reise nach Südamerika zahlreiche Fossilfunde entdeckte. Dabei etablierte sich auch die Vorstellung, dass die baumbewohnenden heutigen Faultiere näher miteinander verwandt seien und den bodenbewohnenden gegenüberstünden. Erst in der zweiten Hälfte des 20. Jahrhunderts konnte dies – anfangs durch anatomische Untersuchungen, später auch durch molekulargenetische Analysen – widerlegt werden. Demnach gehören die Dreifinger-Faultiere in die monotypische Familie der Bradypodidae, die Zweifinger-Faultiere dagegen in die ebenfalls monotypische Familie der Choloepodidae. Daher sind die Anpassungen der heutigen Faultiere an die Lebensweise in den Bäumen als konvergente Entwicklung anzusehen.
Körperbau
Allgemeines Aussehen und Größe

Die heutigen baumbewohnenden Faultiere erreichen eine Gesamtlänge von 42 bis 80 cm und werden zwischen 2 und 11 kg schwer. Der Kopf ist sehr kurz, das Gesicht eher rund. Die kleinen Augen liegen weit auseinander, schauen aber nach vorn, die runde Nase ist deutlich abgeflacht, die Ohren sind klein und im Fell verborgen. Der Schwanz besteht nur als stummelartiges Rudiment. Typischerweise sind die Gliedmaßen sehr lang, die vorderen länger als die hinteren, was besonders deutlich bei den Dreifinger-Faultieren ausgeprägt ist. Die beiden heutigen Gattungen unterscheiden sich durch die Anzahl der sichtbaren Finger. An den Hinterbeinen haben beide Gruppen jeweils drei Zehen. Die Finger und Zehen tragen große, sichelförmig gebogene Klauen und sind etwa gleich lang.[1][2]
Die ausgestorbenen Faultiere wichen in ihrem Aussehen teilweise von den heute lebenden Vertretern ab und übertrafen diese in ihren Körpermaßen – abgesehen von einigen sehr kleinen Vertretern – teilweise erheblich. Vor allem die Formen aus dem Pleistozän erreichten dabei extreme Maße. So wies Scelidotherium eine Länge von 2,7 m auf bei einem Gewicht von rund 800 kg. Glossotherium wurde 3,25 m lang und gut 1,5 t schwer.[3] Die Angehörigen der größten bekannten Gattungen, Megatherium und Eremotherium, erreichten aber eine Gesamtlänge von bis zu 6 m und ein Gewicht von schätzungsweise 4 bis 6 t, womit sie neben den aus Eurasien eingewanderten Rüsseltieren die größten landlebenden Säugetiere jener Zeit in Amerika darstellten.[4][5] Diese zumeist bodenbewohnenden Faultiere wiesen wie zahlreiche ihrer stammesgeschichtlichen Vorgänger kurze und kräftige Gliedmaßen auf und verfügten zudem über einen längeren Schwanz.[6]
Schädel- und Gebissmerkmale
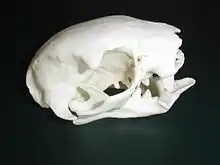
Die Schädel der heutigen Zwei- und Dreifinger-Faultiere sind durchschnittlich 10,8 beziehungsweise 6,7 cm lang und allgemein deutlich gerundet und kurz. Die größten Schädel innerhalb der Faultiere besaßen Eremotherium und Megatherium mit Maßen zwischen 65 und 86 cm. Allgemein weisen die Faultiere eine recht vielfältige Schädelgestaltung auf. So kamen Formen mit langschmalen Schädeln wie Nothrotherium und Scelidotherium oder mit kurzen und breiten Schnauzen, etwa Lestodon vor. Generelle Merkmale der Faultiere sind ein stark reduzierter Mittelkieferknochen und ein verlängerter Oberkiefer.[7] Zu den auffälligsten Eigenschaften der Schädel gehört weiterhin der nicht vollständig ausgebildete Jochbogen, ein Charakteristikum, das ebenfalls bei den Ameisenbären auftritt. Teilweise verleitete dieses Merkmal, das auch bei den nicht näher verwandten Schuppentieren nachgewiesen ist, dazu, auf eine eher insektenfressende Ernährungsweise der frühesten Faultiervertreter zu schließen, doch sind alle bisher aufgefundenen Fossilformen als Pflanzenfresser identifiziert. Nur einige der größten Vertreter der Faultiere wie Megatherium, Megalonyx und Paramylodon besaßen sekundär wieder voll ausgeprägte Jochbögen. Des Weiteren tritt am vorderen Bogenansatz am Jochbein ein stark nach unten verlängerter, seitlich abgeflachter Knochenauswuchs auf. Dieser dient dem Musculus masseter der Kaumuskulatur als Ansatzstelle und ermöglicht ausgeprägte vor- und rückwärts gerichtete Kaubewegungen. Ein ähnlicher Knochenauswuchs ist bei den Glyptodontidae, Verwandten der Gürteltiere, zu finden, doch weist dieser dort einen unterschiedlichen Aufbau auf und führt auch zu einem abweichenden Ansetzen der Kaumuskulatur, so dass beide Knochenauswüchse wohl unabhängig entstanden sind. Ebenfalls typisch ist das Vorkommen einer Septomaxilla (Os nariale) im vorderen Nasenhöhlenbereich. Diese Verknöcherung tritt sonst weitgehend nur bei Kloakentieren und älteren mesozoischen Säugetieren auf.[8][9]
.jpg.webp)
Besonderheiten sind auch im Gebissaufbau vorhanden, welcher von dem der Höheren Säugetiere abweicht. Bei den meisten Faultieren fehlen die vorderen Zähne, also die Schneidezähne. In der Regel sind je Kieferbogen im Oberkiefer fünf, im Unterkiefer vier Zähne ausgebildet, insgesamt also 18. Nur wenige Linien wie etwa die entwickelten Nothrotheriidae haben den jeweils vordersten Zahn reduziert. In der Regel lassen sich bei den Faultieren zwei Zahntypen unterscheiden: Die hinteren Zähne sind homodont, so dass im ausgebildeten Zustand nicht zwischen Prämolaren und Molaren unterschieden werden kann, sie werden zumeist als molariform bezeichnet. Der jeweils vorderste Zahn ist bei den Bradypodidae, also den Dreifinger-Faultieren, klein und meißelartig gestaltet (sogenannter anterior chisel-shaped tooth oder „vorderer meißelartiger Zahn“). Die Megalonychidae wie auch die Zweifinger-Faultiere sowie die Mylodontidae haben diesen in einen eckzahnartigen umgestaltet, der daher die Bezeichnung caniniform trägt; er übertrifft die anderen Zähne deutlich an Höhe. Im geschlossenen Gebiss stehen die oberen und unteren caniniformen Zähne genau umgekehrt im Vergleich zu den anderen Höheren Säugetieren, das heißt, der untere ruht hinter dem oberen und nicht wie sonst umgekehrt üblich. Daher wurde vermutet, dass der jeweils vorderste Zahn dem eigentlichen Eckzahn nicht homolog entspricht.[7] Eine Ausnahme zeigen die Megatheriidae, bei denen alle Zähne gleich gestaltet sind. Untersuchungen zur Zahnbildung im Embryonalstadium gaben Aufschluss über die genauere Gebissstruktur der Faultiere. Sofern die Mineralisationsfolge der Zähne der Faultiere mit der der sonstigen Höheren Säugetiere übereinstimmt, bildet der jeweils hinterste Zahn den ersten Molaren, die drei davor liegenden Zähne stimmen demzufolge mit den Prämolaren überein. Im Unterkiefer schließen die Prämolaren auch den vordersten caniniformen (Choloepus) oder meißelförmigen (Bradypus) Zahn mit ein. Der jeweils vorderste Zahn im Oberkiefer wäre gemäß der Abfolge der Zahnanlage identisch mit dem Eckzahn. Im Embryonalzustand formen sich auch Schneidezähne heraus, die aber anschließend wieder sehr schnell absorbiert werden.[10] Ein zusätzliches Charakteristikum der Zähne der Faultiere stellt das Fehlen des Zahnschmelzes dar: die Zähne bestehen hauptsächlich aus verschiedenen Lagen von Zahnbein, darunter das besonders harte Orthodentin.[11] Außerdem weisen die Kauflächen der hinteren Zähne nicht das für Säugetiere charakteristische Muster aus verschiedenen Höckerchen und Leisten auf – allerdings sind zwei querstehende Leisten (Lophen) ausgebildet, die das Zerquetschen der Nahrung ermöglichen. Eine weitere Besonderheit besteht darin, dass kein Zahnwechsel vom Milch- zum Dauergebiss erfolgt. Vielmehr wachsen die Zähne das gesamte Leben lang, wobei junge Zähne zuerst rund sind und später ihre eher eckige Form erhalten. Möglicherweise findet aber ein Wechsel des oberen caniniformen Zahns bei den Zweifinger-Faultieren in einem sehr frühen Stadium der Individualentwicklung statt.[10][9][12]
Skelettmerkmale

Bedeutende Skelettmerkmale bestehen vor allem im Bereich der Wirbelsäule. Der Hals umfasst bei den Dreifinger-Faultieren acht bis zehn Wirbel, wodurch die Tiere über einen sehr beweglichen Kopf verfügen. Bei den Zweifinger-Faultieren sind dagegen nur fünf bis sieben Halswirbel ausgebildet, ihr Hals ist also deutlich kürzer. Es wird angenommen, dass die nach den sieben Halswirbeln folgenden eins bis drei bei den Dreifinger-Faultieren vorverlagerte rippenlose Brustwirbel darstellen, bei den Zweifinger-Faultieren aber die vordersten zwei Brustwirbel rippentragende Halswirbel repräsentieren.[13][14] Bei allen fossilen Faultieren, von denen die Halswirbelsäule bekannt ist, wurden bisher ausschließlich sieben Wirbel nachgewiesen. Die Anzahl der Brustwirbel variiert in den einzelnen Faultiergattungen und liegt bei den Dreifinger-Faultieren bei 16, bei den Zweifinger-Faultieren bei 24 und beim ausgestorbenen Hapalops bei 22. Sehr stark reduziert ist die Lendenwirbelsäule, die bei allen bekannten Gattungen drei Wirbel einnimmt. Vor allem an den Lendenwirbeln und den hinteren Brustwirbeln treten zusätzliche Gelenkflächen auf, die sich an den seitlichen Gelenkfortsätzen befinden und xenarthrische Gelenke (Nebengelenke oder Xenarthrale) genannt werden. Diese verbinden die vorhergehenden mit den nachfolgenden Gelenkfortsätzen und stabilisieren den Rücken so zusätzlich.[15] Bei den heutigen Faultieren ist nur ein kurzer, stummelartiger Schwanz, bestehend aus 4 bis 5 Wirbeln, ausgebildet; ausgestorbene besaßen aber teilweise recht lange Schwänze mit deutlich mehr Schwanzwirbeln.[9]

Einzelne Besonderheiten finden sich auch am Bewegungsapparat. Als besondere Anpassung an ihre Lebensweise besitzen die rezenten Faultiere extrem lange und schlanke Gliedmaßen, wobei die vorderen der Dreifinger-Faultiere etwa anderthalb mal so lang sind wie die hinteren; bei den Zweifinger-Faultieren ist das Verhältnis wesentlich ausgewogener.[1][2] Die fossilen Faultiere wiesen häufig kürzere und robustere Beine auf. Vor allem bei den bodenbewohnenden Faultieren waren die Vorderbeine meist kürzer als die Hinterbeine.[6] Typisch für alle Faultiere ist das Auftreten eines Dritten Trochanter als Muskelansatzstelle am Schaft des Oberschenkelknochens, der weniger stark ausgeprägt ist als bei den verwandten Gürteltieren und dessen Lage sehr variiert. Schien- und Wadenbein sind nicht miteinander verwachsen, eine Ausnahme stellen hier die großen Megatheriidae dar. Die Dreifinger-Faultiere haben an den Vorderfüßen drei (Strahlen II bis IV), die Zweifinger-Faultiere zwei krallenbewehrte Strahlen (Strahlen II und III), die meist die gleiche Länge haben. An den Hinterfüßen kommen jeweils drei Strahlen vor.[16] Die weiteren Zehenstrahlen sind in ihrer Länge reduziert und funktionslos. Die Anzahl der krallenführenden Strahlen bei den bodenlebenden ausgestorbenen Faultieren schwankt. Bedeutend ist hier aber die Konstruktion des Hinterfußes. Einige Vertreter setzten mit dem ganzen Fuß auf und verfügten so über eine plantigrade Fortbewegung (Sohlengänger). Bei anderen wiederum war der Hinterfuß seitlich verdreht, so dass diese mit dem fünften (äußeren) Strahl und dem Fersenbein auftraten (pedolateral), eine Bewegungsform, die sich mehrfach unabhängig in den einzelnen Faultierlinien entwickelte.[9][17]
Fell

Im Fell der Dreifinger-Faultiere können zwei Schichten deutlich unterschieden werden: Das kurze und sehr dichte Unterfell und das lange und strohige Deckhaar. Die Zweifinger-Faultiere weisen dagegen nur das Deckhaar auf. Ein besonderes Kennzeichen der Haare der Faultiere stellt das Fehlen des Markkanals (Medulla) dar. Der Haarstrich verläuft vom Bauch zum Rücken und damit entgegengesetzt zu dem anderer Säugetiere. Dadurch kann das Regenwasser besser ablaufen, was eine evolutionäre Anpassung an die überwiegend hängende Lebensweise im Geäst der Bäume darstellt. Des Weiteren besitzen die Haare der Zweifinger-Faultiere an der Außenfläche 3 bis 9 Längsrippeln und -rillen, die über die gesamte Länge verlaufen. Dies ist einmalig unter Säugetieren. Bei den Dreifinger-Faultieren kommt dies nicht vor; deren Haare weisen unter der Cuticula kleine Lufträume auf. Als Schutz hat sich bei Faultieren eine ungewöhnliche Tarnung entwickelt: In den Haaren siedeln Algen, die den Tieren zwischen den Blättern als grün-changierende Färbung zugutekommen – ein Effekt, der vor allem in der Regenzeit deutlich zu Tage tritt.[18][19][20]
Durch fossilisierte Funde des Weichteilgewebes in einigen Höhlen Nord- und Südamerikas ist eine Fellbedeckung auch bei ausgestorbenen Formen nachgewiesen, so bei Mylodon, Megalonyx und Nothrotheriops. Die überlieferten Haare sind meist lang und zottelig, zudem heller oder dunkler braun gefärbt. Es ist anzunehmen, dass zahlreiche fossile Faultiere somit ein Fell besaßen.[21] Diskutiert wird, ob die in den tropischen Regionen verbreiteten, extrem großen Vertreter, etwa Megatherium und Eremotherium ebenfalls behaart waren. Hier sprechen die riesigen Körpergrößen und die damit verbundene und notwendige Thermoregulation dafür, dass wie bei anderen großen, heutigen Pflanzenfressern, so Elefanten, Nashörner und Flusspferde, keine sichtbare Fellbedeckung bestand, sondern die Haut mehr oder weniger nackt war.[22] Einige der großen Bodenfaultiere wie etwa Mylodon oder Glossotherium besaßen zusätzlich diskus- oder linsenförmige Knochenplättchen (Osteoderme), die in der Haut ausgebildet waren. Diese hatten mit 0,5 bis 3 cm Durchmesser eine geringe Größe und wiesen im Gegensatz zu ähnlichen Bildungen bei den Gürteltieren und Glyptodonten einen einfachen, kompakten Bau auf. Da sie in der Regel isoliert aufgefunden werden, waren sie höchstwahrscheinlich regellos in der Haut ausgebildet und nicht fest miteinander verwachsen wie bei den Panzern der heutigen Gürteltiere.[23]
Innere Organe
Im Gegensatz zu anderen auf Blattnahrung spezialisierten Säugetieren wird bei den Faultieren die Nahrung im vorderen Magen-Darm-Bereich verdaut. Der Magen besteht aus drei teilweise getrennten Kammern, die mit dem Magenpförtner verbunden sind. Im vollständig gefüllten Zustand erreicht er bis zu einem Drittel des gesamten Körpergewichts eines Tieres. Eine Besonderheit stellen die Lungen dar, die bei beiden Gattungen keine deutliche Trennung in einzelne Flügel erkennen lassen, was eventuell mit dem Bau des Brustkorbs zusammenhängt. Die Milz ist bei den Dreifinger-Faultieren irregulär-schlauchförmig gestaltet, bei den Zweifinger-Faultieren aber flach-dreieckig. Die Nieren liegen sehr tief in der Bauchhöhle, die anschließende Harnblase erreicht 12 cm Durchmesser und speichert bis zu 1 l Urin. Bei Jungtieren nimmt sie fast die Hälfte der Bauchfellhöhle ein. Eine Gallenblase besitzen nur die Zweifinger-Faultiere – bei diesen ist sie aber sehr klein, Dreifinger-Faultiere haben keine ausgebildet.[19] Im Gegensatz zu zahlreichen, nicht zu den Primaten zählenden Säugetieren ist die Gebärmutter einfach gestaltet, weicht dadurch aber markant von einigen Vertretern der Gürteltiere als nahe Verwandte innerhalb der Nebengelenktiere ab.[24]
Sinnesorgane
Allgemein orientieren sich die Faultiere über den Geruchs- und Tastsinn. Der Sehsinn der heutigen Faultiere ist aufgrund des fehlenden Musculus ciliaris, wodurch die Tiere kurzsichtig sind, unterentwickelt. Die stark konvex gekrümmte Hornhaut und die sehr dicke Augenlinse führen zu einer geringen Auflösung des Sichtfeldes. Allerdings ist die Sehfähigkeit der Jungtiere besser als die der Ausgewachsenen. Da bei den Zweifinger-Faultieren die Linse deutlich schmaler ist im Vergleich zum Durchmesser als bei den Dreifinger-Faultieren, ist diese auch weniger leistungsfähig.[19]
Auch das Gehör ist weniger gut entwickelt. Allerdings ist das Ohr der heutigen Faultiere auf einen eher niedrigen Frequenzbereich zwischen 0,3 und 30 kHz ausgelegt, was vor allem mit dem Aufbau der Hörschnecke zu begründen ist. Erwachsene Tiere werden überwiegend durch Laute von 2 bis 8 kHz aktiviert, was sich auch die Jungtiere zunutze machen, wenn sie von der Mutter getrennt werden. Die Ruflaute von jungen Zweifinger-Faultieren sind dabei durchschnittlich niedriger als die von jungen Dreifinger-Faultieren.[25] Da der akustische Sinn aber offensichtlich nur eine geringe Rolle spielt, sind nur wenige Ruflaute bei den Faultieren bekannt.[19] Anhand des Vergleichs des Innenohrs der rezenten Arten mit ausgestorbenen Formen konnte unter anderem für Glossotherium und Lestodon ein ähnlicher Frequenzbereich ermittelt werden, So lag die optimale Hörfrequenz zwischen 1,7 und 2,4 kHz, während die Obergrenze mit 15,3 bis 16,5 kHz erreicht war.[26][27]
Verbreitung
Die Faultiere sind hauptsächlich im zentralen und nördlichen Südamerika und in Teilen Mittelamerikas sowie auf einigen Inseln der Karibik verbreitet. Sie bewohnen tropische Regenwälder des Flachlands und Bergwälder, selten nutzen sie offenere Landschaften. Höheren Lagen über 2400 m werden nur gelegentlich aufgesucht. Beide heutigen Gattungen tolerieren keine kühleren Temperaturen. Aufgrund des fehlenden Unterfells sind die Zweifinger-Faultiere stärker für Kälte empfindlich und besitzen eine höhere Thermoneutralität (24 °C) als die Dreifinger-Faultiere (18 °C). Allerdings ist das Fell der Zweifinger-Faultiere in höheren Lagen deutlich dichter.[18][28]
Der Ursprung der Faultiere ist höchstwahrscheinlich in Südamerika zu suchen. Mittel- und Nordamerika wurden in mehreren Ausbreitungswellen erreicht. So sind bereits im beginnenden Oligozän vor rund 34 Millionen Jahren Faultiere erstmals auf den Karibischen Inseln nachgewiesen, im Oberen Miozän vor etwa 8 Millionen Jahren besiedelten sie Nordamerika. Die Einwanderung in beide Regionen erfolgte wohl über kleine Inseln. Mit der Schließung des Isthmus von Panama und der Entstehung einer Landbrücke zwischen Süd- und Nordamerika im Pliozän vor rund 4 Millionen Jahren und dem damit einsetzenden Großen Amerikanischen Faunenaustausch kam es zu einer weiteren Besiedlung Mittel- und Nordamerikas durch Faultiere. Im Pleistozän erreichten sie ihre größte Ausdehnung über beide Kontinente. So kam Mylodon fast bis an die Südspitze Südamerikas vor, während Megalonyx im Hohen Norden Nordamerikas in Alaska nachgewiesen ist. Die Faultiere nutzten im Laufe ihrer Stammesgeschichte eine Vielzahl an Lebensräumen. So waren sie wie heute in dichten Wäldern, aber auch in Savannen und Steppen bis hin zu Wüsten anzutreffen, ebenso wie in hohen Gebirgslagen und an der Meeresküste.[21][29]
Lebensweise
Allgemein und Fortbewegung

Die rezenten Zwei- und Dreifinger-Faultiere sind sowohl tag- als auch nachtaktiv und strikt einzelgängerisch sowie baumbewohnend (arboricol), wobei sie sich häufig in den Baumkronen aufhalten. In den Bäumen bewegen sie sich meist mit dem Rücken nach unten hängend vorwärts (suspensorische Fortbewegung). An diese Lebensweise sind die heutigen Faultiere unter anderem durch ihre langen Gliedmaßen und die gebogenen Klauen, die als Haken fungieren, angepasst, weiterhin durch stark bewegliche Gelenke an Armen und Beinen und einen kurzen und gerundeten Brustkorb mit einer hochflexiblen Schlüsselbein-Brustbein-Verbindung. Zudem erforderte die ungewöhnliche Körperhaltung und die baumkletternde Bewegungsweise eine Umstrukturierung der Muskeln, vor allem im Bereich der vorderen Gliedmaßen, die bei dieser Art der Fortbewegung den Antrieb geben.[30][16] Dadurch wird ein kraftsparendes Hängen und Hangeln ermöglicht. Die Bewegungen sind allgemein sehr langsam und die erreichten Geschwindigkeiten liegen bei wenigen Metern pro Minute. Innerhalb eines Tages legen die Tiere aber selten mehr als einige Dutzend bis hundert Meter zur Futtersuche zurück. Die Bäume werden nur äußerst selten verlassen. Am Boden bewegen sich die heutigen Faultiere eher unbeholfen fort und krabbeln dort mit den Unterarmen und Sohlen der Hinterbeine vorwärts. Jedoch sind sie sehr gute Schwimmer.[18][19][31]
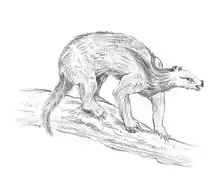
Die ausgestorbenen Faultiere insgesamt nutzten eine weit größere Vielfalt an Lebensräumen und verfügten über ein umfangreicheres Spektrum an Fortbewegungsarten. Einige der heute fossilen Formen waren ebenfalls baumbewohnend, was vor allem für einen Teil der Faultiere der Karibischen Inseln angenommen werden kann. Andere Vertreter wie Diabolotherium aus dem Pleistozän der peruanischen Anden entwickelten möglicherweise die Befähigung, in felsigen Gebirgsgebieten zu klettern, wobei hier ursprünglich auch eine baumbewohnende Lebensweise nicht ausgeschlossen wurde.[32][29] Zu den frühesten Vertretern mit einer baumkletternden Fortbewegung gehören etwa Hapalops und Schismotherium aus der Zeit des Unteren und Mittleren Miozän. Allerdings bestand ein großer Unterschied zu den heutigen Baumfaultieren. So besaßen diese fossilen Faultierformen eher kurze und kräftige Gliedmaßen, was eine Fortbewegung in den Bäumen eher nach Art der heutigen Ameisenbären oder Schuppentiere annehmen lässt, die aufrecht klettern. Zudem steht die sich aus dem robusten Knochenbau ergebende massige Muskulatur der Vorderbeine mit sehr breit ausgebildeten Vorderfüßen und einem stark ausgedehnten oberen Gelenk der Elle, das Olecranon, in Verbindung, wodurch eine grabende Lebensweise auch nicht ausgeschlossen ist.[33][34][35] Dies kann auch für einen Teil der Formen aus dem Pleistozän vermutet werden, die einen ähnlichen Bau der Vorderbeine und Vorderfüße zeigen, so Scelidotherium und Glossotherium. Funde von fossilen Grabbauten von 0,8 bis 1,8 m Weite und bis zu 40 m Länge in der Region um Mar del Plata im östlichen Argentinien werden als Hinterlassenschaften dieser Tiere gedeutet. Diese weisen auch noch in einigen Fällen Kratzspuren auf, deren Abstände mit denen der Krallen der Faultiere übereinstimmen. Mit einem Gewicht von 1,5 t wäre Glossotherium eines der größten bekannten grabenden Tiere überhaupt.[3][6][36]

Zahlreiche andere Faultiere waren aber reine Bodenbewohner und bewegten sich überwiegend vierfüßig fort. Dies gilt vor allem für die größten Vertreter wie Megatherium und Eremotherium, deren Vorderbein sich mit einem kürzeren und anders ausgerichteten Olecranon etwas von dem der grabenden Faultiere unterscheidet, so dass sie daraus folgernd nicht die nötige Kraft aufbringen konnten, um im Erdreich zu graben. Eine teilweise zweifüßige Fortbewegung wurde anhand von Ichnofossilien angenommen,[37] doch erscheint dies skelettmorphologisch eher unwahrscheinlich. Allerdings konnten sich die großen Bodenfaultiere auf die Hinterbeine aufrichten, wobei der kräftige Schwanz als Stütze diente, wie es heute noch bei den Gürteltieren und Ameisenbären der Fall ist. Ermöglicht wurde dies auch dadurch, dass der Hauptteil der Körperlast über den Hinterbeinen lag. In einer aufgerichteten Position konnten die großen Bodenfaultiere in den Kronen von Bäumen weiden oder mit den freien Vorderbeinen Äste heranziehen.[6] Eine besondere Fortbewegungsform hat sich bei Thalassocnus herausgebildet. Durch Skelettmodifikationen etwa am Schwanz und an den Hinterbeinen kann hier auf eine semi-aquatische Lebensweise geschlossen werden. Diese Faultiergattung bewohnte die Küstengebiete des Pazifiks vom heutigen Peru bis Chile.[38][39]
Ernährung und Stoffwechsel
.jpg.webp)
Die heutigen Faultiere ernähren sich fast ausschließlich von Laub (folivor), nur die Zweifinger-Faultiere fressen hin und wieder auch Früchte, Insekten und kleinere Wirbeltiere. Unter der Blattnahrung dominieren vor allem Bäume, seltener Lianen. Einzelne Individuen sind dabei auf bestimmte Baumarten spezialisiert, die heutigen Faultiere insgesamt fressen aber viele verschiedene Blattpflanzen.[31] Zur Nahrungsaufnahme haben sich bei den Faultieren spezielle Anpassungen herausgebildet, wie eine dicke, bewegliche Zunge und ebenfalls bewegliche Lippen zum Abzupfen der Blätter. Das große Zungenbein und die verknöcherten, angrenzenden Knorpel fungieren als Muskelansatzstellen für die Zunge und Kehle.[19]
Da Blätter eine faserige und nährstoffarme Kost sind, wird sie lange im Magen verdaut, was bis zu 150 Stunden dauern kann. Dementsprechend haben Faultiere für ihre Größe auch die niedrigsten Stoffwechselraten aller Säugetiere, die bei etwa 40 bis 45 % zu der vergleichbar großer Tiere liegt. Daher bewegen sich Faultiere langsam hangelnd durch das Geäst. Die Muskelkontraktion läuft etwa 3- bis 6-mal langsamer als bei einer Hauskatze ab. Die Tiere sind, abhängig von der Jahreszeit, bis zu 20 Stunden am Tag inaktiv, die sie schlafend oder ruhend verbringen. Nur etwa alle acht Tage werden Kot und Urin abgesetzt. Während Zweifinger-Faultiere ihre Exkremente teilweise einfach vom Baum fallen lassen, steigen Dreifinger-Faultiere zum Kotabsetzen regelmäßig auf den Boden herab. Abgesehen von etwaigen Baumwechseln, ist dies die einzige ebenerdig stattfindende Tätigkeit der Faultiere. Auch die Körpertemperatur ist, ungewöhnlich für Säugetiere, stärker variabel: In aktiven Phasen steigt sie an und liegt, abhängig von der Umgebung, bei 32,7 bis 35,5 °C, in der Nacht, bei kühleren Tageszeiten oder im Schlaf kann sie rapide absinken. Der niedrige Stoffwechsel wird teilweise mit der Minderung der Gefahr der Aufnahme giftiger Substanzen, die sich in den Blättern befinden, erklärt. Um wichtige Ergänzungsstoffe zu erhalten, die die Faultiere aus ihrer energiearmen Blätterkost nicht entnehmen können, hat sich eine besondere Symbiose mit einigen Motten aus der Gruppe der Chrysauginae entwickelt, die in ihrem Fell leben. Diese „Faultiermotten“ legen ihre Eier in die Exkremente der Faultiere, von denen sich die Larven ernähren, und suchen nach der Metamorphose einen neuen Faultierwirt.[18][19] Die Motten geben unter anderem Stickstoff- und Phosphorverbindungen in das Fell ab, wodurch wiederum das Wachstum der im Fell lebenden Algen gefördert wird. Da die Faultiere während der Fellpflege die Algen fressen, nehmen sie diese Verbindungen ebenfalls auf. Die höhere Konzentration von Algen im Fell verstärkt weiterhin den Tarneffekt der Tiere. Die Symbiose ist bei den Dreifinger-Faultieren stärker ausgebildet als bei den Zweifinger-Faultieren.[40]

Die Ernährungsweise der ausgestorbenen Faultiere ist recht gut untersucht, danach können diese ebenfalls als Pflanzenfresser angesehen werden. Zur Rekonstruktion des Ernährungsverhaltens werden verschiedene Methoden herangezogen. Anatomische Untersuchungen bei einigen baumbewohnenden Faultieren der Karibischen Inseln, etwa Neocnus, ergaben aufgrund eines ähnlich gebauten Kauapparates zu den heutigen Vertretern eine überwiegende blattfressende Ernährungsweise.[41] Bei den bodenbewohnenden Faultieren können anhand des Baus der Schnauze, vor allem der Symphyse des Unterkiefers, zwei Gruppen unterschieden werden. Formen mit einer schmalen Symphyse wie Megatherium besaßen eine entsprechend schmale Schnauze, wobei die Muskelansatzstellen der Gesichtsmuskulatur eine bewegliche, spitze Oberlippe annehmen lassen. Diese Tiere ernährten sich analog zu heutigen Pflanzenfressern mit ähnlich gestalteter Oberlippe von weicher Pflanzenkost wie Blätter. Vertreter mit breiter Symphyse verfügten über ein breites, mit wulstigen Lippen ausgestattetes Maul. Hierzu gehören unter anderem Lestodon und Glossotherium, die beide demnach Grasfresser waren, vergleichbar dem heutigen Breitmaulnashorn. Dazwischen liegen einige intermediäre Formen, so Mylodon oder Scelidotherium, bei denen eine Ernährung basierend auf gemischte Pflanzenkost angenommen wird.[42] Fossile Nahrungsreste liegen in Form von Koprolithen vor, die in einigen Höhlen in Nord- und Südamerika massenhaft auftreten. Für Megatherium konnte so eine auf Blätter basierende Ernährung nachgewiesen werden, mit Bevorzugung von Meerträubel-, Fabiana- oder Junellia-Gewächsen. Jene von Nothrotheriops lieferten Hinweise auf nicht weniger als 72 Pflanzengattungen, die häufig Xerophyten umfassen.[43] Mylodon wiederum ernährte sich vorwiegend grasfressend,[21] möglicherweise aber auch allesfressend.[44] Weitere Ergebnisse bei der Rekonstruktion der Ernährungsweise lieferten Isotopenanalysen, die für Lestodon und Glossotherium eine grasbasierende Nahrung in offenen Landschaften ergaben.[45] Insgesamt weisen die Ergebnisse der verschiedenen Analysemethoden auf eine vielfältige Ernährung der ausgestorbenen Faultiere hin.[29]
Ob die ausgestorbenen Faultiere einen ähnlich niedrigen Stoffwechsel wie die rezenten hatten, ist ungeklärt. Aminosäure-Untersuchungen an Knochen von Nothrotheriops ergaben eine durchschnittliche Körpertemperatur von 34,4 °C, was relativ gering für ein Tier von mehr als 250 kg Körpergewicht ist, weshalb dieses wohl empfindlich auf kühlere Temperaturen reagiert hat. Dem gegenüber wird angenommen, dass einige sehr große Bodenfaultiere, wie Mylodon, die während des Pleistozäns subarktische Regionen bewohnten, aufgrund ihrer extremen Körpermasse weniger kälteempfindlich waren.[21][18]
Fortpflanzung und Mortalität
Das Fortpflanzungsverhalten der heutigen Faultiere ist nur unzureichend erforscht. Weibchen erreichen nach drei bis vier Jahren die Geschlechtsreife, Männchen etwas später. Für die Zweifinger-Faultiere wird angenommen, dass sich Weibchen das ganze Jahr fortpflanzen können, bei den meisten Arten der Dreifinger-Faultiere besteht eine jahreszeitliche Abhängigkeit. Nach einer Trächtigkeit von 6 (Dreifinger-Faultiere) bis 11,5 (Zweifinger-Faultiere) Monaten wird ein einzelnes, 190 bis 450 g schweres Jungtier geboren. Die Geburt erfolgt ebenfalls in hängender Haltung, anschließend klammert sich das Jungtier auf der Bauchseite des Muttertiers fest, bis es selbstständig ist. Die Jungtiere beginnen nach einigen Wochen mit der Aufnahme fester Nahrung und werden nach einem bis zwei Monaten entwöhnt.[46][19] Die Lebenserwartung der Faultiere in der freien Wildbahn ist unbekannt, sie liegt aber wahrscheinlich vergleichbar hoch wie jene der Gürteltiere und Ameisenbären. Ein eingefangenes, reproduktionsfähiges Männchen war wenigstens 12 Jahre alt. In Gefangenschaft werden Faultiere teilweise über 30 bis hin zu 50 Jahre alt.[47][48] Zu den hauptsächlichen Fressfeinden gehören große Katzen, Greifvögel und Schlangen. Etwa die Hälfte aller erwachsenen Tiere wird beim Abstieg von den Bäumen von diesen Beutegreifern erlegt.[40]
Systematik
Äußere Systematik
Innere Systematik der Nebengelenktiere nach Gibb et al. 2015[49]
|
Die Faultiere (Folivora) bilden eine Unterordnung innerhalb der Ordnung der Zahnarmen (Pilosa). Dieser können weiterhin auch die Ameisenbären (Vermilingua) zugewiesen werden, beide stellen somit eine engere Verwandtschaftsgruppe dar. Die Zahnarmen wiederum sind ein Teil der Überordnung der Nebengelenktiere (Xenarthra), welche zusätzlich noch die Gepanzerten Nebengelenktiere (Cingulata) mit den heutigen Gürteltieren (Dasypoda) beinhalten. Die Nebengelenktiere stellen eine der vier Hauptlinien der Höheren Säugetiere dar, die den anderen drei (zusammengefasst als Epitheria) als Schwestergruppe gegenüberstehen.[50] Als gemeinsames Merkmal aller Nebengelenktiere können die namengebenden xenarthrischen Gelenke (Nebengelenke, auch Xenarthrale) an den Gelenkfortsätzen der hinteren Brust und der Lendenwirbel angesehen werden. Eine Ausnahme bilden hier nur die Glyptodontidae innerhalb der Cingulata, deren Lendenwirbel als einzigartiges Merkmal miteinander verwachsen sind. Ein weiteres, aber variierendes Merkmal stellt die unterschiedliche Ausprägung des Gebisses gegenüber den meisten anderen Höheren Säugetieren dar. Während Ameisenbären überhaupt keine Zähne besitzen, sind bei den Gepanzerten Nebengelenktieren und den Faultieren die vorderen nicht ausgebildet, während die hinteren einen homodonten Aufbau aufweisen und über keinen Zahnschmelz verfügen.[51] Die Nebengelenktiere galten schon sehr früh in der Forschungsgeschichte als eigenständige und natürliche Gruppe, die nur in Südamerika bis in einigen Teilen Nordamerikas vorkommt. Der Ursprung der Nebengelenktiere ist unbekannt, die ältesten Fossilfunde stammen aus dem Paläozän vor mehr als 56 Millionen Jahren aus Südamerika und repräsentieren Vertreter der Gürteltiere.[52] Mit Hilfe molekulargenetischer Untersuchungen konnte eine Abspaltung der Nebengelenktiere von den anderen Höheren Säugetieren bereits in der ausgehenden Unterkreide vor etwa 103 Millionen Jahren ermittelt werden. Die Gürteltiere trennten sich von der gemeinsamen Linie mit den Zahnarmen zu Beginn des Paläozän vor etwa 65 Millionen Jahren ab, die Aufspaltung der Ameisenbären und Faultiere erfolgte dann vor rund 58 Millionen Jahren.[53][54][49]
Innere Systematik
Innere Systematik der Faultiere nach Varela et al. 2019 (basierend auf skelettanatomischen Merkmalen)[55]
|
Heute existieren zwei Gattungen von Faultieren, die Zweifinger-Faultiere (Choloepus) mit zwei Arten und die Dreifinger-Faultiere (Bradypus) mit vier Arten. Einschließlich der ausgestorbenen Formen sind gegenwärtig wenigstens 400 Arten in über 90 gültig beschriebenen Gattungen bekannt, was die Faultiere neben den Gürteltieren und den Glyptodonten zu einer der formenreichsten Gruppen innerhalb der Nebengelenktiere macht.[56][29] Diese werden in der Regel in fünf bis zehn Familien eingegliedert, deren Vertreter vom Oligozän bis zum Pleistozän und darüber hinaus in Amerika präsent waren und die zusätzlich näher oder entfernter miteinander verbundene Verwandtschaftsverhältnisse bilden.[57]
Aus skelettanatomischen Gründen können mehrere große Linien differenziert werden. Eine bedeutende Gruppe stellt die Überfamilie der Megatherioidea dar. Diese vereinen die eigentlichen riesenhaften, bodenlebenden Faultiere. Als ein gemeinsames Merkmal kann die Struktur der hinteren Zähne angeführt werden, deren Kauflächen zwei querständige Schneidkanten aufweisen. In die Gruppe gehören die Megalonychidae, welche durch die Modifikation des jeweils vordersten Zahns charakterisiert werden, der eine eckzahn- (caniniform) oder schneidezahnähnliche (incisiform) Form aufweist und durch ein langes Diastema von den hinteren, molarenartigen Zähnen getrennt wird. Die Megalonychidae in der klassischen, auf Skelettmerkmalen beruhenden Sichtweise umfassen kleine und große Vertreter der Faultiere, darunter größere Bodenfaultiere des kontinentalamerikanischen Festlands, kleinere Vertreter der Westindischen Inseln sowie die Zweifinger-Faultiere (Choloepus), die als einzige Angehörigen dieser Familie keinen Fossilnachweis haben, während alle anderen nur fossil oder subfossil belegt sind. Aufgrund der durch die Skelettmerkmale belegten tiefen Einbettung der Zweifinger-Faultiere in eine Abstammungsgruppe aus ausgestorbenen karibischen Faultieren favorisierten zahlreiche Wissenschaftler eine Herleitung ersterer von letzteren.[55] Die Megatheriidae brachten die größten Faultiervertreter hervor, doch vor allem die frühesten Formen waren vergleichsweise klein. Sie zeichneten sich allgemein durch einförmige Zähne aus, da die jeweils vordersten Zähne nicht eckzahnförmig umgestaltet waren. Die dritte Familie stellen die Nothrotheriidae dar, deren Vertreter einen eher kleineren Körperbau hatten. Sie wiesen zudem markant lange und schmale Schädel auf mit jeweils eckzahnähnlichen vordersten Zähnen. Allerdings hatten spätere Formen diese reduziert, so dass je Kieferabschnitt nur vier Zähne im Ober- und drei im Unterkiefer bestanden. Einige Formen wie Schismotherium oder Pelecyodon aus dem Unteren Miozän können keiner genauen Familie zugewiesen werden und zählen teilweise zur Stammgruppe der Megatherioidea.[58] Auch jüngere Vertreter wie Hiskatherium und möglicherweise auch Diabolotherium sind derzeit nur als Mitglieder der Megatherioidea klassifiziert ohne genaue familiäre Zuweisung.[59] Als zweite große Formengruppe wird die Überfamilie der Mylodontoidea angesehen. Neben den Megatheriidae stellten die Mylodontidae die größten Faultierformen. Typisch für die entwickelten Vertreter waren als Anpassung an eine stärker grashaltige Nahrung hochkronige Zähne mit flacher Kaufläche. Die hinteren Zähne zeigten einen runden oder ovalen Querschnitt, die vordersten waren eckzahnartig gestaltet. Die Scelidotheriidae gelten manchmal auch nur als Unterfamilie der Mylodontidae. Neben einem ähnlichen Gebiss waren ihre Schädel durch ihre langgestreckte Form bestimmt.[21] In die nähere Verwandtschaft zu den Mylodonten sind auch die Orophodontidae einzuordnen, die jedoch einen bereits im Oligozän wieder erloschenen Seitenzweig darstellen. Nach einzelnen Auffassungen könnten diese aber auch näher mit den Megatherioidea verwandt sein.[57][60][55] Die letzte Gruppe umfasst die der Bradypodidae und ist monotypisch. Sie schließt die Dreifinger-Faultiere (Bradypus) ein, die zweite, rezente Gattung, welche wie die Zweifinger-Faultiere über keinen Fossilnachweis verfügt. Charakteristisch sind bei diesen der kurze, gerundete Schädel und ein meißelartiger vorderer Zahn.[7] Die Bradypodidae bilden das Schwestertaxon aller übrigen Faultierfamilien. Ein entscheidender Hinweis darauf ist die Gestaltung des Mittelohrs, wo bei den Dreifinger-Faultieren eine Paukenblase, bei den Zweifinger-Faultieren und den meisten Bodenfaultieren ein tympanischer Ring besteht.[11][57] Aus diesem Grund werden alle Faultierfamilien unter Ausschluss der Bradypodidae in der höheren Gruppe der Eufolivora zusammengefasst (die Bezeichnung „Eufolivora“ wurde im Jahr 2019 etabliert[55] und ersetzt den zuvor im Jahr 2004 von Timothy J. Gaudin geprägten Begriff „Eutardigrada“.[57]).
Innere Systematik der Faultiere nach Presslee et al. 2019 (basierend auf Proteinanalysen)[61]
Die Unterteilung der Megalocnoidea erfolgt nach Delsuc et al. 2019[62] |
Die anatomisch ermittelten Verwandtschaftsverhältnisse lassen sich auf molekulargenetischem und biochemischem Wege nicht bestätigen. Die Trennung der Drei- und Zweifinger-Faultiere fand nach genetischen Daten im Oligozän vor rund 30 Millionen Jahren statt, was unter anderem eine molekulargenetische Analyse aus dem Jahr 2015 ergab, in der alle rezenten Vertreter der Nebengelenktiere berücksichtigt waren.[49] Die genetischen Verwandtschaftsbeziehungen der heutigen baumlebenden Formen zu den ausgestorbenen großen Bodenfaultieren blieben lange Zeit ungeklärt. Bereits in der Wende vom 20. zum 21. Jahrhundert wurden DNA-Untersuchungen durchgeführt, in deren übereinstimmenden Ergebnissen die Dreifinger-Faultiere stärker mit den Nothrotheriidae, die Zweifinger-Faultiere dagegen mit den Mylodontidae clusterten.[63][64][65][66][67][68] Diesen Ergebnissen aber widersprachen Kollagenuntersuchungen aus dem Jahr 2015 mit Einbeziehung der heutigen Faultiere und einiger Bodenfaultiere. Als Resultat dieser standen die heutigen Baumfaultiere deutlich näher zueinander als zu den Bodenfaultieren.[69] Problematisch bei diesen Arbeiten war, dass zu wenige fossile Arten analysiert wurden und die ermittelten Daten so uneindeutig blieben. Zwei im Jahr 2019 veröffentlichte umfangreiche Untersuchungen zur Molekulargenetik und zur Proteinstruktur ergaben durch Berücksichtigung von Vertretern fast aller fossilen Familien ein schlüssigeres Bild. Demnach lassen sich innerhalb der Faultiere drei Großgruppen unterscheiden. Eine stellen die Megatherioidea mit den Megatheriidae, den Nothrotheriidae und den Megalonychidae dar, wobei sich letztere auf die großen Bodenfaultiere Nord- und Südamerikas reduzieren. Zuzüglich stehen in dieser Gruppe die Dreifinger-Faultiere. Die zweite große Gruppe wird durch die Mylodontoidea repräsentiert, in denen die Mylodontidae, die Scelidotheriidae und die Zweifinger-Faultiere stehen. Als dritte große Linie formen die Faultiere der Westindischen Inseln die Megalocnoidea mit den Familien der Parocnidae und der Acratocnidae. Die Diversifizierung der Faultiere begann schon sehr früh. Die karibischen Faultiere hatten sich bereits im Übergang vom Eozän zum Oligozän vor rund 35 Millionen Jahren losgelöst, die Megatherioidea und Mylodontoidea folgten wenig später. Wenigstens vor 28 Millionen Jahren hatten sich die meisten der bekannten Familien herausdifferenziert.[70][62][61]
Überblick über die rezenten und fossilen Familien der Faultiere
Zu den Faultieren werden folgende Familien gezählt:[21][11]
- Unterordnung Folivora Delsuc, Catzeflis, Stanhope & Douzery, 2001
- Überfamilie Megalocnoidea Kraglievich, 1923
- Familie Acratocnidae Varona, 1974
- Familie Parocnidae Delsuc, Kuch, Gibb, Karpinski, Hackenberger, Szpak, Martínez, Mead, McDonald, MacPhee, Billet, Hautier & Poinar, 2019
- Überfamilie Mylodontoidea Gill, 1872
- Familie Mylodontidae Gill, 1872
- ? Familie Orophodontidae Ameghino, 1895
- Familie Scelidotheriidae Ameghino, 1889
- Familie Choloepodidae Gray, 1871
- Überfamilie Megatherioidea Gray, 1892
- Familie Megatheriidae Gray, 1821
- Familie Megalonychidae Gervais, 1855
- Familie Nothrotheriidae Gaudin, 1994
- Familie Bradypodidae Gray, 1821
In einigen Systematiken sind die Scelidotheriidae und die Orophodontidae als Unterfamilien in die Mylodontidae eingeordnet.[55]
Stammesgeschichte
Ursprünge und Entwicklung
Fossile Überreste von Faultieren sind allgemein recht häufig, konzentrieren sich aber hauptsächlich auf drei zeitliche Epochen, einerseits den Übergang vom Unteren zum Mittleren Miozän vor 18 bis 16 Millionen Jahren (lokalstratigraphisch Santacruzium genannt), andererseits der Übergang vom Oberen Miozän zum Pliozän (lokalstratigraphisch Huayquerium genannt) vor etwa 6 bis 5 Millionen Jahren und das ausgehende Pleistozän (lokalstratigraphisch Lujanium genannt) vor 13.000 bis 8.500 Jahren. Eine höhere Anzahl an Funden ist bereits aus dem Mittleren Oligozän (lokalstratigraphisch Deseadum genannt) vor etwa 29 bis 26 Millionen Jahren überliefert, doch betrifft dies weitgehend nur die Vertreter der Mylodonten. Teilweise werden diese zeitlich begrenzten Fossilkonzentrationen mit Überlieferungslücken der jeweils folgenden Zeit erklärt, sie können aber durchaus auch einen verstärkten Entwicklungsschub der Faultiere mit nachfolgendem Zusammenbruch der Bestände infolge klimatisch-geographischer Veränderungen anzeigen. Im Falle des Santacruziums sind die meisten Faultiere aus dem südlichen Teil Südamerikas belegt, der damals günstigere Lebensbedingungen bot. Im weiteren Verlauf des Miozäns sorgten aber die Auffaltung der Anden und die zunehmende Vergletscherung von Antarktika für eine erhebliche Verschlechterung der Klimabedingungen in Patagonien mit dramatischen Auswirkungen für die damalige Lebensumwelt. Der Rückgang der Diversität der Faultiere zum Ende des Huayqueriums ist dagegen eventuell mit dem allmählichen Einsetzen des Großen Amerikanischen Faunenaustauschs verbunden, während der drastische Rückgang am Ende des Lujaniums die Quartäre Aussterbewelle reflektiert.[55]
Der Ursprung der gesamten Gruppe ist unbekannt. Einer der möglicherweise ältesten Funde könnte von der Seymour-Insel etwa 100 km südöstlich der Nordspitze der Antarktischen Halbinsel stammen. Dieser umfasst einen nur etwa 2 cm langen Zahnfund, der einem Eckzahn ähnelt und für Faultiere typisch kein Zahnschmelz aufweist. Entdeckt wurde er in der La-Meseta-Formation, die überwiegend aus Sandsteinen besteht und in das Mittlere bis obere Eozän vor 42 bis 36 Millionen Jahren datiert. Paläobotanische Untersuchungen ergaben, dass die Region damals dicht mit Scheinbuchen bewachsen war, die in einem temperierten bis kühlen Klima wuchsen, vergleichbar dem des heutigen Patagonien.[71][72] Erneute Analysen der Zahnstruktur, vor allem des Zahnbeins, ergaben aber Abweichungen von den heute bekannten Faultieren. Der Zahn wird nun einem eventuell bisher unbekannten Säugetier zugewiesen.[73] Bereits Anfang des 20. Jahrhunderts waren einzelne Funde aus dem Unteren und Mittleren Eozän Patagoniens zu verschiedenen Faultieren verwiesen worden, etwa Protobradys und Proplathyarthrus. Letzteres ist über ein Zehenglied und ein Sprungbein überliefert. Beide Gattungen sind aber nach heutigem Stand ebenfalls nicht eindeutig den Faultieren zuweisbar.[60][21]
Oligozän
Die ersten eindeutigen Fossilfunde von Faultieren stammen aus dem Oligozän. Zu den sehr frühen Gattungen zählen Orophodon, Octodontotherium und Paroctodontotherium, die teilweise der Familie der Orophodontidae zugewiesen werden, eine mit den Mylodontidae verwandte Gruppe.[57] Zu den bedeutendsten Fundstellen gehören La Flecha in Patagonien und Salla-Luribay in Bolivien, die Funde dort beschränken sich in der Regel auf Zahn- und Kieferreste.[60][56] Allerdings wurden auf der ähnlich alten Lokalität Quebrada Fiera im westlichen Argentinien auch Teile des Körperskeletts von Octodontotherium geborgen. Darunter befinden sich Reste der Lendenwirbelsäule, die zu den ältesten Nachweisen der xenarthrischen Gelenke bei den Faultieren gehören. Von Quebrada Fiera stammt ebenfalls Similhapalops, eine Gattung, die den Megatheriidae nahesteht und über einzelne Kieferknochen und Teile des Bewegungsapparates belegt ist.[74] Eine Besonderheit stellt Pseudoglyptodon dar, welches eine Mischung aus Merkmalen der Faultiere und der Glyptodontidae aufweist. So ist das Gebiss mit 5 Zähnen je Oberkiefer- und vier je Unterkieferhälfte, davon jeweils der vorderste eckzahnartig, ähnlich strukturiert wie das der Faultiere, die hinteren Backenzähne besitzen jedoch anstatt zwei querstehenden Leisten drei lappenartige Bildungen auf der Kauoberfläche, was charakteristisch für die trilobaten Zähne der Glyptodonten ist. Funde von Pseudoglyptodon kamen ebenfalls in Salla-Luribay zu Tage, welche auf 29 bis 26 Millionen Jahren datieren. Ein nahezu vollständiger Schädel ist wiederum aus der Tinguiririca-Fauna des zentralen Chile belegt.[75] Weiterhin lassen sich zu dieser Zeit auch die frühesten Vertreter der Megalonychidae nachweisen, so unter anderem Deseadognathus anhand eines Unterkiefers aus der Deseado-Formation in Patagonien, der damit einen Vorfahren der Zweifinger-Faultiere darstellt.[76] Insgesamt besaß die Gruppe der Faultiere im ausgehenden Oligozän mit rund einem Dutzend Gattungen verteilt auf mehrere Familien bereits eine recht hohe Vielfalt. Diese drückt sich auch in unterschiedlichen Anpassungen aus, so in der Fortbewegungsweise von plantigrad bis pedolateral oder in der Art der Ernährung, wobei unter anderem mit dem Mylodontiden Paroctodontotherium bereits eine eher auf Gras spezialisierte Form vorkommt. Zudem variiert das Körpergewicht mit 40 bis 250 kg schon beträchtlich.[56][77][21]
Enigmatisch erscheint ein bisher nicht benannter Vertreter der Faultiere aus Puerto Rico. Nachgewiesen anhand eines oberen Fragmentes eines Oberschenkelknochen aus der Juana-Díaz-Formation nahe Yauco, datiert dieser aufgrund ebenfalls vorkommender Foraminiferen auf 34 bis 33 Millionen Jahre und ist damit etwas älter als Deseadognathus. Die Größe des Fundes lässt auf einen der kleinsten Vertreter der fossilen Faultiere schließen, der etwa die Größe der heutigen Dreifinger-Faultiere erreichte.[78][21] Die Karibischen Inseln wurden möglicherweise über eine kurzzeitig, vor 35 bis 33 Millionen existente Landbrücke in Form einer Landzunge oder kleinerer Inselgruppen erreicht, welche durch tektonische Bewegungen entstanden war.[79] Der Fund kann als Hinweis darauf gewertet werden, dass die karibischen Faultiere bereits sehr früh einen eigenständigen Entwicklungsweg gingen.[62]
Miozän

Aus dem Beginn des Miozän sind nur wenige Fossilfunde von Faultieren überliefert, darunter Chubutherium, bekannt nur von wenigen Skelettresten, und Holomegalonyx. Beide stammen aus der argentinischen Provinz Chubut.[21] Zentral sind die Funde aus der Santa-Cruz-Formation in Patagonien aus der Zeit vor 18 bis 16 Millionen Jahren, dem Übergang vom Unteren zum Mittleren Miozän, die eine erste umfassende Radiation der Faultiere anzeigen. Das Fossilmaterial ist sehr umfangreich und beinhaltet neben Einzelfunden auch partiell und vollständig erhaltene Skelette. Bis heute sind fast ein Dutzend Gattungen aus der Formation bekannt, die vier große Familien repräsentieren. So gehören Megalonychotherium und Eucholoeops zu den Megalonychidae, Analcitherium zu den Mylodontidae, während Nematherium die Scelidotheriidae vertritt und Prepotherium sowie Planops die Megatheriidae. Andere Formen wie Schismotherium können nur allgemein als basale Vertreter der Megatherioidea eingeordnet werden. Unterschiedlich bewertet wird die Stellung des sehr häufig vorkommenden Hapalops, da es als früher Vertreter sowohl der Megatheriidae als auch der Megalonychidae in Frage kommt. Die Faultiere der Santa-Cruz-Formation waren kleine bis mittelgroße Tiere von 35 bis 123 kg Körpergewicht. Die Skelettanatomie ist abweichend von den heutigen Faultieren und ähnelt ein wenig den Ameisenbären, vor allem die kürzeren Vordergliedmaßen verweisen auf eine bodenbewohnende oder grabende, teilweise aber auch baumkletternde Lebensweise.[33][34] Letztere unterschied sich aber deutlich von der der rezenten Gattungen. Auch in der Ernährungsweise gab es bestimmte Anpassungen. Während die Megatherien vorwiegend an Blattnahrung angepasst waren, bevorzugten die Mylodontidae härtere und faserigere Pflanzennahrung.[80][58] Etwa gleichalt zu den Funden aus der Santa-Cruz-Formation sind Faultierreste aus Kuba, die der Lagunitas-Formation nahe Domo de Zaza entstammen. Sie umfassen einige Schädelreste und Elemente des Körperskeletts und wurden als zur Gattung Imagocnus gehörig beschrieben, dessen Körpergewicht rund 200 kg betrug.[78][81]

Aus dem Mittleren Miozän sind wiederum nur wenige Fossilfunde bekannt. Fast zeitgleich zum späten Abschnitt des Santacruziums kommt mit Hiskatherium ein eher kleiner Megatherioide vor, dessen Nachweis mit Hilfe einiger Gebissfragmente aus Quebrada Honda in Bolivien gelang.[59] Megathericulus kann als Vertreter der stammesgeschichtlich jüngeren Megatherien (Megatheriinae) angesehen werden. Diese moderneren Megatherien durchlaufen eine rasante Entwicklung, über ihre frühesten Angehörigen ist aber nur wenig bekannt. Allerdings erreichte im Oberen Miozän Pyramiodontherium mit 2,5 t ein bereits enormes Körpergewicht.[82] Im Mittleren Miozän erscheint mit den Nothrotheriidae, die mit den Megatherien nahe verwandt sind, eine weitere große Familie.[83] Bedeutend ist die Gattung Thalassocnus, die sich durch eine stärkere Anpassung an eine semi-aquatische bis aquatische Lebensweise auszeichnet, was vor allem an der Ausprägung der Hinterbeine und der Hinterfüße erkennbar ist. Bedeutende Fossilvorkommen entstammen der Pisco-Formation entlang der peruanischen und chilenischen Küste, die ältesten Funde datieren auf 7 bis 8 Millionen Jahre.[38][39] Aus dem westlichen Amazonasgebiet stammt dagegen Mionothropus, das anhand eines Teilskelettes beschrieben wurde und in den näheren Verwandtschaftskreis des späteren Nothrotherium gehört.[84][21] Herausragend im nördlichen Südamerika ist die Urumaco-Sequenz des Falcón-Beckens im nördlichen Venezuela, die in den Übergang vom Mittleren zum Oberen Miozän datiert. Die hier vorkommende Faultiergemeinschaft ist sehr umfangreich und enthält mit Baraguatherium,[85] Eionaletherium[86] oder Bolivartherium[87] verschiedene Formen der Mylodonten sowie mit Urumaquia und Proeremotherium auch Angehörige der Megatherien.[88]
Erstmals erreichten die Faultiere im Oberen Miozän auch Nordamerika. Da der Kontinent zu jener Zeit noch nicht über eine Landbrücke mit Südamerika verbunden war, belegt dieses Auftreten, dass die Faultiere befähigt waren, offene Meeresstrecken zu überwinden, möglicherweise über Wanderungen von Insel zu Insel. Die frühesten Nachweise sind mit Pliometanastes, ein Megalonychid, und dem Mylodontid Thinobadistes aus Kalifornien und Florida überliefert, beide weisen ein Alter von rund 8 Millionen Jahren auf. Während letzteres ausstarb, entwickelte sich ersteres zu Megalonyx weiter, dessen ältester Nachweis mit einem Alter von 6,7 Millionen Jahren in der Lemoyne-Fauna in Nebraska erbracht wurde.[21][89][90] Noch im ausgehenden Miozän traten Zacatzontli, ebenfalls ein Megalonychidae, in Mexiko und Sibotherium, ein Megatheriidae, in Costa Rica auf.[91][92]
Plio- und Pleistozän

Im Pliozän sind erstmals Gattungen nachweisbar, die für das spätere Pleistozän und auch für das heutige Bild vor allem der großen Bodenfaultiere bestimmend sind. Allerdings ist es teilweise noch schwierig, diese aufgrund der zahlreichen Überlieferungslücken mit den Vorgängerformen in direkte Verbindung zu bringen. So entstanden unter anderem Glossotherium aus der Familie der Mylodontidae, Megatherium, die namensgebende Form der Megatherien und mit Proscelidodon und Scelidotherium Vertreter der Familie der Scelidotheriidae. Die Formen des Miozän wie der Nothrotheriide Thalassocnus starben hingegen im Verlauf des Pliozäns aus. Während des Pliozän kam es weiterhin durch die Schließung des Isthmus von Panama zur Bildung einer Landbrücke nach Nordamerika und in deren Folge zum Großen Amerikanischen Faunenaustausch, so dass zahlreiche Faultierformen nach Nordamerika einwanderten.[93] Aus Mittelamerika sind zu jener Zeit aber nur spärliche Fossilreste von Faultieren bekannt. Dazu gehört das große Meizonyx und ein kleinerer Vertreter von Megalonyx.[21]
Im Pleistozän bestand eine recht hohe Vielfalt an verschiedenen Faultierformen. So sind aus dieser Zeit rund zwei Dutzend Gattungen aus Nord- und Südamerika bekannt. Einige besaßen eine nur regionale Verbreitung, wie unter anderem das sehr große Archaeomylodon aus der Pamparegion[94] oder Diabolotherium aus den Andengebieten Perus, das sich, wie die zahlreichen Funde aus Höhlen annehmen lassen, womöglich felskletternd fortbewegte.[32][95] Aus den nördlichen Anden aus einer Höhe von über 3200 m wiederum ist Megistonyx aus der Gruppe der Megalonychidae überliefert.[96] In die gleiche Verwandtschaftsgruppe gehören Australonyx, das zum Ausklang der letzten Kaltzeit ein Mosaik aus Wäldern und Savannen bewohnte.[97] sowie Nohochichak[98] und Xibalbaonyx[99] beide sind auf Yucatán aus Unterwasserhöhlen belegt. Vor allem die großen und bekannteren Formen waren zu jener Zeit teilweise recht weit verbreitet. So besiedelte das gigantische, bis zu 6 t schwere Megatherium vorwiegend höher gelegene oder temperierte Regionen in Südamerika, sein naher und ähnlich großer Verwandter Eremotherium die tropischen und subtropischen Tiefländer bis in den Süden Nordamerikas. Das über große Bereiche Südamerikas nachgewiesene Mylodon besaß mit Funden aus der Cueva del Milodón in der chilenischen Provinz Última Esperanza bei 51°35‘ südlicher Breite und aus Tres Arroyos auf Feuerland bei 53°23‘ das südlichste Vorkommen aller Faultiere. Das aufgerichtet bis zu 2,6 m hohe Megalonyx erreichte dagegen in Nordamerika bei etwa 68° nördlicher Breite die nördlichsten Fundpunkte und ist dort unter anderem in Yukon und Alaska nachgewiesen.[100][21][89] Bemerkenswert ist auch, dass zahlreiche Formen im Verlauf des Pliozäns und des Pleistozäns eine massive Körpergrößenzunahme durchliefen. So erreichten die früheren Vertreter von Megalonyx ein Gewicht von etwa 184 kg, spätere aber von knapp 1,1 t, was eine Zunahme um fast das sechsfache bedeutet.[93]
Aussterben der Bodenfaultiere

Zahlreiche der heute nur fossil überlieferten Faultiere starben zum Ende des Pleistozäns im Zuge der Quartären Aussterbewellen aus. Für Südamerika stammen sehr junge Alterswerte für Mylodon aus der Cueva del Milodón im südlichen Chile und liegen bei 11.330 bis 13.630 BP,[101] aus der nur wenige Kilometer entfernten Cueva Chica bei 10.780 bis 14,240 BP.[102] Späte Funde von Eremotherium in Itaituba am Rio Tapajós, einem Nebenfluss des Amazonas, datieren auf 11.340 BP,[103] während jene von Nothrotherium – ermittelt anhand eines Koproliths aus der Höhle Gruta dos Breiões im brasilianischen Bundesstaat Bahia – 12.200 BP ergaben.[104] Für Megatherium, Glossotherium und Lestodon konnten Altersdaten an der Fundstelle Paso Otero am Río Quequén Grande in Argentinien auf 10.200 bis 10.450 BP ermittelt werden.[105] Eventuell trat Megatherium noch später auf, da Daten aus Campo Laborde, ebenfalls Argentinien, bei 8000 BP. und damit im Unteren Holozän liegen. Es wäre der bisher jüngste Nachweis eines Bodenfaultiers aus Südamerika,[106] neuere Datierungen verschieben die Werte aber auf 10.250 bis 12.730 Jahre BP.[107] Für Nordamerika sind weniger Daten bekannt. Nothrotheriops-Reste aus der Rampart Cave am Grand Canyon wurden auf ein Alter von 10.400 bis 11.480 BP bestimmt. Mit 11.430 bis 11.485 BP ähnlich alt ist ein später Nachweis von Megalonyx von der Lang Farm in Illinois.[108][21]
Das Aussterben zahlreicher Faultiere fällt sowohl in Nord- als auch in Südamerika in den Zeitraum des Ausklingens der letzten Kaltzeit (vor 110.000 bis 10.000 Jahren), was mit dramatischen Klimaveränderungen einherging. Zu jenem Zeitpunkt betrat auch der Jetztmensch erstmals amerikanischen Boden und breitete sich sehr schnell von Nord- nach Südamerika aus. So gehört zu den frühesten Nachweisen menschlicher Aktivitäten in Südamerika die Fundstelle Monte Verde in Chile, die ein Alter von etwa 14.500 Jahren aufweist, mit 13.000 Jahren etwas jünger ist Pedra Pintada im zentralen Brasilien.[109] Allerdings ist bis heute unklar, ob der Mensch tatsächlich für das Aussterben der Faultiere verantwortlich ist, Belege für die Jagd auf diese Tiere sind äußerst selten. Einer der wenigen Nachweise stammt aus Quebrada de Quereo im nördlichen Chile, wo neben zahlreichen Steinartefakten auch Reste zweier Individuen eines Mylodontiden (Mylodon oder Glossotherium) entdeckt wurden.[110] Im bereits erwähnten Campo Laborde wurde offensichtlich ein Skelett von Megatherium durch frühe menschliche Siedler zerlegt.[106] Ein weiterer Hinweis ist ein bearbeiteter Zahn von Eremotherium von der São-José-Farm im brasilianischen Bundesstaat Sergipe,[111] doch ist hier unklar, ob die Menschen das Stück nur aufsammelten oder das Tier selbst erlegten.[112] Auch aus Nordamerika sind nur wenige Fundstellen bekannt, an denen menschliche Hinterlassenschaften und Faultierreste vorkommen, etwa Kimmswick in Missouri, wo verknöcherte Hautschildchen von Paramylodon aufgedeckt wurden.[113] Eine mögliche direkte Interaktion zwischen Menschen und großen Bodenfaultieren wurde im Jahr 2018 anhand von Trittsiegeln und Fährten im White Sands National Monument in New Mexico publiziert. Die Ichnofossilien weisen ein Alter von rund 15.000 bis 10.000 Jahren auf und zeigen verschiedene sich überschneidende Spuren. In mehreren Bereichen des Aufeinandertreffens menschlicher Fußabdrücke auf solche von Bodenfaultieren gehen letztere von einer schnurgeraden in eine kreisförmige Anordnung über, was auf Verteidigungshaltungen der Tiere schließen lässt.[114] Im Hinblick auf die bisherige Seltenheit von Mensch-Faultier-Interaktionen brauchen die frühen amerikanischen Siedler die Tiere prinzipiell nicht direkt bejagt zu haben, auch Veränderungen der Landschaften können indirekt zum Aussterben zahlreicher Faultierlinien geführt haben.[21]
Bemerkenswert ist, dass auf einigen Inseln der Karibik Faultiere teilweise weitaus länger überlebt haben als auf dem amerikanischen Festland. Reste von Neocnus mehrerer Fundstellen auf Hispaniola datieren auf etwa 5260 bis 4840 BP beziehungsweise 5300 bis 4970 BP. Mit 6350 bis 4950 BP ähnlich jung sind Funde von Parocnus aus einer Erdpechgrube auf Kuba, noch jünger dagegen jene von Megalocnus mit 4190 BP, gewonnen anhand eines Zahnes aus einem Abri bei Havanna. Die Altersdaten fallen zusammen mit den ersten Besiedlungen der karibischen Inseln, allerdings wurden bisher keine menschlichen Hinterlassenschaften zusammen mit den Faultieren gefunden.[115][116]
Zur Herkunft der heutigen Faultiere
Der Ursprung der heutigen Faultiere ist unbekannt, Fossilmaterial und demzufolge Vorgängerformen liegen nicht vor. Die Zwei- und Dreifinger-Faultiere sind mit ihrer Lebensweise – nahezu vollständiges Leben in Bäumen, blattfresserische Ernährung und der daraus resultierende Metabolismus – stark an die tropischen Regenwälder angepasst und von diesen abhängig. Einzigartig ist ihre suspensorische Fortbewegung im Geäst. Für diese Art der Fortbewegung sind bisher keine Vorgänger- oder Übergangsformen bekannt, innerhalb der großen Gruppe der ausgestorbenen Faultiere wies kein Vertreter eine ähnliche Spezialisierung auf. Die Bodenfaultiere waren an zahlreiche Lebensweisen infolge einer unterschiedlichen Nischennutzung angepasst, die Fortbewegung reicht von vierfüßig bis teilweise zweifüßig laufend über kletternd (in Bäumen oder Felsen) bis zu schwimmend, wobei baumkletternde fossile Faultiere sich aber dem Skelettbau zufolge grundsätzlich anders im Geäst fortbewegten als die rezenten Arten. Aufgrund dessen und mit Hinblick auf den Fossilreport dürften die frühesten Faultiere ebenfalls bodenbewohnend und/oder baumkletternd gewesen sein.[117] Das Vorkommen der heutigen Baumfaultiere in den Regionen Amerikas mit dichtem tropischem Regenwald sowie ihre extremen Anpassungen an das Biotop sprechen dafür, dass sie auch dort ihren Ursprung haben. Genetische Untersuchungen datieren die Aufspaltung der Zwei- und Dreifinger-Faultiere in das Oligozän vor rund 30 Millionen Jahren zurück.[49] Dieses Ergebnis in Verbindung mit einzelnen anatomischen Unterschieden zwischen den beiden rezenten Gattungen führt zu der Annahme, dass sich die suspensorische Fortbewegung jeweils unabhängig entwickelt hat. Möglicherweise lebten die Vorgängerformen während des Miozäns oder Pliozäns in einem ähnlichen ökologischen Umfeld, etwa dem „Proto-Amazonas“, und formten nach und nach die spezielle Lebensweise heraus. Wann diese sich tatsächlich herausbildete, ist unklar; die an zahlreichen Fundstellen in der Region, viele davon erst im 21. Jahrhundert entdeckt, dokumentierte diverse Faultierfauna lieferte bis heute keine Hinweise auf einen suspensorischen Gang. Aus dem bisherigen Fehlen im Fossilreport schlussfolgern einige Wissenschaftler, dass die kopfunter hängende Fortbewegungsweise eine eher späte Bildung darstellt, die eventuell erst im Pliozän entstand.[118]
Nomenklatur
Die heute gültige wissenschaftliche Bezeichnung Folivora für die Faultiere wurde im Jahr 2001 von Frédéric Delsuc und Forscherkollegen eingeführt. Der Name leitet sich von den lateinischen Wörtern folium für „Blatt“ und vorare für „verschlingen“ her, er bezieht sich somit auf die bevorzugte Nahrungsressource der Tiere.[119] Daneben sind aber noch weitere Namen im Gebrauch. Der älteste verfügbare Name ist Tardigrada. Auch dieser ist lateinischen Ursprungs und bedeutet so viel wie tardus („langsam“) und gradus („Schritt“), ihm liegt folglich die langsame Fortbewegungsweise der Faultiere zugrunde. Die Bezeichnung benutzte Lazzaro Spallanzani im Jahr 1776 in abgewandelter Form (il tardigrado) für die Klasse der Bärtierchen (die offizielle korrekte Nennung als Tardigrada datiert in die 1840er Jahre). Erst rund zwanzig Jahre später, 1795, wurde sie durch John Latham und Hugh Davies im Rahmen von Johann Reinhold Forsters Abhandlung Zoología indica offiziell für die Faultiere etabliert. Bereits 1762 hatte aber Mathurin-Jacques Brisson in seinem Werk Regnum animale in classes IX distributum sive Synopsis methodica die Zwei- und Dreifinger-Faultiere unter der Gattungsbezeichnung Tardigradus vereint.[120] Ihm voraus geht das Sammelwerk Thesaurus aus dem Jahr 1734, in dem der Autor Albert Seba mit Tardigradus auf das Weißkehl-Faultier verwies.[121] Im Jahr 1842 führte Richard Owen den Begriff Phyllophaga ein,[122] der aus dem Griechischen stammt und sich aus den Wörtern φύλλον (phyllon „Blatt“) und φαγεῖν (phageín „fressen“) zusammensetzt. Wie Folivora bezieht sich Phyllophaga auf die Ernährungsweise. Allerdings war der Name zuvor im Jahr 1826 von Thaddeus William Harris für eine Gattung der Käfer vergeben worden. Da somit sowohl Tardigrada als auch Phyllophaga von anderen Tiergruppen belegt sind, bevorzugen einige Wissenschaftler für die Faultiere die Bezeichnung Folivora. Die Internationalen Regeln für die Zoologische Nomenklatur verbieten jedoch höherrangige Homonyme nicht,[123] weswegen beide Namen verfügbar sind und bis heute in wissenschaftlichen Veröffentlichungen verwendet werden.[124][125][126]
Forschungsgeschichte
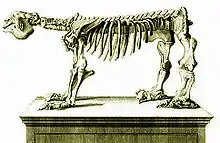
Die offizielle wissenschaftliche Benennung heutiger Faultiere erfolgte im Jahr 1758 durch Linnaeus, wobei er die beiden rezenten Gattungen in einer, Bradypus, vereinte.[127][1][2] Die Bezeichnung Bradypus hatte Linnaeus bereits 1735 in der Erstauflage seines Systema naturae verwendet,[128] den überwiegenden Teil der Angaben entnahm er aus Albert Sebas Werk Thesaurus von 1734.[121] Fast 40 Jahre nach Linnaeus' Erstbeschreibung war es Georges Cuvier, der 1796 ein vollständiges Skelett von Megatherium beschrieb. Dieses war Ende der 1780er Jahre bei Luján in östlichen Argentinien entdeckt und an das Real Gabinete de Historia Natural in Madrid versandt worden. Dort hatte es Juan Bautista Bru de Ramón präpariert und im Jahr 1793 aufgestellt, das erste nach wissenschaftlichen Maßstäben rekonstruierte Skelett eines ausgestorbenen Wirbeltiers überhaupt, allerdings mit einer nach heutiger Auffassung unnatürlichen Pose. Cuvier erfuhr von diesem Skelett und fertigte so seine Beschreibung über eines der größten Säugetiere Amerikas an. Seine Publikation ist in mehrfacher Hinsicht bedeutend: Einerseits stellt sie Cuviers erste Veröffentlichung über ein ausgestorbenes Tier dar, andererseits bemerkte er, dass ein ähnliches Tier in der heutigen Fauna nicht mehr existiert, was zu damaliger Zeit eine revolutionäre Idee darstellte. Zudem begründete Cuvier mit Hilfe des Megatherium-Skelettes die Vergleichende Anatomie.[5] Nur drei Jahre nach Cuvier beschrieb Thomas Jefferson Knochen eines großen Tieres mit langen Krallen aus dem US-Bundesstaat Virginia, die er aber einem Raubtier zuwies[129] und die 1825 als zu Megalonyx gehörig erkannt wurden.[130]
Eine große Phase der Erforschung der Faultiere begann 1832, als Charles Darwin auf seiner Reise mit der HMS Beagle Südamerika erreichte. Bis 1834 sammelte er vor allem in Argentinien mehr als 5000 Fossilreste, die er nach England an das Royal College of Surgeons schickte (von der Sammlung haben aber nur 175 Objekte die intensiven Bombardements von London 1941 während des Zweiten Weltkriegs überstanden). Dort studierte Richard Owen die Fossilien ab 1836, was zur Beschreibung von Gattungen wie Glossotherium, Scelidotherium oder Mylodon führte.[131] Die Arbeiten Owens gehören noch heute zu den Standardwerken über die ausgestorbenen Bodenfaultiere. So war es maßgeblich auch Owen, der die baumbewohnenden Faultiere als Tardigrada von den bodenbewohnenden als Gravigrada abtrennte und beide gemeinsam in das Taxon Phyllophaga stellte.[122] Vor allem im Übergang vom 19. zum 20. Jahrhundert wurden zahlreiche Faultierformen entdeckt und beschrieben, so unter anderem von bedeutenden Forschern wie den Gebrüdern Carlos und Florentino Ameghino oder John Bell Hatcher, die mehrfach Expeditionen nach Südamerika tätigten. Dabei hielt sich die Ansicht über eine nahe Verwandtschaft der heutigen Baumfaultiere zueinander und die Abtrennung von den Bodenfaultieren noch bis weit in das 20. Jahrhundert. So trennte auch der amerikanische Zoologe George Gaylord Simpson in seinem Standardwerk zur Klassifizierung der Säugetiere 1945 beide Faultiergruppen voneinander ab und verwies die heutigen Faultiere allesamt zur Familie Bradypodidae.[130]
Die Zuordnung aller heute lebenden Faultiere in eine Familie beruhte weitgehend auf ihrer Anpassung an das Leben in den Bäumen, ebenso wie ihrer ungewöhnlichen Fortbewegungsweise und einiger atypischer Schädelmerkmale. Erst Ende der 1960er und zu Beginn der 1970er Jahre wurde der Irrtum erkannt, woraufhin die Zweifinger-Faultiere aus den Bradypodidae ausgegliedert und in die Megalonychidae verwiesen wurden.[7] Für diese Neubetrachtung der Verwandtschaft der Zweifinger-Faultiere sprachen vor allem der vergrößerte und eckzahnartig gestaltete vorderste Zahn, die Struktur des Jochbeins und das Fehlen einer verknöcherten Paukenblase am Mittelohr.[2] Dadurch sind die jeweiligen Anpassungen an das kopfunterhängende (suspensorische) Leben in den Baumkronen und die damit verbundenen anatomischen Anpassungen und Überprägungen des Körperbaus der rezenten Faultiere als eine konvergente Entwicklung anzusehen,[16] die eine der eindrucksvollsten innerhalb der gesamten Klasse der Säugetiere darstellt.[57] In den 1990er Jahren konnten molekulargenetische Untersuchungen das anatomisch begründete weniger nahe Verwandtschaftsverhältnis der beiden rezenten Faultiergattungen durch Einbeziehung fossiler Formen untermauern.[63][65] Eine eindeutige Klärung der verwandtschaftlichen verhältnisse der rezenten und fossilen Faultiere zueinander erbrachten dann genetische und biochemische Analysen im Jahr 2019.
Faultiere und Menschen

Als Regenwaldbewohner sind die heutigen Faultiere besonders von Brandrodungen bedroht, die in großem Ausmaß durchgeführt werden, um Felder und Siedlungen anzulegen. Hinzu kommt eine verstärkte Jagd auf die Tiere, einerseits als Nahrungsgrundlage, andererseits aber auch zum illegalen Verkauf als Heimtiere, was häufig Jungtiere betrifft. Nach Angaben der IUCN sind die beiden Arten der Zweifinger-Faultiere, das Eigentliche und das Hoffmann-Zweifingerfaultier, in ihrem Bestand derzeit nicht bedroht, ebenso wie das Weißkehl- und das Braunkehl-Faultier aus der Gruppe der Dreifinger-Faultiere, da alle genannten Arten ein recht weites Verbreitungsgebiet haben. Das Kragenfaultier, das nur in Südostbrasilien vorkommt, gilt als bedroht, während das Zwergfaultier, nur bekannt von einer kleinen Insel vor der Ostküste Panamas, vom Aussterben bedroht ist.[132] Bei den nicht bedrohten Arten ist der Populationstrend unbekannt, allerdings sinkt dieser bei den bedrohten. Problematisch erscheint dabei, dass kaum Daten über die Dynamik der verschiedenen Faultierpopulationen vorliegen, ebenso wie in vielen Fällen die Lebensweise der einzelnen Arten noch wenig erforscht ist. Alle Arten sind aber in geschützten Gebieten vertreten.[28]
Literatur
- Richard M. Fariña, Sergio F. Vizcaíno und Gerardo de Iuliis: Megafauna. Giant beasts of Pleistocene South America. Indiana University Press, 2013, S. 1–436 ISBN 978-0-253-00230-3
- Alfred L. Gardner (Hrsg.): Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008 (S. 157–164) ISBN 0-226-28240-6
- Ronald Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore 1999, ISBN 0-8018-5789-9
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald und Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. Systematic Biology 68 (2), 2019, S. 204–218
- Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 1–370 ISBN 978-0-8130-3165-1
- Don E. Wilson und DeeAnn M. Reeder: Mammal Species of the World. Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4
Einzelnachweise
- Alfred L. Gardner: Family Bradypodidae Gray, 1821. In: Alfred L. Gardner (Hrsg.): Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008 (S. 158–164)
- Alfred L. Gardner und Virginia L. Naples: Family Megalonychidae P. Gervais, 1855. In: Alfred L. Gardner (Hrsg.): Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008 (S. 165–168)
- Sergio F. Vizcaíno, Marcelo Zaráte, M. Susana Bargo und Alejandro Dondas: Pleistocene burrows in the Mar del Plata area (Argentina) and their probable builders. Acta Palaeontologica Polonica 46 (2), 2001, S. 289–301
- Fernando Henrique de Souza Barbosa, Hermínio Ismael de Araújo-Júnior und Edison Vicente Oliveira: Neck osteoarthritis in Eremotherium laurillardi (Lund, 1842; Mammalia, Xenarthra) from the Late Pleistocene of Brazil. International Journal of Paleopathology 6, 2014, S. 60–63, doi:10.1016/j.ijpp.2014.01.001
- Sergio F. Vizcaíno, M. Susasna Bargo und Richard A. Fariña: Form, function, and paleobiology in xenarthrans. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 86–99
- M. Susana Bargo, Sergio F. Vizcaíno, Fernando M. Archuby und R. Ernesto Blanco: Limb bone proportions, strength and digging in some Lujanian (Late Pleistocene-Early Holocene) mylodontid ground sloths (Mammalia, Xenarthra). Journal of Vertebrate Paleontology 20 (3), 2000, S. 601–610
- Virginia L. Naples: Cranial osteology and function in the tree sloths. Bradypus and Choloepus. American Museum Novitates 2739, 1982, S. 1–21
- U. Zeller, J. R. Wible und M. Eisner: New Ontogenetic Evidence on the Septomaxilla of Tamandua and Choloepus (Mammalia, Xenarthra), with a Reevaluation of the Homology of the Mammalian Septomaxilla. Journal of Mammalian Evolution 1 (1), 1993, S. 31–46
- H. Gregory McDonald: Xenarthran skeletal anatomy: primitive or derived? Senckenbergiana biologica 83, 2003, S. 5–17
- Lionel Hautier, Helder Gomes Rodrigues, Guillaume Billet und Robert J. Asher: The hidden teeth of sloths: evolutionary vestiges and the development of a simplified dentition. Scientific Reports 6, 2016, S. 27763, doi:10.1038/srep27763
- Daniela C. Kalthoff: Microstructure of Dental Hard Tissues in Fossil and Recent Xenarthrans (Mammalia: Folivora and Cingulata). Journal of Morphology 272, 2011, S. 641–661
- Sergio F. Vizcaíno: The teeth of the “toothless”: novelties and key innovations in the evolution of xenarthrans (Mammalia, Xenarthra). Paleobiology 35 (3), 2009; S. 343–366
- Lionel Hautier, Vera Weisbecker, Marcelo R. Sánchez-Villagra, Anjali Goswami und Robert J. Asher: Skeletal development in sloths and the evolution of mammalian vertebral patterning. In PNAS 107 (44), 2010, S. 18903–18908 ()
- Hideki Endo, Osamu Hashimoto, Hajime Taru, Keisuke Sugimura, Shin-ichi Fujiwara, Takuya Itou, Hiroshi Koie, Masato Kitagawa und Takeo Sakai: Comparative Morphological Examinations of the Cervical and Thoracic Vertebrae and Related Spinal Nerves in the Two-Toed Sloth. Mammal Study 38 (3), 2013, S. 217–224
- Timothy J. Gaudin: The morphology of the xenarthrous vertebrae (Mammalia: Xenarthra). Fieldiana 1505 (41), 1999, S. 1–38
- John A. Nyakatura: The Convergent Evolution of Suspensory Posture and Locomotion in Tree Sloths. Journal of Mammalian Evolution 19, 2012, S. 225–234
- H. Gregory McDonald: Evolution of the Pedolateral Foot in Ground Sloths: Patterns of Change in the Astragalus. Journal of Mammalian Evolution 19, 2012, S. 209–215
- D. P. Gilmore, C. P. Da Costa und D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. Brazilian Journal of Medical and Biological Research 34 (1), 2001, S. 9–25 ()
- Desmond Gilmore, Denia Fittipaldi Duarte und Carlos Peres da Costa: The physiology of two- and three-toed sloth. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 130–142
- Milla Suutari, Markus Majaneva, David P Fewer, Bryson Voirin, Annette Aiello, Thomas Friedl, Adriano G Chiarello und Jaanika Blomster: Molecular evidence for a diverse green algal community growing in the hair of sloths and a specific association with Trichophilus welckeri (Chlorophyta, Ulvophyceae). BMC Evolutionary Biology 10, 2010, S. 86
- H. Gregory McDonald und Gerardo de Iuliis: Fossil history of sloths. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 39–55
- Richard M. Fariña, Sergio F. Vizcaíno und Gerardo de Iuliis: Megafauna. Giant beasts of Pleistocene South America. Indiana University Press, Bloomington und Indianapolis, 2013, S. 1–436 (S. 259–260)
- Robert V. Hill: Comparative Anatomy and Histology of Xenarthran Osteoderms. Journal of Morphology 267, 2005, S. 1441–1460
- Kurt Benirschke: Reproductive parameters and placentation in anteaters and sloths. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 160–171
- G. G. Montgomery und M. E. Sunquist: Contact-Distress Calls of Young Sloths. Journal of Mammalogy 55 (1), 1974, S. 211–213
- R. Ernesto Blanco und Andrés Rinderknecht: Estimation of Hearing Capabilities of Pleistocene Ground Sloths (Mammalia, Xenarthra) from Middle-Ear Anatomy. Journal of Vertebrate Paleontology 28 (1), 2008, S. 274–276
- R. Ernesto Blanco und Andrés Rinderknecht: Fossil evidence of frequency range of hearing independent of body size in South American Pleistocene ground sloths (Mammalia, Xenarthra). Comptes Rendus Palevol 11, 2012, S. 549–554
- Mariella Superina, Tinka Plese, Nadia Moraes-Barros und Agustín Manuel Abba: The 2010 Sloth Red List Assessment. Edentata 11 (2), 2010, S. 115–134
- François Pujos, Timothy J. Gaudin, Gerardo de Iuliis und Cástor Cartelle: Recent advances on variability, mrpho-functional adaptions, dental terminology, and evolution of Sloths. Journal of Mammalian Evolution 19, 2012, S. 159–169
- John A. Nyakatura und Martin S. Fischer: Functional morphology of the muscular sling at the pectoral girdle in tree sloths: convergent morphological solutions to new functional demands? Journal of Anatomy 219, 2011, S. 360–374
- Adriano Garcia Chiarello: Sloth ecology. An overview of field studies. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 269–280
- François Pujos, Gerardo de Iuliis, Christine Argot und Lars Wedelin: A peculiar climbing Megalonychidae from the Pleistocene of Peru and its implication for sloth history. Zoological Journal of the Linnean Society 149, 2007, S. 179–235
- Néstor Toledo, M. Susana Bargo, Guillermo Hernán Cassini und Sergio F. Vizcaíno: The Forelimb of Early Miocene Sloths (Mammalia, Xenarthra, Folivora): Morphometrics and Functional Implications for Substrate Preferences. Journal of Mammalian Evolution 19, 2012, S. 185–198
- Néstor Toledo, M. Susana Bargo und Sergio F. Vizcaíno: Muscular Reconstruction and Functional Morphology of the Forelimb of Early Miocene Sloths (Xenarthra, Folivora) of Patagonia. The Anatomical Record 296, 2013, S. 305–325
- Néstor Toledo, M. Susana Bargo und Sergio F. Vizcaíno: Muscular Reconstruction and Functional Morphology of the Hind Limb of Santacrucian (Early Miocene) Sloths (Xenarthra, Folivora) of Patagonia. The Anatomical Record 298, 2015, S. 842–864
- Alessandro Marques de Oliveira und Charles Morphy D. Santos: Functional morphology and paleoecology of Pilosa (Xenarthra, Mammalia) based on a two-dimensional geometric Morphometrics study of the Humerus. Journal of Morphology 279 (10), 2018, S. 1455–1467, doi:10.1002/jmor.20882
- R. Ernesto Blanco und Ada Czerwonogora: The gait of Megatherium Cuvier 1796 (Mammalia, Xenarthra, Megatheriidae). Senckenbergiana biologica 83 (1), 2003, S. 61–68
- Christian de Muizon und H. Gregory McDonald: An aquatic sloth from the Pliocene of Peru. Nature 375, 1995, S. 224–227
- Christian de Muizon, H. Gregory McDonald, Rodolfo Salas und Mario Urbina: An early species of the aquatic sloth Thalassocnus (Mammalia, Xenarthra) from the late Miocene of Peru. Journal of Vertebrate Paleontology 23, 2003, S. 886–894
- Jonathan N. Pauli, Jorge E. Mendoza, Shawn A. Steffan, Cayelan C. Carey, Paul J. Weimer und M. Zachariah Peery: A syndrome of mutualism reinforces the lifestyle of a sloth. Proceedings of the Royal Society B 281, 2014, S. 20133006, doi:10.1098/rspb.2013.3006
- Robert K. McAfee: Feeding Mechanics and Dietary Implications in the Fossil Sloth Neocnus (Mammalia: Xenarthra: Megalonychidae) From Haiti. Journal of Morphology 272, 2011, S. 1204–1216
- M. Susana Bargo, Néstor Toledo und Sergio F. Vizcaíno: Muzzle of South American Pleistocene Ground Sloths (Xenarthra, Tardigrada). Journal of Morphology 267, 2006, S. 248–263
- Robert S. Thompson, Thomas R. van Devender, Paul S. Martin, Theresa Foppe und Austin Long: Shasta Ground Sloth (Nothrotheriops shastense Hoffstetter) at Shelter Cave, New Mexico: Environment, Diet, and Extinction. Quaternary Research 14, 1980, S. 360–376
- Julia V. Tejada, John J. Flynn, Ross MacPhee, Tamsin C. O’Connell, Thure E. Cerling, Lizette Bermudez, Carmen Capuñay, Natalie Wallsgrove und Brian N. Popp: Isotope data from amino acids indicate Darwin’s ground sloth was not an herbivore. Scientific Reports 11, 2021, S. 18944, doi:10.1038/s41598-021-97996-9
- Ada Czerwonogora, Richard A. Fariña und Eduardo Pedro Tonni: Diet and isotopes of Late Pleistocene ground sloths: irst results for Lestodon and Glossotherium (Xenarthra, Tardigrada). Neues Jahrbuch für Geologie und Paläontologie Abhandlungen 262 (3), 2011, S. 257–266
- Erica Taube, Joël Keravec, Jean-Christophe Vié und Jean-Marc Duplantier: Reproductive biology and postnatal development in sloths, Bradypus and Choloepus: review with original data from the field (French Guiana) and from captivity. Mammal Review 31 (3), 2001, S. 173–188
- Paula Lara-Ruiz und Adriano Garcia Chiarello: Life-history traits and sexual dimorphism of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). Journal of Zoology 267, 2005, S. 63–73
- DER SPIEGEL: Trauer um weltweit ältestes Faultier Paula: Das Ende der Gemütlichkeit. (online), abgerufen am 10. August 2020
- Gillian C. Gibb, Fabien L. Condamine, Melanie Kuch, Jacob Enk, Nadia Moraes-Barros, Mariella Superina, Hendrik N. Poinar und Frédéric Delsuc: Shotgun Mitogenomics Provides a Reference Phylogenetic Framework and Timescale for Living Xenarthrans. Molecular Biology and Evolution 33 (3), 2015, S. 621–642
- Maureen A. O'Leary, Jonathan I. Bloch, John J. Flynn, Timothy J. Gaudin, Andres Giallombardo, Norberto P. Giannini, Suzann L. Goldberg, Brian P. Kraatz, Zhe-Xi Luo, Jin Meng, Xijun Ni, Michael J. Novacek, Fernando A. Perini, Zachary S. Randall, Guillermo W. Rougier, Eric J. Sargis, Mary T. Silcox, Nancy B. Simmons, Michelle Spaulding, Paúl M. Velazco, Marcelo Weksler, John R. Wible und Andrea L. Cirranello: The Placental Mammal Ancestor and the Post–K-Pg Radiation of Placentals. Science 339, 2013, S. 662–667, doi:10.1126/science.1229237
- Kenneth D. Rose: The beginning of the age of mammals. Johns Hopkins University Press, Baltimore, 2006, S. 1–431 (S. 200–204)
- Sergio F. Vizcaíno und W. J. Loughry: Xenarthran biology: Past, present and future. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 1–7
- Frédéric Delsuc, Michael J. Stanhope und Emmanuel J.P. Douzery: Molecular systematics of armadillos (Xenarthra, Dasypodidae): contribution of maximum likelihood and Bayesian analyses of mitochondrial and nuclear genes. Molecular Phylogenetics and Evolution 28, 2003, S. 261–275
- Frédéric Delsuc, Sergio F Vizcaíno und Emmanuel J. P. Douzery: Influence of Tertiary paleoenvironmental changes on the diversification of South American mammals: a relaxed molecular clock study within xenarthrans. BMC Evolutionary Biology 4 (11), 2004, S. 1–13
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald und Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. Systematic Biology 68 (2), 2019, S. 204–218
- Bruce J. Shockey und Federico Anaya: Grazing in a New Late Oligocene Mylodontid Sloth and a Mylodontid Radiation as a Component of the Eocene-Oligocene Faunal Turnover and the Early Spread of Grasslands/Savannas in South America. Journal of Mammalian Evolution 18, 2011, S. 101–115
- Timothy J. Gaudin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. Zoological Journal of the Linnean Society 140, 2004, S. 255–305
- M. Susana Bargo, Néstor Toledo und Sergio F. Vizcaíno: Paleobiology of Santacrucian sloths and anteaters (Xenarthra, Pilosa). In: Sergio F. Vizcaíno, Richard F. Kay und M. Susana Bargo (Hrsg.): Early Miocene paleobiology in Patagonia: High-latitude paleocommunities of the Santa Cruz Formation. Cambridge University Press, New York, 2012, S. 216–242
- François Pujos, Gerardo De Iuliis und Bernardino Mamani Quispe: Hiskatherium saintandrei, gen. et sp. nov.: An Unusual Sloth from the Santacrucian of Quebrada Honda (Bolivia) and an Overview of Middle Miocene, Small Megatherioids. Journal of Vertebrate Paleontology 31 (5), 2011, S. 1131–1149
- François Pujos und Gerardo de Iuliis: Late Oligocene Megatherioidea fauna (Mammalia: Xenarthra) from Salla-Luribay (Bolivia): New data on basal sloth radiation and Cingulata-Tardigrada split. Journal of Vertebrate Paleontology 27 (1), 2007, S. 132–144
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins und Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. Nature Ecology & Evolution 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D. E. MacPhee, Guillaume Billet, Lionel Hautier und Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. Current Biology 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043
- Matthias Höss, Amrei Dilling, Andrew Currant und Svante Pääbo: Molecular phylogeny of the extinct ground sloth Mylodon darwinii. Proceedings of the National Academy of Sciences 93, 1996, S. 181–185
- Alex D. Greenwood, Jose Castresana, Gertraud Feldmaier-Fuchs und Svante Pääbo: A Molecular Phylogeny of Two Extinct Sloths. Molecular Phylogenetics and Evolution 18 (1), 2001, S. 94–103
- Michael Hofreiter, Julio L. Betancourt, Alicia Pelliza Sbriller, Vera Markgraf und H. Gregory McDonald: Phylogeny, diet, and habitat of an extinct ground sloth from Cuchillo Curá, Neuquén Province, southwest Argentina. Quaternary Research 59, 2003, S. 364–378
- Hendrik Poinar, Melanie Kuch, Gregory McDonald, Paul Martin und Svante Pääbo: Nuclear Gene Sequences from a Late Pleistocene Sloth Coprolite. Current Biology 13, 2003, S. 1150–1152
- Andrew A. Clack, Ross D. E. MacPhee und Hendrik N. Poinar: Mylodon darwinii DNA sequences from ancient fecal hair shafts. Annals of Anatomy 194, 2012, S. 26–30
- Graham J. Slater, Pin Cui, Analía M. Forasiepi, Dorina Lenz, Kyriakos Tsangaras, Bryson Voirin, Nadia de Moraes-Barros, Ross D. E. MacPhee und Alex D. Greenwood: Evolutionary Relationships among Extinct and Extant Sloths: The Evidence of Mitogenomes and Retroviruses. Genome Biology and Evolution 8 (3), 2016, S. 607–621
- Michael Buckley, Richard A. Fariña, Craig Lawless, P. Sebastián Tambusso, Luciano Varela, Alfredo A. Carlini, Jaime E. Powell und Jorge G. Martinez: Collagen Sequence Analysis of the Extinct Giant Ground Sloths Lestodon and Megatherium. PLoSONE 10 (11), 2015, S. e0139611, doi:10.1371/journal.pone.0139611
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Jonathan Hughes, Paul Szpak, John Southon, Jacob Enk, Ana T. Duggan und Hendrik N. Poinar: Resolving the phylogenetic position of Darwin’s extinct ground sloth (Mylodon darwinii) using mitogenomic and nuclear exon data. Proceedings of the Royal Society B 285, 2018, S. 20180214, doi:10.1098/rspb.2018.0214
- Sergio F. Vizcaíno und Gustavo J. Scillato-Yané: Short note o an Eocene tardigrade (Mammalia, Xenarthra) from Seymour Island, West Antarctica. Antarctic Science 7 (4), 1995, S. 407–408
- Sergio F. Vizcaíno, Mariano Bond, Marcelo A. Reguero und R. Pascual: Youngest record of fossil land mammals from Antarctica: its significance on the evolution of terrestrial environment on Antarctic Peninsula during the late Eocene. Journal of Paleontology 71, 1997, S e. 348–350
- Ross D. E. MacPhee und Marcelo A. Reguero: Reinterpretation of a Middle Eocene Record of Tardigrada (Pilosa, Xenarthra, Mammalia) from La Meseta Formation, Seymour Island, West Antarctica. American Museum Novitates 3689, 2010, S. 1–21
- François Pujos, Martin R. Ciancio, Analía M. Forasiepi, Michel Pujos, Adriana M. Candela, Bárbara Vera, Marcelo A. Reguero, Ana María Combina und Esperanza Cerdeño: The late Oligocene xenarthran fauna of Quebrada Fiera (Mendoza, Argentina) and its implications for sloth origins and the diversity of Palaeogene cingulates. Papers in Paleontology 7 (3), 2021, S. 1613–1656, doi:10.1002/spp2.1356
- Malcolm McKenna, André R. Wyss und John J. Flynn: Paleogene Pseudoglyptodont Xenarthrans from Central Chile and Argentine Patagonia. American Museum Novitates 3536, 2006, S. 1–18
- Alfredo A. Carlini und Gustavo J. Scillato-Yané: The oldest Megalonychidae (Xenarthra: Tardigrada); phylogenetic relationships and an emended diagnosis of the family. Neues Jahrbuch für Geologie und Paläontologie Abhandlungen 233 (3), 2004, S. 423–443
- Daniela C. Kalthoff und Jeremy L. Green: Feeding Ecology in Oligocene Mylodontoid Sloths (Mammalia, Xenarthra) as Revealed by Orthodentine Microwear Analysis. Journal of Mammalian Evolution 25 (4), 2018, S. 551–564
- Ross D. E. MacPhee und Manuel A. Iturralde-Vinent: Origin of the Greater Antillean Land Mammal Fauna, 1: New Tertiary Fossils from Cuba and Puerto Rico. American Museum Novitates 3141, 1995, S. 1–31
- Manuel Iturralde-Vinent und Ross D. E. MacPhee: Paleogeography of the Caribbean region: Implications for Cenozoic biogeography. Bulletin of the American Museum of Natural History 238, 1999, S. 1–95
- Sergio F. Vizcaíno, M. Susana Bargo, Richard F. Kay, Richard A. Fariña, Mariana Di Giacomo, Jonathan M. G. Perry, Francisco J. Prevosti, Néstor Toledo, Guillermo H. Cassini und Juan C. Fernicola: A baseline paleoecological study for the Santa Cruz Formation (late–early Miocene) at the Atlantic coast of Patagonia, Argentina. Palaeogeography, Palaeoclimatology, Palaeoecology 292, 2010, S. 507–519
- Ross D. E. MacPhee, Manuel A. Iturralde-Vinent und Eugene S. Gaffney: Domo de Zaza, an Early Miocene Vertebrate Locality in South-Central Cuba, with Notes on the Tectonic Evolution of Puerto Rico and the Mona Passage. American Museum Novitates 3394, 2003, S. 1–42
- Gerardo de Iuliis, Guillermo H. Ré und Sergio F. Vizcaíno: The Toro Negro Megatheriine (Mammalia, Xenarthra): A new species of Pyramiodontherium and a review of Plesiomegatherium. Journal of Vertebrate Paleontology 24 (1), 2004, S. 214–227
- François Pujos, Gerardo De Iuliis, Bernardino Mamani Quispe und Ruben Andrade Flores: Lakukullus anatisrostratus, gen. et sp. nov., A New Massive Nothrotheriid Sloth (Xenarthra, Pilosa) from the Middle Miocene of Bolivia. Journal of Vertebrate Paleontology 34 (5), 2014, S. 1243–1248
- Gerardo de Iuliis, Timothy J. Gaudin und Matthew J. Vicars: A new genus and species of nothrotheriid sloth (Xenarthra, Tardigrada, Nothrotheriidae) from late Miocene (Huayquerian) of Peru. Paleontology 54 (1), 2011, S. 171–205
- Ascanio D. Rincón, Andrés Solórzano, H. Gregory McDonald und Mónica Núñez Flores: Baraguatherium takumara, Gen. et Sp. Nov., the Earliest Mylodontoid Sloth (Early Miocene) from Northern South America. Journal of Mammalian Evolution 24, 2017, S. 179–191
- Ascanio D. Rincón, H. Gregory McDonald, Andrés Solórzano, Mónica Núñez Flores und Damián Ruiz-Ramoni: A new enigmatic Late Miocene mylodontoid sloth from northern South America. Royal Society Open Science 2, 2015, S. 140256, doi:10.1098/rsos.140256
- Alfredo A. Carlini, Gustavo J. Scillato-Yané und Rodolfo Sánchez: New Mylodontoidea (Xenarthra, Phyllophaga) from the middle Miocene–Pliocene of Venezuela. Journal of Systematic Palaeontology 4, 2006, S. 255–267
- Alfredo A. Carlini, Diego Brandoni und Rodolfo Sánchez: First Megatheriines (Xenarthra, Phyllophaga, Megatheriidae) from the Urumaco (Late Miocene) and Codore (Pliocene) Formations, Estado Falcón, Venezuela. Journal of Systematic Palaeontology 4 (3), 2006, S. 269–278
- H. Gregory McDonald, C. R. Harnington und Gerardo de Iuliis: The Ground Sloth Megalonyx from Pleistocene Deposits of the Old Crow Basin, Yukon, Canada. Arctic 53 (3), 2000, S. 213–220
- Gary S. Morgan: The Great American Biotic Interchange in Florida. Bulletin of the Florida Museum of Natural History 45 (4), 2005, S. 271–311
- H. Gregory McDonald und Oscar Carranza-Castañeda: Increased xenarthran diversity of the Great American Biotic Interchange: a new genus and species of ground sloth (Mammalia, Xenarthra, Megalonychidae) from the Hemphillian (late Miocene) of Jalisco, Mexico. Journal of Paleontology 91 (5), 2017, S. 1069–1082
- Ascanio D. Rincón, Ana L. Valerio und César Laurito: First fossil record of a Megatheriidae-Megatheriinae in the Early Hemphillian (Late Miocene) from San Gerardo de Limoncito, Curré Formation, Costa Rica. Revista Geológica de América Central 62, 2020, doi:10.15517/rgac.v62i0.41278
- H. Gregory McDonald: Paleoecology of extinct Xenarthrans and the Great American Biotic Interchange. Bulletin of the Florida Museum of Natural History 45 (4), 2005, S. 313–333
- Luciano Brambilla und Damián Alberto Ibarra: Archaeomylodon sampedrinensis, gen. et sp. nov., a new mylodontine from the middle Pleistocene of Pampean Region, Argentina. Journal of Vertebrate Paleontology 38 (6), 2018, S. e1542308, doi:10.1080/02724634.2018.1542308
- Bruce J. Shockey, Rodolfo Salas-Gismondi, Patrice Baby, Jean-Loup Guyot, María Cristina Baltazar, Luis Huamán, Andrew Clack, Marcelo Stucchi, François Pujos, Jenna María Emerson und John J. Flynn: New Pleistocene cave faunas of the Andes of Central Peru: radiocarbon ages and the survival of low latitude, Pleistocene DNA. Palaeontologia Electronica 12 (3), 2009, 15A (PDF)
- H. Gregory McDonald, Ascanio D. Rincón und Timothy J. Gaudin: A New Genus of Megalonychid Sloth (Mammalia, Xenarthra) from the Late Pleistocene (Lujanian) of Sierra De Perija, Zulia State, Venezuela. Journal of Vertebrate Paleontology 33 (5), 2013, S. 1226–1238
- Gerardo De Iuliis, François Pujos und Cástor Cartelle: A new ground sloth (Mammalia: Xenarthra) from the Quaternary of Brazil. Comptes Rendus Palevol 8, 2009, S. 705–715
- H. Gregory McDonald, James C. Chatters und Timothy J. Gaudin: A new genus of megalonychid ground sloth (Mammalia, Xenarthra) from the late Pleistocene of Quintana Roo, Mexico. Journal of Vertebrate Paleontology 37 (3), 2017, S. e1307206, doi:10.1080/02724634.2017.1307206
- Sarah R. Stinnesbeck, Eberhard Frey, Jerónimo Avíles Olguín, Wolfgang Stinnesbeck, Patrick Zell, Heinrich Mallison, Arturo González González, Eugenio Aceves Núñez, Adriana Velázquez Morlet, Alejandro Terrazas Mata, Martha Benavente Sanvicente, Fabio Hering und Carmen Rojas Sandoval: Xibalbaonyx oviceps, a new megalonychid ground sloth (Folivora, Xenarthra) from the Late Pleistocene of the Yucatán Peninsula, Mexico, and its paleobiogeographic significance. Paläontologische Zeitschrift 91 (2), 2017, S. 245–271
- Claudio Latorre: Paleontología de mamíferos del alero Tres Arroyos 1, Tierra del Fuego. Anales del Instituto de la Patagonia 26, 1998, S. 77–90
- Luis Alberto Borrero und Fabiana María Martin: Taphonomic observations on ground sloth bone and dung from Cueva del Milodón, Ultima Esperanza, Chile: 100 years of research history. Quaternary International 278, 2012, S. 3–11
- Fabiana Martin, Manuel San Román, Flavia Morello, Dominique Todisco, Francisco J. Prevosti und Luis A. Borrero: Land of the ground sloths: Recent research at Cueva Chica, Ultima Esperanza, Chile. Quaternary International 305, 2013, S. 56–66
- Dilce de Fátima Rossetti, Peter Mann de Toledo, Heloísa Maria Moraes-Santos und Antônio Emídio de Araújo Santos, Jr.: Reconstructing habitats in central Amazonia using megafauna, sedimentology, radiocarbon, and isotope analyses. Quaternary Research 61, 2004, S. 289–300
- Nicholas J. Czaplewski und Cástor Cartelle: Pleistocene Bats from Cave Deposits in Bahia, Brazil. Journal of Mammalogy 79 (3), 1998, S. 784–803
- Gustavo Martínez, María A. Gutiérrez und Eduardo P. Tonni: Paleoenvironments and faunal extinctions: Analysis of the archaeological assemblages at the Paso Otero locality (Argentina) during the Late Pleistocene-Early Holocene. Quaternary International 299, 2013, S. 53–63
- Gustavo G. Politis und Pablo G. Messineo: The Campo Laborde site: New evidence for the Holocene survival of Pleistocene megafauna in the Argentine Pampas. Quaternary International 191, 2008, S. 98–114
- Gustavo G. Politis, Pablo G. Messineo, Thomas W. Stafford Jr. und Emily L. Lindsey: Campo Laborde: A Late Pleistocene giant ground sloth kill and butchering site in the Pampas. Science Advances 5, 2019, S. eaau4546, doi:10.1126/sciadv.aau4546
- Blaine W. Schubert, Russell Wm. Graham, H. Gregory McDonald, Eric C. Grimm und Thomas W. Stafford, Jr Latest Pleistocene paleoecology of Jefferson’s ground sloth (Megalonyx jeffersonii) and elk-moose (Cervalces scotti) in northern Illinois. Quaternary Research 61, 2004, S. 231–240
- Anthony D. Barnosky und Emily L. Lindsey: Timing of Quaternary megafaunal extinction in South America in relation to human arrival and climate change. Quaternary International 217, 2010, S. 10–29
- Donald Jackson S.: Evaluating evidence of cultural associations of Mylodon in the semiarid region of Chile. In: L. Miotti, M. Salemme und M. Flegenheimer (Hrsg.): Where the south winds blow: ancient evidence of Paleo South Americans. Texas A&M University, 2003, S. 77–81
- Mário André Trindade Dantas, Albérico Nogueira de Queiroz, Fabiana Vieira dos Santos und Mario Alberto Cozzuol: An anthropogenic modification in an Eremotherium tooth from northeastern Brazil. Quaternary International 253, 2012, S. 107–109
- Alex Hubbe, Paulo M. Haddad-Martim, Mark Hubbe und Walter A. Neves: Comments on: “An anthropogenic modification in an Eremotherium tooth from northeastern Brazil”. Quaternary International 269, 2012, S. 94–96
- Michael D. Cannon und David J. Meltzer: Early Paleoindian foraging: examining the faunal evidence for large mammal specialization andregional variability in prey choice. Quaternary Science Reviews 23, 2004, S. 1955–1987
- David Bustos, Jackson Jakeway, Tommy M. Urban, Vance T. Holliday, Brendan Fenerty, David A. Raichlen, Marcin Budka, Sally C. Reynolds, Bruce D. Allen, David W. Love, Vincent L. Santucci, Daniel Odess, Patrick Willey, H. Gregory McDonald und Matthew R. Bennett: Footprints preserve terminal Pleistocene hunt? Human-sloth interactions in North America. Science Advances 4, 2018, S. eaar7621
- David W. Steadman, Paul S. Martin, Ross D. E. MacPhee, A. J. T. Jull, H. Gregory McDonald, Charles A. Woods, Manuel Iturralde-Vinent und Gregory W. L. Hodgins: Asynchronous extinction of late Quaternary sloths on continents and islands. PNAS 102, 2005, S. 11763–11768
- Ross D. E. MacPhee, Manuel Iturralde-Vinent und Osvaldo Jimeénez Vázquez: Prehistoric Sloth Extinctions in Cuba: Implications of a New “Last” Appearance Date. Caribbean Journal of Science 43 (1), 2007, S. 94–98
- Timothy J. Gaudin und Darin A. Croft: Paleogene Xenarthra and the evolution of South American mammals. Journal of Mammalogy 96 (4), 2015, S. 622–634
- François Pujos, Gerardo De Iuliis und Cástor Cartelle: A Paleogeographic Overview of Tropical Fossil Sloths: Towards an Understanding of the Origin of Extant Suspensory Sloths? Journal of Mammalian Evolution 24 (1), 2017, S. 19–38, doi:10.1007/s10914-016-9330-4
- Frédéric Delsuc, François M. Catzeflis, Michael J. Stanhope und Emmanuel J. P. Douzery: The evolution of armadillos, anteaters and sloths depicted by nuclear and mitochondrial phylogenies: Implications for the status of the enigmatic fossil Eurotamandua. Proceedings of the Royal Society London B 268, 2001, S. 1605–1615
- Mathurin-Jacques Brisson: Regnum animale in classes IX distributum sive Synopsis methodica. Haak, Paris, Leiden 1756–1762, S. 1–296 (S. 21–23) ()
- Albert Seba: Locupletissimi rerum naturalium thesauri accurata descriptio, et iconibus artificiosissimis expressio, per universam physices historiam. Amsterdam, 1734, Taf. 34 sowie S. 53 ()
- Richard Owen: Description of the Skeleton of an Extinct Gigantic Sloth, Mylodon robustus Owen, with Observations on the Osteology, Natural Affinities, and Probable Habits of the Megatheroid Quadrupeds in General. R and J Taylor, London, 1842, S. 1–176 (S. 167 und 168)
- International Commission on Zoological Nomenclature: International Code of Zoological Nomenclature. London () (Kapitel 12, Artikel 52–60)
- Robert Hoffstetter: Remarques sur la phylogénie et la classification des édentés xénarthres (mammiféres) actuels et fossiles. Bulletin du Muséum National d’Histoire Naturelle 2. Série 41 (1), 1969, S. 91–103 ()
- Richard M. Fariña und Sergio F. Vizcaíno: Slow moving or browsers? A note on nomenclature. Senckenbergiana biologica 83, 2003, S. 3–4
- Alfred L. Gardner: Order Pilosa Flower, 1883. In: Alfred L. Gardner (Hrsg.): Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008 (S. 157–158)
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 34 ()
- Carl von Linné: Systema naturae. 1. Auflage, 1735, ohne Seitenangabe ()
- Thomas Jefferson: A Memoir on the Discovery of Certain Bones of a Quadruped of the Clawed Kind in the Western Parts of Virginia. Transactions of the American Philosophical Society 4, 1799, S. 246–260
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 69–72)
- Juan Carlos Fernicola, Sergio F. Vizcaíno und Gerardo De Iuliis: The fossil mammals collected by Charles Darwin in South America during his travels on board the HMS Beagle. Revista de la Asociación Geológica Argentina 64 (1), 2009, S. 147–159
- IUCN: IUCN Red List of Threatened Species. Version 2013.2. ()