Rüssel
Der Rüssel (neulat. Proboscis von griech. προβοσκίς) im engeren Sinne stellt ein Organ dar, das aus der Verschmelzung der Nase mit der Oberlippe entstand, was zur Bildung eines langgestreckten, fleischig-muskulösen Schlauches bei Elefanten und Tapiren führte. Im weiteren Sinne bezeichnet der Begriff die in mehr oder weniger ähnlicher Art verlängerten Mund- und Nasenabschnitte bei vielen anderen Tieren. Die Bezeichnung Rüssel wird vor allem im Bereich der Säugetiere und der Wirbellosen verwendet. Ein echter Rüssel wie bei Elefanten und Tapiren zeichnet sich durch eine hohe Flexibilität mit variantenreicher Nutzbarkeit aus, wobei neben der Atmung die aktive Nahrungsaufnahme von hoher Bedeutung ist. Die weiteren rüsselartigen Bildungen sind in ihrer Funktionalität zumeist eingeschränkt und stehen in vielen Fällen nicht im direkten Zusammenhang mit der Ernährung.

Rüssel im engeren Sinne bei Säugetieren
Funktion des echten Rüssels

Die mit den Elefanten und deren engere und weitere Verwandtschaft (Rüsseltiere oder Proboscidea) verbundene Bezeichnung Proboscis schließt somit eine Nasenstruktur ein, die neben ihrer originären Funktion als Riechorgan zudem in erster Linie als Greifhand für die Nahrungsaufnahme eingesetzt wird. Darüber hinaus dient sie als Saug- und Druckpumpe beim Trinken oder beim Sandbaden, als Werkzeug zur Körperpflege, als Transportmittel, als Waffe, als Schnorchel oder zur sozialen Interaktion zwischen einzelnen Individuen (etwa im gegenseitigen Umschlingen der Rüssel) sowie zur Kommunikation (etwa bei Drohgebärden oder Dominanzansprüchen). Im Gegensatz zur hohen Funktionalität des Elefantenrüssels ist der kurze Rüssel der Tapire neben der Atmung und der Nahrungsaufnahme weniger vielseitig einsetzbar. So ist die Größe der mit dem Rüssel benutzbaren Objekte stark begrenzt. Allerdings dient er wie bei den Elefanten zur sozialen Kommunikation (etwa beim Flehmen) oder als Schnorchel.[1]
Anatomische Voraussetzungen
_at_the_Royal_Veterinary_College_anatomy_museum.JPG.webp)
Funktional echte Rüssel kommen heute nur bei den Elefanten (Elephantidae) und den Tapiren (Tapiridae) innerhalb der Gruppe der Säugetiere vor. Der echte Rüssel meint eine Verschmelzung der Nase mit der Oberlippe und die Herausbildung eines langgestreckten, fleischigen Schlauches mit den Nasenlöchern am unteren, freien Ende und einem fehlenden knöchernen oder knorpeligen Unterbau. Er besteht hauptsächlich aus Muskeln, Nervenbahnen, Bindegewebe, Blut- und Lymphgefäßen sowie Haut und Haaren. Knorpelgewebe befindet sich nur am Schädel und trennt unter anderem die beiden Nasenlöcher. Die hohe Biegsamkeit und Beweglichkeit des Rüssels wird durch eine große Anzahl an längs- und quergerichteten sowie schraubenartig oder schräg verlaufenden Muskelsträngen gewährleistet. Die Anzahl der Einzelmuskeln bei Elefanten beträgt schätzungsweise rund 150.000.[1][2][3]

Bei der evolutiven Entstehung des hochfunktionalen Rüssels der Elefanten und Tapire kam es im Verlauf der Stammesgeschichte neben den Veränderungen in der Weichteilmorphologie (Nase und Oberlippe) auch zu zahlreichen skelettanatomischen Umbauten am Schädel. Dies betrifft vor allem eine extreme Reduktion im Bereich des Nasenbeins, das nur noch als kurzer Fortsatz besteht. Die Nasenöffnungen sind dadurch teilweise massiv erweitert. Bei beiden ist das Nasenbein zudem stark nach hinten am Schädel versetzt, so dass bei den Tapiren der Naseninnenraum bis oberhalb der Orbita reicht und bis zu 75 % der Schädellänge einnimmt, wovon der Nasenvorraum wiederum drei Viertel beansprucht. Andere Knochen des Gesichtsschädels, wie der Oberkiefer oder der Zwischenkieferknochen nahmen bei Elefanten und Tapiren dagegen an Massivität zu und fungieren als Ansatz für die Muskulatur des Rüssels. Das Mittelkieferbein hat vollständig den Kontakt zum Nasenbein verloren, bei den Elefanten bildet es die massiven Alveolen der Stoßzähne. Sowohl bei den Elefanten als auch bei den Tapiren sind diese Veränderungen deutlich im Schädelbau erkennbar, die Reduktion der oberen Gesichtsschädel war notwendig, damit die ausgedehnte Rüsselmuskulatur genug Platz bekam. Allerdings ist der Umbau des Schädels bei den Elefanten wesentlich weiter fortgeschritten und betrifft auch weite Bereiche des Ober- und Unterkiefers und des Gebisses. So reduzierte sich das vordere Gebiss deutlich, da bei den heutigen und zahlreichen ausgestorbenen Vertretern bis auf die Stoßzähne keine Schneidezähne mehr ausgebildet sind, deren Funktion durch die primäre Nahrungsaufnahme mit dem Rüssel verloren ging. Die Tapire dagegen besitzen noch ein vollständiges vorderes Gebiss, dass aber durch kleine Schneidezähne (bis auf den oberen äußeren, der einem Eckzahn ähnelt) funktional etwas umstrukturiert ist.[1][2][3]
Evolution des Rüssels
Die Entwicklung eines Rüssels begann sowohl bei Elefanten als auch bei Tapiren relativ früh in der Stammesgeschichte. Bei den Elefanten ist sie verbunden mit der zunehmenden Körpergröße einhergehend mit der Ausbildung langer, säulenartiger Beine, einer Verkürzung des Nackens und damit einer sehr hohen Lage des Schädels. Dabei entstand der Rüssel zur Überbrückung der Distanz zwischen Kopf und Boden und ist somit ein überlebenswichtiges Organ. Möglicherweise waren schon bei den frühen Vertretern der Rüsseltiere des Eozäns wie Numidotherium oder Barytherium Rüssel ausgebildet, wobei dies meist nur durch die Struktur und hohe Lage des Nasenbeins indiziert wird. Bei anderen frühen Rüsseltieren wie Moeritherium wird dagegen kein Rüssel angenommen. Die Entwicklung vollzog sich stufenweise und begann mit einem tapirartigen, kurzen Rüssel, der teilweise auch für das riesige Deinotherium postuliert wird.[4] Ob sich der Rüssel der heutigen Elefanten nur einmal entwickelte oder in den verschiedenen Linien der Rüsseltiere mehrfach unabhängig entstand, ist bisher unbekannt.[5] Bei den Tapiren bildete sich ebenfalls der Rüssel bereits bei Formen des Eozäns aus der Gruppe der Tapiroidea heraus. Sehr frühe Formen wie Heptodon oder Hyrachyus besaßen noch einen kleinen, vorgerückten Naseninnenraum, der eher an Pferde erinnerte. Bei anderen Vertretern wie Helaletes war der Naseninnenraum schon weit nach hinten gezogen und endete oberhalb der mittleren Prämolaren. Allerdings war das Nasenbein noch sehr lang, was gegen einen deutlichen Rüssel spricht, da der in diesem dann eingebettete Knochen dessen Beweglichkeit stark eingeschränkt hätte. Dem gegenüber zeigte Colodon aus dem Übergang zum Oligozän schon ein stark reduziertes Nasenbein, was einen Rüssel bei diesem sehr wahrscheinlich macht.[6][7] Somit bildeten sich sowohl bei den Elefanten als auch bei den Tapiren der Rüssel vor rund 30 Millionen Jahren heraus, bei den Vorfahren der Elefanten setzte sich diese Entwicklung aber im Nachfolgenden tiefgreifender fort.[1]
Die bekannten auffälligen skelettanatomischen Veränderungen, die mit der Bildung eines Rüssels einhergehen, können als Vergleich bei ausgestorbenen Säugetiergruppen herangezogen. So weisen einige, heute nicht mehr existente Gruppen ähnliche Umgestaltungen des Schädels auf, die einen echten Rüssel bei diesen annehmen lassen. Dazu gehören unter anderem die eozänen bis oligozänen Amynodontidae aus der näheren Verwandtschaft der Nashörner, deren Schädelstruktur der späten Formen wie Amynodontopsis und Cadurcodon mit dem stark zurückentwickelten Nasenbein an die der Tapire erinnert, ebenso wie sich beide Gruppen in der Gebissstruktur gleichen.[8] Als ein mögliches Beispiel konvergenter Evolution zu den Rüsseltieren können die Astrapotheria angesehen werden, die zu den Südamerikanischen Huftieren gehören und vom Eozän bis zum Miozän lebten. Bei diesen kam es wie etwa bei den riesigen Astrapotherium und Granastrapotherium nicht nur zu einer extremem Zurückbildung des Nasenbeins, sondern auch zum vollständigen Verlust der Schneidezähne und der Entwicklung der Eckzähne zu ausgeprägten Stoßzähnen, die bis zu 1 m lang wurden. Zudem war der Oberkiefer gegenüber dem Unterkiefer stark in der Länge geschrumpft, so dass eine Nahrungsaufnahme nur über ein zusätzliches Organ wie einem Rüssel möglich war. Abnutzungsspuren an den Stoßzähnen, die denen der heutigen Elefanten gleichen und auf ein effektives Zusammenarbeiten von Stoßzahn und Rüssel deuten, lassen annehmen, dass der Rüssel bei den Astrapotheria wenigsten so lang war, dass er die Spitzen der Stoßzähne erreichen konnte.[9][10] Andererseits wird auch für das pleistozäne Macrauchenia aus der Gruppe der Litopterna aufgrund der Gestaltung des vorderen Schädels von einem Rüssel ausgegangen.[11]
Etymologie
Das in der Wissenschaftssprache verwendete Wort Proboscis stammt ursprünglich aus dem Griechischen (προβοσκίς, proboskís) und wird allgemein mit „Rüssel“ übersetzt. Es wurde in dieser Form auch in das Neulateinische übernommen.[12][13] Die griechische Vorsilbe προ- (pro-) bedeutet dabei so viel wie „sich vor etwas befinden“, der Wortstamm bezieht sich auf die griechischen Wörter βοσκή (boskḗ „Futter“, „Weide“) und βόσκειν (bóskein „weiden“, „füttern“ bzw. βόσκω bósko „ich weide“). Somit steht der Rüssel ursächlich mit der Nahrungsaufnahme im Zusammenhang (teilweise wird Proboscis auch einfach mit „vor dem Maul“ übersetzt[14]). Das Wort proboskís wurde bereits von Aristoteles im 4. Jahrhundert v. Chr. im Bezug auf den Elefantenrüssel verwendet,[15] dürfte nach Ansicht einiger Wissenschaftler aber wesentlich älter sein. Aristoteles beschrieb in seinen Werken De partibus animalium und Historia animalium den Rüssel sehr ausführlich und bemerkte, dass Elefanten diesen wie eine Hand einsetzen würden. Sie verwenden den Rüssel seinen Ausführungen zufolge zum Ergreifen von Nahrung, um diese anschließend ins Maul zu stecken. Weiterhin würden sie mit dessen Hilfe trinken, andere Gegenstände berühren beziehungsweise den Rüssel darum wickeln oder etwas transportieren. Zudem war Aristoteles bewusst, dass der Rüssel keine Knochen besitzt und diesem Umstand seine hohe Biegsamkeit verdankt, und dass Elefanten ohne Rüssel auch keine Nahrung zu sich nehmen können.[16]
Tierhaltung
In der Zootierhaltung dient mitunter das Rüsselloch als technisches Hilfsmittel bei der Fütterung.
Rüsselartige Bildungen im weiteren Sinne bei Säugetieren

Im weiteren Sinne bezeichnet der Begriff Rüssel häufig verlängerte oder vergrößerte Nasenpartien bei vielen anderen Säugetieren, die aber streng genommen keine echten Rüsselbildungen darstellen. Hierzu gehören etwa die Nasenaffen (Nasalis), Nasenbären (Nasua), Igel (Erinaceidae), Spitzmäuse (Soricidae), Rüsselspringer (Macroscelidea), Tenreks (Tenrecidae), Opossums (Caenolestidae) Nasenbeutler (Peramelemorphia) oder einige Vertreter der Paarhufer (Artiodactyla), beispielsweise Schweine (Suidae), Saigaantilopen (Saiga) oder Dikdiks (Madoqua). In vielen Fällen fand hier aber kein gravierender anatomischer Umbau des Schädels statt, sondern es kam Großteils zu Veränderungen im Weichteilgewebe. So ist bei den Rüsselspringern das Rostrum kompakt gebaut mit langgezogenen Nasenbein, die ausgezogene Nase wird überwiegend aus Knorpel gebildet, die Oberlippe besteht separat und ist nicht mit der Nase verschmolzen. Zwar wird die Nase bei der Suche nach Nahrung sondierend eingesetzt und ist als Riechorgan äußerst mobil, die Nahrungsaufnahme erfolgt letztendlich mit der für Insektenfresser typischen verlängerten Zunge.[17] Bei zahlreichen Paarhufern sind die Nasenbeine deutlich reduziert oder nach hinten versetzt. bei der Saiga ist der Naseninnenraum zusätzlich extrem vergrößert und der Zwischenkieferknochen derartig umgestaltet, dass er eine muskulöse große Nase trägt, die teilweise über die Oberlippe hängt. Sie stellt aber eine spezielle Anpassung zur Filterung von Staub in trockenen Landschaften dar.[18] Ähnlich verhält es sich mit der ebenfalls ausgedehnten und vorn überhängenden Nase des Elchs, die aber so nur bei ausgewachsenen Individuen auftritt. Ihre direkte Funktion ist unbekannt, teilweise wird spekuliert, dass es sich hierbei um eine Anpassung handelt, die das Fressen von Wasserpflanzen ermöglicht, wobei Elche zu deren Erwerb bis zu 5 m tief tauchen und etwa eine Minute oder mehr unter Wasser verbleiben.[19][1]
Prinzipiell erreicht keine der besonderen Nasenbildungen bei den Säugetieren die hohe Funktionalität der Rüssel der Elefanten oder der Tapire. Sie stehen auch nicht mit der direkten Nahrungsaufnahme in Verbindung, sondern stellen jeweilige Anpassungen an die ökologischen Umstände dar. Abseits von der Tatsache, dass zahlreiche der Strukturen häufig als „Rüssel“ (Proboscis) bezeichnet werden, wurden Vorschläge für eine differenziertere Unterscheidung gemacht. So sollten nach Meinung einiger Wissenschaftler reine Verlängerungen der Nase, die die Nasenlöcher mit einbeziehen aber nicht die Oberlippe und die je nach Art oder Gruppe eine unterschiedliche, zumeist aber begrenzte Funktion besitzen wie etwa bei den Rüsselspringern, der Saiga und dem Elch, als Prorhiscis bezeichnet werden (griechisch ῥίς (rhīs) für „Nase“).[1]
Weitere rüsselartige Bildungen im Tierreich
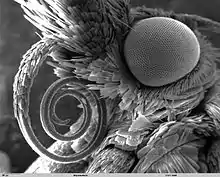

Weder Vögel noch Reptilien, mit Ausnahme einiger Weichschildkröten, besitzen ausgeprägte rüsselartige Strukturen. Bei einigen Fischen sind aber Verlängerungen der Nase oder Streckungen der Schnauze bekannt, die teilweise als rüsselartig bezeichnet werden. Hierzu gehören etwa Langnasenchimären (Rhinochimaera), Pflugnasenchimären (Callorhinchidae), Löffelstöre (Polyodon), Stachelaale (Mastacembelidae) oder die Nilhechte (Mormyridae).[1]
Des Weiteren sind bei einigen Wirbellosen die Mundwerkzeuge derartig umgestaltet, dass häufig von Rüsseln gesprochen wird, wie beispielsweise der Saugrüssel der Schmetterlinge, der zum Aufsaugen des Blütennektars oder (bei wenigen Arten) des Blutes warmblütiger Lebewesen, im Bedarfsfall auch zum Anritzen von Blüten dient und im Ruhezustand eingezogen oder eingerollt wird. Darüber hinaus stellt der Saugrüssel der Fliegen und Wanzen ein Saugorgan dar, das im Bedarfsfall auch zum vorherigen Aufstechen von Oberflächen verwendet wird. Bei Rüsselkäfern und einigen wenigen anderen Käferfamilien wird die Verlängerung des Kopfes Rüssel genannt, die Mundwerkzeuge sitzen jedoch an der Spitze des unbeweglichen Rüssels.[20][21]
Viele marine Schnecken, insbesondere fleischfressende, haben einen langen ausstreckbaren Rüssel (Proboscis), mithilfe dessen sie durch Lücken in der Schale oder gebohrte Löcher (Mondschnecken, Stachelschnecken) an die Weichteile der Beute gelangen oder die Schale mit Säure auflösen (Tonnenschnecken). Einige parasitieren mithilfe ihres sehr langen Rüssels an Fischen, so die Zwergtritonshörner der Gattung Colubraria[22][23] oder Gitterschnecken der Gattung Cancellaria.[24]
Einzelnachweise
- Antoni V. Milewski und Ellen S. Dierenfeld: Structural and functional comparison of the proboscis between tapirs and other extant and extinct vertebrates. Integrative Zoology 8, 2013, S. 84–94.
- Lawrence M. Witmer, Scott D. Sampson und Nikos Solounias: The proboscis of tapirs (Mammalia: Perissodactyla): a case study in novel narial anatomy. Journal of Zoology 249, 1999, S. 249–267.
- Jeheskel Shoshani: Skeletal and basic anatomical features of elephants. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 9–20.
- G. N. Markov, N. Spassov und V. Simeonovski: A reconstruction of the facial morphology and feeding behaviour of the deinotheres. In: G. Cavarretta et al. (Eds.): The World of Elephants – International Congress. Consiglio Nazionale delle Ricerche. Rom, 2001, S. 652–655.
- Jeheskel Shoshani, Robert M. West, Nicholas Court, Robert J. G. Savage, John M. Harris: The earliest proboscideans: general plan, taxonomy, and palaeoecology. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and Palaeoecology of the Elephants and their Relatives. Oxford, New York, Tokyo, 1996, S. 57–75.
- Robert M. Schoch: A review of the Tapiroids. In: Donald R. Prothero und Robert M. Schoch (Hrsg.): The evolution of Perissodactyls. New York und Oxford, 1989, S. 298–320.
- Leonard B. Radinsky: Origin and Early Evolution of North American Tapiroidea. Peabody Museum of Natural History Yale University Bulletin 17, 1963, S. 1–106.
- William P. Wall: Cranial evidence for a proboscis in Cadurcodon and a review of snout structure in the family Amynodontidae (Perissodactyla, Rhinocerotoidea). Journal of Paleontology 54 (5), S. 968–977.
- Steven J. Johnson und Richard H. Madden: Uruguaytheriine astrapotheres of tropical South America. In: Richard F. Kay, Richard H. Madden, Richard L. Cifelli und John J. Flynn (Hrsg.): Vertebrate Paleontology in the Neotropics. The Miocene Fauna of La Venta, Colombia. Smithsonian Institution Press, Washington, 1997, S. 355–382.
- M. C. Vallejo-Pareja, J. D. Carrillo, J. W. Moreno-Bernal, M. Pardo-Jaramillo, D. F. Rodriguez-Gonzalez und J. Muñoz-Duran: Hilarcotherium castanedaii, gen. et sp. nov., a new Miocene astrapothere (Mammalia, Astrapotheriidae) from the Upper Magdalena Valley, Colombia. Journal of Vertebrate Paleontology 2015, doi:10.1080/02724634.2014.903960.
- Bruce J. MacFadden und Bruce J. Shockey: Ancient feeding ecology and niche differentiation of Pleistocene mammalian herbivores from Tarija, Bolivia: morphological and isotopic evidence. Paleobiology 23, 1997, S. 77–100.
- Karl Ernst Georges: Ausführliches lateinisch-deutsches Handwörterbuch. 8., verbesserte und vermehrte Auflage. Hahnsche Buchhandlung, Hannover, 1918 ()
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck, Vieweg & Sohn, Braunschweig, 1914 ()
- Jeheskel Shoshani und Pascal Tassy: Order Proboscidea - Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 173–175.
- Wilhelm Pape: Handwörterbuch der griechischen Sprache. Braunschweig, 1914 ().
- Merlin Peris: Aristotle's Notices on the Elephant. Gajah 22, 2003, S. 71–75.
- Jean E. Kratzing und Peter F. Woodall: The rostral nasal anatomy of 2 elephant shrews. Journal of Anatomy 157, 1988, S. 135–143.
- Andrew B. Clifford und Lawrence M. Witmer: Case studies in novel narial anatomy: 3. Structure and function of the nasal cavity of saiga (Artiodactyla: Bovidae:Saiga tatarica). Journal of Zoology 264, 2004, S. 217–230.
- Andrew B. Clifford und Lawrence M. Witmer: Case studies in novel narial anatomy: 2. The enigmatic nose of moose (Artiodactyla: Cervidae:Alces alces). Journal of Zoology 262, 2004, S. 339–360.
- Harald W. Krenn und Horst Aspöck: Form, function and evolution of the mouthparts of blood-feeding Arthropoda. Arthropod Structure & Development 41, 2012, S. 101–118.
- Jessica I. Grant, Dylan M. Djani und Matthew S. Lehnert: Functionality of a reduced proboscis: fluid uptake by Phigalia strigataria (Minot) (Geometridae: Ennominae). Journal of the Lepidopterists’ Society 66 (4), 2012, S. 211–215.
- Philippe Bouchet und Doug Perrine: More gastropods feeding at night on parrotfishes. Bulletin of Marine Science 59, 1996, S. 224–228.
- Marco Oliverio und Maria Vittoria Modica: Relationships of the haematophagous marine snail Colubraria (Rachiglossa, Colubrariidae), within the neogastropod phylogenetic framework. Zoological Journal of the Linnean Society 158, 2009, S. 779–800.
- J. B. O’Sullivan, R. R. McConnaughey und M. E. Huber: A blood-sucking snail: the Cooper's nutmeg, Cancellaria cooperi Gabb, parasitises the California electric ray, Torpedo californica Ayres. Biological Bulletin 172, 1997, S. 362–366.