Rüsseltiere
Die Rüsseltiere (Proboscidea) sind eine Ordnung der Säugetiere, der heute nur noch die Familie der Elefanten angehört. Diese vereint mit dem Afrikanischen Elefanten, dem Waldelefanten und dem Asiatischen Elefanten drei Arten. Benannt wurde die Ordnung nach ihrem Rüssel als auffälligstem äußerem Merkmal. Weitere Charakteristika finden sich bei den heutigen Vertretern in dem generell großen und massiven Körperbau mit säulenförmigen Beinen, dem voluminösen Kopf und kurzen Hals sowie den Stoßzähnen, die aus den vergrößerten oberen Schneidezähnen entstanden. Die rezenten Elefanten sind in den tropischen Regionen Afrikas südlich der Sahara, in Süd- und Südostasien wie auch in Teilen Ostasiens verbreitet und nutzen eine Vielzahl unterschiedlicher Landschaftsräume. Sie leben in komplexen Sozialverbänden mit Herden aus Mutter- und Jungtieren sowie einzelgängerischen männlichen Tieren, die mitunter aber auch Junggesellenverbände bilden können. Zwischen den einzelnen Individuen findet eine komplexe Kommunikation statt. Die Nahrung besteht überwiegend aus Pflanzen, hierbei sowohl Gräser als auch Blätter, Früchte und Ähnliches. Die genaue Zusammensetzung variiert mit den Jahreszeiten. In der Regel wird in einem Abstand von mehreren Jahren ein Junges geboren, das in der Herde aufwächst.
| Rüsseltiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Asiatischer Elefant (Elephas maximus) | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Seelandium (Paläozän) bis heute | ||||||||||||
| 60 bis 0 Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Proboscidea | ||||||||||||
| Illiger, 1811 |
Der Ursprung der Ordnung reicht bis in das Paläozän vor rund 60 Millionen Jahren zurück. Die ältesten Formen sind aus dem nördlichen Afrika bekannt. Hierbei handelt es sich um noch relativ kleine, teils aquatisch lebende Tiere ohne Rüssel und Stoßzähne. Beide Merkmale bildeten sich erst später heraus. Es entstanden im Laufe der Stammesgeschichte verschiedene Familien, von denen die Deinotheriidae, die Mammutidae, die Gomphotheriidae und die Stegodontidae die bekanntesten sind. Die Familien und deren Mitglieder spiegeln die Vielgestaltigkeit der Rüsseltiere wider. Spätestens vor rund 20 Millionen Jahren erreichten die Rüsseltiere über eine Landbrücke Eurasien und breiteten sich dort aus. Einige Vertreter wanderten bis nach Amerika, sodass die Rüsseltiere eine fast weltweite Verbreitung aufwiesen, ausgenommen waren Australien, Antarktika und die meisten weit vom Festland entfernten Inseln. Dabei passten sich die Tiere unterschiedlichsten Lebensräumen an, die von den tropischen und waldreichen Ursprungsgebieten bis hin zu Hochgebirgslandschaften und arktischen Offenlanden reichen. Die Elefanten stellen das jüngste Glied der stammesgeschichtlichen Entwicklung dar und traten erstmals vor rund 7 Millionen Jahren im Oberen Miozän in Erscheinung. Zum Ende des Pleistozäns starb ein Großteil der Rüsseltiere aus.
Die wissenschaftliche Bezeichnung der Rüsseltiere als Proboscidea stammt aus dem Jahr 1811. Anfänglich wurde die Gruppe mit den unterschiedlichsten Huftieren assoziiert. Eine angenommene nähere verwandtschaftliche Beziehung zu den Seekühen und den Schliefern kam erstmals in der zweiten Hälfte des 19. Jahrhunderts auf. Diese Gemeinschaft, später unter der Bezeichnung Paenungulata bekannt, konnte in der Folgezeit sowohl skelettanatomisch als auch genetisch und biochemisch untermauert werden. Vor allem die Molekulargenetik stellte im Übergang vom 20. zum 21. Jahrhundert heraus, dass die Rüsseltiere näher mit anderen originär afrikanischen Tieren in Beziehung stehen. Die sich daraus ergebende Verwandtschaftsgruppe, der neben den Paenungulata auch verschiedene insektenfressende Tiere wie die Rüsselspringer, die Tenrekartigen und das Erdferkel angehören, wurde daher mit Afrotheria benannt. Herausragende Arbeit bei der Erforschung der Rüsseltiere leistete im ersten Drittel des 20. Jahrhunderts Henry Fairfield Osborn.
Merkmale
Allgemein und Habitus
.jpg.webp)
Die heutigen Rüsseltiere stellen die größten landlebenden Tiere dar. Das Körpergewicht reicht von 2 bis über 6 t bei einer Schulterhöhe von 2 bis 4 m. Die Tiere zeichnen sich durch einen massigen Körperbau, einen wuchtigen Kopf auf kurzem Hals und säulenförmige Beine aus. Die auffälligsten äußeren Merkmale finden sich in dem namensgebenden, überaus langen Rüssel sowie in den Stoßzähnen und den großen, lamellenartig aufgebauten Mahlzähnen. Der Körper ist in der Regel nur wenig behaart. Eine Besonderheit der Weichteilanatomie stellt die Temporaldrüse seitlich der Augen dar, die nur bei den Elefanten vorkommt.[1][2][3] In ihrer stammesgeschichtlichen Vergangenheit zeigten die Rüsseltiere eine recht hohe Variabilität. Die Körpergröße reichte von rund 8 kg kleinen Tieren aus der frühesten Phase der Ordnung bis hin zu riesenhaften Formen mit bis zu 16 t Körpergewicht.[4][5][6] Hinsichtlich Körpergröße und einzelner äußerer Merkmale wie der Stoßzahnausprägung liegt bei den heutigen Arten ein deutlicher Geschlechtsdimorphismus vor, der sich auch bei einigen ausgestorbenen Formen nachweisen lässt.[7]
Sowohl der Rüssel als auch die Stoßzähne entwickelten sich evolutiv erst nach und nach. Als gemeinsame Kennzeichen (Synapomorphie) aller Rüsseltiere können daher unter anderem die generell vergrößerten mittleren Schneidezähne der oberen Zahnreihe – aus denen heraus später die Stoßzähne entstanden –, der Verlust des vordersten Prämolaren sowie Zahnschmelzprismen mit einem schlüssellochartigem Querschnitt herausgestellt werden.[8][9]
Schädel


Als anatomische Besonderheit weist der sehr große Kopf der Rüsseltiere ein mit luftgefüllten Hohlräumen durchsetztes Schädeldach auf. Diese bienenwabenartig geformten Kammern, die durch dünne Knochenplättchen voneinander getrennt sind, durchziehen das Stirn-, Scheitel- und Nasenbein sowie den Mittelkieferknochen. Sie verringern nicht nur das Gewicht des gesamten Schädels, sondern führen gleichzeitig zu einem enormen Zuwachs an Volumen der Schädeloberfläche. Dieser Volumenzuwachs war notwendig, um einerseits über die mächtige Nackenmuskulatur den Halt des Kopfes inklusive der evolutiv immer größer werdenden Stoßzähne zu gewährleisten, andererseits aber auch um der kräftigen Kaumuskulatur für den massiven Unterkiefer Ansatzfläche zu geben. Die Entwicklung eines derartigen luftgefüllten Schädels begann stammesgeschichtlich schon sehr früh bei den Rüsseltieren und ist bei einigen Vertretern wie Barytherium schon im Oligozän, möglicherweise auch schon im späten Eozän nachgewiesen.[1][10]
Der Unterkiefer zeichnet sich bei zahlreichen frühen Rüsseltieren durch eine verlängerte Symphyse aus, welche am vorderen Ende die beiden Kieferhälften miteinander verbindet. Die Streckung des Unterkieferkörpers resultierte dabei häufig aus der Bildung der unteren Stoßzähne, deren Alveolen seitlich an der Symphyse anlagen. Dadurch weisen diese frühen Rüsseltiere einen eher gestreckten Gesichtsbereich aus und können so als longirostrin („langschnauzig“) betrachtet werden. In mehreren Linien der Rüsseltiere, so bei den Mammutidae, den Gomphotheriidae und den Elephantidae, kam es im weiteren Verlauf der Stammesgeschichte zur Kürzung der Symphyse und damit des Gesichtsbereiches, meist verbunden mit der Reduktion der unteren Stoßzähne. Diese Formen werden als brevirostrin („kurzschnauzig“) bezeichnet.[11]
Allgemein
Das ursprüngliche permanente Rüsseltiergebiss besaß noch die vollständige Bezahnung der Höheren Säugetiere mit 44 Zähnen bestehend aus drei Schneidezähnen, einem Eckzahn, vier Prämolaren und drei Molaren je Kieferast.[5] Daher kann für ursprüngliche Rüsseltiere folgende Zahnformel angegeben werden: . Im Laufe der stammesgeschichtlichen Evolution reduzierte sich die Zahnanzahl kontinuierlich. Dies führte über den Verlust des Eckzahns, der hinteren Schneidezähne und der vorderen Prämolaren hin zum Gebiss der heutigen Elefanten, das nur einen Schneidezahn in der oberen Zahnreihe (Stoßzahn) und drei Molaren je Kieferbogen aufweist. Hinzu kommen drei Milchprämolaren. Die Zahnformel der modernen Rüsseltiere lautet demzufolge: . Zusätzlich wiesen einige ältere Vertreter der Kronengruppe der Rüsseltiere (Loxodonta, Elephas und Mammuthus) noch zwei dauerhafte Prämolaren auf. Der Verlust der Dauerprämolaren erfolgte in den jeweiligen Linien unabhängig voneinander.[12] Die drei Milchprämolaren werden von einigen Experten aufgrund der starken Ähnlichkeit zu den Molaren auch als Milchmolaren angesprochen,[13] sind aber aus ontogenetischer Sicht Prämolaren.[1]
Vorderes Gebiss und Stoßzähne


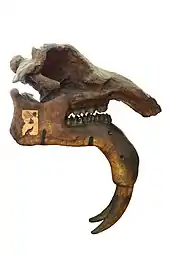
Das markanteste Skelettelement bilden die Stoßzähne, welche die heutigen Elefanten generell in der oberen Zahnreihe tragen. Viele frühe Vertreter der Rüsseltiere wiesen zusätzlich auch Stoßzähne im Unterkiefer auf. Im Fall der Deinotheriidae und einzelner anderer Vertreter kamen sie nur dort vor.[14] Ihre Form ist sehr variabel. So können sie nach oben oder unten gebogen sowie gedrillt sein, beziehungsweise mehr oder weniger gerade verlaufen oder eine Schaufelform aufweisen. Mitunter stehen sie eng beieinander oder weit auseinander. Auch die Länge ist verschieden. Bei frühen Rüsseltieren glichen sie eher Hauern, die oben senkrecht, unten vielfach horizontal aus dem Kiefer herausragten, bei einigen Mammuten und Mammutiden wiesen sie demgegenüber Längen von 4 bis 5 m auf.[15][16] Prinzipiell handelt es sich bei den Stoßzähnen um Bildungen der Schneidezähne, die im Verlauf der Stammesgeschichte in Verbindung mit der allgemeinen Reduktion der Zahnanzahl im Gebiss der Rüsseltiere hypertrophierten und so zu den größten Zähnen aller bekannten ausgestorbenen oder noch lebenden Tiere heranwuchsen.[9] Dabei entstanden die oberen Stoßzähne aus dem jeweils zweiten Schneidezahn (I2) des Kieferastes, während der Ursprung der Unterkieferstoßzähne unter Experten lange diskutiert, mittlerweile aber mit dem ersten Schneidezahn (I1) des Kieferastes identifiziert wurde.[17] Ausnahmen finden sich unter anderem in den Moeritheriidae, bei denen auch die unteren Stoßzähne den zweiten Schneidezähnen entstammen, während bei den Barytheriidae jeder Kieferast zwei Stoßzähne trug, insgesamt also acht ausgebildet waren. Diese entsprachen jeweils den ersten beiden Schneidezähnen des Kieferbogens. Die graduelle Verlängerung der Stoßzähne während der fortlaufenden Stammesgeschichte zog auch funktionale Veränderungen nach sich. Heute setzen Elefanten ihre großen Stoßzähne auf vielfältige Weise ein, etwa unterstützend bei der Nahrungsaufnahme, zum Transport schwerer Gegenstände oder bei Rivalenkämpfen. Ursprünglich aber dienten die Stoßzähne wohl primär der Nahrungsaufnahme. Durch die senkrechte Stellung in der oberen Zahnreihe und die horizontale in der unteren entstand eine Art Schere, mit der Nahrungspflanzen zerschnitten werden konnten.[18]
Da die Stoßzähne der Rüsseltiere häufig einen relativ ähnlichen Bau aufweisen, ist eine genaue Zuweisung bei Einzelfunden eher schwierig. Unterschiede finden sich jedoch im Detail. Strukturell bestehen die Stoßzähne aus drei Einheiten. Im Innern befindet sich die Pulpa, die hauptsächliche Wachstumszone. Diese wird vom Zahnbein umhüllt, welches den Großteil eines Stoßzahns ausmacht und dem eigentlichen „Elfenbein“ entspricht. Es handelt sich um ein Gemisch aus Carbonat-Hydroxylapatit-Kristallen, die mit Kollagenfasern verbunden sind. Erstere sind hauptsächlich für die Härte der Stoßzähne verantwortlich, letztere für die Elastizität. Das Zahnbein ist dadurch stark mineralisiert und frei von Zellen. Gebildet wird es in kleinen Kanälchen, die radial um das Zentrum des Stoßzahns angeordnet sind. In der Regel haben diese Kanälchen variierende Formen, stoßen aber in spitzen Winkeln aneinander. Die näher zum Zentrum gelegenen Kanälchen sind zumeist größer als die randlich gelagerten. Dadurch treten innerhalb eines Stoßzahns Unterschiede in Dichte und absoluter Anzahl der Kanälchen auf. Teilweise werden diese Kanälchen von Zahnbeinrippeln durchbrochen, die parallel zum Stoßzahnkern verlaufen. Dieser generelle Zahnbeinaufbau zeigt innerhalb der Rüsseltiere einzelne Variationen. So haben Vertreter der Mammutidae einen höheren Anteil an Zahnbeinrippeln zum Stoßzahnkern hin, während bei den Gomphotheriidae und Elephantidae die Stoßzähne sowohl nahe der Pulpa als auch zum Rand hin eher homogen aufgebaut sind. Unklar ist hierbei, welche von beiden die ursprünglichere Variante darstellt.[19] Die äußere Hülle des Stoßzahns wird durch eine dünne Lage aus Zahnzement gebildet. Auch hier ergeben sich einzelne Abweichungen zwischen den verschiedenen Rüsseltieren. Vor allem bei stammesgeschichtlich älteren Linien ist häufig noch eine umgebende Schicht aus Zahnschmelz ausgebildet, die den Stoßzahn bandförmig umgibt. Bei den Elephantidae fehlt diese Zahnschmelzschicht zumeist vollständig.[20][21]
Die Stoßzähne heutiger Elefanten besitzen als weitere Auffälligkeit ein internes Muster aus abwechselnd hell und dunkel gefärbten Bereichen. In Zahnlängsrichtung ergeben sie ein Bandmuster, im Zahnquerschnitt hingegen sind sie schachbrettartig angeordnet. Bedingt durch die rundliche Form des Stoßzahns besteht das Schachbrettmuster dadurch aus rhombischen Flächen mit radialer bis tangentialer Anordnung, wodurch optisch der Eindruck eines komplexen spiraligen Gebildes entsteht. Die Winkel, mit denen die Rhomben aneinander anliegen, unterscheiden sich zwischen den Arten und haben somit taxonomischen Wert. Das Muster wird als „Schreger-Linien“ bezeichnet und ist bei Säugetieren anderer Ordnungen mit stoßzahnartigen Bildungen nicht bekannt.[22] Der Ursprung der „Schreger-Linien“ wird kontrovers diskutiert. Nach verschiedenen Theorien entstehen sie entweder durch die Anordnung der Zahnbein-Kanälchen oder durch die spezielle Orientierung der Kollagenfasern.[23][24][21] Histologische Untersuchungen konnten die „Schreger-Linien“ auch bei anderen Rüsseltieren wie Anancus und Stegodon nachweisen, die alle in ein näheres Verwandtschaftsumfeld der Elefanten gehören. Bemerkenswerterweise kommen sie aber bei stammesgeschichtlich älteren Formen wie etwa Deinotherium nicht vor. Einige Forscher gehen daher davon aus, dass es sich um ein einzigartiges Merkmal elephantoider Rüsseltiere handelt, das sich nur einmal während der Rüsseltier-Evolution herausbildete.[25] Allerdings sind „Schreger-Linien“ auch bei Gomphotherium und Mammut dokumentiert.[26][27]
Hinteres Gebiss und Zahnwechsel
Zur systematischen Einteilung der Rüsseltiere wird hauptsächlich der Aufbau der Molaren herangezogen. Die Kaufläche dieser Mahlzähne ist sehr vielgestaltig und der jeweiligen Lebensweise der Tiere angepasst. Die wichtigsten Grundtypen sind folgende:[28][29][30][11]
| Zahntyp | Beschreibung | Beispiele | Foto |
|---|---|---|---|
| bunodont | Grundtypus der Rüsseltierzähne; das Kauflächenmuster besteht aus größeren kegelförmigen Höckern, die paarweise quer zur Längsachse des Zahns angeordnet sind; in der Mitte der Längsachse des Zahns verläuft eine tiefe Rille und teilt die Paare jeweils in der Hälfte; an die Haupthöcker sind kleine Nebenhöcker angelehnt, deren Anzahl im Laufe der Stammesentwicklung von zwei auf vier und mehr je Halbleiste zunehmen kann; zudem kommen Leisten und Grate vor, die mitunter die Längsrille und die Querfurchen zwischen den Leisten versperren; die Anordnung der Höcker, Nebenhöcker und Sperrleisten ist teils irregulär, im abgekauten Zustand entsteht so ein Kleeblattmuster; stammesgeschichtlich jüngere Rüsseltiere entwickeln das bunodonte Muster weiter, so können die einzelnen Halbleisten versetzt zueinander stehen („Anancoidie“), ein V bilden („chevroning“) oder es entstehen zahlreiche Furchen und Kleinhöcker („Ptychodontie“ beziehungsweise „Choerodontie“) | frühe Rüsseltiere wie Eritherium und Saloumia, Moeritheriidae, Gomphotheriidae |  Molar von Gomphotherium |
| zygodont | aus dem bunodonten Typ heraus entwickelt; die Höcker formen einem scharfen Grat, die Längsrille und die Querfurchen werden häufig nicht durch Leisten und Grate blockiert; die Nebenhöcker stehen mit den Haupthöckern in einer Linie, so dass gerade verlaufende Jochen entstehen, die zum Teil auch im abgekauten Zustand sichtbar bleiben; generell sind zygodonte Molaren breiter als bunodonte | Mammutidae |  Molar von Mammut |
| lophodont | ebenfalls aus dem bunodonten Typ heraus entstanden; die kegelförmigen Höcker sind durch scharfe Grate miteinander verwachsen, die sich wiederum aus einer hohen Zunahme der Anzahl der Nebenhöcker formen | Numidotheriidae, Phosphatheriidae, Barytheriidae, Deinotheriidae Stegodontidae |  Molar von Deinotherium |
| lamellodont | wiederum vom bunodonten Muster abgeleitet; der Zahn wird aus lamellenartigen Schmelzfalten gebildet; die Schmelzlamellen resultieren wie die lophodonten Zähne aus der anwachsenden Zahl an Nebenhöckern | Elephantidae |  Molar von Mammuthus |
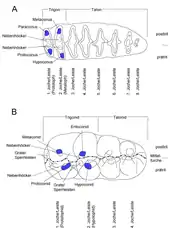
Daneben gibt es einzelne Übergangsformen wie bunolophodont, bunozygodont oder zygolophodont. Die frühesten Rüsseltiere wie Eritherium besaßen ein bunodontes Muster.[5] Die einzelnen Zahnformen bildeten sich dann innerhalb der verschiedenen Rüsseltierlinien unabhängig voneinander heraus. Dadurch wiesen Stammformen einiger Linien wie etwa Losodokodon bei den Mammutidae noch deutlicher bunodonte Molaren auf, aus denen sich dann das typisch zygodonte Muster der Spätformen entwickelte.[31] Die Rüsseltiermolaren lassen sich dabei von den ursprünglich tribosphenischen Zähnen der Höheren Säugetiere herleiten, deren Kauoberfläche stark topographisch gegliedert ist. Die tribosphenischen Zähne bestehen aus einem erhabenen Bereich, Trigon bei den Oberkiefer- und Trigonid bei den Unterkiefermahlzähnen genannt, auf dem sich die drei Haupthöcker befinden. Diese Haupthöcker werden wiederum als Para-, Proto- und Metaconus an den oberen und als Paraconid, Protoconid und Metaconid an den unteren Molaren bezeichnet; in zahlreichen Ableitungen von der tribosphenischen Grundstruktur der Mahlzähne hat sich in vielen Säugetierlinien auf den oberen Molaren ein vierter Höcker, der Hypoconus zumeist unabhängig voneinander herausgeformt. Dem Trigon schließt sich ein niedriger gelegener Abschnitt mit den Nebenhöckern an, der wiederum das sogenannte Talon bei den Oberkiefer- und das Talonid bei den Unterkiefermahlzähnen bildet. Auf den häufig voluminöseren Mahlzähnen des Unterkiefers trägt das Talonid einige größere Höcker, wie das Hypoconid und das Entoconid. Bei den Zähnen der Rüsseltiere umfasst der vordere Teil das Trigon beziehungsweise das Trigonid, der hintere das Talon beziehungsweise das Talonid. Bezogen auf die Oberkiefermolare entspricht das vordere Höckerpaar dem Paraconus und dem Protoconus mit dem Protoloph als Querleiste oder -joche (an den Unterkiefermolaren demzufolge das Protoconid und das Metaconid sowie das Protolophid). Das zweite Höckerpaar wird durch den Metaconus und den Hypoconus gebildet, beide verbindet das Metaloph (an den Unterkiefermolaren entsprechend das Hypoconid und Entoconid sowie das Hypolophid). Die nach hinten folgenden Höckerpaare entstehen dann aus dem Talon/Talonid heraus. Eine Längsrille, die mittig über die gesamte Zahnlänge verläuft, unterteilt die Höckerpaare beziehungsweise Leisten oder Joche in je zwei Halbleisten/Halbjoche, deren zungenseitiger Bereich als Entoloph (Entolophid) und der wangenseitige Bereich als Ectoloph (Ectolophid) bezeichnet wird. Besonders deutlich ist dies bei den bunodonten und zygodonten, weniger jedoch bei den lophodonten und lamellodonten Molaren erkennbar. Alle Rüsseltiermolaren besitzen aber dadurch zwei Zahnteilflächen, die aufgrund des Kaumechanismus der Tiere stärker oder schwächer beansprucht werden. Der stärker abgenutzte Teil wird prätrit, der schwächere posttrit benannt. Im Oberkiefer ist der stärker abgekaute Zahnteil immer zungenseitig, der weniger starke wangenseitig ausgebildet. Bei den Unterkiefermolaren verhält es sich genau umgekehrt.[28][29][30][32]
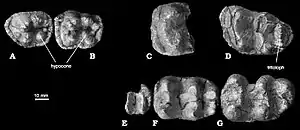

Eine weitere Besonderheit ist die zunehmende Komplexität und relative sowie absolute Vergrößerung der Molaren. Die ersten beiden Mahlzähne der frühesten Rüsseltiere verfügten über insgesamt zwei Höckerpaare, waren also bilophodont (mit zwei Leisten oder Jochen) gestaltet. Der dritte Mahlzahn wies häufig drei Leisten auf, wenn auch die dritte teils schwach entwickelt war. Die Höcker der beiden (vorderen) Leisten entsprechen dem Trigon beziehungsweise dem Trigonid. Im weiteren Verlauf erhöhte sich die Anzahl der Leisten auf den ersten beiden Molaren zunächst auf drei, wodurch trilophodonte Zähne (mit drei Leisten oder Jochen) entstanden. Hier setzte dann auch eine Differenzierung der beiden vorderen Molaren zum hintersten ein, da letzterer in der Regel eine höhere Anzahl an Leisten aufweist, so anfänglich zwischen vier und fünf (generell hat der hinterste untere Molar mehr Leisten als der hinterste obere). Die neuen zusätzlichen Höckerpaare entstanden aus dem Talon beziehungsweise Talonid, jede weitere Leiste stellt prinzipiell nur eine Vervielfältigung der vorhergehenden dar. Bei den modernen Elefanten entwickelte sich dies bis ins Extreme, da beispielsweise innerhalb der Mammute der hinterste Backenzahn bis zu 30 Leisten aufweisen kann. Die Mahlzähne der moderneren Rüsseltierlinien stellen mit Längen von teils über 20 cm und einem Gewicht von mitunter mehr als 5 kg die größten unter den Säugetieren dar.[33][34][28][29][30]
Die heutigen Rüsseltiere haben hochkronige (hypsodonte) Backenzähne, das heißt, die Kronenhöhe eines Molars übertrifft deren Weite deutlich, teilweise um das Doppelte. Die massive Zunahme der Kronenhöhe ist eine Entwicklung der modernen Elefanten und stellt eine Anpassung an harte Grasnahrung dar, begünstigt durch die Ausbreitung der Gräser im Verlauf des Miozäns. Trotzdem ist auch in einzelnen älteren Rüsseltierlinien wie den Gomphotheriidae eine gewisse Zunahme der Kronenhöhe zu verzeichnen.[28][29][30] Der größte Teil der Vertreter der Rüsseltiere wies jedoch niederkronige, also brachyodonte Mahlzähne auf.[33][35] Als eine Besonderheit der entwickelten Rüsseltiere ist die Ausformung des Zahnschmelzes zu betrachten, der aus drei Lagen besteht: einer äußeren Schicht aus radial ausgerichteten Prismen, einer mittleren Schicht aus Hunter-Schreger-Bändern (variabel hell oder dunkel gestreifte Zahnschmelzbänder mit jeweils unterschiedlich gerichteten Prismen) und einer inneren Schicht aus einem dreidimensionalen Geflecht aus miteinander verwobenen Prismenbündeln. Unterschiede bestehen zu den frühesten Rüsseltieren wie den Phosphatheriidae, den Moeritheriidae oder den Phiomiidae bei denen der Zahnschmelz in der Regel nur aus zwei Lagen aufgebaut ist, wobei häufig, aber nicht in jedem Fall, die beiden oberen Lagen vorkommen. Davon abweichend wurden für die Zähne der Deinotheriidae weitgehend nur die verwobenen Prismenbündel berichtet,[36] neuere Studien aus dem Jahr 2021 lassen jedoch annehmen, dass diese einen ähnlich komplexen Zahnschmelzaufbau wie die meisten anderen Rüsseltiere besaßen.[37] Vor allem die dreidimensional verwobenen Bündel werden als besondere Aushärtungsstufe des Zahnschmelzes angesehen, wodurch dieser den horizontal wirkenden Kräften beim Kauvorgang besser widerstehen kann. Demnach entstand bei den Rüsseltieren die besonders harte Variante des Zahnschmelzes weit vor dem Zeitpunkt, zu dem sich höhere Zahnkronen ausbildeten, was als eine Art der Präadaption aufgefasst werden kann.[38]
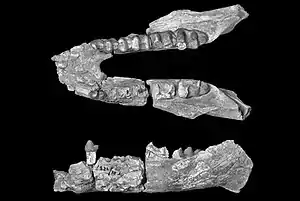

Der Zahnwechsel der heutigen Elefanten erfolgt nicht vertikal wie bei den meisten Säugetieren, sondern horizontal. Dadurch sind von den drei Prämolaren und drei Molaren je Kieferbogen in der Regel nur einer bis anderthalb gleichzeitig in Funktion. Diese durchgebrochenen Zähne werden beim Kauen der Pflanzennahrung stark abgenutzt. Im hinteren Teil des Gebisses bildet sich währenddessen neues Zahnmaterial, das kontinuierlich nach vorn geschoben wird. So steht den Elefanten beim Verlust eines Zahnes jeweils wieder ein neuer zur Verfügung. Dieser Prozess kann nach dem Durchbruch des ersten Milchprämolaren insgesamt fünfmal wiederholt werden, was sechs Zahngenerationen entspricht (drei Milchoprämolaren und drei Molaren). Der horizontale Zahnwechsel entstand durch die Vergrößerung der Zähne infolge der Herausbildung zusätzlicher Leisten und durch die Verkürzung des Kiefers im Verlauf der Rüsseltierevolution, so dass nicht mehr alle Zähne gleichzeitig Platz fanden. Erstmals aufgetreten ist dieses Merkmal im Verlauf des Oligozän. Vor dieser einschneidenden Veränderung wechselten die Rüsseltiere vergleichbar zu anderen Säugetieren ihre Zähne im vertikalen Modus. Bei diesen Vertretern waren demgemäß dann alle Zähne des Dauergebisses gleichzeitig in Funktion. Die Umstellung des Zahnwechsels ist möglicherweise mit einer generellen Änderung im Ernährungsverhalten und im Kauprozess verbunden. Die Deinotheriidae wechselten ihre Zähne vertikal, die gleichzeitig auftretenden und nahezu gleich großen Gomphotheriidae dagegen horizontal. Letztere hatten gegenüber ersteren deutlich größere Zähne mit mehr Leisten, was hinsichtlich Abnutzungserscheinungen und Ähnlichem eine größere Bandbreite an Nahrung ermöglichte.[39][12]
Körperskelett


Besondere skelettanatomische Merkmale sind die säulenförmigen Gliedmaßen, die senkrecht unter dem Körper stehen, wobei die oberen und unteren Partien der Extremitäten einen Winkel von 180° bilden. Dies unterscheidet die Rüsseltiere von zahlreichen anderen Säugetieren, deren Beine in einem leichten Winkel angeordnet sind. Die deutlich vertikale Stellung, die schon bei den Deinotheriidae vollständig ausgebildet war, unterstützte dabei die enorme Gewichtszunahme der frühen Vertreter dieser Ordnung. Urtümliche Rüsseltiere aus dem Eozän wie Numidotherium und Barytherium besaßen noch deutlich angewinkeltere Beine.[40][41][17] Darüber hinaus zeigen die Gliedmaßen mit ihren langen oberen Extremitätenabschnitten gegenüber kurzen unteren Anpassungen an das hohe Gewicht (graviportal). Elle und Speiche sind nicht miteinander verwachsen, fixieren sich allerdings bei Drehung des Vorderbeins gegenseitig. Der Oberschenkelknochen ist vorn und hinten verschmälert. Weiterhin besitzen die Langknochen keine Knochenmarkhöhle, sondern der Raum ist mit Spongiosa gefüllt, was den Beinen eine größere Festigkeit gibt. Die Blutbildung findet dabei in den Zwischenräumen statt.[1] Die einzelnen Hand- und Fußwurzelknochen sind seriell angeordnet, das heißt, sie überschneiden sich an den Gelenkflächen nicht gegenseitig, sondern liegen hintereinander (taxeopod). Vorder- und Hinterfüße weisen in der Regel je fünf Strahlen auf. Als weitere Besonderheit an den Füßen besitzen Rüsseltiere einen sechsten „Zeh“, der jeweils hinter dem Daumen beziehungsweise dem großen Zeh ansetzt. Die Ansatzstelle befindet sich jeweils am oberen (proximalen), nach hinten innen zeigenden Gelenkende des Metacarpus I (Daumen) beziehungsweise des Metatarsus I (großer Zeh) und besteht aus Knorpelmaterial, das teilweise verknöchert ist. Er dient zur Unterstützung der anderen Zehen bei der Stabilisierung des hohen Körpergewichtes. Die Bildungen werden am Vorderfuß als Präpollex („Vordaumen“) beziehungsweise am Hinterfuß als Prähallux („Vorzehe“) bezeichnet. Auch diese sind schon bei den Deinotheriidae nachweisbar und gehen so bis ins frühe Miozän zurück. Die Entwicklung dieser anatomischen Besonderheit hängt mit der enormen Körpergrößenzunahme der Rüsseltiere in jener Zeit zusammen, die verbunden ist mit der Abkehr von der eher amphibischen Lebensweise der frühen Proboscidea-Vertreter hin zu einer rein terrestrischen. Dadurch änderte sich auch die generelle Fußposition. Ursprüngliche Rüsseltiere wiesen eher horizontal orientierte Fußknochen auf und waren funktionell an den Sohlengang angepasst. Bei den heutigen Elefanten bilden die Zehen einen Halbkreis und stehen deutlicher senkrecht gerichtet. Dadurch können die Elefanten als Zehenspitzengänger angesehen werden. Der jeweils sechste „Zeh“ bildete sich dabei wohl als Stützelement während der Umgestaltung der Fußanatomie und der gleichzeitig massiv zunehmenden Körpermasse heraus.[42][8][11]
Rüssel


Auffälligstes Kennzeichen der Rüsseltiere ist der Rüssel, der aus der Verwachsung der Oberlippe mit der Nase entsteht und bei den heutigen Elefanten bereits im Embryonalstadium herausgebildet wird.[43][44] Am unteren Ende des Rüssels treten die beiden Nasengänge heraus. Er besteht aus bis zu 150.000 längs, zirkular oder schräg verlaufenden Muskelfasern einer Vielzahl verschiedener Muskeln und übt als feinfühliges Greiforgan zahlreiche Funktionen aus. Primär überbrückt er die Distanz zwischen dem Kopf und dem Boden, was der kurze Nacken der Tiere nicht mehr leisten kann. Dadurch ist er essenziell bei der Nahrungsaufnahme, indem er bodenbewachsende Pflanzen abreißt oder aber Wasser aufnimmt und zum Maul führt. Umgekehrt kann er auch zum Erreichen höher gelegener Objekte wie etwa Blätter in den Baumkronen eingesetzt werden. Darüber hinaus dient er als Atmungs- und Transportorgan und hat zudem als Tast- und Sinnesorgan eine hohe Bedeutung in der sozialen Kommunikation.[1] Als rein muskuläre Bildung beansprucht der Rüssel einen größeren Teil des Gesichtsbereichs des Schädels. Durch seine Herausformung kam es zu einer massiven Umstrukturierung und Kürzung des knöchernen Unterbaus. Dies beinhaltet vor allem eine deutliche Reduktion des Nasenbeins, das meist nur noch als kurzer Fortsatz besteht. Die Nasenöffnung ist dagegen extrem groß ausgebildet. Durch die Umgestaltung des Gesichtsschädels erhielt die massive Rüsselmuskulatur großflächige Ansatzstellen.[45][46]
Bei fossilen Rüsseltieren ist das Vorhandensein eines Rüssels nur indirekt über die Gesichtsanatomie, hauptsächlich der Nasenregion, ableitbar. Die frühesten Formen wiesen demgemäß wohl noch keinen Rüssel auf. Erste Anzeichen für einen Rüssel finden sich bei Numidotherium aus dem Unteren bis Mittleren Eozän. Die Entwicklung begann möglicherweise über nur kurze, eher tapirartige Rüssel, die aus einer sehr beweglichen Oberlippe hervorgingen und sich erst allmählich im Zuge der Körpergrößenzunahme verlängerten. Auch für die teils riesigen Vertreter von Deinotherium wird aufgrund der hohen Lage der Nasenöffnung hin zur Oberseite des Schädels ein eher kurzer Rüssel vermutet,[46] der aber ausreichend lang gewesen sein muss, um damit den Boden zu erreichen.[47] Einige Forscher nehmen an, dass sich der Rüssel innerhalb der Rüsseltiere mehrfach unabhängig herausgebildet hat.[8]
Gehirn
Die Rüsseltiere gehören zu den wenigen Säugetiergruppen, bei denen sich ein Gehirn von mehr als 700 g ausbildete vergleichbar den Primaten und den Walen. Heutige Elefanten besitzen ein Gehirnvolumen von 2900 bis 9000 cm³. Bezogen auf ein Körpergewicht von 2,2 bis 6,6 t entspricht dies einem Enzephalisationsquotienten von 1,1 bis 2,2, der Durchschnittswert liegt bei 1,7. Im Vergleich dazu beträgt der Encephalisationsquotient beim Menschen etwa 7,5.[8][9][48] Der Aufbau des Gehirns der Elefanten ist komplex. Es besteht aus rund 257 Milliarden Nervenzellen, was der 3fachen Menge gegenüber dem Gehirn des Menschen entspricht. Abweichend von diesem sind rund 98 % der Nervenzellen bei den Elefanten im Kleinhirn ausgebildet.[49] Außerdem ist der Schläfenlappen stärker entwickelt als beim Menschen.[8][9] Die Gehirne ausgestorbener Rüsseltiere sind nur selten überliefert, Ausnahmen bilden hier einzelne Eismumien vom Wollhaarmammut (Mammuthus primigenius).[50] Von anderen Fossilformen liegen nur ausnahmsweise Informationen zu den Ausmaßen des Gehirns vor, die dann weitgehend anhand von Ausgüssen des Innenraums des Hirnschädels gewonnen wurden. Hier ließ sich zeigen, dass bei einigen verzwergten Elefanten wie dem Sizilianischen Zwergelefanten (Palaeoloxodon falconeri) ein vergleichsweise großes Gehirn ausgebildet war, das bei einem Körpergewicht von 190 kg rund 1800 cm³ erreichte und so zu einem Enzephalisationsquotienten von etwa 3,75 führte.[51][48]
Der älteste bekannte Schädelausguss gehört zu Moeritherium, welches in den Übergang vom Oberen Eozän zum Unteren Oligozän gehört. Dessen Gehirnvolumen betrug schätzungsweise 240 cm³, bei einem vermuteten Körpergewicht von 810 kg. Der Enzephalisationsquotient kann somit mit rund 0,2 angegeben werden. Ein proportional vergleichbares Verhältnis zwischen Gehirngröße und Körpergewicht war beim etwa gleichalten Palaeomastodon ausgebildet. Dessen Gehirnvolumen betrug 740 cm³, das Körpergewicht lag bei 2,5 t und der Enzephalisationsquotient bei 0,3. Das Gehirnvolumen vergrößerte sich dann im Verlauf der Stammesgeschichte schrittweise, was offensichtlich parallel zur Körpergewichtszunahme stattfand. Dabei lässt sich aber ein gegenüber der Körpergröße schnelleres Gehirnwachstum feststellen, da sich auch der Enzephalisationsquotient erhöhte. Jedoch erfolgte dies nicht in allen Linien der Rüsseltiere im gleichen Tempo. Die Mammutidae, die eine relativ ursprüngliche Linie innerhalb der Rüsseltiere bilden, aber etwa zeitgleich mit den modernen Elefanten auftraten und erst im Pleistozän verschwanden, hatten ein verhältnismäßig kleines Gehirn. Zygolophodon besaß nur einen Enzephalisationsquotienten von 0,5, resultierend aus einem rund 5130 cm³ großen Gehirn und einem Körpergewicht von bis zu 16 t. Das Amerikanische Mastodon (Mammut americanum) als Endglied der Mammutiden-Entwicklung besaß dementsprechend Werte von 3860 bis 4630 cm³ für das Gehirnvolumen, 6,4 bis 8,0 t für das Körpergewicht und dementsprechend 0,30 bis 0,74 für den Enzephalisationsquotienten. Was die deutliche Volumenzunahme des Gehirns bei den Rüsseltieren verursachte, ist ungeklärt. Im Vergleich zu den frühesten Rüsseltieren aus dem Eozän und Oligozän zeigen alle moderneren Linien aus dem Miozän deutlich größere Gehirne, auch in Bezug auf das Körpergewicht. Die Zeitphase war in Afrika durch eine zunehmende Austrocknung aufgrund einer Klimaänderung charakterisiert. Zusätzlich entstand eine Landbrücke nach Eurasien, die einen Faunenaustausch ermöglichte und in dessen Folge die Rüsseltiere auch mit anderen größeren Pflanzenfressern in Konkurrenz traten.[52][53]
Haarkleid

Die drei heute lebenden Elefantenarten besitzen nur ein spärliches Fellkleid. Längere und dichtere Haarbüschel sind lediglich am Kinn, an der Rüsselspitze und am Schwanzende ausgebildet.[2][3] Die nahezu fehlende Haarbedeckung ist ein Resultat aus der enormen Körpergröße der Tiere, ihrer Verbreitung in tropisch-warmen Klimazonen und aus der sich daraus ergebenden Thermoregulation. Sie erfolgt in der Regel über die Haut, die Ohren und teilweise über eine fluktuierende Körpertemperatur.[54][55][56][57] Ein dichtes Fell hingegen war beim Wollhaarmammut durch sein weit nördliches Vorkommen in arktischen und subarktischen Regionen notwendig und ist über zahlreiche mumifizierte Kadaver aus dem Permafrostgebiet belegt. Das Fell setzt sich aus einer dichten, krausen Unterwolle und langen Deckhaaren zusammen. Strukturell ähneln sich die Haare der heutigen Elefanten und des Wollhaarmammuts. Sie weisen eine konische, zum Ende hin spitzer werdende Form auf und zeichnen sich durch eine weitgehend fehlende Markröhre aus. Ihre Länge variiert von 10 bis 13 cm, ihre Farbgebung von gelblich-braun über dunkelbraun bis schwärzlich,[58][59] wobei eine variierende Haarfarbe beim Wollhaarmammut auch genetisch feststellbar ist.[60] Inwiefern stammesgeschichtlich ältere und mitunter deutlich kleinere Rüsseltiere über ein Fell verfügten, kann derzeit nicht mit Sicherheit gesagt werden, ein Großteil der bekannten Formen lebte unter tropischen Klimaverhältnissen. Für das Amerikanische Mastodon, das in den temperierten Nadel- und Mischwäldern Nordamerikas heimisch war, sind Fellreste überliefert, die offensichtlich ebenfalls aus dichtem Unter- und langem Deckhaar bestehen.[61]
Verbreitung
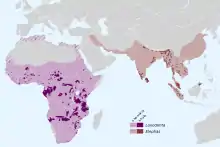
Die heutigen Elefanten sind in den weitgehend tropisch geprägten Landschaften Afrikas südlich der Sahara und Süd-, Südost- und Ostasiens verbreitet. Ihr Lebensraum ist vielgestaltig und umfasst je nach Art dichte tropische Wälder, offene Savannen- und Buschgebiete sowie wüstenartige Regionen. Der Ursprung der Gruppe liegt höchstwahrscheinlich in Afrika, wo sie erstmals im Paläozän vor rund 60 Millionen Jahren nachweisbar ist. Zum damaligen Zeitpunkt bildete der Kontinent eine gemeinsam Landmasse mit der Arabischen Halbinsel, war aber noch nicht über Landbrücken mit anderen Erdteilen verbunden. Solche Landbrücken entstanden erst im Unteren Miozän vor mehr als 20 Millionen Jahren, als sich der nördlich gelegene Tethys-Ozean schloss und so eine Verbindung zum heutigen Eurasien entstand. Zu den ersten Auswanderern gehörten die Mammutidae und die Gomphotheriidae, die erstmals eurasischen Boden betraten. Einige Vertreter, wie zum Beispiel Zygolophodon oder Gomphotherium, erreichten über Nordasien auch den nordamerikanischen Kontinent, wo sich dann eigenständige Entwicklungslinien herausbildeten. Den ersten Auswanderern folgten die Deinotheriidae, allerdings verbreiteten sie sich nicht so weit, wie die Mammutidae und Gomphotheriidae, sondern blieben auf Eurasien beschränkt. Die erste Auswanderungswelle ging vor rund 20 bis 22 Millionen Jahren vonstatten. Das Auftreten der Rüsseltiere außerhalb Afrikas wird als Proboscidean datum event bezeichnet, wobei dieses ursprünglich als singulär angesehene Ereignis nach neueren Untersuchungen aus mindestens einem halben Dutzend einzelnen Phasen bestand. In Nordamerika sind Rüsseltiere seit dem Mittleren Miozän vor gut 16 Millionen Jahren belegt.[62] Im Zuge der Bildung des Isthmus von Panama und der Entstehung einer geschlossenen amerikanischen Landmasse im Pliozän vor 3 Millionen Jahren kam es zum Großen Amerikanischen Faunenaustausch, in dessen Folge einige Vertreter der Gomphotheriidae auch Südamerika besiedelten.[8][63][64]
Die Rüsseltiere waren somit einst über einen Großteil der Alten und Neuen Welt verbreitet, lediglich den australischen und antarktischen Kontinent sowie die meisten weit vom Festland entfernten Inseln, wie Madagaskar und Neuguinea haben sie niemals erreicht. Dabei umfasste ihr Lebensraum nicht nur die tropisch geprägten Landschaftsräume wie bei den heutigen Vertretern, er erstreckte sich vor allem im Pleistozän weit nach Norden bis in den arktischen Bereich hinein. In der Regel nutzten die verschiedenen Rüsseltiere Tiefländer als Habitate, einige Angehörige wie Cuvieronius hatten zusätzlich auch gebirgiges Hochland erschlossen.[64] Einige küstennahe Inseln wurden ebenfalls erreicht, wo die Rüsseltiere dann typische Zwergformen ausbildeten.[65][66][67] Noch bis ins späte Pleistozän waren die Rüsseltiere mit mehreren Familien über Amerika, Eurasien und Afrika verbreitet. Heute findet man sie nur noch mit einer Familie in Afrika und Südasien in Form der Elefanten.[8]
Lebensweise und Ökologie
Sozialverhalten und Fortpflanzung
.jpg.webp)
Die Lebensweise der Elefanten ist relativ gut dokumentiert. Es besteht innerhalb der einzelnen Arten ein komplexes Sozialsystem. Die Basis bildet die Mutter-Jungtier-Gemeinschaft. Mehrere dieser kleinen Einheiten formen eine Familiengruppe oder Herde bestehend aus überwiegend miteinander verwandten Tieren. Darüber hinaus gibt es übergeordnete Zusammenschlüsse wie Familienverbände, Clans und ähnliches, die aber im Unterschied zur Herde häufig nur temporären Charakter tragen. Männliche Tiere hingegen sind weitgehend Einzelgänger oder sammeln sich in Junggesellenverbänden.[68][2][3] Inwiefern sich eine derartige Gruppenbildung auf die ausgestorbenen Vertreter übertragen lässt, ist in vielen Fällen ungewiss und allenfalls für die Mitglieder der jüngsten Linien in Teilen dokumentiert. Dass zumindest eine gewisse Sozialstruktur bereits im Miozän vor rund 8 bis 9 Millionen Jahren ausgebildet war, zeigen Spurenfossilien aus der Baynunah-Formation in den Vereinigten Arabischen Emiraten. Hier finden sich wenigstens 13 Fährten von Rüsseltieren, die auf einer Breite von 20 bis 30 m über eine Distanz von 190 m parallel zueinander verlaufen. Aufgrund der Größe der einzelnen Trittsiegel und der Schrittlänge können mehrere größere und ein relativ kleines Individuum auseinandergehalten werden, die individuelle Größe der Verursacher liegt in der Variationsbreite der heutigen Elefanten. Die Spurengruppe wird von einer einzelnen Fährte eines extrem großen Tieres gekreuzt, die mit einer Länge von 260 m eine der längsten durchgehenden der Welt darstellt. Die zusammenhängenden parallelen Spuren repräsentieren wohl eine Herde bestehend aus Alt- und Jungtieren, die einzelne quer verlaufende kann demnach auf ein solitäres männliches Tier zurückgeführt werden. Da die Trittsiegel selbst keine weiteren anatomischen Details verraten und die Baynunah-Formation verschiedene Rüsseltiere wie Deinotherium und Stegotetrabelodon birgt, ist unklar, zu welcher Form sie gehören (zudem besteht die Möglichkeit, dass sie von verschiedenen Arten oder Gattungen herrühren).[69] Ein ähnliches Bild vermitteln Trittsiegel aus Matalascañas in Spanien, die der Gattung Palaeoloxodon zugewiesen werden, mit einer Altersstellung im beginnenden Oberpleistozän aber deutlich jünger sind.[70]
Innerhalb der einzelnen Sozialstrukturen der Elefanten findet eine intensive Kommunikation auf verschiedenen Ebenen statt. Diese wird unter anderem durch optische Signale wie Körperhaltung und Gestik oder durch chemische Reize etwa aus dem Kot und Urin beziehungsweise über Sekretausscheidungen gesteuert. So dienen chemische Signale zur Unterscheidung von Familienmitgliedern und fremden Individuen. Hinzu kommt die taktile Kommunikation mittels des Rüssels. Eine herausragende Bedeutung hat aber die Lautkommunikation, die sehr vielfältig ist und in vielen Fällen den Infraschall nutzt. Hier kann vor allem das soziale Grollen hervorgehoben werden, das Frequenzen von 10 bis 200 Hz abdeckt und der gegenseitigen Kontaktaufnahme dient.[71][72][2][3] Darüber hinaus sind Elefanten für ihre kognitiven Leistungen bekannt, die neben dem Langzeitgedächtnis auch das Erlernen artfremder Geräusche, Manipulation der Umwelt, soziales Einfühlungsvermögen bis hin zum Umgang mit verstorbenen Artgenossen und Selbstreflexion beinhalten.[73][74] In der Regel lassen sich solche komplexen Verhaltensweisen bei Fossilformen nur schwer ermitteln. Der Bau des Innenohres kann aber zumindest Rückschlüsse auf die möglicherweise wahrgenommenen Frequenzen und damit die Lautkommunikation liefern. Heutige Elefanten besitzen eine Hörschnecke mit doppelter Windung, was kombiniert 670 bis 790 ° ergibt. Die Anzahl der Windungen wird häufig mit der Befähigung zur Wahrnehmung bestimmter Frequenzen in Verbindung gebracht. Außerdem fehlt an der Basiswindung die Lamina spiralis secundaria, wodurch die Basilarmembran recht weit ausgedehnt ist, was wiederum als eine Anpassung an das Hören im Infraschallbereich gilt. Für einige der frühesten Vertreter mit bekanntem Innenohr, etwa Eritherium, Phosphatherium und Numidotherium aus dem Paläozän beziehungsweise Eozän, lässt sich ein leicht anderer Bau rekonstruieren. Ihre Hörschnecke weist nur anderthalb Windungen auf und verfügt über eine entwickelte sekundäre Lamina. Daher gehen Wissenschaftler davon aus, dass die frühen Rüsseltiere wohl nur für höhere Frequenzen empfindlich waren.[75][76] Möglicherweise schon mit den Mammutidae, spätestens aber mit dem Aufkommen der Verwandtschaft um die modernen Elefanten war das heute bekannte Innenohr ausgebildet.[77][78]

Die chemische Kommunikation hat des Weiteren eine hohe Bedeutung bei Fortpflanzung der Elefanten. Weibliche Tiere strömen Pheromonsignale aus, die den Status ihres Brunftzyklus angeben und vor allem Einfluss auf Bullen in der Musth haben. Die Musth tritt bei ausgewachsenen männlichen Tieren einmal jährlich auf. Hierbei handelt es sich um eine hormongesteuerte Phase, gekennzeichnet durch einen erheblichen Anstieg des Testosterons. Äußerlich wirkt sich die Musth durch einen starken Ausstoß von Duftsekreten aus der Temporaldrüse aus. Während der Musth sind Bullen stark aggressiv und es kommt zu Dominanzkämpfen um das Paarungsvorrecht, die mitunter tödlich oder in schweren Verletzungen enden können.[79][2][3] Dass die Temporaldrüse als äußerer Marker der Musth und damit eines komplexen Fortpflanzungsverhaltens auch bei ausgestorbenen Formen vorkam, konnte durch Eismumien der Gattung Mammuthus belegt werden.[9] Für andere Vertreter der Rüsseltiere ohne Weichteilüberlieferung ist dies nur bedingt ableitbar. Bei einigen Skelettfunden der Gattung Mammut lassen sich Knochenbeschädigungen in Form von Rippenbrüchen und ähnlichem nachweisen, die teilweise den Tod des entsprechenden Individuums verursachten und vergleichbar mit Verletzungen bei heutigen Elefantenkämpfen sind. Die Tiere starben nach weiteren Analysen weitgehend im ausgehenden Frühjahr, also zu einer bestimmten Jahreszeit, so dass hier eventuell ein Hinweis auf die Ausprägung eines hormongesteuerten Sexualverhaltens bereits sehr früh im Rüsseltierstammbaum vorliegt.[80][81] Bei Notiomastodon als südamerikanischen Vertreter der Gomphotheriidae trat vermutlich ebenfalls die Musth auf, wofür periodisch einsetzende Wachstumsanomalien am Stoßzahn eines männlichen Individuums sprechen, die jeweils im Frühsommer begannen.[82] Die Stoßzähne weiblicher Individuen der Mammutidae zeigen wiederum längeranhaltende Wachstumsphasen, die aber etwa alle drei bis vier Jahre unterbrochen wurden. Dies stimmt mit dem Geburtenintervall bei den Kühen der heutigen Elefanten überein, die alle 4 bis 8 Jahre ein Kalb zur Welt bringen. Die phasenweise aufkommende Unterbrechung des Wachstumsschubs an den Stoßzähnen von Mammut wird mit höheren Investitionskosten bei der Aufzucht des Nachwuchses beispielsweise durch die Produktion der Muttermilch erklärt, wodurch wichtige Mineralien zur Stoßzahnbildung nicht zur Verfügung standen. Das erste Einsetzen der Wachstumsanomalien nach rund zehn Jahren korrespondiert zur Geschlechtsreife junger weiblicher und männlicher Elefanten.[83]
Ernährung
Allgemein sind Rüsseltiere auf pflanzliche Kost spezialisiert. Die variable Gestaltung der Backenzähne ermöglichte den verschiedenen Vertretern die Erschließung zahlreicher pflanzlicher Nahrungsquellen. Die heutigen Elefanten mit ihren lamellodonten Zähnen ernähren sich sowohl von weichen Pflanzenbestandteilen wie Blätter, Zweige, Früchte oder Rinde als auch von harter Pflanzenkost wie Gräser. Der jeweilige Anteil der einzelnen Komponenten variiert mit der Jahreszeit. Dabei nimmt hauptsächlich während der Regenzeit der Grasanteil erheblich zu.[2][3] Eine wahrscheinlich noch stärkere gras- und krautbasierte Ernährungsweise zeigten die Mammute, vor allem das Wollhaarmammut, das in den arktischen Steppenlandschaften lebte. Hinweise darauf liefern nicht nur die Zähne mit ihrer extrem hohen Lamellenanzahl, sondern auch die Mageninhalte und Kotreste einiger gut überlieferter Eismumien Sibiriens.[84][85]
Die auf Gräser spezialisierte Lebensweise ist eine relativ moderne Entwicklung innerhalb der Stammesgeschichte der Rüsseltiere und geht mit der Austrocknung des Klimas und der dadurch bedingten Ausbreitung offener Steppen- und Savannenlandschaften im Miozän einher. In diesem Zusammenhang steht nicht nur die zunehmende Anzahl der Lamellen an den Elefantenmolaren, sondern auch die markante Erhöhung der Zahnkronen, die es ermöglichten dem starken Abrieb beim Kauen der Gräser zu widerstehen. Phylogenetisch ältere Rüsseltierlinien ernährten sich zumeist von weicherer Pflanzenkost, was unter anderem aus den Kauoberflächen der Molaren hergeleitet werden kann. Hier sprechen die bunodonten Zahnmuster für eine weitgehend generalisierte Pflanzenkost, zygodonte und lophodonte Zähne verweisen eher auf Laubfresser. Zudem können die niedrigen Zahnkronen als Indiz auf eine derartige Präferenz gewertet werden. Des Weiteren helfen neben fossilisierten Nahrungsresten auch Isotopenanalysen und charakteristische Abrasionsspuren an den Zähnen bei der Klärung der Ernährungsweise ausgestorbener Formen. Die anhand des zygodonten Zahnmusters der Mammutidae vermutete Bevorzugung von Blättern und Zweigen wird durch verschiedene Dung- und Darminhalte von Mammut bestätigt. In diesen dominieren Baum- und Strauchreste sowie solche von Wasserpflanzen, untergeordnet sind aber auch Gräser enthalten. Ein vergleichbares Ergebnis lieferten Isotopenuntersuchungen. Als bevorzugte Lebensräume dienten vor allem Nadel-Mischwälder.[86][87][88] Die ursprünglichsten Vertreter der Rüsseltiere wie Barytherium und Moeritherium lebten dagegen vorwiegend in sumpf- oder wasserreichen Gegenden und fraßen überwiegend Wasserpflanzen, was ebenfalls anhand von Isotopenanalysen ermittelt wurde.[89][90]
Bereits vor den Elephantidae nutzten einige Formen der Gomphotheriidae die sich ausbreitenden Offenlandschaften. Ihre Ernährung blieb aber weitgehend gemischt, wie dies auch ihr bunodonter Zahnbau verrät. Allerdings gingen offensichtlich einzelne Angehörige der Rüsseltierlinie zu einer stärker grasbasierten Ernährung über und nahmen hier die Entwicklung der Elefanten vorweg, ohne dabei aber deren zahnanatomische Anpassungen auszuprägen.[91][92] Im Vergleich zu den trilophodonten Gomphotherien und einigen stammesgeschichtlich jüngeren tetralophodonten Formen wie Anancus besaßen innerhalb der modernen Elefanten bereits die frühen Vertreter von Loxodonta und Mammuthus eine deutlich flexiblere Nahrungsaufnahme. Ermittelt wurde dies über Analysen zu den Isotopenverhältnissen an Zähnen aus der Fundstelle Langebaanweg im südwestlichen Afrika. Möglicherweise sicherte diese Anpassungsfähigkeit das Überleben der Gattungen bis in das ausgehende Pleistozän und darüber hinaus.[93] Zu einem ähnlichen Ergebnis kam eine Studie zur Ernährungsweise des eher waldbewohnenden Stegodon im Vergleich zu den offeneren Landschaften nutzenden frühen Vertretern von Elephas in Ostasien.[94]
Ökologische Einflüsse
_(Kruger_National_Park%252C_2002)_01.jpg.webp)
Die Rüsseltiere haben einen großen Einfluss auf ihr unmittelbares Biotop. Durch das Entrinden von Bäumen, Fressen von Blättern, Abknicken von Zweigen und Ästen, das Herausreißen von Büschen und kleinen Bäumen oder das Spalten größerer wirken beispielsweise die heutigen Elefanten stark auf die Landschaft ein. Sie können dadurch geschlossene Gebiete öffnen, Waldränder zurückdrängen oder offene Landschaften frei halten. Eine große Bedeutung hat dies für die Savannen Ost- und Südafrikas. Zudem transportieren die Tiere Samen über nennenswerte Strecken und tragen so zur Verbreitung von Pflanzen bei. Aber auch im kleineren Maßstab wirken Elefanten, indem in ihren Trittsiegel oder in ihrem Kot eng begrenzte Lebens- und Entwicklungsräume für andere Lebewesen entstehen. Aus diesem Grund gelten Elefanten als ecosystem engineers.[2][3] Eine ähnliche Funktion kann auch für ausgestorbene Formen wie den Mammuten der Mammutsteppe angenommen werden.[95][96] Möglicherweise trat dieses Verhalten aber schon sehr früh im Rüsseltier-Stammbaum auf, das bis in das frühe Miozän oder gar Oligozän zurückreicht. Zu diesem Zeitpunkt erschienen unter anderem mit den Deinotheriidae die ersten größeren Rüsseltiere mit sehr großen Stoßzähnen, deren überlieferten Abnutzungsspuren und Beschädigungen auf das großflächige Abschaben von Rinde oder auf ein Spalten von Bäumen schließen lassen.[97]
Systematik
Äußere Systematik
Innere Systematik der Afrotheria nach Heritage et al. 2021[98]
|
Die Rüsseltiere sind eine Ordnung innerhalb der Überordnung der Afrotheria, welche wiederum eine der vier Hauptlinien der Höheren Säugetieren darstellen. Den Afrotheria werden verschiedene Gruppen zugewiesen, deren Ursprungsgebiet mehr oder weniger auf dem afrikanischen Kontinent liegt oder die zu dessen ursprünglichen Bewohnern zählen. Ihre Zusammengehörigkeit beruht dabei weniger auf anatomischen Gemeinsamkeiten, sondern mehrheitlich auf Ergebnissen molekulargenetischer Untersuchungen. Es lassen sich innerhalb der Afrotheria zwei Großgruppen unterscheiden: die Paenungulata und die Afroinsectiphilia. Zu letzteren zählen die Rüsselspringer und die Tenrekartigen, manchmal wird ihnen auch das Erdferkel zugeordnet. Die Paenungulata demgegenüber schließen die Rüsseltiere, die Seekühe und die Schliefer ein. Im Gegensatz zu den Afrotheria als gesamte Gruppe findet die engere Verwandtschaft von Elefanten, Sirenen und Schliefern sowohl genetisch als auch morphologisch-anatomisch Unterstützung. Jedoch sind die genaueren Beziehungen der drei Gruppen zueinander in Diskussion.[99] Einerseits fungieren die Schliefer als die Schwestergruppe der beiden anderen Linien. In diesem Fall werden die Elefanten und Seekühe in die gemeinsame Übergruppe der Tethytheria eingegliedert. In einer weiteren Auffassung stehen die Schliefer und Elefanten in einem Schwestergruppenverhältnis, während die Seekühe die Position der Außengruppe einnehmen.[100][101] Als dritte Konstellation kommt eine engere Bindung der Schliefer an die Seekühe in Betracht mit den Elefanten als Schwestertaxon zu beiden.[102][103] Der Ursprung der Afrotheria liegt den molekulargenetischen Untersuchungen zufolge in der Oberkreide vor 90,4 bis 80,9 Millionen Jahren. Gut 15 Millionen Jahre später trennten sich die Paenungulata und die Afroinsectiphilia voneinander ab. Die Rüsseltiere differenzierten sich nur wenig später heraus. Die gewonnenen genetischen Daten decken sich relativ gut mit dem Fossilbericht, wonach die ältesten Vertreter der Rüsseltiere bereits im Paläozän vor mehr als 60 Millionen Jahren nachweisbar sind.[102][101][104]
Innere Systematik
Innere Systematik der Rüsseltiere nach Cozzuol et al. 2012[105]
|
Die Rüsseltiere stellen eine relativ formenreiche Gruppe innerhalb der Afrotheria dar. Es sind heute rund 160 Arten bekannt,[9] davon mehr als 130 aus Afrika, Asien und Europa, die sich auf über 50 Gattungen verteilen. Diese können wiederum rund einem Dutzend unterschiedlicher Familien zugewiesen werden. Der weitaus größte Teil der bekannten Formen ist ausgestorben und nur über Fossilfunde bekannt. Von diesen wurden einige erst nach dem Jahr 2000 entdeckt, darunter auch bedeutende frühe Formen wie Eritherium oder Daouitherium. Neben den Elefanten (Elephantidae) als einzige heute noch fortbestehende Familie mit den drei heutigen Arten stellen die Stegodontidae, die Gomphotheriidae, die Mammutidae und die Deinotheriidae die bekanntesten Familienvertreter dar. Bis auf letztgenannte handelt es sich weitgehend um recht moderne Entwicklungslinien der Rüsseltiere, die teilweise noch bis in das ausgehende Pleistozän überlebt hatten. Sehr urtümliche Angehörige der Ordnung werden hingegen in die Phosphatheriidae, die Numidotheriidae, die Moeritheriidae oder in die Barytheriidae eingegliedert.[3]
Es gibt verschiedene Ansätze, die Familien der Rüsseltiere auf höherer systematischer Ebene zu ordnen, als Grundlage wird vielfach die Morphologie der Backenzähne herangezogen. Diese Einteilung in einzelne Großgruppen ist allerdings nicht ganz eindeutig, was hauptsächlich für die frühen Vertreter gilt. Relativ unumstritten sind die Elephantiformes. Diese definieren sich anhand des Zahnaufbaus der ersten beiden Molaren, welche drei, vier oder mehr querstehende Leisten aufweisen (tri-, tetra-, pentalophodonte Zähne). Einige Autoren wie Jeheskel Shoshani trennen von diesen die urtümlicheren Plesielephantiformes ab, die sich durch nur zwei Leisten auf den ersten beiden Dauermolaren auszeichnen (bilophodonte Zähne). Beide Gruppen können als Unterordnungen aufgefasst werden. Dabei ist die Stellung der Deinotheriidae innerhalb der Plesielephantiformes problematisch, da ihr zweiter Molar zwar einen bilophodonten Aufbau hat, ihr erster dem gegenüber jedoch trilophodont ist. Ersteres stellt hier möglicherweise kein ursprüngliches, sondern ein abgeleitetes Merkmal dar.[106][107] Aus diesem Grund werden die Plesielephantiformes von einigen Wissenschaftlern als paraphyletisch eingestuft.[108] Andere Autoren wie Emmanuel Gheerbrant unterscheiden die frühen Rüsseltiere nach der Kauflächenstruktur der Molaren. Sie trennen eine lophodonte Gruppe von einer bunodonten Gruppe ab. Zu ersterer zählen Formen wie Barytherium, Numidotherium, Phosphatherium oder Daouitherium, zu letzterer solche wie Moeritherium und Saloumia. Arcanotherium wiederum vermittelt durch die eher bunolophodonten Zähne zwischen beiden Formenkreisen. Nach ihrer Charakterform Barytherium wird die lophodonte Gruppe auch als "barytherioide Gruppe" bezeichnet.[109][110] Allerdings scheint auch dies keine natürliche Gemeinschaft zu sein.[111]
Die frühesten Elephantiformes traten mit Dagbatitherium bereits im Mittleren Eozän des westlichen Afrikas auf.[112] Innerhalb dieser bilden die Elephantimorpha eine Teilordnung, in welcher alle Rüsseltiere vereinigt sind, die über das Merkmal des horizontalen Zahnwechsels verfügen. Sie schließt somit die Mammutidae, Gomphotheriidae, Stegodontidae und Elephantidae ein, während andere Gruppen wie die Palaeomastodontidae und Phiomiidae außerhalb stehen. Den Übergang bildet wohl die Gattung Eritreum aus dem Oberen Oligozän des nordöstlichen Afrikas, bei der dieser besondere Zahnaustausch stammesgeschichtlich erstmals belegt ist.[39] Bei den stammesgeschichtlich jüngeren Formen bestehen gegenwärtig einzelne Schwierigkeiten. So sind die Gomphotheriidae als Gesamtgruppe (Überfamilie der Gomphotherioidea) höchstwahrscheinlich paraphyletisch, da sie aus phylogenetischer Sicht auch die Stegodontidae und die Elefanten als jüngste Entwicklungslinien beinhalten. Um die Elephantidae, Stegodontidae und Gomphotheriidae als monophyletische Gruppe zu vereinen, führten Jeheskel Shoshani und Pascal Tassy im Jahr 1998 die Elephantida als übergeordnetes Taxon ein mit den Gomphotherioidea und Elephantoidea als Mitglieder. Gleichzeitig wurden einige tetralophodonte Gomphotherien (Anancus, Tetralophodon und andere) aus den Gomphotherioidea ausgegliedert und den Elephantoidea zugewiesen. Den Elephantida stehen die Mammutida gegenüber, in denen aber lediglich die Familie der Mammutidae geführt wird.[113][106][107]
Die hier vorgestellte systematische Gliederung fußt weitgehend auf den Ausarbeitungen von Jeheskel Shoshani und Pascal Tassy, die beide Autoren im Jahr 2005 vorstellten,[107] aber auf langjährigen Untersuchungen beruhen.[113][106] Während die Gliederung der ältesten Rüsseltiere allgemein problematisch erscheint, unterteilen einige andere Autoren wie unter anderem Malcolm C. McKenna und Susan K. Bell 1997 die jüngeren Entwicklungslinien der Elephantimorpha lediglich in die Mammutoidea und die Elephantoidea, letztere schließen dann die Gomphotherien, Stegodonten und Elefanten jeweils auf Familienebene ein.[114] Ein weiteres Modell wurde im Jahr 2010 von William J. Sanders präsentiert, der hier – allerdings bezogen nur auf afrikanische Rüsseltiere – einzig die Elephantoidea herausstellt, welche neben den bereits genannten Gruppen auch die Mammutiden enthalten.[35]
Innere Systematik der Rüsseltiere nach Buckley et al. 2019 basierend auf biochemischen Daten[115]
|
Innere Systematik der Rüsseltiere nach Baleka et al. 2021 basierend auf genetischen Daten[116]
|
Zunehmend gewinnen molekulargenetische und biochemische Methoden Bedeutung bei der systematischen Gliederung der Rüsseltiere. Bereits Ende des 20. Jahrhunderts ließ sich die anatomisch begründete enge Bindung zwischen den rezenten Elefanten und den ausgestorbenen Mammuten auch genetisch belegen, allerdings mit dem vorläufigen Ergebnis einer näheren Verwandtschaft von Mammuthus zu Loxodonta, der Gruppe der Afrikanischen Elefanten.[117][118] In späteren und vielfach wiederholten Analysen verschob sich das Verhältnis dann hin zu einer engeren Beziehung zwischen den Mammuten und der Gattung Elephas, welche den Asiatischen Elefanten einschließt.[119][120][121] Diesen vertiefenden Studien zufolge diversifizierten sich die Elefanten als jüngstes Glied der Rüsseltierentwicklung im ausgehenden Miozän. Dabei spalteten sich zuerst Loxodonta und Elephas vor gut 7,6 Millionen Jahren voneinander ab, die Trennung von letzterem und Mammuthus vollzog sich vor etwa 6,7 Millionen Jahren.[121][122][123] Später wurden noch andere Vertreter der Elefanten wie Palaeoloxodon mit einbezogen. Dadurch eröffnete sich eine komplexe Frühgeschichte der Elefanten, die wahrscheinlich zahlreiche Hybridisierungsereignisse während der initialen Aufspaltung beinhaltete.[124][125] Allerdings kam es auch in stammesgeschichtlich jüngerer Zeit häufig zur Vermischung, wie dies einzelne genetische Studien an nordamerikanischen Mammuten darlegen.[126][127] Ebenfalls schon Ende des 20. Jahrhunderts konnte das Erbgut der im Vergleich zu den Elefanten wesentlich urtümlicheren Rüsseltiergattung Mammut sequenziert werden.[128] Dieses erste Ergebnis und auch nachfolgende Untersuchungen bestätigten die zuvor durch Fossilfunde ermittelte lange eigenständige Entwicklung der Mammutida und der Elephantida als Großgruppen der Elephantimorpha. Die Abspaltung von Mammut von der Linie, die zu den heutigen Elefanten führte, reicht bis in das ausgehende Oligozän vor rund 26 Millionen Jahren zurück. Die Daten fanden auch mit Kollagenanalysen Unterstützung.[121][129][123] Eine im Jahr 2019 veröffentlichte Studie gewährte erstmals Einblick in die biochemischen Verwandtschaftsverhältnisse von Notiomastodon als einem südamerikanischen Repräsentanten der Gomphotheriidae. Entgegen der oftmals postulierten näheren Stellung der Gomphotherien und Elefanten ergab sich hier jedoch eine engere Beziehung zu den Mammutidae.[115] Abweichend davon sehen genetische Analysen aus dem Jahr 2021 Notiomastodon wiederum in einem Schwestergruppenverhältnis zu den Elefanten.[116]
Überblick über die Familien und Gattungen der Rüsseltiere
Die Gliederung basiert auf den Bearbeitungen von Shoshani und Tassy aus dem Jahr 2005[107] und einzelne, teils darauf aufbauende jüngere Darstellungen.[63][35] Berücksichtigung finden hierbei sowohl in der Folgezeit neu eingeführte Gattungen[130][31][111][131][132][14][133][134][112] und höhere taxonomische Gruppen,[110][135][136] als auch weitere systematische Arbeiten.[137][138] Vor allem die Gomphotheriidae, und hier insbesondere der amerikanische Strang, wurden mehrfach revidiert.[64][105] Stärkere Aufmerksamkeit erhielten dabei die südamerikanischen Vertreter.[139][140][141][142]
- Ordnung: Proboscidea Illiger, 1811
- Plesielephantiformes Shoshani, 2001
- Eritherium Gheerbrant, 2009
- Daouitherium Gheerbrant, Sudre, Cappetta, Iarochène, Amaghzaz & Bouya, 2002
- Saloumia Tabuce, Sarr, Adnet, Lebrun, Lihoreau, Martin, Sambou, Thiam & Hautier, 2020
- Familie: Phosphatheriidae Gheerbrant, Sudre & Tassy, 2005
- Phosphatherium Gheerbrant, Sudre & Cappetta, 1996
- Überfamilie: Moeritherioidea Andrews, 1906
- Familie: Moeritheriidae Andrews, 1906
- Moeritherium Andrews, 1901
- Überfamilie: Numidotherioidea Shoshani & Tassy, 1992
- Arcanotherium Delmer, 2009
- Omanitherium Seiffert, Nasir, Al-Harthy, Groenke, Kraatz, Stevens & Al-Savigh, 2012
- Familie: Numidotheriidae Shoshani & Tassy, 1992
- Numidotherium Mahboubi, Ameur, Crochet & Jaeger, 1986
- Überfamilie: Barytherioidea Andrews, 1906
- Familie: Barytheriidae Andrews, 1906
- Barytherium Andrews, 1901
- Überfamilie: Deinotherioidea Bonaparte, 1845
- Familie: Deinotheriidae Bonaparte, 1841
- Unterfamilie: Chilgatheriinae Sanders. Kappelmann & Rasmussen, 2004
- Chilgatherium Sanders, Kappelman & Rasmussen, 2004
- Unterfamilie: Deinotheriinae Sanders, Kappelman & Rasmussen, 2004
- Deinotherium (+ Prodeinoterium) Kaup, 1829
- Elephantiformes Tassy, 1988
- Hemimastodon Pilgrim, 1912
- Dagbatitherium Hautier, Tabuce, Mourlam, Kassegne, Amoudji, Orliac, Quillévéré, Charruault, Johnson & Guinot, 2021
- Eritreum Shoshani, Walter, Abraha, Berhe, Tassy, Sanders, Marchant, Libsekal, Ghirmai & Zinner, 2006
- Familie: Palaeomastodontidae Andrews, 1906
- Palaeomastodon Andrews, 1901
- Familie: Phiomiidae Kalandadze & Rautian, 1992
- Phiomia Andrews & Beadnell, 1902
- Elephantimorpha Tassy & Shoshani, 1997
- Mammutida Tassy & Shoshani, 1997
- Überfamilie: Mammutoidea Hay, 1922
- Familie: Mammutidae Hay, 1922
- Losodokodon Rasmussen & Gutiérrez, 2009
- Eozygodon Tassy & Pickford, 1983
- Miomastodon Osborn, 1922
- Zygolophodon Vacek, 1877
- Sinomammut Mothé, Avilla, Zhao, Xie & Sun, 2016
- Mammut Blumenbach, 1799
- Elephantida Tassy & Shoshani, 1997
- Überfamilie: Gomphotherioidea Hay, 1922
- Familie: Gomphotheriidae Hay, 1922
- Pediolophodon Lambert, 2007
- Unterfamilie: Choerolophodontinae Gaziry, 1976
- Choerolophodon Schlesinger, 1917
- Afrochoerodon Pickford, 2001
- Unterfamilie: Amebelodontinae Barbour, 1927
- Progomphotherium Pickford, 2003
- Archaeobelodon Tassy, 1984
- Afromastodon Pickford, 2003
- Protanancus Arambourg, 1945
- Serbelodon Frick, 1933
- Amebelodon Barbour, 1927
- Konobelodon Lambert, 1990
- Torynobelodon Barbour, 1929
- Eurybelodon Lambert, 2016
- Platybelodon Borissiak, 1928
- Aphanobelodon Wang, Deng, Ye, He & Chen, 2017
- Unterfamilie: Gomphotheriinae Hay, 1922
- Gomphotherium Burmeister, 1837
- Serridentinus Osborn, 1923
- Unterfamilie: Rhynchotheriinae Hay, 1922
- Eubelodon Barbour, 1912
- Rhynchotherium Falconer, 1868
- Stegomastodon Pohlig, 1912
- Cuvieronius Osborn, 1923
- Notiomastodon (+ Amahuacatherium, Haplomastodon) Cabrera, 1929
- Gnathabelodon Barbour & Sternberg, 1935
- Blancotherium May, 2019
- Unterfamilie: Sinomastodontinae Wang, Jin, Deng, Wei & Yan, 2012
- Sinomastodon Tobien, Chen & Li, 1986
- Überfamilie: Elephantoidea Gray, 1821
- Tetralophodon (+ Morrillia) Falconer; 1857
- Anancus Aymard, 1855
- Paratetralophodon Tassy, 1983
- Familie: Stegodontidae Osborn, 1918
- Stegolophodon Pohlig, 1888
- Stegodon Falconer, 1847
- Selenotherium Mackaye, Brunet & Tassy, 2005
- Familie: Elephantidae Gray, 1821
- Unterfamilie Stegotetrabelodontinae Aguirre, 1969
- Stegotetrabelodon Petrocchi, 1941
- Stegodibelodon Coppens, 1972
- Unterfamilie Elephantinae Gray, 1821
- Primelephas Maglio, 1970
- Loxodonta Anonymous, 1827
- Stegoloxodon Kretzoi, 1950
- Palaeoloxodon Matsumoto, 1924
- Elephas Linnaeus, 1758
- Mammuthus Brookes, 1828
Die Stellung von Khamsaconus innerhalb der Rüsseltiere ist nicht eindeutig. Bekannt über einen Milchprämolaren aus dem Unteren Eozän des Ouarzazate-Becken in Marokko, wurde der Fund ursprünglich von Jean Sudre und Kollegen 1993 zu den Louisinidae geordnet, eine wohl mit den Rüsselspringern näher verwandte Gruppe.[143] Der Verweis zu den Rüsseltieren stammt hauptsächlich von Emmanuel Gheerbrant,[144] was teilweise andere Autoren übernahmen. Später wurde auch eine Beziehung zu den Schliefern in Betracht gezogen.[110][35]
Stammesgeschichte
Ursprünge und Evolutionstrends

Die Rüsseltiere sind eine relativ alte Ordnung der Säugetiere, erste Vertreter traten bereits im Paläozän vor mehr als 60 Millionen Jahren auf. Der Ursprung der Gruppe ist nicht vollständig geklärt. Es bestehen aber einzelne Übereinstimmungen mit einigen „Condylarthra“-artigen Huftieren des frühen Paläogens Afrikas. Zu nennen wäre hier Ocepeia aus dem Ouled-Abdoun-Becken in Marokko, das unter anderem den vergrößerten zweiten und den reduzierten dritten oberen Schneidezahn mit den Rüsseltieren teilt, ebenso die luftgefüllten Schädelknochen wie auch den bilophodonten Aufbau der Mahlzähne. Letzteres gilt zusätzlich für Abdounodus aus der gleichen Fundregion. Strukturelle Unterschiede in der Höckerausbildung stellt beide Formen jedoch nicht in die direkte Vorfahrenlinie der Rüsseltiere, sondern in den eher entfernten Verwandtenkreis.[145][146] Hier zeigen auch weitergehende Schädelanalysen, etwa am Innenohr, dass die frühen Vertreter der Paenungulata sich phänomorphologisch stark ähnelten und eine größere Differenzierung erst später stattfand.[5][147][76] Im Eozän des heutigen Süd- und Südostasien waren die Anthracobunidae verbreitet, die über den Zahn- und Fußaufbau einige Ähnlichkeiten zu den Rüsseltieren zeigen. Abweichend von den meisten Rüsseltieren kam allerdings noch ein vorderster Prämolar vor. Teilweise wurden die Anthracobunidae innerhalb der Rüsseltiere geführt,[148][149] heute stufen sie zahlreiche Forscher als Stammformen der Tethytheria ein.[150][151] Einer anderen Auffassung zufolge stehen die Anthracobunidae aber eher den Unpaarhufern näher.[152]
Ihre Vielgestaltigkeit, der reiche Fossilbeleg und die weite räumliche und zeitliche Verbreitung verleihen den Rüsseltieren eine hohe Bedeutung für die Biostratigraphie. Die stammesgeschichtliche Entwicklung kann grob in drei Stufen eingeteilt werden, verbunden mit einer jeweiligen Auffächerung in zahlreiche Gattungen und Arten sowie Anpassung an unterschiedliche ökologische Nischen (adaptive Radiation). Generelle Trends in der Evolution der Rüsseltiere sind eine markante Größenzunahme – die ältesten Formen waren weniger als einen Meter groß, während spätere Formen bis zu mehr als 4 m Schulterhöhe erreichten –, Vergrößerung des Schädels, vor allem des Schädeldaches als Ansatzstelle für eine mächtige Nacken- und Kaumuskulatur, verbunden mit der Verkürzung des Kieferbereiches, Verkürzung des Halsbereiches, Ausbildung eines Rüssels, Hypertrophie der jeweils zweiten beziehungsweise ersten Schneidezähne mit Ausbildung großer Stoßzähne ebenso wie die Tendenz zur Ausformung großer Molaren bei gleichzeitigem Verlust der vorderen Prämolaren und weitgehend auch des vorderen Gebisses sowie die Änderung des Zahnaustausches vom für Säugetiere typischen vertikalen hin zum horizontalen Wechsel. Weiterhin bedeutend ist, dass frühere Rüsseltiere eher Blattfresser (browser) waren, während die späteren Formen stärker auf Grasnahrung (grazer) spezialisiert waren.[8][9]
Erste Radiation
Die erste Radiation erfolgte vor 61 bis etwa 24 Millionen Jahren und fand nahezu vollständig in Afrika und auf der Arabischen Halbinsel statt, die damals mit dem Kontinent verbunden war. Alle bisher bekannten Formen sind aus Nordafrika (einschließlich der Arabischen Halbinsel) und untergeordnet auch aus Westafrika und Ostafrika belegt. Die Vertreter dieser urtümlichsten Rüsseltiere hatten noch deutlich bunodont aufgebaute Zähne mit zwei Querleisten auf den ersten beiden und maximal vier auf dem dritten Molaren, die jeweils einen hohen Zahnschmelzhöcker an den Enden aufwiesen. Einige Formen besaßen auch noch einen Eckzahn je Kieferast. Charakteristisch ist der hier noch vorkommende vertikale Zahnwechsel, so dass alle Zähne gleichzeitig in Gebrauch waren.[9][64][62]
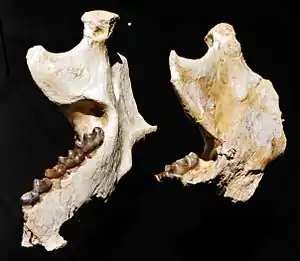
Als ältestes Rüsseltier gilt derzeit Eritherium, das 2009 anhand einzelner Schädelfragmente erstmals beschrieben wurde. Es war ein nur 3 bis 8 kg schweres Tier, das im nördlichen Afrika lebte, wo es im Ouled-Abdoun-Becken von Marokko nachgewiesen ist. Charakteristisch für diesen Vertreter sind die schwach ausgebildeten Leisten auf dem Kauflächen der somit bunodonten Molaren, allerdings deutet sich auf dem letzten Molar bereits eine dritte Leiste an.[5][147] Von Phosphatherium wurden seit 1996 mehrere Gebissreste gleichfalls im Ouled-Abdoun-Becken ausgegraben. Es lebte vor etwa 55 Millionen Jahren und war kaum größer als ein Fuchs. Rein äußerlich hatten die Tiere wenig mit späteren Rüsseltieren gemeinsam, ihr Zahnbau, der dem von Eritherium ähnelte aber stärker ausgebildete Leisten zwischen den Zahnhöckern besitzt und so eine Tendenz zur Lophodontie aufweist, spricht für eine enge Verwandtschaft.[153][144] Eine noch stärkere Tendenz zu lophodonten Zahnformen zeigen unter anderem Numidotherium und Daouitherium, welche etwa gleich alt sind. Ersteres wurde mit zahlreichen Schädel- und Körperskelettteilen in El-Kohol in Algerien, letzteres wiederum über einen Unterkiefer im Ouled-Abdoun-Becken dokumentiert.[154][109] Moeritherium aus dem Eozän Nordafrikas war ein weiteres frühes Mitglied der Rüsseltiere. Es war etwa so groß wie ein Tapir und besaß einen schweineähnlichen Kopf mit einer verlängerten Nasen-Oberlippe sowie leicht verlängerten Schneidezähnen im Ober- und Unterkiefer. Neben Elefantenmerkmalen trägt der Schädel auch gemeinsame Kennzeichen mit dem der Seekühe. Des Weiteren zeichnet sich die Gattung durch einen sehr langen Körper aus. Mit Barytherium fand die erste enorme Körpergrößenzunahme innerhalb der Rüsseltier-Linie statt. Die Tiere erreichten eine Schulterhöhe von 2,5 bis 3 m und besaßen insgesamt acht kurze Stoßzähne, je zwei pro Kieferast. Beide Formen sind in nennenswerter Fundanzahl aus der Fundregion des Fayyum in Ägypten dokumentiert, die dortigen Fossilreste datieren in den Übergang vom Oberen Eozän zum Unteren Oligozän.[18] Mit Moeritherium nahe verwandt ist Saloumia, von dem aber bisher nur ein Backenzahn aus dem Senegal vorliegt.[134] Aufgrund der zahlreichen beschriebenen Formen des Paläozäns und des Eozäns können die Rüsseltiere eine der vollständigsten Fossilsequenzen aus der Frühgeschichte einer Ordnung der Höheren Säugetiere vorweisen.[5][63][35]

Ebenfalls in die erste Radiationsphase gehören die Deinotheriidae, die erstmals im Verlauf des Oligozän erschienen und eine frühe Abspaltung darstellen. Charakteristisch für diese Rüsseltiergruppe sind die Stoßzähne, die nur im Unterkiefer vorkommen und abwärts biegen. Sie dienten als Werkzeuge zum Abschaben von Baumrinde. Der früheste Vertreter, Chilgatherium aus dem nordöstlichen Afrika, war noch relativ klein, bisher sind aber nur Zähne geborgen worden. Dagegen verfügt Deinotherium über einen reichhaltigen Fossilbeleg. Die Angehörigen der Gattung nahmen im Laufe ihrer Stammesgeschichte kontinuierlich an Größe zu und wuchsen so vor allem im Pliozän und Pleistozän teilweise auf über 4 m Schulterhöhe heran. Im Untere Miozän mit der Schließung der Tethys und der Entstehung einer Landbrücke nach Norden wanderten die Deinotheriidae auch in Eurasien ein. In Europa starben sie im Verlauf des Pliozäns, in Afrika im Unteren Pleistozän vor rund einer Million Jahren aus. Aufgrund ihres langen Bestands und weiten Verbreitung stellen die Deinotheriidae eine der ersten erfolgreichen Rüsseltiergruppen dar.[155][11][35] Aus forschungsgeschichtlicher Sicht sind die Schädelfunde von Eppelsheim in Rheinland-Pfalz von Bedeutung, da hier Deinotherium erstmals 1829 wissenschaftlich beschrieben und später auch die Position der Stoßzähne korrekt erkannt wurden.[156] Einige Autoren stellen die Zugehörigkeit der Deinotheriidae zu den Rüsseltieren aufgrund der Zahn- und Gebissmorphologie in Frage und möchten sie eher in näherer Verwandtschaft zu den Seekühen sehen,[157] diese Auffassung wird aber nur wenig geteilt.[158]
Palaeomastodon und Phiomia waren weitere sehr frühe Rüsseltiergattungen aus dem Eozän und Oligozän Nordafrikas, vorrangig aus dem Fayyum. Sie gehören ebenfalls noch zu Vertretern der ersten Radiation, sind aber mit den späteren Rüsseltierarten schon deutlich näher verwandt als mit den früheren. Es bereitet derzeit noch Probleme, die frühen Formen mit diesen beiden Gattungen zu verbinden, da offensichtlich noch Zwischenglieder fehlen.[63] Wahrscheinlich umfasst Phiomia die Schwesterlinie zu den späteren Gomphotherien (Gomphotheriidae), während Palaeomastodon jene der Mammutiden (Mammutidae) darstellt. Unterschiede zwischen beiden Vertretern finden sich im Zahnbau. So besitzt Phiomia jeweils drei Leisten auf den vorderen Molaren, Palaeomastodon hat hingegen nur auf den unteren drei, auf den oberen hingegen zwei.[30][39]

Die Mammutidae stellen die letzte und eine der wichtigsten Gruppen innerhalb der ersten Radiation dar. Ihre Entwicklungslinie begann laut molekulargenetischen Untersuchungen bereits vor wenigstens 26 Millionen Jahren.[121] Die Molaren sind zygodont mit maximal vier Schmelzleisten auf dem letzten Zahn. Der spezielle Aufbau der Backenzähne kennzeichnet sie als weitgehende Blattfresser. Weiterhin waren diese Rüsseltiere durch zwei obere Stoßzähne charakterisiert, während ältere Formen ebenfalls zwei kleinere Stoßzähne im Unterkiefer hatten, die im Laufe der weiteren Evolution erst reduziert und später verloren gingen. Ihren Ursprung hat die Rüsseltiergruppe in Afrika. Die älteste Gattung findet sich hier mit Losodokodon aus dem Oberen Oligozän, die aber nur anhand einiger Backenzähne aus Kenia überliefert ist.[31] Über einen häufigeren Nachweis verfügt Eozygodon, das ebenfalls weitgehend auf Afrika beschränkt blieb. Das bedeutendste Fundmaterial liegt mit einem fragmentierten Teilskelett von der untermiozänen Fundstelle der Meswa Bridge ebenfalls in Kenia vor, von wo auch das Erstbeschreibungsmaterial stammt.[159] Vereinzelten Hinweisen nach trat Eozygodon eventuell im Mittleren Miozän auch in Eurasien auf, wie der Unterkiefer eines nicht ausgewachsenen Tieres aus der Lengshuigou-Formation in der chinesischen Provinz Shaanxi vermuten lässt.[160] Dagegen ist Zygolophodon ähnlich den Deinotheriidae seit dem Unteren Miozän auch aus Eurasien überliefert, während die bekannteste Gattung, Mammut, als einer der ersten Rüsseltiervertreter über Nordasien auch Nordamerika erreichte. Hier formte sich das Amerikanische Mastodon (Mammut americanum) heraus, das noch zeitgleich mit den Vertretern der späteren Gattung Mammuthus lebte und gegen Ende der letzten Kaltzeit im Oberen Pleistozän ausstarb. In Eurasien sind seit dem Oberen Miozän mehrere Arten von Mammut nachgewiesen. Die bekannteste dürfte Mammut borsoni sein, ein riesiges Tier, dessen nahezu gerade verlaufende Stoßzähne bis zu 5 m lang und damit die längsten unter den Rüsseltieren sind. Ein nahezu vollständiges Skelett ist unter anderem aus Milia in Griechenland dokumentiert.[16] Die eurasische Linie von Mammut verschwand aber weitgehend im Pliozän und Unteren Pleistozän wieder.[161][11] Der Gattungsname Mammut führt häufig zur Verwirrung, da dessen Vertreter mit den eigentlichen Mammuten, deren Gattungsname Mammuthus lautet, nicht näher verwandt sind.[162][63][35]
Zweite Radiation

Die zweite Radiationsphase setzte im Miozän ein. Bei den Angehörigen dieser Gruppe ist erstmals der horizontale Zahnwechsel nachweisbar. Hervorzuheben ist aber, dass die Mammutidae zwar überwiegend in die erste Radiationsphase eingegliedert werden, die späteren Vertreter wie Mammut das Merkmal des horizontalen Zahnwechsels aber ebenfalls besitzen.[9] Der neue Modus des Zahnaustausches resultiert in der Verkürzung der Kieferknochen und der zunehmenden Komplexität der Backenzähne. Diese beinhaltet, dass die Molaren unter anderem durch die Erhöhung der Leistananzahl auf bis zu sechs deutlich größer werden. Darüber hinaus entwickelt sich das bunodonte Grundmuster der Kaufläche weiter und es entstehen wiederum lophodonte und bedingt zygodonte Zähne.[9][64] Möglicherweise an der Basis der zweiten Radiation steht Eritreum aus dem späten Oligozän Nordostafrikas. Der bisher aufgefundene Unterkieferrest vermittelt in seiner Zahnmorphologie noch zwischen Phiomia beziehungsweise Palaeomastodon und den späteren Rüsseltieren, weist aber schon den horizontalen Zahnwechsel auf.[39] Die wichtigsten Gruppen der zweiten Radiationsphase sind die Gomphotheriidae und die Stegodontidae, zwei Rüsseltierfamilien, die ursprünglich zusammen mit den Mammutidae zur Überfamilie der „Mastodonten“ (Mastodontoidea) zusammengefasst wurden.[163] Die „Mastodonten“ prägten aus forschungshistorischer Sicht die zweite Radiationsphase, der Begriff wird aber heute nur noch als Bestandteil eines Gattungsnamens oder umgangssprachlich für das Amerikanische Mastodon gebraucht.[164]


Als die bedeutendste Rüsseltierlinie der zweiten Radiationsphase können die Gomphotheriidae hervorgehoben werden. Auch diese ist zuerst in Afrika nachweisbar, die Angehörigen verbreiten sich aber spätestens ab dem Unteren Miozän vor gut 22 Millionen Jahren über Eurasien bis nach Nordamerika. Die Gomphotheriidae bilden eine der erfolgreichsten Gruppen innerhalb der Rüsseltiere, da sie sich im Zuge der Auskühlung des Klimas und der damit einhergehenden Ausbreitung offener Landschaften im Miozän in zahlreiche Untergruppen aufspalteten. So vereinen sie heute fast die Hälfte aller bekannten Taxa, die sich wiederum in mehrere Unterfamilien aufteilen lassen.[9] Allgemein handelt es sich bei den Gomphotheriidae um Rüsseltiere mit vier Stoßzähnen, je zwei im Ober- und im Unterkiefer. Ein weiteres Merkmal sind ein weitgehend bunodonter, aber variantenreicher Zahnbau der Molaren, wobei die Milchzähne und die ersten beiden Dauermolaren drei Schmelzleisten besitzen – weswegen sie ursprünglich auch als trilophodonte Gomphotherien bezeichnet wurden –, während der letzte Backenzahn vier, fünf und mehr Rippen hat.[165][64] Zur Unterteilung der Gomphotheriidae werden unter anderem die Stoßzähne herangezogen. So weisen die Gomphotheriinae in der oberen Zahnreihe zwei deutlich nach unten gerichtete Stoßzähne auf, während jene des Unterkiefers langgestreckt und abgeflacht sind. Ihre Angehörigen zählen zu den Basalformen der gesamten Familie. Die Charakterform Gomphotherium erreicht von Afrika kommend vor rund 20 Millionen Jahren weite Teile Eurasiens und setzt wenig später auch nach Nordamerika über. Als einer der bedeutendsten Funde gilt das Skelett von Gweng bei Mühldorf am Inn östlich von München, das ein nahezu vollständiges Individuum von rund 3 m Körperhöhe repräsentiert.[166] Die auf Afrika und Eurasien beschränkten Choerolophodontinae wiederum haben dagegen kurze, in ihrer Länge deutlich reduzierte Unterkieferstoßzähne, während die Amebelodontinae wie Platybelodon aus Asien und Amebelodon aus Nordamerika mit stark verlängerten und verbreiterten, schaufelartig umgebildeten Unterkieferstoßzähnen ausgestattet sind. Die oberen Stoßzähne weisen bei den Amebelodontinae nur eine geringe Größe auf. Diese Entwicklung geht teilweise so weit, dass sich im Gegensatz zu den meisten Rüsseltieren die oberen Stoßzähne ganz verlieren, wie es etwa Aphanobelodon aus dem östlichen Asien zeigt.[14] Die Rhynchotheriinae wiederum ähneln den Gomphotheriinae, haben aber seitlich abgeflachte Unterkieferstoßzähne. Sie bilden einen teilweise amerikanischen Zweig, der aus den ursprünglich Gomphotherium-artigen Formen hervorgeht, ein typischer Vertreter ist hier Stegomastodon. Im weiteren Verlauf und begünstigt durch den Großen Amerikanischen Faunenaustausch vor rund 3 Millionen Jahren besiedeln sie auch Südamerika, wo sich dann eigenständige Formen herausentwickeln. Die südamerikanischen Gomphotherien unterscheiden sich von ihren Verwandten in Eurasien und Nordamerika durch ihr vergleichsweise kurzes Rostrum und den höher aufgewölbten Schädel. Dadurch entstehen aus den einst langschnauzigen (longirostrinen) Gomphotherien kurzschnauzige (brevirostrine) Formen. Die Schädelumgestaltung entstand aus dem weitgehend vollständigen Verlust der unteren Stoßzähne. Die aus Südamerika bekannten Gattungen Notiomastodon und Cuvieronius werden daher manchmal auch in die eigene Unterfamilie der Cuvieroniinae eingeordnet. Eine vergleichbare Entwicklung durchlaufen die Sinomastodontinae in Ostasien.[135] Einige der zu den Gomphotheriidae gezählten Arten überlebten bis ins späte Pleistozän.[63][35][64]

Aus den trilophodonten Gomphotherien entwickelten sich die tetralophodonten Formen heraus, welche auf den Milchzähnen und den vorderen Dauermolaren je vier Schmelzleisten besaßen. Bedeutend sind hier Tetralophodon und Anancus, die im Mittleren beziehungsweise im Oberen Miozän erstmals in Afrika und Eurasien in Erscheinung treten. Ihre etwas moderneren Schädelmerkmale rücken beide Gattungen in die nähere Verwandtschaft zu den Stegodontidae und Elephantidae und damit der Überfamilie der Elephantoidea.[107] Beide Gattungen zeichnen sich durch stark reduzierte Unterkieferstoßzähne aus, die teils nur noch im Milchgebiss ausgeprägt sind. Für Anancus ist zudem die seitlich zueinander versetzte Leistenstruktur der Molaren charakteristisch. Vermutlich ist Anancus ein eurasischer Abkömmling von Tetralophodon, der später wieder nach Afrika einwanderte.[47][63][35] Unabhängig von dieser altweltlichen Entwicklungslinie entstanden in Amerika offensichtlich auch Gomphotherien-artige Formen mit einer höheren Anzahl an Schmelzleisten wie das spätmiozäne Pediolophodon aus Nebraska, welches allerdings nur auf dem zweiten Mahlzahn vier Schmelzfalten aufweist, auf dem ersten dagegen drei.[130]
Die zweite große Gruppe innerhalb der zweiten Radiationsphase umfasst die Stegodontidae, die sich im Mittleren Miozän vor etwa 15 Millionen Jahren in Ost- beziehungsweise Südostasien aus Gomphotherien mit bunodonten Molaren entwickelten.[167][168] Die älteste Form ist Stegolophodon. Aus dieser ging dann die spätere und dominante Gattung Stegodon hervor, die typische gerippte, aus bis zu neun Leisten bestehende und mitunter hochkronige Molaren besitzt. In der Regel haben die Stegodonten nur obere, eng stehende Stoßzähne, die unteren sind in den verkürzten Unterkiefern weitgehend reduziert oder nicht mehr ausgebildet. Die Rüsseltiergruppe war über einen Großteil Eurasiens verbreitet. Der Schwerpunkt findet sich aber im östlichen und südöstlichen Asien, hier entstanden auf einzelnen Inseln wie etwa auf Flores zudem verzwergte Formen.[65] Im späten Miozän und frühen Pliozän tritt sie auch in Afrika auf, bleibt dort aber ein rares Faunenelement.[169] Amerika erreichten die Stegodontidae hingegen nicht.[170][35]
Dritte Radiation

Die dritte Radiationsphase begann im Oberen Miozän vor 7 Millionen Jahren und umfasst die Gruppe der Elefanten, die einzige Rüsseltierfamilie, die bis heute überlebt hat. Typisch für die Tiere sind deutlich verkürzte und stark aufgewölbte Schädel. Die Molaren zeigen sich auffallend verlängert und sind lamellenartig aufgebaut mit einer zwischen acht und 30 variierenden Lamellenzahl. Dabei sind die Lamellen flach ausgebildet und nicht mehr so prominent erhöht wie bei den vorhergehenden Rüsseltiergruppen. Im Laufe der Radiationsphase erhöht sich nicht nur die Zahnkrone beständig, auch nimmt die Lamellenanzahl zu, während sich die Zahnschmelzdicke je Lamelle reduziert. Es handelt sich hierbei um typische Anpassungen an eine zunehmend von Gräsern dominierte Ernährungsweise. Auch sind die unteren Stoßzähne weitgehend zurückentwickelt und den oberen fehlt als charakteristisches Kennzeichen eine Zahnschmelzhülle.[9]
Als ursprünglichere Gruppe gelten die Stegotetrabelodontinae, die vom ausgehenden Miozän vor etwas mehr als 7 Millionen Jahren bis zum Pliozän weitgehend nur in Afrika verbreitet ist. Die älteste Form der moderneren Elephantinae findet sich Primelephas, welcher nahezu zeitgleich im östlichen und zentralen Afrika in Erscheinung tritt. Ihm folgen in relativ engem zeitlichen Abstand Mammuthus, Loxodonta und Palaeoloxodon. Weitgehend problematisch bei diesen frühen Elefanten ist der Umstand, dass das nur stark fragmentiert überlieferte Fundmaterial eine sichere Unterscheidung nicht in jedem Fall zulässt.[171][33][63] Loxodonta, die Gattung der heutigen Afrikanischen Elefanten, bleibt während ihrer gesamten Stammesgeschichte auf Afrika beschränkt, Mammuthus und Palaeoloxodon hingegen betreten vor rund 3 Millionen Jahren auch eurasischen Boden.[172] Hier formen sich eigenständige Entwicklungslinien heraus, die bekanntesten Vertreter sind bei Mammuthus das Wollhaarmammut (Mammuthus primigenius), bei Palaeoloxodon der Europäische Waldelefant (Palaeoloxodon antiquus). Für beide Arten gibt es einen umfassenden Fossilbericht. So liegen von ersterer neben Einzelfunden bis hin zu ganzen „Mammutfriedhöfen“ auch verschiedentlich Eismumien aus dem Permafrost Nordasiens vor, die sich begünstigt durch die Anpassung der Tiere an das arktische Klima bis heute erhalten haben.[15][173] Von letzterer kamen unter anderem mehrere, teils vollständige Skelettreste im Geiseltal zu Tage.[174] Mammuthus wanderte als einzige Elefantenform vor knapp 2 Millionen Jahren nach Amerika, wo wiederum eine eigenständige Entwicklung einsetzte.[15] Elephas und damit die Gattung der Asiatischen Elefanten hingegen lässt sich erstmals im ausgehenden Pliozän in Südasien nachweisen.[33] Generell handelt es sich bei den Elefanten um sehr große Tiere. Mit dem Steppenmammut (Mammuthus trogontherii) und dem Präriemammut (Mammuthus columbis) entstanden einige der größten dokumentierten Rüsseltierformen, deren Schulterhöhe jeweils rund 4,5 m betrug.[9][6] Dem gegenüber beherbergten zahlreiche Inseln des Mittelmeers und einige des Pazifiks verschiedene verzwergte Formen, wobei bei manchen Zwergelefanten die Körpergrößenreduktion soweit fortschritt, dass sie nur rund 2 bis 7 % der Größe der Ausgangsformen aufweisen.[65][67]
Ausklang
Im Neogen, besonders im Pleistozän, fand eine weltweite Verbreitung der Rüsseltiere auf alle Kontinente, außer Australien und Antarktika, mit zahlreichen Arten statt. Diese Verbreitung kann nur durch die Annahme ausgedehnter Wanderungen über Landbrücken stattgefunden haben, die vor rund 20 Millionen Jahren zwischen Afrika und Eurasien und vor rund 3,5 Millionen Jahren zwischen Nord- und Südamerika entstanden waren. Mit der weiten Verbreitung der Rüsseltiere im Verlauf des Miozäns erhöhte sich auch ihre Diversität und es entstanden zahlreiche Arten und Gattungen. Wahrscheinlich verhinderten Anpassungen an unterschiedliche Landschaftsräume eine zu starke Konkurrenz untereinander. Ein erster Niedergang ist aber bereits im ausgehenden Miozän vor rund 8 Millionen Jahren zu verzeichnen. Dies wird mit der allgemeinen Abkühlung und stärkeren Saisonalisierung des Klimas sowie der damit einhergehenden Ausbreitung von C4-Gräsern in Verbindung gebracht. Die Veränderungen führten dazu, dass ein größerer Teil der Lebensräume weniger produktiv war als noch zuvor unter wärmeren Bedingungen und bei der Dominanz von C3-Pflanzen. Der Effekt wurde dann vor rund 3 Millionen Jahren mit dem allmählichen Einsetzen des Eiszeitalters verstärkt, was zum Aussterben zahlreicher Rüsseltierlinien führte.[62] Dennoch lebten in der Zeit des ausgehenden Pleistozäns, also in einem Zeitraum von vor 50.000 bis vor etwa 12.000 Jahren, noch fast ein Dutzend Gattungen von Rüsseltieren: Mammut, Stegomastodon, Notiomastodon, Cuvieronius, Stegodon, Loxodonta, Palaeoloxodon, Elephas und Mammuthus. Für die meisten Rüsseltiervertreter während der rund 60 Millionen Jahre währenden Stammesgeschichte kann aufgrund zu geringer Funde kein genaues Aussterbeszenario erstellt werden, die spätpleistozänen Formen bieten jedoch bedingt durch das größere Fossilaufkommen diese Möglichkeit. Besonders für Mammut, Notiomastodon und Mammuthus[175][176][177][178] sowie bedingt auch für Cuvieronius und Palaeoloxodon ist das Verschwinden gut dokumentiert. Während Loxodonta und Elephas bis heute bestehen, starb ein Teil der anderen Rüsseltiere im Übergang vom Pleistozän zum Holozän aus. Mammuthus und Palaeoloxodon überlebten teilweise noch bis in das Mittlere Holozän.[179][65] Dabei ging mit dem Aussterben der meisten Rüsseltiergattungen, aber auch anderer großer Säugetiere bis zum Beginn des Holozäns, möglicherweise die Ausbreitung des modernen Menschen (Homo sapiens) einher. Jedoch können neben dem Menschen zusätzlich auch die starken Klimaschwankungen der Warm- und Kaltphasen der letzten Kaltzeit und verschiedene andere Faktoren als Ursachen in Frage kommen. Die Gründe der sogenannten Quartären Aussterbewelle, die unter Umständen einen längerdauernden Zeitraum in Anspruch nimmt, unterliegen einem starken wissenschaftlichen Disput.[107] So wird angenommen, dass Cuvieronius sowohl in Nord- als auch in Südamerika bereits vor der Ankunft des Menschen sein letztes Auftreten hatte und möglicherweise im Konkurrenzdruck zu anderen Rüsseltieren ausstarb.[175][180]
Forschungsgeschichte
Taxonomie und Etymologie
Die Gattung Elephas war bereits im Jahr 1758 von Linnaeus (1707–1778) in seinem für die zoologische Nomenklatur bedeutenden Werk Systema Naturae offiziell eingeführt worden, schloss damals aber sowohl die asiatischen als auch die afrikanischen Elefanten ein.[181] Frédéric Cuvier (1773–1838) trennte dann 1825 die Gattung Loxodonta ab, wobei der Name selbst erst durch eine Publikation zwei Jahre später Anerkennung fand.[182][183] Im Jahr 1821 fasste John Edward Gray (1800–1875) die Elefanten in der Familie der Elephantidae zusammen.[184] Bereits zehn Jahre vor Gray, 1811, hatte Johann Karl Wilhelm Illiger (1775–1813) die Bezeichnung Proboscidea für die Elefanten genutzt, welche auf dem auffälligsten Kennzeichen der Tiere basiert, den Rüssel. Demzufolge wies er sie im Deutschen als „Rüsseltiere“ aus.[185] Der Name Proboscidea leitet sich von der griechischen Bezeichnung προβοσκίς (proboskis) her, welche heute allgemein mit „Rüssel“ übersetzt wird. Mit der griechischen Vorsilbe προ- (pro-) wird eine Ortslage („sich vor etwas befinden“) ausgedrückt, das griechische Wort βοσκή (boskḗ) bedeutet etwa „Futter“ oder „Weide“ (als Verb βόσκειν (bóskein) „weiden“ oder „füttern“). Der Rüssel als funktionelles Organ steht somit mit der Nahrungsaufnahme im Zusammenhang.[186][187] Andere Autoren übersetzen Proboscis auch einfach mit „vor dem Maul“.[3]
Dickhäuter, Huftiere und afrikanische Tiere – Zur höheren Systematik

Die systematische Stellung der Elefanten wurde im Laufe der Zeit sehr unterschiedlich bewertet. Nach Linnaeus gehörten sie in eine als Bruta bezeichnete Gruppe, in der unter anderem auch die Seekühe, Faultiere sowie Schuppentiere standen und die sich durch fehlende Schneidezähne auszeichnete.[181] Johann Friedrich Blumenbach verschob Ende des 18. Jahrhunderts die Elefanten in die bereits von Linnaeus konzipierte Gruppe der Belluae und stellte ihnen so verschiedene Huftiere wie die Tapire, Nashörner, Flusspferde und die Schweine zur Seite. Er beschrieb die Bellue als große plumpe Tiere mit geringer Körperbehaarung.[188] Seine Zusammenstellung sollte sich für den weiteren Verlauf des 18. und für das 19. Jahrhundert als die prinzipielle Verwandtschaftszuordnung der Rüsseltiere erweisen. Noch 1795 fassten dann Étienne Geoffroy Saint-Hilaire (1772–1844) und Georges Cuvier (1769–1832) diese zu den Pachydermata zusammen,[189] denen Cuvier später noch die Pekaris, Schliefer und einige ausgestorbene Formen hinzufügte.[190] Die Pachydermata zeitigte nur eine kurze Bestandsdauer in der Systematikgeschichte, sie haben aber einen langen Nachklang, da in einer populären Betrachtung ihr Name als „Dickhäuter“ bis heute überlebt. Sie blieben aber nicht die einzigen Gliederungsversuche im 19. Jahrhundert. Illiger selbst hatte in seiner Schrift von 1811 die Rüsseltiere zu einer Einheit namens Multungulata („Vielhufer“) gestellt, die aber konzeptionell den Pachydermata entsprach. Gray wiederum übernahm 1821 Illigers Ordnungseinheit und setzte den Elefanten zusätzlich noch mit den „Mastodonten“ eine altertümliche Rüsseltiergruppe zur Seite. Er integrierte die Rüsseltiere in eine übergeordnete Gruppe namens Quadripedes („Vierfüßer“), die als äußerst weit gefasste Gruppe alle vierfüßig laufenden Säugetiere einschloss, neben den Huftieren also auch noch die Raubtiere, Nagetiere, Insektenfresser, Nebengelenktiere und weitere.[184] Das Konstrukt der Pachydermata hingegen wurde bereits 1816 von Henri Marie Ducrotay de Blainville erstmals aufgebrochen. In einem tabellenartigen Übersichtswerk unterschied er mehrere Gruppen an Huftieren. So trennte de Blainville Tiere mit einer geraden Anzahl an Zehen (onguligrades à doigts pairs) von solchen mit einer ungeraden Anzahl (onguligrades à doigts impairs) ab. Die Elefanten schloss er als einzige Mitglieder in eine höhere Gruppe namens Gravigrades ein, stellte sie aber an die Seite der unpaarigen Huftiere.[191] Mehr als drei Dekaden später, 1848, übernahm Richard Owen den Ansatz de Blainvilles und etablierte sowohl die Paarhufer (Artiodactyla) als auch die Unpaarhufern (Perissodactyla), womit er die Pachydermata endgültig aufspaltete.[192][193]
Unbeeinflusst von der Aufspaltung der Pachydermata blieb die angenommene Verwandtschaft der Rüsseltiere mit den Huftieren auch nachfolgend weitgehend bestehen. Dem gegenüber merkte Theodore Gill im Jahr 1870 eine engere Bindung zwischen den Seekühen und den Schliefern an, er gab dieser Verwandtschaftsbeziehung allerdings keinen speziellen Namen.[194] Andere Autoren belegten ähnliche Verwandtschaftsverhältnisse mit verschiedenen Bezeichnungen. Edward Drinker Cope nutzte in den 1880 und 1890er Jahren etwa Taxeopoda, während Richard Lydekker in den 1890er Jahren und Max Schlosser in den 1920er Jahren von den Subungulata sprachen. Die meisten verwendeten Bezeichnungen erwiesen sich aber jeweils als problematisch. Copes Taxeopoda enthielten ursprünglich Huftiere mit seriellem Fußaufbau (Rüsseltiere, Schliefer und einige ausgestorbene Formen), welche sich von den übrigen Huftieren mit alternierendem Fußaufbau (Paarhufer, Unpaarhufer) unterschieden. Letztere trennte er als Diplarthra ab. In seinem abschließenden Konzept fügte er aber noch die Primaten zu den Taxeopoda hinzu. Die Subungulata nach Lydekker und Schlosser ähnelten in ihrer Zusammensetzung Copes Taxeopoda, der Name war aber schon 1811 von Illiger für die Meerschweinchenverwandten benutzt worden. George Gaylord Simpson etablierte daher im Jahr 1945 in seiner generellen Taxonomie der Säugetiere die Paenungulata als eine neue übergeordnete Gruppe für die Elefanten, Schliefer und Seekühe nebst diversen ausgestorbenen Formen.[193] Die Paenungulata sah Simpson als Bestandteil der Protungulata.[193] Dagegen führten 1997 Malcolm C. McKenna und Susan K. Bell die Paenungulata (hier als Uranotheria benannt) einschließlich der Elefanten allgemein innerhalb der Ungulata.[114]
In zahlreichen Systematiken wurden die Paenungulata als näher verwandt mit den Unpaarhufern erachtet. Mit den Ende des 20. Jahrhunderts verstärkt aufkommenden biochemischen und molekulargenetischen Untersuchungsmethoden änderte sich die Sichtweise. Bereits Anfang der 1980er Jahre verwiesen Proteinanalysen nicht nur auf eine enge Verwandtschaft von Elefanten, Schliefern und Seekühen, sondern auch mit dem Erdferkel,[195] was weitere Untersuchungen untermauerten.[196] Mitte der 1990er Jahre bestätigten dann genetische Untersuchungen die Homogenität der Paenungulata.[197][198] Diesen ersten Befunden folgten im Übergang zum 21. Jahrhundert weitere Analysen. Sie deckten letztendlich auf, dass die Elefanten, Schliefer und Seekühe sowie das Erdferkel einer Gruppe angehören, die auch die Tenreks, Goldmulle und Rüsselspringer einschließt. Es handelt sich hierbei um originär in Afrika verbreitete Tiergruppen, die gesamte Gemeinschaft wurde folglich als Afrotheria bezeichnet.[199][200][201][102] Die Ergebnisse ließen sich später reproduzieren, eine weitere Festigung der Ansicht ergab sich durch die Isolierung eines spezifischen Retroposons, das sogenannte AfroSINE, welches allen Vertretern der Afrotherien gemein ist.[202][203]
„Mastodonten“ und Co. – Zur inneren Gliederung
Bereits bis zum ersten Drittel des 19. Jahrhunderts waren durch die Einführung der Gattungen Elephas und Loxodonta, der Familie der Elephantidae sowie der Ordnung der Proboscidea alle wichtigen taxonomischen Einheiten benannt. Den ersten fossilen Vertreter wies Blumenbach im Jahr 1799 mit Mammut aus,[188] dem im Verlauf des 19. Jahrhunderts mit Mammuthus 1828, Deinotherium 1829, Gomphotherium 1837, Stegodon 1847 oder Anancus 1855 zahlreiche weitere folgen sollten. Noch in den letzten Jahren des 18. Jahrhunderts stellte Georges Cuvier, der zu den ersten Verfechtern der vergleichenden Anatomie gehört, erstmals die heutigen Elefanten ausgestorbenen Vertretern gegenüber.[204] Auf Cuvier geht nachfolgend auch die Gattungsbezeichnung „Mastodon“ zurück, die er im Jahr 1817 offiziell etablierte, in abgewandelter Form als „Mastodonte“ hatte er sie schon 1806 verwendet.[205] Innerhalb seiner neuen Gattung differenzierte Cuvier zwei Arten heraus: „Mastodon giganteum“ und „Mastodon“ angustidens.[190] Mit ersterer bezeichnete Cuvier das heutige Amerikanische Mastodon, mit letzterer eine Form von Gomphotherium. Dadurch vereinte er zwei aus heutiger Sicht nicht näher miteinander verwandte Rüsseltierformen unter einer Gattung, die einerseits durch ein zygodontes, andererseits durch ein bunodontes Zahnmuster charakterisiert sind. Die Bezeichnung „Mastodon“ setzte sich in den nächsten mehr als 150 Jahren weitgehend durch. Charles Frédéric Girard führte im Jahr 1852 die Familie der „Mastodontidae“ ein (allerdings hatte Gray bereits 1821 den Begriff „Mastodonadae“ verwendet[184]).[206]

In den ersten drei Jahrzehnten des 20. Jahrhunderts prägte Henry Fairfield Osborn (1857–1935) die Erforschung der Rüsseltiere. Im Fokus seines Interesses standen vor allem die Fossilreste, die auch zentraler Gegenstand einer von ihm organisierten und im Frühjahr 1907 durchgeführten Expedition des American Museum of Natural History in das Fayyum-Gebiet in Ägypten waren.[207][208] Als Ergebnis seiner Forschungstätigkeiten publizierte er in den 1920er und 1930er Jahren mehrere Aufsätze über die Phylogenie der Rüsseltiere. Sein zweibändiges Gesamtwerk The Proboscidea erschien posthum 1936 und 1942 und bildet eine über 1600-seitige Zusammenstellung seiner Forschungsarbeiten zu dem Thema. Darin unterschied Osborn über 350 Arten und Unterarten in mehr als 40 Gattungen sowie 8 Familien. Die Benennung der einzelnen Gruppen folgte dabei in einem Osborn’schen Prinzip und nicht nach der in der Zoologie gängigen Vorgehensweise (etwa der Prioritätsregel oder der Regelung, dass Familiennamen auf gültigen Gattungsnamen beruhen). Beispielsweise bezeichnete er die Deinotheriidae mit Curtognathidae und die Gomphotheriidae mit Bunomastodontidae. Prinzipiell aber stellte Osborn mit den Moeritherioidea, Deinotherioidea, Mastodontoidea und Elephantoidea vier große Formengruppen innerhalb der Proboscidea heraus. Die ersten beiden Gruppen sah Osborn als die semi-aquatisch lebende Ursprungsgruppe an, letztere beiden als Wald- und Offenlandbewohner. In den Mastodontoidea vereinte er die zygodonten „echten Mastodonten“ (Mammutidae) und die bunodonten Formen (Gomphotheriidae). Nach seiner Auffassung gingen die zygodonten Mastodonten aus Palaeomaston hervor, die bunodonten hingegen aus Phiomia.[163][209][210] Später, mit seinem The Proboscidea-Kompendium, führte Osborn noch die Stegodontoidea als fünfte Großgruppe ein, die er in einer engen Beziehung zu den zygodonten Mastodonten wähnte und als Ursprungsgruppe der Elefanten betrachtete. Zudem untermauerte er hierin seine bereits im Übergang vom 19. zum 20. Jahrhundert erarbeitete Theorie zu einem afrikanischen Ursprung der Rüsseltiere, die er durch die im Fayyum entdeckten Knochenfunde aus dem Eozän und Oligozän bestätigt sah.[211]
Nur wenige Jahre darauf aber verwarf George Gaylord Simpson in seiner Säugetier-Taxonomie Osborns Schema. Er kritisierte dabei Osborns Nichtbeachtung nomenklatorischer Regeln. In einem eigenen Gliederungsversuch transferierte er Osborns Bezeichnungen in die gängige Nomenklatur und unterschied dadurch ebenfalls vier Großgruppen, denen er die Bezeichnungen Moeritherioidea, Barytherioidea, Deinotherioidea und Elephantoidea gab. Innerhalb letzterer führte er drei Familien: So teilte er die Mastodonten in die Gomphotheriidae sowie die Mammutidae auf und stellte ihnen die Elephantidae zur Seite, denen er nicht nur die heutigen Elefanten, sondern auch die Stegodonten zuordnete. Problematisch blieben in Simpsons Augen die Barytherioidea, die von anderen Autoren manchmal auch als außerhalb der Rüsseltiere stehend eingestuft wurden.[193]
Im weiteren Verlauf des 20. Jahrhunderts hatten unter anderem Forscher wie John M. Harris und Vincent J. Maglio maßgeblichen Anteil an der Erforschung der Elefanten und ihrer fossilen Verwandtschaft. In einer Übersicht zur afrikanischen Rüsseltier-Fauna aus dem Jahr 1978 stellten sie eine überarbeitete Systematik der Ordnung vor, die sie weitgehend auf die Elephantiformes eingrenzten und urtümlichere Gruppen wie die der Moeritherien, Barytherien und Deinotherien aussonderten. Innerhalb ihrer „Stamm“-Rüsseltiere unterschieden sie die übergeordneten Gruppen der Mammutoidea und der Gomphotherioidea, mit ersteren die Mammutidae und Stegodontidae, letzteren die Gomphotheriidae und Elephantidae einschließend.[212][213][214] McKenna und Bell gliederten im Jahr 1997 die Proboscidea weitgehend im klassischen Sinne und integrierten die älteren Gruppen wie Barytherien, Moeritherien und Deinotherien wieder in die Ordnung. Die jüngeren Gruppen teilten sie wie die Autoren zuvor in zwei Linien, von denen eine die Mammutoidea beinhaltete, die andere die Elephantoidea, der alle anderen Rüsseltiere angehörten (Gomphotherien, Stegodonten und Elefanten).[114] Die heute weitgehend gebräuchliche systematische Unterteilung der Rüsseltiere geht auf Jeheskel Shoshani sowie Pascal Tassy zurück und wurde im Jahr 2005 publiziert.[107] Knapp zehn Jahre zuvor hatten beide Wissenschaftler gemeinsam bereits eine Monographie herausgegeben, die wie Osborns Werk mit The Proboscidea betitelt ist. In der Folgezeit gab es unter anderen durch William J. Sanders und Kollegen im Jahr 2010 eine umfangreiche Revision der afrikanischen Rüsseltiere.[35] Der Erforschung der frühesten Rüsseltiere widmete sich im ausgehenden 20. Jahrhundert und in den ersten beiden Jahrzehnten des 21. Jahrhunderts unter anderem Emmanuel Gheerbrant.[153][144][109][110][5][147]
Rüsseltiere und Menschen
In der Spätphase der Rüsseltier-Entwicklung und mit der Herausbildung und Entwicklung des Menschen kam es zu zahlreichen Interaktionen zwischen beiden Gruppen. Anfänglich besiedelten die Rüsseltiere und die Frühmenschen gemeinsame Lebensräume, wie an den verschiedensten Fundstellen des Pleistozäns in Afrika und Eurasien belegt werden konnte. Spätestens seit dem Mittelpleistozän nutzte der frühe Mensch die Rüsseltiere auch zunehmend als Nahrungs- und Rohstoffquelle. Eindeutige Belege der Jagd sind zwar eher selten, liegen aber evident unter anderem mit der Lanze von Lehringen aus der letzten Warmzeit (Eem-Warmzeit) vor, deren Schaft im Skelett eines Europäischen Waldelefanten steckte.[215] Rohstoffnutzung hingegen lässt sich an zahlreichen Lokalitäten nachweisen, zumeist angezeigt durch zerlegte Kadaver. Dies betrifft nicht nur die ehemals in Eurasien oder Afrika heimischen Formen wie Mammuthus und Palaeoloxodon, auch aus Amerika sind zahlreiche Hinweise dokumentiert und erweitern so das Spektrum um Gattungen wie Notiomastodon oder Mammut.[216][217] Vor allem im Ausklang der letzten Kaltzeit und mit dem Aufkommen der jungpaläolithischen Kunst wurden Rüsseltiere in das künstlerische Schaffen des Menschen mit einbezogen. Körperteile der Tiere kamen nicht nur bei der Herstellung von Objekten der mobilen Kleinkunst zur Anwendung, auch dienten sie selbst als Vorbild für verschiedenste Darstellungen, seien es Kleinplastiken oder Ritzungen in Stein und Knochen beziehungsweise Gravuren und Höhlenmalereien auf Felswänden. Hervorzuheben sind hier die zahlreichen Mammutbildnisse der Frankokantabrischen Höhlenkunst.[218][219]
Bis heute haben drei Elefantenarten überlebt. Zumindest dem Afrikanischen und dem Asiatischen Elefanten kann eine große lokale Bedeutung in Kunst und Kultur zugesprochen werden, die sich in zahlreichen Darstellungen auf Felswänden und im Falle von letzterem auch in der Tempelarchitektur sowie im religiösen Kontext äußert. Der Asiatische Elefant ist auch der einzige Vertreter im dauerhaften Dienst der Menschen, er stellt aber kein vollständig domestiziertes Tier dar.[220] Die Bestände der drei heute lebenden Elefantenarten sind durch Jagd hauptsächlich auf die Stoßzähne und zusätzlich durch die zunehmende Lebensraumzerstörung in Folge der Ausbreitung menschlicher Siedlungen und Wirtschaftsflächen gefährdet.[221][222][223]
Literatur
- Juan L. Cantalapiedra, Óscar Sanisidro, Hanwen Zhang, María T. Alberdi, José L. Prado, Fernando Blanco und Juha Saarinen: The rise and fall of proboscidean ecological diversity. Nature Ecology & Evolution, 2021, doi:10.1038/s41559-021-01498-w
- Ursula B. Göhlich: Order Proboscidea. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 157–168.
- Jan van der Made: The evolution of the elephants and their relatives in the context of a changing climate and geography. In: Harald Meller (Hrsg.): Elefantenreich. Eine Fossilwelt in Europa. Halle/Saale, 2010, S. 340–360.
- William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Saegusa und Cyrille Delmer: Proboscidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 161–251.
Einzelnachweise
- Jeheskel Shoshani: Skeletal and basic anatomical features of elephants. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 9–20.
- G. Wittemyer: Family Elephantidae (Elephants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World.Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 50–79.
- Jeheskel Shoshani und Pascal Tassy (plus weitere Autoren): Order Proboscidea – Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 173–200.
- Per Christiansen: Body size in proboscideans, with notes on elephant metabolism. Zoological Journal of the Linnean Society 140, 2004, S. 523–549.
- Emmanuel Gheerbrant: Paleocene emergence of elephant relatives and the rapid radiation of African ungulates. PNAS 106 (26), 2009, S. 10717–10721.
- Asier Larramendi: Shoulder height, body mass, and shape of proboscideans. Acta Palaeontologia Polonica 61 (3), 2016, S. 537–574
- Kathlyn M. Smith und Daniel C. Fisher: Sexual dimorphism of structures showing indeterminate growth: tusks of American mastodons (Mammut americanum). Paleobiology 37 (2), 2011, S. 175–194.
- Jeheskel Shoshani und Pascal Tassy: Summary, conclusions, and a glimpse into the future. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 335–348.
- Jeheskel Shoshani: Understanding proboscidean evolution: a formidable task. Tree 13, 1998, S. 480–487.
- Wighart von Koenigswald: Lebendige Eiszeit. Klima und Tierwelt im Wandel. Theiss-Verlag, Stuttgart 2002, S. 1–190 (S. 42–53) ISBN 3-8062-1734-3
- Ursula B. Göhlich: Order Proboscidea. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 157–168.
- William J. Sanders: Horizontal tooth displacement and premolar occurrence in elephants and other elephantiform proboscideans. Historical Biology 30 (1–2), 2018, S. 137–156, doi:10.1080/08912963.2017.1297436.
- Ekke W. Günther: Die Gebisse der Waldelefanten von Bilzingsleben. In: Dietrich Mania (Hrsg.): Bilzingsleben IV. Homo erectus – Seine Kultur und seine Umwelt. Veröffentlichungen des Landesmuseums für Vorgeschichte in Halle 44, Berlin 1991, S. 149–174.
- Shi-Qi Wang, Tao Deng, Jie Ye, Wen He und Shan-Qin Chen: Morphological and ecological diversity of Amebelodontidae (Proboscidea, Mammalia) revealed by a Miocene fossil accumulation of an upper-tuskless proboscidean. Journal of Systematic Palaeontology 15 (8), 2017, S. 601–615 doi:10.1080/14772019.2016.1208687.
- Adrian M. Lister und Paul Bahn: Mammuts – Die Riesen der Eiszeit. Sigmaringen, 1997, S. 1–168.
- Dick Mol und Wilrie van Logchem: The Mastodon of Milia – the longest tusks in the world. Deposits 19, 2009, S. 26–32.
- Cyrille Delmer: Reassessment of the generic attribution of Numidotherium savagei and the homologies of lower incisors in proboscideans. Acta Palaeontologica Polonica 54 (4), 2009, S. 561–580.
- Jeheskel Shoshani, Robert M. West, Nicholas Court, Robert J. G. Savage und John M. Harris: The earliest proboscideans: general plan, taxonomy, and palaeoecology. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 57–75.
- W. David Lambert: The microstructure of proboscidean ivory and its application to the subordinal identification of isolated ivory specimens. Bulletin of the Florida Museum of Natural History 45 (4), 2005, S. 521–530.
- Arun Banerjee: Das Mammutelfenbein. In: Ulrich Joger und Ute Koch (Hrsg.): Mammuts aus Sibirien. Darmstadt, 1994, S. 38–42.
- Sebastian J. Pfeifer, Wolfram L. Hartramph, Ralf-Dietrich Kahlke und Frank A. Müller: Mammoth ivory was the most suitable osseous raw material for the production of Late Pleistocene big game projectile points. Scientific Reports 9, 2019, S. 2303 doi:10.1038/s41598-019-38779-1.
- Arun Banerjee: Vergleichende Untersuchung der „Schreger-Struktur“ an Stoßzähnen von Elefanten. Mainzer Naturwissenschaftliches Archiv 42, 2004, S. 77–88.
- Marie Albéric, Mason N. Dean, Aurélien Gourrier, Wolfgang Wagermaier, John W. C. Dunlop, Andreas Staude, Peter Fratzl und Ina Reiche: Relation between the Macroscopic Pattern of Elephant Ivory and Its Three-Dimensional Micro-Tubular Network. PLoS ONE 12 (1), 2017, S .e0166671, doi:10.1371/journal.pone.0166671.
- Marie Albéric, Aurélien Gourrier, Wolfgang Wagermaier, Peter Fratzl und Ina Reiche: The three-dimensional arrangement of the mineralized collagen fibers in elephant ivory and its relation to mechanical and optical properties. Acta Biomaterialia 72, 2018, S. 342–351, doi:10.1016/j.actbio.2018.02.016.
- Attila Virág: Histogenesis of the Unique Morphology of Proboscidean Ivory. Journal of Morphology 273, 2012, S. 1406–1423.
- David L. Fox: Growth increments in Gomphotherium tusks and implications for late Miocene climate change in North America. Palaeogeography, Palaeoclimatology, Palaeoecology 156, 2000, S. 327–348.
- Daniel C. Fisher, Michael D. Cherney, Cody Newton, Adam N. Rountrey, Zachary T. Calamari, Richard K. Stucky, Carol Lucking und Lesley Petrie: Taxonomic overview and tusk growth analyses of Ziegler Reservoir proboscideans. Quaternary Research 82, 2014, S. 518–532.
- Heinz Tobien: The structure of the mastodont molar (Proboscidea, Mammalia). Part 1: The bunodont pattern. Mainzer Geowissenschaftliche Mitteilungen 2, 1973, S. 115–147.
- Heinz Tobien: The structure of the mastodont molar (Proboscidea, Mammalia). Part 2: The zygodont and zygobundodont patterns. Mainzer Geowissenschaftliche Mitteilungen 4, 1975, S. 195–233.
- Heinz Tobien: The structure of the mastodont molar (Proboscidea, Mammalia). Part 3: The Oligocene mastodont genera Palaeomastodon, Phiomia and the Eo/Oligocene paenungulate Moeritherium. Mainzer Geowissenschaftliche Mitteilungen 6, 1978, S. 177–208.
- D. Tab Rasmussen und Mercedes Gutiérrez: A Mammalian fauna from the Late Oligocene of Northwestern Kenya. Palaeontographica Abteilung A 288 (1–3), 2009, S. 1–52.
- Pascal Tassy: Dental homologies and nomenclature in Proboscidea. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 21–25.
- Vincent J. Maglio: Origin and evolution of the Elephantidae. Transactions of the American Philosophical Society 63, 1973, S. 1–149.
- Ralf-Dietrich Kahlke: Die Entstehungs-, Entwicklungs- und Verbreitungsgeschichte des Oberpleistozänen Mammuthus-Coelodonta-Faunencomplexes in Eurasien (Großsäuger). Abhandlungen der Senckenbergischen Naturforschenden Gesellschaft 546, 1994, S. 1–64.
- William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Saegusa und Cyrille Delmer: Proboscidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 161–251.
- H. U. Pfretzschner: Enamel microstructure and hyopsodonty in large mammals. In: Patricia Smith und Eitan Tchernov (Hrsg.): Structure, Function and Evolution of Teeth. London, 1992, S. 147–162.
- Nataniel Białas, Oleg Prymak, Ningthoujam Premjit Singh, Debajyoti Paul, Rajeev Patnaik und Matthias Epple: Teeth of past and present elephants: Microstructure and composition of enamel in fossilized proboscidean molars and implications for diagenesis. Geochemistry, Geophysics, Geosystems 22, 2021, S. e2020GC009557, doi:10.1029/2020GC009557.
- Rodolphe Tabuce, Cyrille Delmer und Emanuel Gheerbrant: Evolution of the enamel microstructure in the earliest proboscideans. Zoological Journal of the Linnean Society 149, 2007, S. 611–628.
- Jeheskel Shoshani, Robert C. Walter, Michael Abraha, Seife Berhe, Pascal Tassy, William J. Sanders, Gary H. Marchant, Yosief Libsekal, Tesfalidet Ghirmai und Dietmar Zinner: A proboscidean from the late Oligocene of Eritrea, a ‘‘missing link’’ between early Elephantiformes and Elephantimorpha, and biogeographic implications. PNAS 103 (46), 2006, S. 17296–17301.
- N. Court: Limb posture and gait in Numidotherium koholense, a primitive proboscidean from the Eocene of Algeria. Zoological Journal of the Linnean Society 111, 1994, S. 297–338.
- G. E. Weissengruber, F. K. Fuss, G. Egger, G. Stanek, K. M. Hittmair und G. Forstenpointner: The elephant knee joint: morphological and biomechanical considerations. Journal of Anatomy 208 (1), 2006, S. 59–72.
- John R. Hutchinson, Cyrille Delmer, Charlotte E. Miller, Thomas Hildebrandt, Andrew A. Pitsillides und Alan Boyde: From Flat Foot to Fat Foot: Structure, Ontogeny, Function, and Evolution of Elephant “Sixth Toes”. Science 334 (6063), 2011, S. 1699–1703, doi:10.1126/science.1211437.
- Martin S. Fischer: Die Oberlippe des Elefanten. Zeitschrift für Säugetierkunde 52, 1987, S. 262–263 ().
- Martin S. Fischer und Uschi Trautmann: Fetuses of African elephants (Loxodonta africana) in photographs. Elephant 2, 1987, S. 40–45.
- William P. Wall: Cranial evidence for a proboscis in Cadurcodon and a review of snout structure in the family Amynodontidae (Perissodactyla, Rhinocerotoidea). Journal of Paleontology 54 (5), 1980, S. 968–977.
- G. N. Markov, N. Spassov und V. Simeonovski: A reconstruction of the facial morphology and feeding behaviour of the deinotheres. In: G. Cavarretta et al. (Eds.): The World of Elephants – International Congress. Consiglio Nazionale delle Ricerche. Rom, 2001, S. 652–655.
- Ursula B. Göhlich: Tertiäre Urelefanten aus Deutschland. In: Harald Meller (Hrsg.): Elefantenreich. Eine Fossilwelt in Europa. Halle/Saale, 2010, S. 362–372.
- George A. Lyras: Brain Changes during Phyletic Dwarfing in Elephants and Hippos. Brain, Behavior and Evolution, 2019, doi:10.1159/000497268.
- Suzana Herculano-Huzel, Kamilla Avelino-de-Souza, Kleber Neves, Jairo Porfírio, Débora Messeder, Larissa Mattos Feijó, José Maldonado und Paul R. Manger: The elephant brain in numbers. Frontiers in Neuroanatomy 8, 2014, S. 46, doi:10.3389/fnana.2014.00046.
- Anastasia S. Kharlamova, Sergei V. Saveliev, Albert V. Protopopov, Busisiwe C. Maseko, Adhil Bhagwandin, und Paul R. Manger: The Mummified Brain of a Pleistocene Woolly Mammoth (Mammuthus primigenius) Compared With the Brain of the Extant African Elephant (Loxodonta africana). The Journal of Comparative Neurology 523, 2015, S. 2326–2343.
- Asier Larramendi und Maria Rita Palombo: Body Size, Biology and Encephalization Quotient of Palaeoloxodon ex gr. P. falconeri from Spinagallo Cave (Hyblean plateau, Sicily). Hystrix, the Italian Journal of Mammalogy 26 (2), 2015, S. 102–109.
- Julien Benoit: A new method of estimating brain mass through cranial capacity in extinct proboscideans to account for the non-neural tissues surrounding their brain. Journal of Vertebrate Paleontology 35, 2015, S. e991021, doi:10.1080/02724634.2014.991021.
- Julien Benoit, Lucas J. Legendre, Rodolphe Tabuce, Theodor Obada, Vladislav Mararescul und Paul Manger: Brain evolution in Proboscidea (Mammalia, Afrotheria) across the Cenozoic. Scientific Reports 9, 2019, S. 9323, doi:10.1038/s41598-019-45888-4.
- Polly K. Phillips und James Edward Heath: Heat exchange by the pinna of the African elephant (Loxodonta africana). Comparative Biochemy and Physiology 101 (4), 1992, S. 693–699.
- Robin C. Dunkin, Dinah Wilson, Nicolas Way, Kari Johnson und Terrie M. Williams: Climate influences thermal balance and water use in African and Asian elephants: physiology can predict drivers of elephant distribution. The Journal of Experimental Biology 216, 2013, S. 2939–2952.
- Moise Koffi, Yiannis Andreopoulos und Latif M. Jiji: The Role of Pinnae Flapping Motion on Elephant Metabolic Heat Dissipation. Journal of Heat Transfer 136, 2014, S. 101101, doi:10.1115/1.4027864.
- António F. Martins, Nigel C. Bennett, Sylvie Clavel, Herman Groenewald, Sean Hensman, Stefan Hoby, Antoine Joris, Paul R. Manger und Michel C. Milinkovitch: Locally-curved geometry generates bending cracks in the African elephant skin. Nature Communications 9, 2018, S. 3865, doi:10.1038/s41467-018-06257-3.
- A. Valente: Hair structure of the Woolly mammoth, Mammuthus primigenius and the modern elephants, Elephas maximus and Loxodonta africana. Journal of Zoology 199 (2), 1983, S. 271–274, doi:10.1111/j.1469-7998.1983.tb02095.x.
- O. F. Chernova, I. V. Kirillova, G. G. Boeskorov, F. K. Shidlovskiy und M. R. Kabilov: Architecture of the hairs of the woolly mammoth and woolly rhino. Proceedings of the Zoological Institute RAS 319 (3), 2015, S. 441–460.
- Holger Römpler, Nadin Rohland, Carles Lalueza-Fox, Eske Willerslev, Tatyana Kuznetsova, Gernot Rabeder, Jaume Bertranpetit, Torsten Schöneberg und Michael Hofreiter: Nuclear gene indicates coat-color polymorphism in mammoths. Science 313 (5783), Juli 2006, S. 62, doi:10.1126/science.1128994.
- Kimberley Sawtelle: Mastodont hair gives clues to habitat. Mammoth Trumpet 6 (4), 1991, S. 8.
- Juan L. Cantalapiedra, Óscar Sanisidro, Hanwen Zhang, María T. Alberdi, José L. Prado, Fernando Blanco und Juha Saarinen: The rise and fall of proboscidean ecological diversity. Nature Ecology & Evolution, 2021, doi:10.1038/s41559-021-01498-w.
- Jan van der Made: The evolution of the elephants and their relatives in the context of a changing climate and geography. In: Harald Meller (Hrsg.): Elefantenreich. Eine Fossilwelt in Europa. Halle/Saale, 2010, S. 340–360.
- María Teresa Alberdi, José Luis Prado, Edgardo Ortiz-Jaureguizar, Paula Posadas und Mariano Donato: Paleobiogeography of trilophodont gomphotheres (Mammalia: Proboscidea). A reconstruction applying DIVA (Dispersion-Vicariance Analysis). Revista Mexicana de Ciencias Geológicas 28 (2), 2011, S. 235–244.
- Maria Rita Palombo: Elephants in miniature. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 275–295.
- Sevket Sen: A review of the Pleistocene dwarfed elephants from the Aegean islands, and their paleogeographic context. Fossil Imprint 73 (1/2), 2017; S. 76–92.
- Athanassios Athanassiou, Alexandra A. E. van der Geer und George A. Lyras: Pleistocene insular Proboscidea of the Eastern Mediterranean: A review and update. Quaternary Science Reviews 218, 2019, S. 306–321.
- Shermin de Silva und George Wittemyer: A Comparison of Social Organization in Asian Elephants and African Savannah Elephants. International Journal of Primatology 33 (5), 2012, S. 1125–1141.
- Faysal Bibi, Brian Kraatz, Nathan Craig, Mark Beech, Mathieu Schuster und Andrew Hill: Early evidence for complex social structure in Proboscidea from a late Miocene trackway site in the United Arab Emirates. Biology Letters 8 (4), 2012, S. 670–673.
- Carlos Neto de Carvalho, Zain Belaústegui, Antonio Toscano, Fernando Muñiz, João Belo, Jose María Galán, Paula Gómez, Luis M. Cáceres, Joaquín Rodríguez-Vidal, Pedro Proença Cunha, Mario Cachão, Francisco Ruiz, Samuel Ramirez-Cruzado, Francisco Giles-Guzmán, Geraldine Finlayson, Stewart Finlayson und Clive Finlayson: First tracks of newborn straight-tusked elephants (Palaeoloxodon antiquus). Scientific Reports 11, 2021, S. 17311, doi:10.1038/s41598-021-96754-1.
- Angela S. Stoeger, Gunnar Heilmann, Matthias Zeppelzauer, Andre Ganswindt, Sean Hensman und Benjamin D. Charlton: Visualizing sound emission of elephant vocalizations: evidence for two rumble production types. PLoS ONE 7 (11), 2012, S. e48907, doi:10.1371/journal.pone.0048907.
- Angela S. Stoeger und Shermin de Silva: African and Asian Elephant Vocal Communication: A Cross-Species Comparison. In: G. Witzany (Hrsg.): Biocommunication of Animals. Springer Science & Media Press, 2014, S. 21–39.
- Moti Nissani: Elephant Cognition: A Review of Recent Experiments. Gajah 28, 2008, S. 44–52.
- Kaori Mizuno, Naoko Irie, Mariko Hiraiwa-Hasegawa und Nobuyuki Kutsukake: Asian elephants acquire inaccessible food by blowing. Animal Cognition 19 (1), 2016, S. 215–222; doi:10.1007/s10071-015-0929-2.
- Nicholas Court: Cochlea anatomy of Numidotherium koholense: auditory acuity in the oldest known proboscidean. Lethaia 25 (2), 1992, S. 211–215, doi:10.1111/j.1502-3931.1992.tb01385.x.
- Arnaud Schmitt und Emmanuel Gheerbrant: The ear region of earliest known elephant relatives: new light on the ancestral morphotype of proboscideans and afrotherians. Journal of Anatomy 228, 2016, S. 137–152.
- Eric G. Ekdale: Morphological variation in the ear region of Pleistocene Elephantimorpha (Mammalia, Proboscidea) from Central Texas. Journal of Morphology 272, 2011, S. 452–464.
- Julien Benoit, Samuel Merigeaud, Rodolphe Tabuce: Homoplasy in the ear region of Tethytheria and the systematic position of Embrithopoda (Mammalia, Afrotheria). Geobios 46, 2013, S. 357–370.
- L. E. L. Rasmussen und B. A. Schulte: Chemical signals in the reproduction of Asian (Elephas maximus) and African (Loxodonta africana) elephants. Animal Reproduction Science 53, 1998, S. 19–34.
- Daniel C. Fisher und David Fox: life history and unilateral loss of molar function in the Cohoes mastodon: A case study in nutritional stress? Journal of Vertebrate Paleontology 27 (3 suppl.), 2007, S. 74A–75A.
- Daniel C. Fisher: New ideas about old bones. American Paleontologist 16 (3), 2008, S. 18–22.
- Joseph J. El Adli, Daniel C. Fisher, Michael D. Cherney, Rafael Labarca und Frédéric Lacombat: First analysis of life history and season of death of a South American gomphothere. Quaternary International 443, 2017, S. 180–188.
- Daniel C. Fisher und David Fox: Calving histories of female mastodons (Mammut americanum). Journal of Vertebrate Paleontology 25 (3 suppl.), 2005, S. 57A.
- Bas van Geel, André Aptroot, Claudia Baittinger, Hilary H. Birks, Ian D. Bull, Hugh B. Cross, Richard P. Evershed, Barbara Gravendeel, Erwin J. O. Kompanje, Peter Kuperus, Dick Mol, Klaas G. J. Nierop, Jan Peter Pals, Alexei N. Tikhonov, Guido van Reenen und Peter H. van Tienderen: The ecological implications of a Yakutian mammoth’s last meal. Quaternary Research 69, 2008, S. 361–376.
- Irina V. Kirillova, J. Argant, E. G. Lapteva, O. M. Korona, J. van der Pflicht, E. V. Zinovyev, A. A. Kotov, O. F. Chernova, E. O. Fadeeva, O. A. Baturina, M. R. Kabilov, F. A. Shidlovskiy und O. E. Zanina: The diet and environment of mammoths in North-East Russia reconstructed from their content of the feces. Quaternary International 406, 2016, S. 147–161.
- Lee A. Newsom und Mathew C. Mihlbachler: Mastodons (Mammut americanum) Diet Foraging Patterns Based on Analysis of Dung Deposits. In: S. David Webb (Hrsg.): First Floridians and Last Mastodons: The Page-Ladson Site in the Aucilla River. Springer, 2006, S. 263–331.
- Hilary H. Birks, Bas van Geel, Daniel C. Fisher, Eric C. Grimm, Wim J. Kuijper, Jan van Arkel und Guido B. A. van Reenen: Evidence for the diet and habitat of two late Pleistocene mastodons from the Midwest, USA. Quaternary Research, 2018, S. 1–21, doi:10.1017/qua.2018.100.
- Victor M. Bravo-Cuevas, Nuria M. Morales-García und Miguel A. Cabral-Perdomo: Description of mastodons (Mammut americanum) from the late Pleistocene of southeastern Hidalgo, central Mexico. Boletín de la Sociedad Geológica Mexicana 67 (2), 2015, S. 337–347.
- Alexander G. S. C. Liu, Erik R. Seiffert und Elwyn L. Simons: Stable isotope evidence for an amphibious phase in early proboscidean evolution. PNAS 105, 2008, S. 5786–5791.
- Mark T. Clementz, Patricia A. Holroyd, Paul L. Koch: Identifying Aquatic Habits Of Herbivorous Mammals Through Stable Isotope Analysis. Palaios 23 (9), 2008, S. 574–585.
- Ivan Calandra, Ursula B. Göhlich und Gildas Merceron: Feeding preferences of Gomphotherium subtapiroideum (Proboscidea, Mammalia) from the Miocene of Sandelzhausen (Northern Alpine Foreland Basin, southern Germany) through life and geological time: evidence from dental microwear analysis. Paläontologische Zeitschrift 84, 2010, S. 205–215.
- Yan Wu, Tao Deng, Yaowu Hu, Jiao Ma, Xinying Zhou, Limi Mao, Hanweng Zhang, Jie Ye und Shi-Qi Wang: A grazing gomphothere in the Middle Miocene Central Asia, 10 million years prior to the origin of Elephantidae. Scientific Reports 8, 2018, S. 7640, doi:10.1038/s41598-018-25909.
- Patricia A. Groenewald, Judith Sealy, Deano Stynder und Kathlyn M. Smith: Dietary resource partitioning among three coeval proboscidean taxa (Anancus capensis, Mammuthus subplanifrons, Loxodonta cookei) from the South African Early Pliocene locality of Langebaanweg E Quarry. Palaeogeography, Palaeoclimatology, Palaeoecology 543, 2020, S. 109606, doi:10.1016/j.palaeo.2020.109606.
- Jiao Ma, Yuan Wang, Changzhu Jin, Yaowu Hu und Hervé Bocherens: Ecological flexibility and differential survival of Pleistocene Stegodon orientalis and Elephas maximus in mainland southeast Asia revealed by stable isotope (C, O) analysis. Quaternary Science Reviews 212, 2019, S. 33–44.
- Ulrich Joger: Lebensweise und Ökologie moderner Elefanten: Sind Rückschlüsse auf den Waldelefanten und seine Umwelt möglich? In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale, 2010, S. 314–321.
- Margret Bunzel-Drüke, Joachim Drüke und Henning Vierhaus: Der Einfluß von Großherbivoren auf die Naturlandschaft Mitteleuropas. Arbeitsgemeinschaft Biologischer Umweltschutz Kreis Soest e.V. 2001 ().
- Friedrich Bachmayer und Helmuth Zapfe: Ein bedeutender Fund von Dinotherium aus dem Pannon von Niederösterreich. Annalen des Naturhistorischen Museums zu Wien 80, 1976, S. 145–162.
- Steven Heritage, Erik R. Seiffert und Matthew R. Borths: Recommended fossil calibrators for time-scaled molecular phylogenies of Afrotheria. Afrotherian Conservation 17, 2021, S. 9–13.
- Rodolphe Tabuce, Laurent Marivaux, Mohammed Adaci, Mustapha Bensalah, Jean-Louis Hartenberger, Mohammed Mahboubi, Fateh Mebrouk, Paul Tafforeau und Jean-Jacques Jaeger: Early Tertiary mammals from North Africa reinforce the molecular Afrotheria clade. Proceedings of the Royal Society Series B 274, 2007, S. 1159–1166.
- Matjaž Kuntner, Laura J. May-Collado und Ingi Agnarsson: Phylogeny and conservation priorities of afrotherian mammals (Afrotheria, Mammalia). Zoologica Scripta 40 (1), 2011, S. 1–15.
- Robert W. Meredith, Jan E. Janečka, John Gatesy, Oliver A. Ryder, Colleen A. Fisher, Emma C. Teeling, Alisha Goodbla, Eduardo Eizirik, Taiz L. L. Simão, Tanja Stadler, Daniel L. Rabosky, Rodney L. Honeycutt, John J. Flynn, Colleen M. Ingram, Cynthia Steiner, Tiffani L. Williams, Terence J. Robinson, Angela Burk-Herrick, Michael Westerman, Nadia A. Ayoub, Mark S. Springer und William J. Murphy: Impacts of the Cretaceous Terrestrial Revolution and KPg Extinction on Mammal Diversification. Science 334, 2011, S. 521–524.
- Mark S. Springer, William J. Murphy, Eduardo Eizirik und Stephen J. O’Brian: Placental mammal diversification and the Cretaceous-Tertiary boundary. PNAS 100 (3), 2003, S. 1056–1061.
- Erik R. Seiffert: A new estimate for afrotherian phylogeny based on simultaneous analysis of genomic, morphological, and fossil evidence. BMC Evolutionary Biology 7, 2007, S. 224.
- Maureen A. O’Leary, Jonathan I. Bloch, John J. Flynn, Timothy J. Gaudin, Andres Giallombardo, Norberto P. Giannini, Suzann L. Goldberg, Brian P. Kraatz, Zhe-Xi Luo, Jin Meng, Xijun Ni, Michael J. Novacek, Fernando A. Perini, Zachary S. Randall, Guillermo W. Rougier, Eric J. Sargis, Mary T. Silcox, Nancy B. Simmons, Michelle Spaulding, Paúl M. Velazco, Marcelo Weksler, John R. Wible und Andrea L. Cirranello: The Placental Mammal Ancestor and the Post–K-Pg Radiation of Placentals. Science 339, 2013, S. 662–667.
- Mario A. Cozzuol, Dimila Mothé und Leonardo S. Avilla: A critical appraisal of the phylogenetic proposals for the South American Gomphotheriidae (Proboscidea: Mammalia). Quaternary International 255, 2012, S. 36–41.
- Jeheskel Shoshani, W. J. Sanders und Pascal Tassy: Elephants and other Proboscideans: a summary of recent findings and new taxonomic suggestions. In: G. Cavarretta et al. (Hrsg.): The World of Elephants – International Congress. Consiglio Nazionale delle Ricerche. Rom, 2001, S. 676–679.
- Jeheskel Shoshani und Pascal Tassy: Advances in proboscidean taxonomy & classification, anatomy & physiology, and ecology & behavior Quaternary International 126–128, 2005, S. 5–20.
- Cyrille Delmer: Phylogenetic relationships between Paleogene proboscideans: New data and impact on tethytherian systematics. Journal of Vertebrate Paleontology 25 (3, suppl.), 2005, S. 50A.
- Emmanuel Gheerbrant, Jean Sudre, Henri Cappetta, Mohamed Iarochène, Mbarek Amaghzaz und Baâdi Bouya: A new large mammal from the Ypresian of Morocco: Evidence of surprising diversity of early proboscideans. Acta Palaeontologica Polonica47 (3), 2002, S. 493–506.
- Emmanuel Gheerbrant, Jean Sudre, Pascal Tassy, Mbarek Amaghzaz, Baâdi Bouya und Mohamed Iarochène: Nouvelles données sur Phosphatherium escuilliei (Mammalia, Proboscidea) de l’Éocène inférieur du Maroc, apports à la phylogénie des Proboscidea et des ongulés lophodontes. Geodiversitas 27 (2), 2005, S. 239–333.
- Erik R. Seiffert, Sobhi Nasir, Abdulrahman Al-Harthy, Joseph R. Groenke, Brian P. Kraatz, Nancy J. Stevens und Abdul Razak Al-Sayigh: Diversity in the later Paleogene proboscidean radiation: a small barytheriid from the Oligocene of Dhofar Governorate, Sultanate of Oman. Naturwissenschaften 99, 2012, S. 133–141, doi:10.1007/s00114-011-0878-9.
- Lionel Hautier, Rodolphe Tabuce, Mickaël J. Mourlam, Koffi Evenyon Kassegne, Yawovi Zikpi Amoudji, Maëva Orliac, Frédéric Quillévéré, Anne-Lise Charruault, Ampah Kodjo Christophe Johnson und Guillaume Guinot: New Middle Eocene proboscidean from Togo illuminates the early evolution of the elephantiform-like dental pattern. Proceedings of th Royal Society of London B Biological Sciences 288 (1960), 2021, S. 20211439, doi:10.1098/rspb.2021.1439.
- Jeheskel Shoshani, Edward M. Golenberg und Hong Yang: Elephantidae phylogeny: morphological versus molecular results. Acta Theriologica Suppl. 5, 1998, S. 89–122.
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 497–504).
- Michael Buckley, Omar P. Recabarren, Craig Lawless, Nuria García und Mario Pino: A molecular phylogeny of the extinct South American gomphothere through collagen sequence analysis. Quaternary Science Reviews 224, 2019, S. 105882, doi:10.1016/j.quascirev.2019.105882.
- Sina Baleka, Luciano Varela, P. Sebastián Tambusso, Johanna L.A. Paijmans, Dimila Mothé, Thomas W. Stafford Jr., Richard A. Fariña und Michael Hofreiter: Revisiting proboscidean phylogeny and evolution through total evidence and palaeogenetic analyses including Notiomastodon ancient DNA. iScience, 2022, doi:10.1016/j.isci.2021.103559.
- Erika Hagelberg, Mark G. Thomas, Charles E. Cook Jr., Andrei V. Sher, Gennady F. Baryshnikov und Adrian M. Lister: DNA from ancient mammoth bone. Nature 370, 1994, S. 333–334.
- M. Noro, R. Masuda, I. A. Dubrovo, M. C. Yoshida und M. Kato: Molecular phylogenetic inference of the woolly mammoth Mammuthus primigenius, based on complete sequences of mitochondrial cytochrome b and 12S ribosomal RNA genes. Journal of Molecular Evolution 46 (3), 1998, S. 314–326.
- Cristian Capelli, Ross D. E. MacPhee, Alfred L. Roca, Francesca Brisighelli, Nicholas Georgiadis, Stephen J. O’Brien und Alex D. Greenwood: A nuclear DNA phylogeny of the woolly mammoth (Mammuthus primigenius). Molecular Phylogenetics and Evolution 40, 2006, S. 620–627, doi:10.1016/j.ympev.2006.03.015.
- Evgeny I Rogaev, Yuri K Moliaka, Boris A Malyarchuk, Fyodor A Kondrashov, Miroslava V Derenko, Ilya Chumakov und Anastasia P Grigorenko: Complete mitochondrial genome and phylogeny of Pleistocene mammoth Mammuthus primigenius. PLoS Biology 4 (3), 2006, S. e73, doi:10.1371/journal.pbio.0040073.
- Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus und Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. PLoS Biology 5 (8), 2007, S. 1663–1671, doi:10.1371/journal.pbio.0050207.
- Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca und Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biology 8 (12), 2010, S. e1000564, doi:10.1371/journal.pbio.1000564.
- M. Buckley, N. Larkin und M. Collins: Mammoth and Mastodon collagen sequences; survival and utility. Geochimica et Cosmochimica Acta 75, 2011, S. 2007–2016.
- Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro, Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. eLife Sciences 6, 2017, S. e25413, doi:10.7554/eLife.25413.
- Eleftheria Palkopoulou, Mark Lipson, Swapan Mallick, Svend Nielsen, Nadin Rohland, Sina Baleka, Emil Karpinski, Atma M. Ivancevic, Thu-Hien To, R. Daniel Kortschak, Joy M. Raison, Zhipeng Qu, Tat-Jun Chin, Kurt W. Alt, Stefan Claesson, Love Dalén, Ross D. E. MacPhee, Harald Meller, Alfred L. Roca, Oliver A. Ryder, David Heiman, Sarah Young, Matthew Breen, Christina Williams, Bronwen L. Aken, Magali Ruffier, Elinor Karlsson, Jeremy Johnson, Federica Di Palma, Jessica Alfoldi, David L. Adelson, Thomas Mailund, Kasper Munch, Kerstin Lindblad-Toh, Michael Hofreiter, Hendrik Poinar und David Reich: A comprehensive genomic history of extinct and living elephants. PNAS 115 (11), 2018, S. E2566–E2574, doi:10.1073/pnas.1720554115.
- Jacob Enk, Alison Devault, Regis Debruyne, Christine E. King, Todd Treangen, Dennis O’Rourke, Steven L. Salzberg, Daniel Fisher, Ross D. E. MacPhee und Hendrik Poinar: Complete Columbian mammoth mitogenome suggests interbreeding with woolly mammoths. Genome Biology 12, 2011, S. R51, doi:10.1186/gb-2011-12-5-r51.
- Jacob Enk, Alison Devault, Christopher Widga, Jeffrey Saunders, Paul Szpak, John Southon, Jean-Marie Rouillard, Beth Shapiro, G. Brian Golding, Grant Zazula, Duane Froese, Daniel C. Fisher, Ross D. E. MacPhee und Hendrik Poinar: Mammuthus population dynamics in Late Pleistocene North America: Divergence, Phylogeography and Introgression. Frontiers in Ecology and Evolution 4, 2016, S. 42, doi:10.3389/fevo.2016.00042.
- Hong Yang, Edward M. Golenberg und Jeheskel Shoshani: Phylogenetic resolution within the Elephantidae using fossil DNA sequence from the American mastodon (Mammut americanum) as an outgroup. PNAS 93, 1996, S. 1190–1194.
- Ludovic Orlando, Catherine Hänni und Christophe J. Douady: Mammoth and elephant phylogenetic relationships: Mammut americanum, the missing outgroup. Evolutionary Bioinformatics 2, 2007, S. 45–51.
- W. David Lambert: New tetralophodont gomphothere material from American Tetralophodon. Journal of Vertebrate Paleontology 27 (3), 2007, S. 676–682.
- Dimilla Mothé, Leonardo S. Avilla, Desi Zhao, Guangpu Xie und Boyang Sun: A new Mammutidae (Proboscidea, Mammalia) from the Late Miocene of Gansu Province, China. Anais da Academia Brasileira de Ciências 88 (1), 2016, S. 65–74.
- W. David Lambert: Eurybelodon shoshanii, an unusual new shovel-tusked gomphothere (Mammalia, Proboscidea) from the late Miocene of Oregon. Journal of Vertebrate Paleontology 36 (3), 2016, S. e1091352, doi:10.1080/02724634.2016.1091352.
- Steven R. May: The Lapara Creek Fauna: Early Clarendonian of south Texas, USA. Palaeontologia Electronica 22 (1), 2019, S. 22.1.15A (S. 1–129, hier 42–62) doi:10.26879/929.
- Rodolphe Tabuce, Raphaël Sarr, Sylvain Adnet, Renaud Lebrun, Fabrice Lihoreau, Jeremy E. Martin, Bernard Sambou, Mustapha Thiam und Lionel Hautier: Filling a gap in the proboscidean fossil record: a new genus from the Lutetian of Senegal. Journal of Paleontology 94 (3), 2020, S. 580–588, doi:10.1017/jpa.2019.98.
- Wang Yuan, Jin ChangZhu, Deng ChengLong, Wei GuangBiao und Yan YaLing: The first Sinomastodon (Gomphotheriidae, Proboscidea) skull from the Quaternary in China. Chinese Science Bulletin 57 (36), 2012, S. 4726–4734.
- Mohammed Al-Kindi, Martin Pickford, Yusouf Al-Sinani, Ibrahim Al-Ismaili, Axel Hartman und Alan Heward: Large mammals from the Rupelian of Oman – Recent finds. Fossil Imprint 73 (3–4), 2017, S. 300–321, doi:10.2478/if-2017-0017.
- George E. Konidaris, ocrates J. Roussiakis, George E. Theodorou und George D. Koufus: The Eurasian Occurrence of the Shovel-Tusker Konobelodon (Mammalia, Proboscidea) as Illuminated by its Presence in the Late Miocene of Pikermi (Greece). Journal of Vertebrate Paleontology 34 (6), 2014, S. 1437–1453.
- Shi-Qi Wang, Xiao-Xiao Zhang und Chun-Xiao Li: Reappraisal of Serridentinus gobiensis Osborn & Granger and Miomastodon tongxinensis Chen: the validity of Miomastodon. Vertebrata PalAsiatica 58 (2), 2020, S. 134–158, doi:10.19615/j.cnki.1000-3118.200310.
- Dimila Mothé, Leonardo S. Avilla, Mário Cozzuol und Gisele R. Winck: Taxonomic revision of the Quaternary gomphotheres (Mammalia: Proboscidea: Gomphotheriidae) from the South American lowlands. Quaternary International 276, 2012, S. 2–7.
- Dimila Mothé, Leonardo S. Avilla und Mario A. Cozzuol: The South American Gomphotheres (Mammalia, Proboscidea, Gomphotheriidae): Taxonomy, Phylogeny, and Biogeography. Journal of Mammalian Evolution 20, 2013, S. 23–32.
- Dimila Mothé und Leonardo Avilla: Mythbusting evolutionary issues on South American Gomphotheriidae (Mammalia: Proboscidea). Quaternary Science Reviews 110, 2015, S. 23–35.
- Dimila Mothé, Marco P. Ferretti und Leonardo S. Avilla: Running Over the Same Old Ground: Stegomastodon Never Roamed South America. Journal of Mammalian Evolution 26 (2), 2019, S. 165–177, doi:10.1007/s10914-017-9392-y.
- Jean Sudre, Jean-Jacques Jaeger, Bernard Sigé und Monique Vianey-Liaud: Nouvelles données sur les Condylarthres du Thanétien et de l’Yprésien du bassin d’Ouarzazate (Maroc). Geobios 26 (5), 1993, S. 609–615.
- Emmanuel Gheerbrant: The oldest known proboscidean and the role of Africa in the radiation of modern orders of placentals. Bulletin of the Geological Society of Denmark 44, 1998, S. 181–185.
- Emmanuel Gheerbrant, Mbarek Amaghzaz, Baadi Bouya, Florent Goussard und Charlène Letenneur: Ocepeia (Middle Paleocene of Morocco): The Oldest Skull of an Afrotherian Mammal. PLoS ONE 9 (1), 2014, S. e89739, doi:10.1371/journal.pone.0089739.
- Emmanuel Gheerbrant, Andrea Filippo und Arnaud Schmitt: Convergence of Afrotherian and Laurasiatherian Ungulate-Like Mammals: First Morphological Evidence from the Paleocene of Morocco. PLoS ONE 11 (7), 2016, S. e0157556, doi:10.1371/journal.pone.0157556.
- Emmanuel Gheerbrant, Baadi Bouya und Mbarek Amaghzaz: Dental and cranial anatomy of Eritherium azzouzorum from the Paleocene of Marocco, earliest known proboscidean material. Palaeontographica, Abteilung A 297 (5/6), 2012, S. 151–183.
- Neil A. Wells und Philip D. Gingerich: Review of Eocene Anthracobunidae (Mammalia, Proboscidea) with an new genus and species, Jozaria palustris, from the Kuldana Formation of Kohat (Pakistan). Contributions from the Museum of Paleontology, The University of Michigan 26 (2), 1983, S. 117–139.
- Philip D. Gingerich, Donald E. Russell und Neil A. Wells: Astragalus of Anthracobune (Mammalia, Proboscidea) from the Early-Middle Eocene of Kashmir. Contributions from the Museum of Paleontology, The University of Michigan 28 (3), 1990, S. 71–77.
- Léonard Ginsburg, Khadim Hussain Durrani, Akhtar Mohammad Kassi und Jean-Loup Welcomme: Discovery of a new Anthracobunidae (Tethytheria, Mammaiia) from the lower Eocene lignite of the Kach-Harnai Area in Baluchistan (Pakistan). Comptes rendus de l’Académie des sciences. Sciences de la Terre et des planètes 328, 1999, S. 209–213.
- Stéphane Ducrocq, Aung Naing Soe, Bo Bo, Mouloud Benammi, Yaowalak Chaimanee, Than Tun, Tin Thein und Jean-Jacques Jaeger: First record of an Anthracobunidae (Mammalia, ?Tethytheria) from the Eocene of the Pondaung Formation, Myanmar. Comptes rendus de l’Académie des sciences. Sciences de la Terre et des planètes 330, 2000, S. 725–730.
- Kenneth D. Rose, Luke T. Holbrook, Kishor Kumar, Rajendra S. Rana, Heather E. Ahrens, Rachel H. Dunn, Annelise Folie, Katrina E. Jones und Thierry Smith: Anatomy, Relationships, and Paleobiology of Cambaytherium (Mammalia, Perissodactylamorpha, Anthracobunia) from the lower Eocene of western India. Journal of Vertebrate Paleontology 39 (suppl.), 2020, S. 1–147, doi:10.1080/02724634.2020.1761370.
- Emmanuel Gheerbrant, Jean Sudre und Henry Cappetta: A Palaeocene proboscidean from Morocco. Nature 383, 1996, S. 68–70.
- Mohammad Mahboubi, R. Ameur, Jean-Yves Crochet und Jean-Jacques Jaeger: Earliest known proboscidean from early Eocene of north-west Africa. Nature 308, 1984, S. 543–544.
- William Sanders, John Kappelmann und D. Tab Rassmussen: New large-bodied mammals from the late Oligocene site of Chilga, Ethiopia. Acta Palaeontologica Polonica 49 (3), 2004, S. 365–392.
- Kati Huttunen: Systematics and Taxonomy of the European Deinotheriidae (Proboscidea, Mammalia). Annalen des. Naturhistorischen Museums zu Wien 103 A, 2002, S. 237–250 (zobodat.at [PDF]).
- H. J. Gregor, R. Kuhn und D. H. Storch: Deinotherium? ein Proboscidier? Documenta Naturae 130, 2000, S. 1–141.
- Kati Huttunen und Ursula Bettina Göhlich: A partial skeleton of Prodeinotherium bavaricum (Proboscidea, Mammalia) from the Middle Miocene of Unterzolling (Upper Freshwater Molasse, Germany). Geobios 35, 2002, S. 489–514.
- Pascal Tassy und Martin Pickford: Un nouveau mastodonte zygolophodonte (Proboscidea, Mammalia) dans le Miocène inférieur d’Afrique orientale: Systématique et paléoenvironnement. Geobios 16 (1), 1983, S. 53–77.
- Xiaoxiao Zhang und Shiqi Wang: First record of Eozygodon (Mammutidae, Proboscidea) in Eurasia. Historical Biology, 2020, doi:10.1080/08912963.2020.1723579.
- Shiqi Wang, Yu Li, Jaroon Duangkrayom, Shao-Kun Chen, Wen He und Shan-Qin Chen: Early Mammut from the Upper Miocene of northern China, and ist implications for the evolution and differentiation of Mammutidae. Vertebrata Palasiatica 55 (3), 2017, S. 233–256.
- Heinz Tobien: Evolution of the zygodons with emphasis of dentition. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 76–84.
- Henry Fairfield Osborn: The Evolution, Phylogeny, and Classification of the Mastodontoidea. Bulletin of the Geological Society of America 32 (3), 1921, S. 327–332.
- Pascal Tassy: Who is who among the Proboscidea? In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 40–48.
- María Teresa Alberdi, José Luis Prado, Edgardo Ortiz-Jaureguizar, Paula Posadas und Mariano Donato: Historical biogeography of trilophodont Gomphotheres (Mammalia, Proboscidea) reconstructed applying dispersion vicariance analysis. In: E. Díaz-Martínez und I. Rábano (Hrsg.): 4th European Meeting on the Palaeontology and Stratigraphy of Latin America. Cuadernos del Museo Geominero, nº 8. Instituto Geológico y Minero de España, (Madrid) 2007, S. 9–14.
- Ursula B. Göhlich: Elephantoidea (Proboscidea, Mammalia) aus dem Mittel- und Obermiozän der Oberen Süßwassermolasse Süddeutschlands: Odontologie und Osteologie. Münchner Geowissenschaftliche Abhandlungen Reihe A 36, München, 1998.
- Pascal Tassy, Pairote Anupandhanant, Léonard Ginsburg, Pierre Meine, Benjavun Ratanasthien und Varaviudth Sutteethorn: A new Stegolophodon (Proboscidea, Mammalia) from the Early Miocene of Northern Thailand. Geobios 25 (4), 1992, S. 511–523.
- Jon E. Kalb, David J. Froehlich und Gordon L. Bell: Palaeobiogeography of late Neogene African and Eurasian Elephantoidea. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 117–123.
- William J. Sanders: Oldest Record of Stegodon (Mammalia: Proboscidea). Journal of Vertebrate Paleontology 19 (4), 1999, S. 793–797.
- Haruo Saegusa: Stegodontidae: evolutionary relationships. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 178–190.
- Vincent J. Maglio: Four new species of Elephantidae from the Plio-Pleistocene of northwestern Kenya. Breviora 341, 1970, S. 1–43
- Adrian M. Lister und Hans van Essen: The earliest Mammoth in Europe. Abstracts of the 18th International Senckenberg Conference 25. bis 30. April 2004 in Weimar.
- A. E. Basilyan, M. A. Anisimov, P. A. Nikolskiy und V. V. Pitulko: Wooly mammoth mass accumulation next to the Paleolithic Yana RHS site, Arctic Siberia: ist geology, age, and relation to past human activity. Journal of Archaeological Science 38, 2011, S. 2461–2474.
- Federica Marano und Maria Rita Palombo: Population structure in straight-tusked elephants: a case study from Neumark Nord 1 (late Middle Pleistocene?, Sachsen-Anhalt, Germany). Bollettino della Società Paleontologica Italiana 52 (3), 2013, S. 207–218.
- José Luis Prado, Joaquín Arroyo-Cabrales, Eileen Johnson, María Teresa Alberdi und Oscar J. Polaco: New World proboscidean extinctions: comparisons between North and South America. Archaeological and Anthropological Sciences 7, 2015, S. 277–288, doi:10.1007/s12520-012-0094-3.
- Grant D. Zazula, Ross D. E. MacPhee, Jessica Z. Metcalfe, Alberto V. Reyes, Fiona Brock, Patrick S. Druckenmiller, Pamela Groves, C. Richard Harington, Gregory W. L. Hodgins, Michael L. Kunz, Fred J. Longstaffe, Daniel H. Mann, H. Gregory McDonald, Shweta Nalawade-Chavan und John R. Southon: American mastodon extirpation in the Arctic and Subarctic predates human colonization and terminal Pleistocene climate change. PNAS 111 (52), 2014, S. 18460-18465, doi:10.1073/pnas.1416072111.
- Anthony J. Stuart, Leopold D. Sulerzhitsky, Lyubov A. Orlova, Yaroslav V. Kuzmin und Adrian M. Lister: The latest woolly mammoths (Mammuthus primigenius Blumenbach) in Europe and Asia: a review of the current evidence. Quaternary Science Reviews 21, 2002, S. 1559–1569.
- Yaroslav V. Kuzmin: Extinction of the woolly mammoth (Mammuthus primigenius) and woolly rhinoceros (Coelodonta antiquitatis) in Eurasia: Review of chronological and environmental issues. Boreas 39, 2010, S. 247–261.
- Adrian M. Lister: Mammoths in miniature. Nature 362, 1993, S. 288–289.
- Gregory James Smith und Larisa R. G. DeSantis: Extinction of North American Cuvieronius (Mammalia: Proboscidea: Gomphotheriidae) driven by dietary resource competition with sympatric mammoths and mastodons. Paleobiology 46 (1), 2020, S. 41–57, doi:10.1017/pab.2020.7.
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 33 ().
- Frédéric Cuvier: Eléphant d’Afrique. In: Étienne Geoffroy Saint-Hilaire, Fréderic Cuvier (Hrsg.): Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d’après des animaux vivans. Tome sixième. Paris 1825 ().
- Anonym: Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d’après des animaux vivans; &c. par MM. Geoffroy Saint-Hilaire et F. Cuvier. Livraisons 52de et 53eme. The Zoological Journal 3, 1827, S. 140–142 ().
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (305) ().
- Johann Karl Wilhelm Illiger: Prodromus systematis mammalium et avium additis terminis zoographicis utriudque classis. Berlin, 1811, S. 1–301 (S. 96) ().
- Antoni V. Milewski und Ellen S. Dierenfeld: Structural and functional comparison of the proboscis between tapirs and other extant and extinct vertebrates. Integrative Zoology 8, 2013, S. 84–94.
- Merlin Peris: Aristotle’s Notices on the Elephant. Gajah 22, 2003, S. 71–75.
- Johann Friedrich Blumenbach: Handbuch der Naturgeschichte. Göttingen, 1779, S. 1–448 (S. 130–133) (), Handbuch der Naturgeschichte. Göttingen, 1797, S. 1–714 (S. 125) () und Handbuch der Naturgeschichte. Göttingen, 1799, S. 1–708 (S. 697–698) ().
- Étienne Geoffroy Saint-Hilaire und Georges Cuvier: Mémoire sur une nouvelle division des Mammifères, et sur les principes qui doivent servir de base dans cette sorte de travail. Magasin Encyclopedique 2, 1795, S. 164–190 (S. 178, 189) ().
- Georges Cuvier: Le regne animal distribue d’apres son organisation pour servir de base a l’histoire naturelle des animaux et d’introduction a l’anatomie comparee. (Band 1) Paris, 1817, S. 1–540 (S. 227–242) ().
- Henri Marie Ducrotay de Blainville: Prodrome d’une nouvelle distribution systèmatique du règne animal. Bulletin des Sciences 3 (3), 1816, S. 105–124 ().
- Richard Owen: Description of teeth and portions of jaws of two extinct anthrocotherioid quadrupeds (Hyopotamus vectianus and Hyop. bovinus) discovered by the Marchioness of Hastings in the Eocene deposits on the N.W. coast of the Isle of Wight: with an attempt to develope Cuvier’s idea of the classification of pachyderms by the number of their toes. The Quarterly journal of the Geological Society of London 4, 1848, S. 103–141 ().
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 243–250).
- Theodore Gill: On the relations of the orders of mammals. Proceedings of the American Association for the Advancement of Science, 19th meeting, 1870, S. 267–270 ().
- Wilfried W. de Jong, Anneke Zweers und Morris Goodman: Relationship of aardvark to elephants, hyraxes and sea cows from α-crystallin sequences. Nature 292, 1981, S. 538–540.
- Malcolm C. McKenna: The alpha crystallin A chain of the eye lens and mammalian phylogeny. Annales Zoologice Fennici 28, 1992, S. 349–360.
- Anne Lavergne, Emmanuel Douzery, Todd Stichler, François M. Catzeflis und Mark S. Springer: Interordinal Mammalian Relationships: Evidence for Paenungulate Monophyly Is Provided by Complete Mitochondrial 12S rRNA Sequences. Molecular Phylogenetics and Evolution 6 (2), 1996, S. 245–258.
- Ole Madsen, Peter M. T. Deen, Graziano Pesole, Cecilia Saccone und Wilfried W. de Jong: Molecular Evolution of Mammalian Aquaporin-2: Further Evidence that Elephant Shrew and Aardvark Join the Paenungulate Clade. Molecular Biology and Evolution 14 (4), 1997, S. 363–371.
- Mark S. Springer, Gregory C. Cleven, Ole Madsen, Wilfried W. de Jong, Victor G. Waddell, Heather M. Amrine und Michael J. Stanhope: Endemic African mammals shake the phylogenetic tree. Nature 388, 1997, S. 61–64.
- Michael J. Stanhope, Victor G. Waddell, Ole Madsen, Wilfried de Jong, S. Blair Hedges, Gregory C. Cleven, Diana Kao und Mark S. Springer: Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals. PNAS 95, 1998, S. 9967–9972.
- Michael J. Stanhope, Ole Madsen, Victor G. Waddell, Gregory C. Cleven, Wilfried W. de Jong und Mark S. Springer: Highly Congruent Molecular Support for a Diverse Superordinal Clade of Endemic African Mammals. Molecular Phylogenetics and Evolution 9 (3), 1998, S. 501–508.
- Masato Nikaido, Hidenori Nishihara, Yukio Hukumoto und Norihiro Okada: Ancient SINEs from African Endemic Mammals. Molecular Biology and Evolution 20 (4), 2003, S. 522–527.
- Hidenori Nishihara, Yoko Satta, Masato Nikaido, J. G. M. Thewissen, Michael J. Stanhope und Norihiro Okada: A Retroposon Analysis of Afrotherian Phylogeny. Molecular Biology and Evolution 22 (9), 2005, S. 1823–1833.
- Georges Cuvier: Mémoire sur les espèces l’éléphans vivantes et fossiles. Mémoires de l’Institut des Sciences et Arts 2, 1799, S. 1–23 ().
- Georges Cuvier: Sur le grand mastodonte. Annales du Muséum d’histoire Naturelle, 1806, S. 270–285 ().
- Charles Girard: On the classification of Mammalia. Proceedings of the American Association for the Advancement of Science 6, 1852, S. 319–335 ().
- Henry Fairfield Osborn: The Fayum Expedition of the American Museum. Science 25 (639), 1907, S. 513–516.
- Henry Fairfield Osborn: Hunting the ancestral elephant in the Fayum desert. Century Magazine 74, 1907, S. 815–835 ().
- Henry Fairfield Osborn: Adaptive radiation and classification of the Proboscidea. PNAS 7, 1921, S. 231–234.
- Henry Fairfield Osborn: Evolution and Geographic Distribution of the Proboscidea: Moeritheres, Deinotheres and Mastodonts. Journal of Mammalogy 15 (3), 1934, S. 177–184.
- Henry Fairfield Osborn: The Proboscidea. New York, Part 1. 1936, S. 1–802 () und Part 2. 1942, S. 805–1675 ().
- Yves Coppens, Vincent J. Maglio, Cary T. Madden und Michel Beden: Proboscidea. In: Vincent J. Maglio und H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harward University Press, 1978, S. 336–367.
- John M. Harris: Deinotherioidea and Barytherioidea. In: Vincent J. Maglio und H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harward University Press, 1978, S. 315–332.
- John M. Harris: Moeritherioidea. In: Vincent J. Maglio und H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harward University Press, 1978, S. 333–335.
- Hartmut Thieme und Stefan Veil: Neue Untersuchungen zum eemzeitlichen Elefanten-Jagdplatz Lehringen, Ldkr. Verden. Die Kunde 36, 1985, S. 11–58.
- Alan J. Bryan, Rodolfo M. Casamiquela, José M. Cruxent, Ruth Gruhn und Claudio Ochsenius: An El Jobo Mastodon Kill at Taima-Taima, Venezuela. Science 200, 1978, S. 1275–1277.
- Donald K. Grayson und David J. Meltzer: Clovis hunting and large mammal extinction: A critical review of the evidence. Journal of World Prehistory 16 (4), 2002, S. 313–359.
- Gerhard Bosinski: Die große Zeit der Eiszeitjäger. Europa zwischen 40.000 und 10.000 v. Chr. Jahrbuch des Römisch-Germanischen Zentralmuseums Mainz 34, 1987, S. 3–139.
- Michel Lorblanchet: Höhlenmalerei. Ein Handbuch. Sigmaringen, 1997.
- Raman Sukumar: The Human–Elephant Relationship through the Ages: A Brief Macro-Scale History. In: Piers Locke und Jane Buckingham (Hrsg.): Conflict, Negotiation, and Coexistence: Rethinking Human–Elephant Relations in South Asia. Oxford, 2016, doi:10.1093/acprof:oso/9780199467228.001.0001.
- K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour und R. D. Taylor: Loxodonta cyclotis. The IUCN Red List of Threatened Species 2021. e.T181007989A181019888 (); zuletzt abgerufen am 26. März 2021.
- K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels und R. D. Taylor: Loxodonta africana. The IUCN Red List of Threatened Species 2021. e.T181008073A181022663 (); zuletzt abgerufen am 26. März 2021.
- C. Williams, S. K. Tiwari, V. R. Goswami, S. de Silva, A. Kumar, N. Baskaran, K. Yoganand und V. Menon: Elephas maximus. The IUCN Red List of Threatened Species 2008. e.T7140A12828813 (); zuletzt abgerufen am 26. März 2021.
Weblinks
- The Paleobiology Database: Proboscidea