Tetrahydrocannabinol
Tetrahydrocannabinol [THC, genauer (–)-Δ9-trans-Tetrahydrocannabinol] ist eine psychoaktive Substanz, die zu den Cannabinoiden zählt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
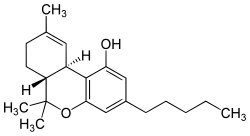 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Tetrahydrocannabinol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C21H30O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses Öl[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A04AD10 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 314,47 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig bis fest | |||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
10,6[2] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Substanz kommt in Pflanzen der Gattung Hanf (Cannabis) vor und ihr wird der Hauptanteil der berauschenden Wirkung zugesprochen. In der Pflanze liegt THC weitgehend in natürlicher Form zweier THC-Säuren vor. Diese werden erst durch Decarboxylierung zu THC umgewandelt, was durch Erhitzen des Pflanzenmaterials erreicht wird.
Die bekannteste natürliche Quelle für Cannabinoide ist das Harz der Cannabispflanze. In Europa von der Polizei beschlagnahmtes Marihuana enthielt im Jahr 2015 zwischen 3 und 22 % THC, durchschnittlich etwa 10 %.[6]
Der amerikanische Chemiker Roger Adams isolierte und identifizierte Cannabidiol aus Pflanzenmaterial und zeigte damit den Zusammenhang zu Cannabinol und Tetrahydrocannabinol.[7] In reiner Form wurde THC erstmals 1964 von Yehiel Gaoni und Raphael Mechoulam am Weizmann-Institut für Wissenschaften in Israel isoliert.[8] Tetrahydrocannabinol unterliegt in Deutschland den Bestimmungen des Betäubungsmittelgesetzes.
Chemie

Gewonnen wird THC hauptsächlich aus der Hanfpflanze (Cannabis). Besonders reich an THC sind die unbefruchteten weiblichen Blüten (etwa 2 bis 30 %); der THC-Gehalt der übrigen Pflanzenteile ist weitaus geringer (knapp 1 %). In den Samen der Pflanze ist kein THC enthalten. Die Blätter nahe der Blüte enthalten etwa 5 bis 6 % THC. Männliche Pflanzen enthalten im Unterschied zu weiblichen nur sehr wenig THC.
Es gibt vom Δ9-Tetrahydrocannabinol vier Stereoisomere:
- (–)-Δ9-trans-Tetrahydrocannabinol und (+)-Δ9-trans-Tetrahydrocannabinol sowie
- (–)-Δ9-cis-Tetrahydrocannabinol und (+)-Δ9-cis-Tetrahydrocannabinol.
Das wesentliche psychoaktiv wirksame Isomer ist das (–)-Δ9-trans-THC (Dronabinol), das 6- bis 100-mal stärker wirksam ist als das (+)-Δ9-trans-THC.[9] Die cis-Formen besitzen keine psychoaktive Wirksamkeit, über ihr natürliches Vorkommen gibt es unterschiedliche Angaben.[10]
Biosynthese
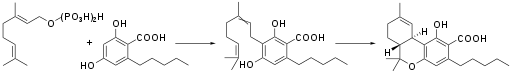
Tetrahydrocannabinol liegt in der Cannabispflanze überwiegend als THC-Säure (THCA, 2-COOH-THC, THC-COOH) vor: Durch enzymatische Kondensation aus den beiden Präkursoren Geranylpyrophosphat und Olivetolsäure wird Cannabigerolsäure gebildet, die anschließend enzymatisch in Tetrahydrocannabinolsäure umgelagert wird. Durch Wärme und UV-Strahlung decarboxyliert die Säure teilweise zum THC. Eine Umwandlung oral aufgenommener THC-Carbonsäure in THC ließ sich in Fütterungsexperimenten mit Ratten nicht nachweisen.[11]
Extraktion

THC ist stark lipophil. Es kann per Extraktion aus THC-haltigem Pflanzenmaterial isoliert werden, wozu unpolare und schwach polare Lösungsmittel wie n-Alkane, Aceton, Isopropylalkohol oder Ethanol geeignet sind. Nach dem Abdampfen des Lösungsmittels bleibt ein harziger, ölartiger Extrakt zurück. Die Zusammensetzung des Extrakts ist abhängig von der Wahl des Lösungsmittels.[13] Bei geeigneten Bedingungen können sehr hohe THC-Konzentrationen bis zu 90 % erreicht werden.[14] Dieser Extrakt wird auch als Haschischöl bezeichnet.[15]
Mit Butan lassen sich lipophile Inhaltsstoffe bei sehr tiefen Temperaturen aus dem Pflanzenmaterial extrahieren; diese Methode bringt allerdings hohe Brand- und Explosionsgefahr mit sich. Butan verdampft bereits bei Zimmertemperatur. Der so erhaltene Extrakt hat ein Aussehen ähnlich wie Bernstein, bei Zimmertemperatur ist er dickflüssig und zieht Fäden wie Kunstharz. Wenn man ihn abkühlt, erstarrt er relativ schnell.[16]
Neben THC enthält der Extrakt weitere Cannabinoide; bei Verwendung stärker polarer Extraktionsmittel wie Ethanol können entsprechend polare Stoffe enthalten sein, wie Chlorophyll, Alkaloide (Trigonellin, Hordenin), Aminosäuren, Aminozucker,[17] eventuell auch ungelöste feine Teile des Ausgangsmaterials. Durch geeignete Verfahren kann der Extrakt noch weiter gereinigt werden.
Synthese/Teilsynthese
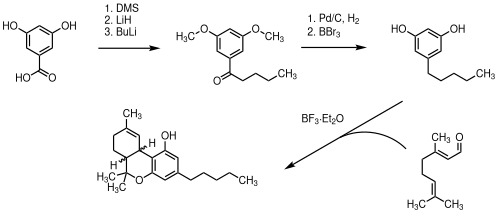
Dronabinol kann aus dem in Zitrusfrüchten vorkommenden Terpen Limonen synthetisiert[18] oder mit aufwendigen Verfahren aus THC-armem Nutzhanf teilsynthetisch hergestellt werden (Extraktion von Cannabidiol und Umwandlung in THC).[19] Es ist dann sehr viel teurer, als wenn man es aus potentem Medizinalcannabis extrahieren würde. Die direkte Extraktion von Dronabinol aus THC-reichen Sorten (welche eine Biosyntheseleistung von 18 bis 22 %, bezogen auf die Trockenmasse der Pflanzenteile, aufweisen können) ist in vielen Ländern aus rechtlichen Gründen nicht möglich.[20] In der Literatur ist als weitere Möglichkeit der Totalsynthese die Herstellung ausgehend von 3,5-Dihydroxybenzoesäure beschrieben. Nach der Funktionalisierung entsteht in einer Hetero-Diels-Alder-Reaktion mit Geranial als Schlüsselschritt racemisches Dronabinol.[21]
Konsumformen von Cannabis
Sofern THC durch Cannabis-Konsum aufgenommen wird, ist die häufigste Konsumform das Rauchen von Haschisch oder Marihuana pur oder gemischt mit Tabak als Joint. Häufig wird THC-haltiges Material auch mithilfe speziellen Rauchzubehörs wie Bongs und Pfeifen geraucht oder mit dem Vaporizer verdampft und inhaliert.
Daneben wird THC auch in Speisen und Getränken verarbeitet. Da THC lipophil ist, kann es in fettreichen Nahrungsmitteln wie Milch, Kuchen, Muffins verarbeitet werden. Dass Konsumenten Cannabis/THC spritzen würden, ist nicht bekannt. THC ist auf Grund seiner Lipophilie ohne Emulgator nicht intravenös applizierbar. Aufgrund seiner schlechten Wasserlöslichkeit kann es in Form von Lösungen oder Emulsionen mit Ethanol, Dimethylsulfoxid, Polysorbat 80, Cremophor EL oder Polyvinylpyrrolidon verabreicht werden.
Pharmakologie
Wirkmechanismen
Der Wirkmechanismus von THC ist noch nicht vollständig aufgeklärt.
THC wirkt auf mindestens zwei Arten von Rezeptoren, die bei Säugetieren vorkommen, namentlich CB1 und CB2. CB1-Rezeptoren befinden sich vorwiegend in zentralen und peripheren Nervenzellen, wo sie die Ausschüttung von Neurotransmittern modulieren. Sie kommen aber auch in anderen Zellen vor, zum Beispiel in der Hypophyse, Immunzellen, gastrointestinalem Gewebe, sympathetischen Ganglien, Herz, Lunge, Harnblase und Nebennieren. CB2-Rezeptoren kommen hauptsächlich in Immunzellen vor und sind an der Zytokinausschüttung beteiligt.
Endocannabinoide sind körpereigene Substanzen, die auf die CB1- und CB2-Rezeptoren wirken. Sie sind Eikosanoide und werden vom Organismus bei Bedarf erzeugt. Die bekanntesten sind Arachidonylethanolamid (Anandamid) und 2-Arachidonylglycerol (2-AG). Die Endocannabinoide und die Cannabinoid-Rezeptoren bilden das sogenannte Endocannabinoid-System.
THC bindet an die CB1-Rezeptoren und beeinflusst die Signalübertragung an diesen Synapsen, mit Auswirkungen auf das zentrale und periphere Nervensystem, wie Glücksgefühl, Entspannung und Analgesie (Schmerzlinderung). Die Aktivierung hemmt über G-Proteine die Adenylylcyclase, blockiert Ca2+-Kanäle und aktiviert K+-Kanäle. Die Transduktionsmechanismen ähneln hierbei den Opioidrezeptor-Subtypen μ, δ und κ.
Über die Rolle der CB2-Rezeptoren ist weniger bekannt, man nimmt jedoch an, dass sie an der Immunmodulation beteiligt sind, weil sie vorwiegend in B-Zellen und in natürlichen Killerzellen vorkommen.
Im Tiermodell wirkt THC antagonistisch auf 5-HT3-Rezeptoren, welche am Brechreiz beteiligt sind. THC wirkt auch auf andere pharmakologische Ziele, wie auf Capsaicin empfindliche perivaskuläre sensorische Nerven.
Das Verteilungsmuster der CB1-Rezeptoren im Gehirn bedingt viele der pharmakologischen Eigenschaften von THC. Im Stammhirn, wo lebenswichtige Funktionen wie Atmung koordiniert werden, sind nur sehr wenige bis gar keine dieser Rezeptoren vorhanden. Im Hippocampus, wo das Kurzzeitgedächtnis angesiedelt ist, finden sich hingegen viele dieser Rezeptoren. CB1-Rezeptoren in den Basalganglien bieten eine Erklärung für den Einfluss von THC auf die Motorik.
Das schwach psychoaktive Cannabidiol (CBD) hat neben eigenen therapeutischen Wirkungen einen modulierenden Einfluss auf THC. Sowohl THC als auch CBD wirken antioxidativ und entfalten so eine neuroprotektive Wirkung, zum Beispiel bei Glutamat-induzierter Excitotoxizität. THC hemmt die Glutamat-Ausschüttung, möglicherweise auch den Eintritt von Calcium über die Ionenkanäle, und könnte deshalb eine neuroprotektive Wirkung entfalten.
Das in Cannabis in geringer Menge enthaltene Δ8-Tetrahydrocannabinol (Δ8-THC) ist psychoaktiv, aber etwas weniger potent als Δ9-THC.
THC und CBD können Zeichen des apoptotischen und nekrotischen Zelltods bei Tumorzellen induzieren.
Metabolismus

Δ9-THC wird im Menschen überwiegend zu 11-Hydroxy-Δ9-THC (11-OH-Δ9-THC) oxidiert. Dieses Stoffwechselprodukt ist ebenfalls psychoaktiv und wird weiter zu 11-Nor-9-carboxy-Δ9-THC (11-COOH-THC, THC-COOH, THC-Carbonsäure, nicht psychoaktiv) verstoffwechselt. In Menschen und Tieren wurden über 100 verschiedene Δ9-THC-Metaboliten identifiziert, nahezu alle sind nicht psychoaktiv.[22] Die Metabolisierung findet im Wesentlichen in der Leber und durch die Cytochrom-P450-Enzyme 2C9, 2C19 und 3A4 statt. Die Metaboliten werden dann aufgrund ihrer lipophilen Eigenschaften im Fettgewebe eingelagert, woraus sie anschließend nur sehr langsam wieder entfernt werden.[22] Mehr als 65 % des ursprünglich vorhandenen THCs werden so in Form von Metaboliten im Stuhl ausgeschieden und rund 25 % im Urin, ein geringer Teil wird im Körper selbst abgebaut.[22] Die Hauptmetaboliten im Urin sind mit Glucuronsäure verestertes THC-COOH und freies THC-COOH, während im Stuhl 11-OH-THC dominiert.[23]
Todesfälle
Die Autoren einer Übersichtsarbeit von 2019 konstatieren, dass während synthetische Cannabinoide zunehmend für Todesfällen verantwortlich seien, in der Literatur nur relativ wenig Todesfälle auf Cannabis zurückgeführt werden könnten. Allerdings würden zahlreiche Berichte über mit Cannabiskonsum zusammenhängende akute Herz-Kreislauf-Probleme existieren. Eine Auswertung von publizierten Todesfällen durch Cannabis ergab, dass mindestens 13 Fälle von tödlichem Herz-Kreislaufversagen registriert waren, was als eine wahrscheinliche Unterschätzung angesehen wurde. Außerdem waren "viele" Fälle von Schlaganfall und Arteriitis (Entzündung von Arterien) aufgezeichnet, wobei letztere oft zu Amputationen geführt hatten.[24]
Pharmakokinetik
Psychische Effekte treten bei folgenden Dosierungen auf: 30 bis 50 μg/kg intravenös, 50 μg/kg bei Rauchinhalation, 120 μg/kg oral.[25] Bei Rauchinhalation geringerer Mengen THC (5 bis 7 mg) überwiegt die sedative Komponente, bei Mengen von 15 mg oder darüber überwiegt Vigilanz, die sich bis zu psychotischen Zuständen steigern kann.
Bei Rauchinhalation gehen ungefähr 20 % des im Rauch vorhandenen Δ9-THC in das Blut über, oral nur etwa 6 %.[26] THC geht vom Rauch sehr schnell ins Blut über, hierbei ist die Entwicklung der Plasmakonzentration mit intravenöser Einnahme vergleichbar. Bei oraler Einnahme in Form von Sesamölkapseln ist die Wirkung wegen des First-Pass-Effekts vermindert, die Bioverfügbarkeit beträgt nur etwa 10 bis 20 %, die höchste THC-Konzentration wird nach etwa zwei Stunden erreicht.
THC ist im Blutplasma überwiegend an Proteine gebunden; maximal 10 % kommen in den roten Blutkörperchen vor. Die Plasmahalbwertszeit nach intravenöser Gabe entwickelt sich in vier Phasen, was nahelegt, dass es mindestens vier Gewebearten gibt, in die THC einsickert, mit jeweils unterschiedlicher Durchlässigkeit und Bindungskapazität. Nach starker Verringerung in den ersten Minuten sinkt die THC-Konzentration nur noch langsam. Die Halbwertszeiten der ersten drei Phasen betragen jeweils 1 Minute, 4 Minuten und 1 Stunde. Die anfänglich kurze Halbwertszeit ist auf den schnellen Übergang von THC in bestimmte Gewebearten sowie auf die schnelle Verstoffwechslung der Substanz zurückzuführen. Nach ungefähr 6 Stunden besteht ein Pseudogleichgewicht zwischen dem THC-Gehalt im Blutplasma und in den Geweben. Die Halbwertszeit der vierten Phase (terminale Halbwertszeit nach Erreichen des Pseudogleichgewichts) wird unterschiedlich mit 19–36 Stunden angegeben. Nach 5 Tagen ist etwa 80 bis 90 % des THC in Form von Metaboliten ausgeschieden, etwa zu zwei Dritteln im Stuhl und zu einem Fünftel im Harn.[27]
Die THC-Konzentration im Gehirn erreicht nach rund 30 Minuten ihr Maximum; die Konzentration ist drei- bis sechsmal höher als im Plasma. Die THC-Konzentrationskurven im Gehirn und im Plasma verlaufen parallel, was für ein uneingeschränktes Passieren der Blut-Hirn-Schranke spricht. Tierversuche haben gezeigt, dass sich THC als lipophile Substanz in bestimmten Gewebearten stark anreichert, zum Beispiel in Körperfett, Herz, Leber und Lunge. Ebenso wurde im Tierversuch nachgewiesen, dass THC durch die Plazenta auf Föten übergeht. Welche Auswirkungen dies hat, ist weitgehend unbekannt.[27]
Synthetische Analoga
| Wirkstoff | Wirkung | Wirkstoff | Wirkung |
|---|---|---|---|
| Δ6a,10a-THC | eventuell psychoaktiv | Δ6a,10a-Hexyl-THC | Synhexyl (Parahexyl), schwächere Wirkung als Δ9-THC |
| Δ6a,10a-Dimethylheptyl-THC | DMH-THC, teilweise psychoaktiv | Δ6a,10a-Methyloctyl-THC | |
| Dimethylheptylpyran | DMHP, CB1-Agonist, potenter als Δ9-THC | BRL 4664 | |
| Nabilon | Antiemetikum, psychoaktiv | Levonantradol | Antiemetikum, psychoaktiv |
| HU-210 | psychoaktiv, 100- bis 800-mal so potent wie Δ9-THC | Dexanabinol (HU-211) | nicht psychoaktiv; Dexanabinol ist das Enantiomer von HU-210[28] |
| CP-47,497 | Analgetikum, psychoaktiv | CP-55,940 | psychoaktiv, rund 45 Mal so potent wie Δ9-THC |
Wirkungen
Bekannte Wirkungen von Δ9-THC auf den Menschen beziehungsweise Wirkungen von Cannabis, die auf Δ9-THC zurückgeführt werden:[29] Eine Studie von 2019 sah keinen ausreichenden Nachweis für eine antidepressive Wirkung.[30]
| Effekte mit therapeutischem Potenzial | Effekte des Rausches („high“) | Andere Wirkungen |
|---|---|---|
|
|
|
Bei regelmäßigem, intensivem Konsum kann sich ein Toleranzeffekt (erforderliche Dosissteigerung, um die gewohnte Wirkung zu erzielen) entwickeln. Entzugssymptome und eine damit einhergehende Entwicklung von Abhängigkeit sind bedingt durch eine Unterfunktion des mesolimbischen Systems (subkortikale Belohnungssysteme), die nach Absetzen des Konsums wirksam wird und andauert, bis sich in diesen Arealen nach maximal zwei bis drei Wochen ein neuronales Gleichgewicht (Entwöhnung) wiederhergestellt hat.[31]
Ein erhöhter THC-Gehalt in illegalen Cannabisprodukten und ein erhöhtes Konsumverhalten ist mit einer höheren Wahrscheinlichkeit an einer psychotischen Störung (u. a. Schizophrenie) zu erkranken assoziiert.[32] Ein ursächlicher Zusammenhang ist bislang jedoch noch nicht gefunden worden. Deshalb bleibt unklar, ob Cannabis hier als alleiniger Faktor oder nur in Kombination mit anderen als Auslöser auftritt.[33][34][35] Als möglicher neurobiologischer Mechanismus wurde eine durch Cannabinoide verursachte Störung dopaminerger Systeme diskutiert.[36]
Reiner Cannabisrauch enthält größere Mengen karzinogener Stoffe als der Rauch von Tabak,[37] doch die Studienlage zum Zusammenhang zwischen Lungenkrebs und dem Konsum von reinem Cannabis ist nicht eindeutig.[38][39] Die Weltgesundheitsorganisation benennt epidemiologische Beweise dafür, dass das Rauchen von Cannabis zwar das Risiko von Hodenkrebs um das Zweieinhalbfache erhöht, nicht jedoch das von Lungen-, Kopf- und Halskrebs. Die Studie führt an, dass die berichteten karzinogenen Wirkungen im Zusammenhang mit dem Rauchen von Cannabis stehen und bei anderen Konsumformen entsprechend abgemildert sind.[40] Als möglicher Grund wird angeführt, dass verschiedene Faktoren dazu beitragen könnten, z. B. potenzielle entzündungshemmende und anti-neoplastische Eigenschaften von THC und anderen Cannabinoiden.[41] Demgegenüber steht eine Längsstudie über 40 Jahre mit 50.000 schwedischen Rekruten, bei der bei reinem Cannabiskonsum unter Berücksichtigung aller anderen Faktoren wie etwa Tabakkonsum ein etwa doppelt so hohes Lungenkrebsrisiko gefunden wurde.[42] Wird Cannabis zusammen mit Tabak, etwa als Joint oder Blunt, geraucht, kommen die Risiken des Nikotinkonsums, wie z. B. das Risiko einer Arteriosklerose, von Lungenerkrankungen wie Lungenkrebs oder einer Nikotinabhängigkeit, hinzu.
Es bestehen keine Hinweise, dass THC selbst mutagen, karzinogen oder teratogen (fruchtschädigend) ist. Schwangere und Stillende sowie Heranwachsende sollten auf den Konsum von THC verzichten, weil Schäden am ungeborenen oder gestillten Kind nicht ausgeschlossen werden können und es Hinweise darauf gibt, dass THC die Entwicklung des nicht ausgereiften Gehirns nachhaltig beeinflussen könnte.[43]
Metaanalysen von 2013 und 2014, die die bis dahin vorliegenden Gehirnstudien durch bildgebende Verfahren auswerteten, gelangten zu dem Ergebnis, dass Cannabiskonsum im präfrontalen Cortex (Stirnseite des Frontallappens der Großhirnrinde) zu einem verminderten Gehirnvolumen und zu einer Beeinträchtigung der weißen Substanz (Nervenverbindungen) führt,[44] sowie zu einem beidseitigen verminderten Volumen des Hippocampus. Bei letzterer Gehirnregion, die eine Schlüsselrolle bei allen Gedächtnisfunktionen hat, bestand zusätzlich eine Korrelation (Entsprechung) zwischen Volumenabnahme und Menge des bisherigen Cannabiskonsums.[45]
Medizinische Anwendung


Die Bundesregierung Deutschland beschloss am 4. Mai 2016 einen Gesetzesentwurf, der die Versorgung der Patienten mit natürlichem Cannabis und die Erstattungsfähigkeit durch die Krankenkassen ermöglichen soll[46] und der am 19. Januar 2017 vom Bundestag einstimmig verabschiedet wurde. Nach der am 9. März 2017 veröffentlichten Verkündung können bedürftige, chronisch Schwerkranke Cannabis auf Rezept bekommen, wobei die Kosten teilweise von den Krankenkassen übernommen werden. Ärzte sollen eigenverantwortlich entscheiden, ob eine Cannabis-Therapie sinnvoll ist, auch wenn im Einzelfall noch andere Behandlungsoptionen bestehen. „Die Patienten müssen also nicht "austherapiert" sein, wie es anfangs hieß, bevor sie einen Anspruch auf ein Cannabis-Rezept haben.“[47]
Dronabinol ist in Deutschland und anderen Staaten als verschreibungspflichtiges Betäubungsmittel für die Herstellung von Rezepturarzneimitteln erhältlich. Unter dem Handelsnamen Marinol® ist es in den Vereinigten Staaten zur Behandlung von Anorexie und Kachexie bei AIDS und als Antiemetikum im Rahmen einer Krebstherapie zugelassen, kein zugelassenes Anwendungsgebiet hingegen ist die Therapie eines zu hohen Augeninnendruckes (Glaukom).
Das vollsynthetische THC-Analogon Nabilon hat ähnliche Indikationen wie Dronabinol. Das THC-Analogon Levonantradol wird in Deutschland nur für Forschungszwecke genutzt. Außerdem befindet sich THC in der klinischen Erprobungsphase für die Behandlung von Glaukomen und Autoimmunerkrankungen, wie Multipler Sklerose, Morbus Crohn oder Colitis ulcerosa. Dass THC Tics bei Betroffenen des Tourette-Syndroms wirksam reduziert, bestätigten die Ergebnisse einer sechswöchigen Studie an der Medizinischen Hochschule Hannover.[48]
Cannabisblüten (lat. „Cannabis flos“ ) sind in den Niederlanden in vier Varietäten mit verschiedenen THC-Nenngehalten verschreibungspflichtig für die Human- und Tiermedizin erhältlich: Bedrocan (THC ca. 22 %; CBD <1 %), Bedrobinol (THC ca. 13,5 %; CBD <1 %), Bediol (THC ca. 6,3 %; CBD ca. 6 %) und Bedica (THC ca. 14 %; CBD <1 %; gemahlene Blüten). Der Verkaufspreis wird mit 34,50 € exkl. Mwst. für 5 g Blüten angegeben (Stand Juli 2017).[49][50] Das Cannabis wird in den Niederlanden unter staatlicher Aufsicht angebaut, der Handel untersteht dem Bureau voor Medicinale Cannabis (BMC).
In Österreich, Kanada und Großbritannien ist ein Mundspray mit den Handelsnamen Sativex (Wirkstoff: Nabiximols, bestehend aus pflanzlichem THC und Cannabidiol) für die Behandlung neuropathischer Schmerzen und Spasmen bei multipler Sklerose sowie zur Behandlung von Schmerzen, Übelkeit und Erbrechen in Zusammenhang mit Krebs- und AIDS-Erkrankungen zugelassen. Weitere Anwendungsgebiete befinden sich in der klinischen Prüfung. In Deutschland ist das Mundspray nach einer Änderung des Betäubungsmittelgesetzes im Mai 2011 seit dem 1. Juli 2011 als verschreibungspflichtiges BTM für die Behandlung von Spastik bei MS zugelassen.[51][52]
Die Inhalation von THC habe laut einer kleinen, plazebo-kontrollierten Studie aus dem Jahr 2007 einen geringfügig positiven Effekt auf neuropathischen Schmerz im Rahmen einer Polyneuropathie bei AIDS.[53]
Drogennachweis
Die Nachweisdauer von THC im Urin beträgt in Abhängigkeit vom Konsum zwei bis 35 Tage – in extremen Konsumfällen sogar noch länger – beziehungsweise etwa 12 Stunden im Blut. Der Nachweis im Urin erfolgt meist über die THC-Metabolite THC-Carbonsäure und 11-Hydroxy-THC. Neben der vergleichsweise aufwendigen LC/MS-Methode existieren für den Nachweis von THC-Metaboliten im Harn eine Reihe von Immunassay-Tests wie etwa Radioimmunassay (RIA), Enzyme-multiplied Immunoassay Technique (EMIT), CEDIA (cloned enzyme donor immunoassay) und FPIA (fluorescence polarization immunoassay). Um die Zahl falsch-positiver Ergebnisse mit diesen Tests zu reduzieren, empfiehlt die US-amerikanische Substance Abuse and Mental Health Services Administration (SAMHSA) einen Cutoff-Wert von 50 ng/ml.[54] Zur hochspezifischen und hochsensitiven Quantifizierung der THC-Carbonsäure im fg-Bereich kann die GC/MS-Methode eingesetzt werden. Dabei werden hochfluorierte Derivate, wie etwa das THC-COOH-HFBA-PFPOH-Derivat unter Verwendung des deuterierten Derivats als internem Standard nach dem Prinzip der Isotopenverdünnungsanalyse mit der NCI-Technik (Negative Chemische Ionisation) vermessen.[55] Diese Methodik vermeidet die oben geschilderten Probleme der falsch-positiven oder falsch-negativen analytischen Ergebnisse, die bei Enzymimmunassays (ELISA) immer wieder beobachtet werden, und findet daher auch in der forensischen Analytik bei Schiedsanalysen Verwendung.[56]
Falsch-negative Ergebnisse können etwa durch verdünnte Harnproben verursacht werden, zum Beispiel bei einer Verdünnung in vivo durch vermehrte Flüssigkeitszufuhr. Über die Verdünnung des Harns können der Kreatinin-Gehalt und die Osmolalität Anhaltspunkte bieten, jedoch herrscht Uneinigkeit darüber, ab welchem Kreatinin-Wert eine Harnprobe als „unverdünnt“ gilt.
Falsch-positive Ergebnisse wurden bei einigen intensivmedizinisch behandelten Patienten berichtet, außerdem bei Personen, welche den Cannabiskonsum zwar aufgegeben haben, jedoch mehr Sport betreiben: Da THC im Fettgewebe gespeichert wird, können beim Abbau von Fettreserven THC-Metaboliten freigesetzt werden.[57]
Besondere Vorsicht ist bei der Interpretation von Haaranalysen geboten. Wie neuere Untersuchungen zeigen, können positive Messwerte nicht zwangsläufig mit einem aktiven Cannabiskonsum in Verbindung gebracht werden.[58]
Eine neue analytische Verfahrensweise zum THC-Nachweis in der Atemluft wurde von NIST-Mitarbeitern entwickelt. Zum Einsatz kommt dabei die sogenannte porous layered open tubular-cryoadsorption (PLOT-cryo)–Methode.[59]
Rechtliches
Deutschland
Δ9-THC ist in Deutschland in die Anlage II des Betäubungsmittelgesetzes (BtMG) als ein verkehrsfähiges, aber nicht verschreibungsfähiges Betäubungsmittel eingestuft. Das zu medizinischen Zwecken verwendete (–)-Δ9-trans-THC (Dronabinol), im Handel als Rezeptursubstanz oder als Fertigarzneimittel Marinol (Einzelimport aus USA oder Kanada möglich gemäß § 73 Abs. 3 AMG), hingegen ist verkehrs- und verschreibungsfähig nach Anlage III. Isomere des Δ9-THC wie etwa Δ6a-, Δ6a(10a)-, Δ7-, Δ8-, Δ9(11)- und Δ10-THC sind nicht verkehrsfähig (Anlage I). In Deutschland wird Dronabinol von Bionorica Ethics und THC Pharm, zwei Tochterunternehmen der Bionorica SE, produziert. Dronabinol-haltige Fertigarzneimittel sind bisher in Deutschland nicht zugelassen.
Die gesetzlichen Krankenkassen (z. B. AOK) übernehmen nur in etwa der Hälfte der Fälle die Kosten der Medikation, die im Einzelfall Kosten von bis zu 800 Euro pro Monat verursachen kann, auch wenn diese Form einer Therapie oft der letzte Ausweg für diverse Krankheitsbilder ist und sein könnte. 2018 lag die Genehmigungsrate seitens der gesetzlichen Krankenkassen bei rund 60 Prozent, wie Bionorica informierte.[60]
THC wirkt auf das Zentralnervensystem, deshalb sollte nach Ansicht des Gesetzgebers nach dem Konsum auf das Benutzen von Maschinen und das Führen von Fahrzeugen verzichtet werden. Die Polizei kann bei Fahrerkontrollen mit einem Schweiß-, Speichel-, Haar- oder Urintest oder durch Untersuchung des Blutes auch längere Zeit nach dem Konsum Spuren von THC nachweisen. Die Nachweisdauer hängt vor allem vom jeweiligen Konsummuster (Dauer, Art der Einnahme, Frequenz, Dosis) ab und kann im Urin zwischen einer Woche und zwei Monaten betragen. Zurzeit ist die gesetzliche Situation allerdings noch nicht eindeutig beschlossen, es drohen aber Geldbußen von mindestens 500 Euro, Fahrverbote bis zu drei Monaten und vier Punkte in Flensburg. Die Polizisten vor Ort können nur orientierende Vortests durchführen, die Blutprobe wird später in einem Labor untersucht und die Menge an THC und seiner Abbauprodukte bestimmt. Aus rechtlicher Sicht handelt es sich um eine Ordnungswidrigkeit, sobald THC im Blut nachweisbar ist.
Im Beschluss des Bayerischen VGH vom 25. Januar 2006, Az. 11 CS 05.1711, steht: „Der derzeitige medizinisch-naturwissenschaftliche Erkenntnisstand rechtfertigt es nicht, bereits ab einer THC-Konzentration von 1,0 ng/ml im Blut eines Kraftfahrzeugführers eine Erhöhung des Risikos für die Verkehrssicherheit als derart gesichert im Sinne des § 11 Abs. 7 FeV (Fahrerlaubnis-Verordnung) anzusehen, dass dem Betroffenen ohne weitere Sachverhaltsaufklärung die Fahrerlaubnis zwingend zu entziehen ist. Bei gelegentlichem Konsum von Cannabis und Fahren mit einer THC-Konzentration zwischen 1,0 und 2,0 ng/ml ist vor einer etwaigen Entziehung der Fahrerlaubnis gemäß § 14 Abs. 1, S. 4 FeV ein medizinisch-psychologisches Gutachten einzuholen.“ (FeV § 11 Abs. 7, FeV § 14 Abs. 1, S. 4, StVG § 3 Abs. 1) Dies gilt aber nur, wenn keine Fahrfehler gemacht wurden. In vielen Fällen ordnet die Verwaltungsbehörde (Fahrerlaubnis) eine Überprüfung der Kraftfahreignung (MPU) zum Nachweis der Kraftfahrtauglichkeit an.
Schweiz
In der Schweiz muss für eine Therapie mit Dronabinol vom Arzt eine patientenspezifische Ausnahmebewilligung beim Bundesamt für Gesundheit (BAG) beantragt werden. Da Dronabinol keine Pflichtleistung der Krankenkassen ist, muss eine Kostenübernahme im Vorfeld und im Einzelfall abgeklärt werden; bei manchen Kassen braucht es dafür eine Zusatzversicherung.[61] Etwa 500 Patienten mit Angststörungen, Epilepsie oder Morbus Crohn profitierten von der ärztlichen Verschreibung von Cannabidiol; Multiple-Sklerose-Betroffene benutzen das rezeptpflichtige Medikament Sativex, das CBD und THC enthält, gegen Verkrampfungen.[62]
In der Schweiz ist seit Anfang 2005 mit einem Drogenschnelltest (engl. „Drug Wipe“) in Verkehrskontrollen zu rechnen.
Seit 2011 ist in der Schweiz Cannabisanbau mit einem THC-Gehalt bis zu 1 % zulässig, dies vor allem wegen der natürlichen Schwankungen in den Hanfpflanzen; zuvor lag der Grenzwert bei 0,3 %, der aber nicht regelmäßig eingehalten werden konnte. Seither nimmt der industrielle Hanfanbau in der Schweiz zu.[62]
Nachweis
Die Methode des THC-Nachweises im Straßenverkehr ist umstritten, da der Konsument nicht unter direktem Einfluss der Droge stehen muss, sondern es für einen positiven Test ausreicht, Tage und Wochen zuvor THC konsumiert zu haben. Dies gilt für alle Urintests, da diese nicht direkt THC nachweisen, sondern ein Abbauprodukt des THC, die Tetrahydrocannabinolsäure (THC-COOH, auch THC-Carbonsäure genannt). Die Cannabinolsäure hat keine berauschende Wirkung mehr. Sie wird allerdings relativ langsam und je nach Konstitution verschieden schnell aus dem Körper ausgeschieden und ist somit längere Zeit, manchmal sogar über Wochen im Urin nachweisbar. Die derzeit zuverlässigste Nachweismethode ist die Gaschromatographie mit Massenspektrometrie-Kopplung (GC/MS) von Derivaten (häufig als Trimethylsilyl-Derivate) der THC-Carbonsäure.[63] Im Gegensatz dazu weisen Speichel- und Schweißtests wie die oben zitierten Drogentests THC mit ausreichender Empfindlichkeit direkt nach.
THC-Gehalte
Cannabisblüten
Konventionell angebaute Cannabisblüten enthalten im Schnitt zwischen 4 % und 6 % THC.[64] Unter Vermeidung einer Besamung (Sinsemilla) steigt der THC-Gehalt auf 9 % bis 12 %.[64] Unter Kunstlicht gewachsenes, speziell auf hohen THC-Gehalt gezüchtetes Marihuana kann hingegen einen Wirkstoffgehalt von 10 % bis zu 20 % aufweisen.[64] In den USA begann man in den 1970er-Jahren mit solchen Züchtungen und setzte sie insbesondere in den Niederlanden seit den 1980er-Jahren fort. Dementsprechend lag der durchschnittliche THC-Gehalt des sogenannten „Nederwiet“ im Jahr 2007 bei etwa 20 %. Dennoch sind Meldungen über angeblich stark erhöhte THC-Gehalte als maßlos übertrieben zu betrachten. US-amerikanische Forscher wiesen darauf hin, dass die als zum Vergleich angegebenen äußerst niedrigen Werte für in den 60er oder 70er-Jahren beschlagnahmtes Cannabis (z. T. unter 1 %) darauf zurückzuführen sein dürften, dass damals die ganzen Pflanzen inklusive Stängel und Blätter analysiert wurden, während heute nur die tatsächlich konsumierten weiblichen Blütenstände untersucht werden.
Haschisch
Haschisch enthält im Schnitt zwischen 10 und 15 % THC,[64] wobei – wie auch bei Marihuana – die Spanne sehr groß sein kann: Hochwertiges Haschisch kann ebenfalls über 20 % THC enthalten. Eine Studie der Universität Leiden aus dem Jahre 2006 untersuchte elf Marihuana-Proben aus niederländischen Coffee-Shops, der THC-Gehalt lag zwischen 11,7 und 19,1 %. Zwei Vergleichsproben von Marihuana aus niederländischen Apotheken enthielten 12,2 beziehungsweise 16,5 % THC.[65] Das auf dem Schwarzmarkt eher selten erhältliche Haschischöl kann je nach Produktionsweise THC-Gehalte von 20[64] bis zu 90 %[14] betragen.
Lebensmittel
Das Bundesinstitut für Risikobewertung (BfR) hat das Risiko psychogener und pharmakologischer Wirkungen durch den Verzehr hanfhaltiger Lebensmittel mit den durch die Überwachungsbehörden ermittelten üblichen Tetrahydrocannabinolgehalten für alle Bevölkerungsgruppen einschließlich von Kindern bewertet. Auf Basis der vorliegenden Daten kommt das BfR zu folgendem Schluss: Der Verzehr hanfhaltiger Lebensmittel mit den zugrunde liegenden Gesamt-∆9-Tetrahydrocannabinol (THC)-Gehalten kann zu einer Überschreitung der von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) vorgeschlagenen Akuten Referenzdosis (ARfD) von 0,001 Milligramm (mg) je Kilogramm Körpergewicht führen.[66]
Literatur
- World Health Organization, Expert Committee on Drug Dependence (Hrsg.): Critical Review of Delta-9-tetrahydrocannabinol (PDF) & Isomers of THC (PDF). Department of Essential Medicines and Health Products, 2018.
- Franjo Grotenhermen, Britta Reckendrees: Die Behandlung mit Cannabis und THC. 6., komplett überarb. und erw. Auflage. Nachtschatten Verlag, 2016, ISBN 978-3-03788-147-7.
- Franjo Grotenhermen, Kirsten Müller-Vahl: Das therapeutische Potenzial von Cannabis und Cannabinoiden. In Deutsches Ärzteblatt International. Band 109, Nr. 29–30, 2012, S. 495–501, doi:10.3238/arztebl.2012.0495.
- Franjo Grotenhermen (Hrsg.): Cannabis und Cannabinoide. Pharmakologie, Toxikologie und therapeutisches Potential. Huber, Bern 2004, ISBN 3-456-84105-1.
- Franjo Grotenhermen: Hanf als Medizin. Ein praxisorientierter Ratgeber zur Anwendung von Cannabis und Dronabinol. 3. Auflage, Nachtschatten Verlag, Solothurn, 2017, ISBN 978-3-03788-285-6.
- Roger Pertwee (Hrsg.): Cannabinoids (= Handbook of Experimental Pharmacology. Band 168). Springer, Berlin 2005, ISBN 3-540-22565-X.
- Arno Hazekamp: Cannabis; extracting the medicine.. Department of Pharmacognosy, Universität Leiden, 2007, ISBN 978-90-90-21997-4.
Weblinks
- Selbsthilfenetzwerk Cannabis-Medizin
- Susanne Uhlenbrock, Claudia Langebrake: Von der Hippie-Droge zum Medikament. In: Pharmazeutische-Zeitung. 21, 2002.
Einzelnachweise
- Eintrag zu Tetrahydrocannabinole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2013.
- Eintrag zu Dronabinol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 4. August 2021.
- Edward R. Garrett, C. Anthony Hunt: Physicochemical Properties, Solubility, and Protein Binding of Δ9-Tetrahydrocannabinol. In: Journal of Pharmaceutical Sciences. Band 63, Nr. 7, 1974, S. 1056–1064, doi:10.1002/jps.2600630705.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (6aR,10aR)-6,6,9-trimethyl-3-pentyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. September 2020.
- Robert B. Forney, Glenn F. Kiplinger: Toxicology and Pharmacology of Marijuana. In: Annals of the New York Academy of Sciences. Band 191, Nr. 1, 1971, S. 74–82, doi:10.1111/j.1749-6632.1971.tb13989.x.
- Europäischer Drogenbericht 2017. (PDF) Abgerufen am 14. November 2017.
- Roger Adams, Madison Hunt, J. H. Clark: Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. In: Journal of the American Chemical Society. Band 62, Nr. 1, 1940, S. 196–200, doi:10.1021/ja01858a058.
- Yehiel Gaoni, Raphael Mechoulam: Isolation, structure and partial synthesis of an active constituent of hashish. In: Journal of the American Chemical Society. Band 86, Nr. 8, 1964, S. 1646–1647, doi:10.1021/ja01062a046.
- Assessment of dronabinol and its stereo-isomers, 34. Meeting des WHO Expert Committee on Drug Dependence (2006).
- Lumír Ondřej Hanuš u. a.: Phytocannabinoids: a unified critical inventory. In: Nat. Prod. Rep. 33, 2016, S. 1357–1392 doi:10.1039/C6NP00074F
- J. Jung, M. R. Meyer, H. H. Maurer, C. Neusüß, W. Weinmann, V. Auwärter: Studies on the metabolism of the Delta9-tetrahydrocannabinol precursor Delta9-tetrahydrocannabinolic acid A (Delta9-THCA-A) in rat using LC-MS/MS, LC-QTOF MS and GC-MS techniques. In: Journal of Mass Spectrometry. Band 44, Nr. 10, 2009, S. 1423–1433, doi:10.1002/jms.1624.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 420.
- Laura J. Rovetto, Niccolo V. Aieta: Supercritical carbon dioxide extraction of cannabinoids from Cannabis sativa L.. In: The Journal of Supercritical Fluids. 129, 2017, S. 16, doi:10.1016/j.supflu.2017.03.014.
- D. Gloss: An Overview of Products and Bias in Research. In: Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics. Band 12, Nummer 4, Oktober 2015, S. 731–734, doi:10.1007/s13311-015-0370-x, PMID 26202343, PMC 4604179 (freier Volltext) (Review).
- Luigi L. Romano, Arno Hazekamp: Cannabis Oil: chemical evaluation of an upcoming cannabis-based medicine. In: Cannabinoids 2013;1(1):1-11.
- WHO Expert Committee on Drug Dependence: Critical Review - Cannabis and cannabis resin. (PDF) World Health Organization, 2018, abgerufen am 2. April 2019 (englisch).
- Eberhard Breitmaier: Alkaloide. Teubner, Stuttgart 1997, ISBN 3-519-03542-1, S. 87 ff.
- John ApSimon (Hrsg.): The Total Synthesis of Natural Products. Vol. 4, John Wiley & Sons, New York 2009, ISBN 978-0-470-12953-1, S. 233.
- Patent DE102005028937 A1, Verfahren zur Herstellung von Dronabinol, abgerufen 21. März 2017.
- F. Stehle u. a.: Heterologe Biosynthese der Tetrahydrocannabinolsäure. In: Pharmakon. 5. Jahrgang, Nr. 2, 2017, S. 142.
- Trachsel, Daniel: Psychedelische Chemie : Aspekte psychoaktiver Moleküle. 4., kompl. neu überarb. Auflage. Nachtschatten Verlag, Solothurn 2011, ISBN 978-3-907080-53-5.
- Lester Grinspoon, James B. Bakalar: Marihuana, die verbotene Medizin. Zweitausendeins, Frankfurt am Main 1994, ISBN 3-86150-060-4.
- M. A. Huestis: Pharmacokinetics and metabolism of the plant cannabinoids, Δ⁹-tetrahydrocannabinol, cannabidiol and cannabinol. In: Handbook of Experimental Pharmacology. Nr. 168, 2005, S. 657–690, doi:10.1007/3-540-26573-2_23.
- O. H. Drummer, D. Gerostamoulos, N. W. Woodford: Cannabis as a cause of death: A review. In: Forensic science international. Band 298, Mai 2019, S. 298–306, doi:10.1016/j.forsciint.2019.03.007, PMID 30925348 (Review).
- The central neuropharmacology of psychotropic cannabinoids. In: Pharmacology & Therapeutics. Band 36, Nr. 2–3, 1988, S. 189–261, doi:10.1016/0163-7258(88)90106-4.
- Klaus Aktories, Ulrich Förstermann, Franz B. Hofmann, Klaus Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, München 2006, ISBN 3-437-44490-5.
- C. Nora Chiang, Rao S. Rapaka: Pharmacokinetics and Disposition of Cannabinoids. (Memento vom 3. Juni 2014 im Internet Archive) In: Structure-Activity Relationships of the Cannabinoids. (= NIDA Research Monograph. Band 79). 1987, S. 173.
- J. J. Feigenbaum, F. Bergmann, S. A. Richmond, R. Mechoulam, V. Nadler, Y. Kloog, M. Sokolovsky: Nonpsychotropic cannabinoid acts as a functional N-methyl-D-aspartate receptor blocker. In: Proceedings of the National Academy of Sciences. Band 86, Nummer 23, Dezember 1989, S. 9584–9587. PMID 2556719. PMC 298542 (freier Volltext).
- Roger G. Pertwee: Pharmacological and therapeutic targets for Δ9-tetrahydrocannabinol and cannabidiol. In: Euphytica. Band 140, Nr. 1–2, 2004, S. 73–82, doi:10.1007/s10681-004-4756-9.
- Louisa Degenhardt: "Cannabinoids for the treatment of mental disorders and symptoms of mental disorders: a systematic review and meta-analysis", doi:10.1016/S2215-0366(19)30401-8. Lancet Psychiatry journal, 28. Oktober 2019.
- E. B. Oleson, J. F. Cheer: A brain on cannabinoids: the role of dopamine release in reward seeking. In: Cold Spring Harbor perspectives in medicine. Band 2, Nummer 8, 2012, S. , doi:10.1101/cshperspect.a012229. PMID 22908200, PMC 3405830 (freier Volltext) (Review).
- M. Di Forti, D. Quattrone u. a.: The contribution of cannabis use to variation in the incidence of psychotic disorder across Europe (EU-GEI): a multicentre case-control study. In: The lancet. Psychiatry. [elektronische Veröffentlichung vor dem Druck] März 2019, doi:10.1016/S2215-0366(19)30048-3, PMID 30902669 (freier Volltext).
- J. A. McLaren, E. Silins, D. Hutchinson, R. P. Mattick, W. Hall: Assessing evidence for a causal link between cannabis and psychosis: a review of cohort studies. In: The International journal on drug policy. Band 21, Nummer 1, Januar 2010, S. 10–19, doi:10.1016/j.drugpo.2009.09.001. PMID 19783132 (Review).
- S. Minozzi, M. Davoli, A. M. Bargagli, L. Amato, S. Vecchi, C. A. Perucci: An overview of systematic reviews on cannabis and psychosis: discussing apparently conflicting results. In: Drug and alcohol review. Band 29, Nummer 3, Mai 2010, S. 304–317, doi:10.1111/j.1465-3362.2009.00132.x. PMID 20565524.
- T. H. Moore, S. Zammit, A. Lingford-Hughes, T. R. Barnes, P. B. Jones, M. Burke, G. Lewis: Cannabis use and risk of psychotic or affective mental health outcomes: a systematic review. In: Lancet. Band 370, Nummer 9584, Juli 2007, S. 319–328, doi:10.1016/S0140-6736(07)61162-3. PMID 17662880.
- R. Kuepper, P. D. Morrison, J. van Os, R. M. Murray, G. Kenis, C. Henquet: Does dopamine mediate the psychosis-inducing effects of cannabis? A review and integration of findings across disciplines. In: Schizophrenia research. Band 121, Nummer 1–3, August 2010, S. 107–117, doi:10.1016/j.schres.2010.05.031. PMID 20580531.
- M. Underner, T. Urban, J. Perriot, I. de Chazeron, J. C. Meurice: Cannabis smoking and lung cancer. In: Revue des maladies respiratoires. Band 31, Nummer 6, Juni 2014, S. 488–498, doi:10.1016/j.rmr.2013.12.002. PMID 25012035 (Review).
- M. Joshi, A. Joshi, T. Bartter: Marijuana and lung diseases. In: Current opinion in pulmonary medicine. Band 20, Nummer 2, März 2014, S. 173–179, doi:10.1097/MCP.0000000000000026. PMID 24384575.
- National Institute on Drug Abuse: What are marijuana's effects on lung health? Abgerufen am 2. April 2019 (englisch).
- WHO Expert Committee on Drug Dependence: Critical Review - Cannabis and cannabis resin. (PDF) World Health Organization, 2018, abgerufen am 2. April 2019 (englisch).
- Luis Ribeiro, Philip W. Ind: Marijuana and the lung: hysteria or cause for concern? In: Breathe. Band 14, Nr. 3, September 2018, S. 196–205, doi:10.1183/20734735.020418, PMID 30186517, PMC 6118880 (freier Volltext).
- Russell C. Callaghan, Peter Allebeck, Anna Sidorchuk: Marijuana use and risk of lung cancer: a 40-year cohort study. In: Cancer Causes & Control. Band 24, Nr. 10, Oktober 2013, S. 1811–1820, doi:10.1007/s10552-013-0259-0.
- World Health Organization, Expert Committee on Drug Dependence (Hrsg.): Critical Review of Cannabis and cannabis resin (PDF), Department of Essential Medicines and Health Products, Section 3: Toxicology, 1.6 Fertility and teratogenesis, S. 6, 2018.
- J. Wrege, A. Schmidt, A. Walter, R. Smieskova, K. Bendfeldt, E. W. Radue, U. E. Lang, S. Borgwardt: Effects of cannabis on impulsivity: a systematic review of neuroimaging findings. In: Current pharmaceutical design. Band 20, Nummer 13, 2014, S. 2126–2137. PMID 23829358, PMC 4052819 (freier Volltext).
- A. Batalla, S. Bhattacharyya, M. Yücel, P. Fusar-Poli, J. A. Crippa, S. Nogué, M. Torrens, J. Pujol, M. Farré, R. Martin-Santos: Structural and functional imaging studies in chronic cannabis users: a systematic review of adolescent and adult findings. In: PloS one. Band 8, Nummer 2, 2013, S. e55821. PMID 23390554, PMC 3563634 (freier Volltext).
- Änderung des Betäubungsmittelrechts: Cannabis für Schwerkranke auf Rezept. Bundesregierung, 4. Mai 2016, abgerufen am 27. Dezember 2016.
- Götz Hausding: Bundestag lässt Cannabis-Arzneimittel für schwerkranke Patienten zu. In: Deutscher Bundestag. (bundestag.de [abgerufen am 12. Mai 2017]).
- K. R. Müller-Vahl u. a.: Delta 9-tetrahydrocannabinol (THC) is effective in the treatment of tics in Tourette syndrome: a 6-week randomized trial. In: J Clin Psychiatry. 2003. PMID 12716250.
- Frederike K. Engels, Floris A. de Jong u. a.: Medicinal cannabis in oncology. In: European Journal of Cancer. 43, 2007, S. 2638–2644, doi:10.1016/j.ejca.2007.09.010.
- Produkt-Portfolio des niederländischen Bureau voor Medicinale Cannabis (niederländisch).
- Fünfundzwanzigste Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften (BGBl. 2011 I S. 821)
- Sativex® approved in Germany for the treatment of spasticity due to Multiple Sclerosis. (Memento vom 6. März 2016 im Internet Archive) GW-Pharmaceuticals, 26. Mai 2011, abgerufen 29. März 2012.
- D. I. Abrams, C. A. Jay, S. B. Shade, H. Vizoso u. a.: Cannabis in painful HIV-associated sensory neuropathy: a randomized placebo-controlled trial. In: Neurology. 13. Februar 2007, Band 68, Nr. 7, S. 515–521.
- Sandra B. Grauwiler, Jürgen Drewe, André Scholer: Sensitivity and Specificity of Urinary Cannabinoid Detection with Two Immunoassays After Controlled Oral Administration of Cannabinoids to Humans. In: Therapeutic Drug Monitoring. Band 30, Nr. 4, 2008, S. 530–535, doi:10.1097/FTD.0b013e318180c7c2.
- H.-U. Melchert, H.-J. Hübschmann, E. Pabel: Analytik der THC-Carbonsäure. Spezifische Detektion und hochsensitive Quantifizierung im Harn durch NCI-GC/MS. In: LABO. Heft 1, 2009, S. 8–12, (PDF).
- Richard A. Gustafson u. a.: Urinary cannabinoid detection times after controlled oral administration of Δ9-tetrahydrocannabinol to humans. In: Clinical Chemistry. Band 49, Nr. 7, 2003, S. 1114–1124, doi:10.1373/49.7.1114.
- Gabriele Halwachs-Baumann: Labormedizin. Klinik, Praxis, Fallbeispiele. Springer, Wien 2006, ISBN 3-211-25291-6.
- B. Moosmann, N. Roth, V. Auwärter: Finding cannabinoids in hair does not prove cannabis consumption. In: Sci Rep. 5, 7. Okt 2015, S. 14906. PMID 26443501.
- T.M. Lovestead and T.J. Bruno, Determination of Cannabinoid Vapor Pressures to Aid in Vapor Phase Detection of Intoxication. Forensic Chemistry. Published online 27 June 2017. PMID 29266138.
- Umsatzplus: Bionorica kann sich auf Kernmarken verlassen, Pharmazeutische Zeitung, 2. März 2018.
- Therapie mit CannabinoidenTherapie mit Cannabinoiden (Memento vom 3. Juni 2014 im Internet Archive), Hänseler AG, abgerufen 5. Oktober 2011.
- Rebekka Haefeli: Jetzt kommt Cannabis light. Für Kiffer eine Riesenenttäuschung, für Pflanzer die grosse Hoffnung: THC-armes Cannabis. Der Handel mit dem Kraut könnte sich zu einem Milliardengeschäft entwickeln. In: Beobachter. Zürich, 7. Juli 2017, S. 36–40.
- S. Strano-Rossi, F. Molaioni, F. Botrè: Rapid screening of drugs of abuse and their metabolites by gas chromatography/mass spectrometry: application to urinalysis. In: Rapid Communications in Mass Spectrometry. Band 19, Nr. 11, 2005, S. 1529–1535, doi:10.1002/rcm.1942.
- Leslie L. Iversen: The Science of Marijuana. Oxford University Press, 2007, ISBN 978-0-19-979598-7. S. 10.
- Arno Hazekamp: Eine Beurteilung der Qualität von medizinischem Cannabis in den Niederlanden. In: Cannabinoids. Band 1, Nr. 1, 2006, S. 1–10. (PDF; 278 kB).
- Bundesinstitut für Risikobewertung: Tetrahydrocannabinolgehalte sind in vielen hanfhaltigen Lebensmitteln zu hoch – gesundheitliche Beeinträchtigungen sind möglich. (PDF) 8. November 2018, abgerufen am 15. November 2018.

