Nabiximols
Nabiximols ist eine als Arzneistoff verwendete Pflanzenextraktmischung aus den Blättern und Blüten der Hanfpflanze (Cannabis sativa L.).
| Allgemeine Angaben | ||
|---|---|---|
| Name | Nabiximols[1] (USAN) | |
| Andere Namen |
| |
| CAS-Nummer | 56575-23-6 | |
| PubChem | 44148067 | |
| ATC-Code | N02BG10 | |
| Wirkstoffklasse | Schmerzmittel | |
| Verschreibungspflicht |
| |
| Komponenten | ||
| Name | Cannabidiol | Tetrahydrocannabinol |
| Strukturformel | 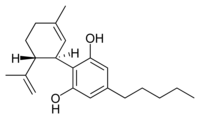 | 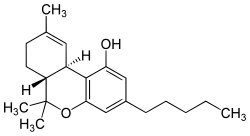 |
| Summenformel | C21H30O2 | C21H30O2 |
| CAS-Nummer | 13956-29-1 | 1972-08-3 |
Nabiximols enthält jeweils standardisierte Gehalte an Tetrahydrocannabinol (THC) und Cannabidiol (CBD) und unterliegt betäubungsmittelrechtlichen Vorschriften. Der Extrakt ist der Wirkstoff eines in Großbritannien, Dänemark, Tschechien und Deutschland zugelassenen Arzneimittels, um spastische Symptome bei Patienten mit Multipler Sklerose im Rahmen einer Zusatzbehandlung zu verbessern. In Kanada umfasst die Zulassung die begleitende Behandlung von neuropathischen Schmerzen bei Multipler Sklerose und die Schmerzbehandlung von Krebspatienten, bei denen eine Therapie mit Opioiden nicht anschlägt.[2][3] Weitere Anwendungsgebiete, insb. die Behandlung von Schmerzen bei Krebs, befinden sich in der klinischen Prüfung.[4]
Entwicklung
Nabiximols wurde von GW Pharmaceuticals entwickelt und besteht aus zwei Dickextrakten, die aus Blättern und Blüten von Cannabis sativa durch Auszug mit flüssigem Kohlendioxid hergestellt werden.[5] Für die Herstellung des einen Extrakts kommt ein CBD-Chemotyp, für die des weiteren Extrakts ein THC-Chemotyp von Cannabis sativa zum Einsatz. Nabiximols wird durch die mengenmäßige Variation der beiden Extrakte auf feste Gehalte an THC und Cannabidiol eingestellt.
Das Nabiximols-haltige Fertigarzneimittel Sativex ist ein Mundspray, das auf die Innenseite der Wange gesprüht wird, da THC über die Mundschleimhaut besonders gut resorbiert wird.
Sativex ist in mehreren europäischen Ländern zugelassen zur zusätzlichen Behandlung von Patienten mit Multipler Sklerose, um mittelschwere bis schwere spastische Symptome zu verbessern.[6][7] Voraussetzung ist, dass die Patienten nicht ausreichend auf eine andere antispastische Therapie angesprochen haben und sich die Beschwerden durch die Therapie mit Sativex erheblich klinisch verbessern. Einen ersten Zulassungsantrag in Großbritannien, Dänemark, Spanien und den Niederlanden hatte der Antragsteller GW Pharmaceuticals Anfang 2007 zurückgezogen, nachdem die Zulassungsbehörden der Länder die therapeutische Wirksamkeit von Sativex als nicht hinreichend bewiesen beurteilten.[5] Nach erneuten Anträgen im Jahr 2009 in Großbritannien und Spanien[8] wurde im Juni 2010 in Großbritannien die Zulassung erteilt, es folgten Zulassungen in Tschechien im April, in Deutschland im Mai und in Dänemark im Juni 2011. In Deutschland ist Sativex seit Juli 2011 im Markt. Vorangegangen war im Mai 2011 die Umstufung von Cannabisextrakt als nicht verkehrsfähigem Betäubungsmittel (Anlage I des deutschen Betäubungsmittelgesetzes, BtMG) in die Gruppe der verschreibungsfähigen Betäubungsmittel (Anlage III des BtMG; nur als Fertigarzneimittel).
Einzelnachweise
- Statement on a Nonproprietary Name adopted by the USAN Council. (Memento vom 12. Januar 2013 auf WebCite; PDF)
- Fact Sheet Sativex. Health Canada, April 2005.
- Fact Sheet Sativex. Health Canada, August 2007.
- Einträge. In: Studienregister ClinicalTrials.gov, Stand 1. Januar 2011.
- Sativex: Bericht für die Öffentlichkeit. (PDF; 479 kB) Britische Zulassungsbehörde MHRA (englisch)
- Sativex Oromucosal Spray: Summary of Product Characteristics. (Memento vom 19. Mai 2012 im Internet Archive; PDF) gwpharm.com, Fachinformation, Stand Juni 2010 (englisch).
- Sativex Spray zur Anwendung in der Mundhöhle: Fachinformation, Almirall Hermal GmbH, Stand Mai 2011.
- GW Reports Highly Statistically Significant Results in Sativex Pivotal Phase III Study in MS Spasticity. Abgerufen am 14. Juli 2021 (englisch).