Dimethylheptylpyran
Dimethylheptylpyran (DMHP) ist ein synthetisches Analogon von Δ9-Tetrahydrocannabinol (Δ9-THC).
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
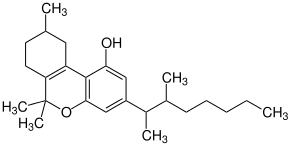 | |||||||||||||
| Gemisch mehrerer Stereoisomerer – vereinfachte Strukturformel ohne Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Dimethylheptylpyran | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C25H38O2 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 370,57 g·mol−1 | ||||||||||||
| Löslichkeit |
In Wasser nahezu unlöslich, löslich in Alkohol und unpolaren Lösungsmitteln[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Pharmakologie
Sowohl DMHP als auch sein Acetat, DMPA erzeugen unterschiedliche Grade an körperlicher und geistiger Beeinträchtigung. Beide Verbindungen rufen orthostatische Hypotonie hervor, und dies bereits in Dosierungen, die weit unter denen liegen, welche leichte geistige Beeinträchtigungen verursachen.[3]
Verglichen mit Δ9-THC vermittelt DMHP eine deutlich stärkere und längere blutdrucksenkende Wirkung, gleichzeitig jedoch eine viel weniger ausgeprägte psychische Wirkung. Die Potenzen von DMHP und DMHPA sind mehr oder weniger ähnlich, das Acetat-Derivat ist jedoch stabiler gegenüber den schädigenden Wirkungen von Licht und Luft.[3]
Es wird vermutet, dass DMHP als CB1-Agonist wirkt.[4]
Sowohl bei Mäusen, Ratten, Kaninchen, Katzen, Hunden als auch bei Affen, denen es intravenös zugeführt wird, verursacht DMHP Ataxie, Mydriasis, Nystagmus und Ptosis.[1]
Die orale Einnahme bei Menschen verursacht Durst, Hypotonie, verschwommene Sicht und ausgeprägten Bewegungsdrang.[1] Nach parenteraler und intravenöser Aufnahme durch den Menschen entfaltet der Stoff ebenfalls seine Wirksamkeit. Die Halbwertzeit im Plasma beträgt bei Ratten und Kaninchen etwa 20 Stunden, beim Menschen 39 Stunden.[1]
Toxizität
Untersuchungen zur akuten Toxizität von DMHP wurden an Mäusen, Ratten, Kaninchen, Katzen, Hunden und Makaken durchgeführt[1], wobei die die mittlere letale Dosis (LD50) im Falle von Mäusen bei 63 mg/kg intravenös lag. Die mittlere Effektive Dosis hingegen liegt bei 0,075 mg/kg, was eine hohe Therapeutische Breite von 840 bedeutet, die damit beispielsweise jene von Fentanyl übertrifft.
In Hunden potenzierten sich jedoch die toxischen Effekte, wenn DMHP gemeinsam mit Kokain, Koffein, D-Amphetamin oder Nalorphin (N-Allylnormorphin, einem schon seit Langem nicht mehr eingesetzten Opioidantagonisten), verabreicht wurde.[1]
Keine Studie zu DMHP offenbarte mutagene, teratogene oder karzinogene Effekte.[1]
Chemie
Die Isomere des DMHP wurden als Acetate isoliert und von ihren Entdeckern Aaron und Ferguson EA 2233-1 bis EA 2233-8 genannt.[1]
An der Luft kommt es rasch zur Autoxidation von DMHP, welches bei Raumtemperatur als schwach-gelbes, viskoses Öl vorliegt, das nicht in Wasser, jedoch in Alkohol und Benzol löslich ist.[1]
Rechtslage
Dimethylheptyltetrahydrocannabinol (DMHP) ist in Deutschland in die Anlage I des Betäubungsmittelgesetzes (BtMG) als ein nicht verkehrsfähiges Betäubungsmittel eingestuft.
Literatur
- National Research Council (U.S.). Committee on Toxicology: Possible Long-term Health Effects of Short-term Exposure to Chemical Agents, National Academy Press, Washington 1984.
Einzelnachweise
- National Research Council (U.S.). Committee on Toxicology: Possible long-term health effects of short-term exposure to chemical agents. National Academy Press, 1982, Washington, D.C., S. 80–94.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. N. Pradhan: Pharmacology of some synthetic tetrahydrocannabinols. In: Neuroscience & Biobehavioral Reviews 8, 1984, S. 369–385, doi:10.1016/0149-7634(84)90058-7.
- L. A. Parker, R. Mechoulam: Cannabinoid agonists and antagonists modulate lithium-induced conditioned gaping in rats. In: Integrative physiological and behavioral science : the official journal of the Pavlovian Society. Band 38, Nummer 2, 2003, S. 133–145, PMID 14527182.