NK-Zelle
NK-Zellen (natürliche Killerzellen) gehören zu den Lymphozyten (Untergruppe der weißen Blutzellen oder Leukozyten). Sie sind in der Lage, abnormale Zellen wie Tumorzellen und virusinfizierte Zellen zu erkennen und abzutöten. NK-Zellen besitzen keine Antigen-spezifischen Rezeptoren und gehören zum angeborenen Immunsystem. Gesunde Menschen haben einen Anteil von 5–15 % NK-Zellen an peripheren mononuklearen Blutzellen.[1]
Die Entwicklung der Zellen
NK-Zellen entwickeln sich wie die anderen Lymphozyten aus lymphatischen Vorläuferzellen im Knochenmark und zirkulieren später im Blutkreislauf. Sie sind größer als T-Lymphozyten und B-Lymphozyten. Zielstrukturen einer NK-Zelle sind virusinfizierte Zellen sowie Krebszellen, die sie über unveränderlich codierte Rezeptoren erkennt.[2]
Ein wichtiger Marker für NK-Zellen ist der Rezeptor CD56. NK-Zellen im Blut werden als CD3-CD56+ definiert. NK-Zellen, die viel CD56 exprimieren (CD56bright), produzieren eher Cytokine, während NK-Zellen, die nur wenig CD56 exprimieren, eher zytotoxische Funktionen ausüben.[3]
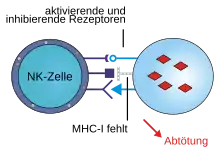
NK-Zellen unterscheiden Tumorzellen und Zellen, die von intrazellulären Mikroorganismen befallen sind, von normalen, körpereigenen Zellen mit Hilfe spezieller Rezeptoren (u. a. KIR-Moleküle, NKG2 mit CD94 und natürliche zytotoxische Rezeptoren), die mit MHC-Klasse-I-Molekülen auf der Oberfläche der Zielzellen interagieren. Tumor- und infizierte Zellen werden normalerweise von den cytotoxischen T-Lymphozyten aufgrund von Fremd-Antigenen, die sie im Komplex mit den MHC-I-Molekülen auf ihrer Oberfläche präsentieren, erkannt und eliminiert. Einige Viren sind in der Lage, die Präsentation von MHC-I-Molekülen auf der Oberfläche ihrer Wirtszellen zu unterdrücken und entgehen so der Zerstörung durch T-Lymphozyten. Die verminderte Expression der MHC-Moleküle auf Tumorzellen und von Mikroorganismen befallenen Zellen wird nun von den NK-Zellen erkannt und führt zur Apoptose der Zielzelle, ein Prinzip, das von dem schwedischen Immunologen Klas Kärre postuliert wurde und als Missing-self-Hypothese bezeichnet wird.
Funktion
NK-Zellen scheinen eine wichtige Rolle an der Schnittstelle zwischen angeborener und erworbener Immunität zu spielen: offensichtlich führt die Interaktion zwischen natürlichen Killerzellen und dendritischen Zellen zu einer Selektion Antigen-präsentierender Zellen und fördert so die Modellierung der erworbenen Immunantwort.[4][5][6]
Erkenntnis aus dem Labor
NK-Zellen müssen nicht aktiviert werden, jedoch kann ihre Aktivität durch Interleukine (IL-2, IL-12) oder Interferone wie IFN-α und IFN-β gesteigert werden, die von Makrophagen sezerniert werden. Nach der Steigerung ihrer Aktivität können sie große Mengen IFN-γ produzieren, welches für die Eindämmung diverser Infektionen relevant ist. Sie können Zellen durch cytotoxische Granula zerstören, die an der Oberfläche der feindlichen Zelle freigesetzt werden, und deren Tod durch Apoptose bewirken. Die Aktivität der NK-Zellen lässt sich labortechnisch durch eine In-vitro-Analyse feststellen (NK-Zell-Aktivitätsanalyse).[7] Kürzlich wurde über den Einsatz spezieller Bioreaktoren berichtet, in denen NK-Zellen in hoher Ausbeute und Reinheit generiert werden können.[8][9][10] Die so unter GMP-Bedingungen erzeugten NK-Zellen zeigten in-vitro eine hohe Zytotoxizität gegenüber Tumorzellen.
Theorie und Praxis
Lange Zeit war nicht genau geklärt, wie NK-Zellen ohne inhibitorische Rezeptoren eine Selbsttoleranz erzeugen. Ein Modell zur Erklärung lieferten Arbeiten, die zeigten, dass es zusätzlich zur NK-Zell-Reifung einen Prozess gibt, den man als „Licensing“ bezeichnet. Bei diesem würden NK-Zellen, die keine inhibitorischen MHC-Klasse-I-Rezeptoren exprimieren, die zum Organismus passen, präsystemisch entweder nicht aktiviert werden (arming model) oder der letzte Aktivierungsschritt würde verhindert werden (disarming model)[11].
Literatur
- Charles A. Janeway jr. u. a.: Immunologie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2002, ISBN 3-8274-1078-9.
- Hans-Gustaf Ljunggren, Klas Kärre: In search of the ‘missing self’: MHC molecules and NK cell recognition. In: Immunology Today. Band 11, 1990, S. 237–244, doi:10.1016/0167-5699(90)90097-S, PMID 2201309.
Weblinks
Einzelnachweise
- Maren Claus, Johann Greil, Carsten Watzl: Comprehensive analysis of NK cell function in whole blood samples. In: Journal of Immunological Methods. Band 341, Nr. 1-2, S. 154–164, doi:10.1016/j.jim.2008.11.006 (elsevier.com [abgerufen am 27. Juli 2017]).
- L. Baggio, Á. M. Laureano, L. M. D. R. Silla, D. A. Lee: Natural killer cell adoptive immunotherapy: Coming of age. In: Clin Immunol. Band 177, Apr 2017, S. 3–11. PMID 26883680.
- Megan A Cooper, Todd A Fehniger, Michael A Caligiuri: The biology of human natural killer-cell subsets. In: Trends in Immunology. Band 22, Nr. 11, S. 633–640, doi:10.1016/s1471-4906(01)02060-9.
- F. Brilot, T. Strowig, C. Munz: NK cells interactions with dendritic cells shape innate and adaptive immunity. In: Frontiers in bioscience : a journal and virtual library. Band 13, 2008, S. 6443–6454, ISSN 1093-4715. PMID 18508671. (Review).
- A. Moretta, E. Marcenaro u. a.: NK cells at the interface between innate and adaptive immunity. In: Cell death and differentiation. Band 15, Nummer 2, Februar 2008, S. 226–233, ISSN 1350-9047. doi:10.1038/sj.cdd.4402170. PMID 17541426. (Review).
- A. Reschner, P. Hubert u. a.: Innate lymphocyte and dendritic cell cross-talk: a key factor in the regulation of the immune response. In: Clinical and Experimental Immunology. Band 152, Nummer 2, Mai 2008, S. 219–226, ISSN 1365-2249. doi:10.1111/j.1365-2249.2008.03624.x. PMID 18336590. PMC 2384094 (freier Volltext). (Review).
- Xavier Michelet, Lydia Dyck u. a.: Metabolic reprogramming of natural killer cells in obesity limits antitumor responses. In: Nature Immunology. Bandf 19, 2018, S. 1330, doi:10.1038/s41590-018-0251-7.
- Y. Meng, J. Sun, T. Hu, Y. Ma, T. Du, C. Kong, G. Zhang, T. Yu, H. Piao: Rapid expansion in the WAVE bioreactor of clinical scale cells for tumor immunotherapy. In: Hum Vaccin Immunother. Band 14, Nr. 10, 2018, S. 2516–2526. PMID 29847223
- K. Bröker, E. Sinelnikov, D. Gustavus, U. Schumacher, R. Pörtner, H. Hoffmeister, S. Lüth, W. Dammermann: Mass Production of Highly Active NK Cells for Cancer Immunotherapy in a GMP Conform Perfusion Bioreactor. In: Front Bioeng Biotechnol. Band 7, 13. Aug 2019, S. 194. PMID 31457007
- Aktueller Zeitschriften-Bericht (aufgerufen am 31. Oktober 2020)
- Sungjin Kim u. a.: Licensing of natural killer cells by host major histocompatibility complex class I molecules. In: Nature. Band 436, Nr. 7051, 4. August 2005, S. 709–713, doi:10.1038/nature03847.