Nicotin
Nicotin, auch Nikotin, ist ein natürlich in den Blättern der Tabakpflanze sowie in geringerer Konzentration auch in anderen Nachtschattengewächsen vorkommendes Alkaloid, das erregende oder lähmende Wirkungen auf Ganglien des vegetativen Nervensystem[8] hat. Selten werden Nicotinderivate als Nicotinoide[9] bezeichnet; meist sind damit die synthetischen, als Insektizide eingesetzten Neonicotinoide[10] gemeint.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Nicotine_Structural_Formula_V1.svg.png.webp) | ||||||||||||||||||||||
| Naturstoff Nicotin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Nicotin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C10H14N2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis bräunliche ölige Flüssigkeit mit tabak- (pyridin-)artigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N07BA01 | |||||||||||||||||||||
| Wirkstoffklasse |
Mittel zur Raucherentwöhnung | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 162,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,01 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
246 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
leicht in Wasser, Ethanol, Diethylether und Chloroform, mischbar mit vielen organischen Lösungsmitteln[3] | |||||||||||||||||||||
| Brechungsindex |
1,5282 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,07 ml·m−3 bzw. 0,5 mg·m−3[6] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Nicotin ist als psychoaktiver Wirkstoff von z. B. Zigaretten eine weit verbreitete Volksdroge (siehe Rauchen).
Geschichte
Die Tabakpflanze wurde in Amerika von den Maya spätestens seit dem 10. Jahrhundert rituell konsumiert. Im Jahr 1492 wurde Christoph Columbus bei Ankunft in der neuen Welt getrockneter Tabak präsentiert.[11] Der Botschafter Frankreichs in Portugal, Jean Nicot de Villemain, sandte im Jahr 1560 Samen von Nicotiana tabacum an den französischen König, der ihre medizinische Verwendung förderte.[12] Nicotin wurde unter der Bezeichnung Nicotianin erstmals 1828 durch den Chemiker Karl Ludwig Reimann und den Mediziner Christian Wilhelm Posselt im Rahmen eines Wettbewerbs der Universität Heidelberg isoliert; die Benennung wählten sie nach Jean Nicot. Die chemische Struktur wurde von Adolf Pinner und Richard Wolffenstein aufgeklärt. Im Jahr 1851 wies der belgische Chemiker Jean Servais Stas nach, dass Hippolyte Visart de Bocarmé sein Opfer Gustave Fougnies mit Nicotin vergiftet hatte.
Vorkommen

Natürliches Vorkommen
Nicotin wird vor allem durch verschiedene Arten der Gattung Nicotiana (vor allem Nicotiana tabacum und Nicotiana rustica) und anderer Gattungen der Nachtschattengewächse (beispielsweise Duboisia hopwoodii und Asclepias syriaca)[13] als Sekundärmetabolit in nennenswerter Menge erzeugt. In sehr geringer Konzentration ist Nicotin auch in einigen anderen Arten der Familie und der nahe verwandten Windengewächse nachgewiesen. Außerhalb dieser Familien tritt der Stoff sporadisch in geringerer Konzentration auf, so zum Beispiel in der Gattung Erythroxylum aus der Familie der Rotholzgewächse.[14] Nicotin kommt in geringeren Mengen auch in verschiedenen Nachtschattengewächsen wie Kartoffeln, Tomaten und Auberginen vor.[15] Da Nicotin in der Tabakpflanze fast ausschließlich in der Wurzel gebildet wird, kann nikotinfreier Tabak aus Tabakpflanzen hergestellt werden, die auf Wurzeln von Tomatenpflanzen aufgepfropft wurden.[16]
Nicotingehalt von Tabakprodukten und Substituten
Der Nicotingehalt des Rauchs einer Zigarette beträgt in einer genormten Rauchmaschine gemessen etwa 0,6 bis 2,4 Milligramm, von denen vom Rauchenden 0,9 bis 1,2 mg aufgenommen werden.[17] Der Nicotinanteil in getrocknetem Tabak liegt bei 0,6 bis 2,9 Prozent der Trockenmasse.[11] Hierbei ist jedoch zu beachten, dass die Angabe der Nicotinmenge pro Zigarette nur eine äußerst eingeschränkte Informationsqualität besitzt, da der Gehalt an aufgenommenem Nicotin je nach Art der Inhalation und der Konstruktion der Zigarette variiert. Des Weiteren ist von wesentlicher Bedeutung, dass ein Raucher durch die Umstellung auf nicotinreduzierte Zigaretten nicht zwingend weniger Nicotin pro Tag zu sich nimmt, da viele Raucher an diesen stärker und länger ziehen. Die Zigarette selbst enthält wesentlich mehr Nicotin (circa 12 mg, siehe Abschnitt toxische Wirkung), das beim Rauchen jedoch größtenteils einfach verbrennt, bevor es eingeatmet wird.
Ein typisches Nicotinpflaster gibt über 16 oder 24 Stunden etwa ein Milligramm Nicotin pro Stunde ab.[18]
Das Tabakschnupfen kann zu einer täglichen Nicotinaufnahmemenge ähnlich derjenigen eines starken Rauchers führen (20 bis 60 mg).[19]
Eigenschaften
Konstitutiver Pflanzenwehrstoff
Nicotiana, so die lateinische Bezeichnung für die Gattung der Tabakpflanzen, erzeugen das Nicotin in ihren Wurzeln. Wenn die Pflanze reift, wandert der Stoff in die Blätter und erreicht dort einen Massenanteil von 0,5 bis zu 7,5 Prozent.[20] Das Nicotin dient in den Pflanzenteilen, insbesondere in den Blättern, zur Abwehr von Fressfeinden der Pflanze, sofern der Fressfeind ein Nervensystem mit nicotinischem Acetylcholinrezeptor aufweist. Nicotin und Nicotinoide sind starke Insektizide.[9]
Physikalische Eigenschaften
Reines Nicotin ist bei Zimmertemperatur eine farblose, ölige Flüssigkeit, die sich an der Luft rasch braun färbt. Es ist eine wasserlösliche Base und im Wasserdampf flüchtig.
| Enantiomere von Nicotin | ||
| Name | (S)-Nicotin | (R)-Nicotin |
| Andere Namen | L-Nicotin (−)-Nicotin |
D-Nicotin (+)-Nicotin Pseudonicotin |
| Strukturformel | -Nicotine_Structural_Formula_V1.svg.png.webp) | -Nicotine_Structural_Formula_V1.svg.png.webp) |
| CAS-Nummer | 54-11-5 | 25162-00-9 |
| 22083-74-5 (Isomerengemisch) | ||
| EG-Nummer | 686-240-2 | |
| 623-834-2 (Isomerengemisch) | ||
| ECHA-Infocard | 100.211.968 | |
| 100.152.478 (Isomerengemisch) | ||
| PubChem | 89594 | 157672 |
| 942 (Isomerengemisch) | ||
| Wikidata | Q28086552 | Q27119762 |
| Q12144 (Isomerengemisch) | ||
Chemische Eigenschaften
Die chemische Struktur von Nicotin, die auf zwei verbundenen Ringen aus Pyridin und Pyrrolidin basiert, wurde von Adolf Pinner und Richard Wolffenstein aufgeklärt.[21][22][23] Nicotin besitzt ein stereogenes Zentrum, es ist chiral. In der Natur kommt ausschließlich (S)-Nicotin vor. Natürliches Nicotin liegt am Chiralitätszentrum in der gleichen Konfiguration vor wie L-Prolin. Das Enantiomer (R)-Nicotin hat keine pathophysiologische Bedeutung. Wenn in diesem Artikel der Begriff ‚Nicotin‘ gebraucht wird, ist stets (S)-Nicotin gemeint.
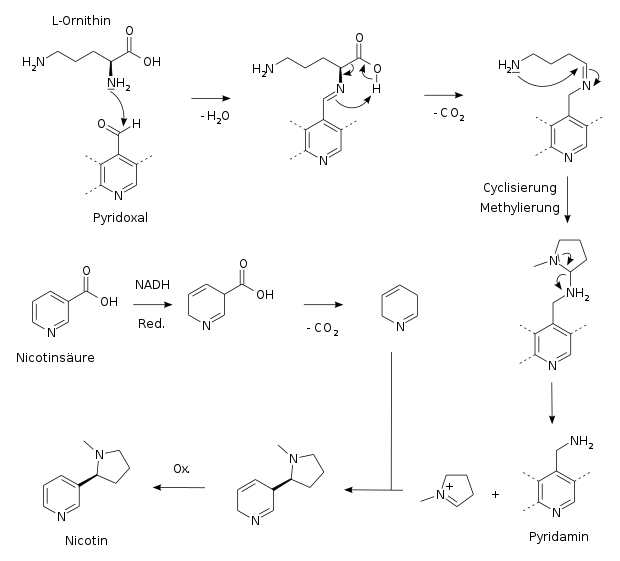
Biosynthese
In Tabakpflanzen wird Nicotin, ausgehend von Nicotinsäure und L-Ornithin, in folgenden Schritten synthetisiert:[24][25]
- 1,4-Reduktion des Pyridinrings der Nicotinsäure zu 1,4-Dihydronicotinsäure, unter Verwendung von NADPH als Reduktionsmittel.
- Decarboxylierung der 1,4-Dihydronicotinsäure zu 1,2-Dihydropyridin.
Parallel dazu:
- Bildung von Putrescin aus L-Ornithin.
- Synthese eines N-Methylpyrrolinium-Kations aus Putrescin.
Reaktion zum fertigen Nicotin:
1,4-Dihydronicotinsäure (ein Enamin) reagiert mit dem N-Methylpyrrolinium-Kation (einem Iminium-Ion) über ein Zwischenprodukt und anschließender Reoxidation des Dihydropyridinrings mit NADP+ zu Nicotin.
Analytik
Die zuverlässige qualitative und quantitative Bestimmung von Nicotin in den verschiedenen Untersuchungsmaterialien gelingt nach angemessener Probenvorbereitung durch die Kopplung der Gaschromatographie oder HPLC mit der Massenspektrometrie.[26][27][28][29] Auch die Headspace-Technik findet in besonderen Fällen Verwendung.[30]
Biochemische Bedeutung und Wirkung
Die Resorption von Nicotin erfolgt abhängig vom pH-Wert unterschiedlich. Zigarrentabak wird aus Blättern gewonnen, die im nicht ganz reifen Zustand geerntet werden. Dies hat zur Folge, dass während Trocknung und Fermentation die Kohlenhydrate im Blatt weitgehend abgebaut werden, sodass im Rauch vornehmlich basische Proteinspaltprodukte vorliegen. Der Rauch von Zigarren weist daher meist einen pH-Wert von 8,0–8,6 auf.[31] Im Zigarettentabak dagegen liegt Nicotin teils in protonierter Form salzgebunden vor, mit einem pH-Bereich des Rauchs von 6,3 bis 5,6.[32] Die Aufnahme freien Nicotins aus alkalischem Rauch erfolgt gut über Schleimhäute. Dabei werden etwa 2–5 % des im Tabak enthaltenen Nicotins aufgenommen. Zur vom Raucher beabsichtigten physiologischen Wirkung des Nicotins aus saurem Zigarettenrauch ist aber das Inhalieren erforderlich, wobei etwa 10–20 % des im Hauptstromrauch enthaltenen Nicotins im Körper verbleiben.[33] Dabei kommt es mit einer vergleichsweise hohen Anflutgeschwindigkeit von 10 bis 20 Sekunden nach dem Inhalieren im Gehirn an.[34] Dort wirkt das Nicotin stimulierend auf die nicotinischen Acetylcholinrezeptoren. Dieser Rezeptortyp befindet sich in parasympathischen Ganglien, sympathischen Ganglien, im Nebennierenmark, Zentralnervensystem und an den motorischen Endplatten. Nicotin aktiviert parasympathische Nerven und hemmt sympathische Nerven in ihrer Aktivität. Außerdem fördert Nicotin die Ausschüttung des Hormons Adrenalin sowie der Neurotransmitter Dopamin und Serotonin. In niedrigen Mengen hat Nicotin dadurch einen stimulierenden Effekt. Nicotin beschleunigt kurzfristig und reversibel den Herzschlag und bewirkt eine Verengung v. a. der peripheren Blutgefäße;[35] dadurch kommt es zu Blutdrucksteigerung, zu leichtem Schwitzen (Abnahme des Hautwiderstandes) und infolge der Verengung der peripheren Blutgefäße zu einem Absinken der Hauttemperatur. Zu den zentralen Effekten gehören vor allem die Steigerung der psychomotorischen Leistungsfähigkeit sowie der Aufmerksamkeits- und Gedächtnisleistungen und eine Entspannung bei manchen negativen affektiven Zuständen.[36] Diese Steigerung ist allerdings nur während der Wirkdauer. Durch die Nicotinzufuhr verringert sich der Appetit. Es kommt zu einer Steigerung der Magensaftproduktion durch Ausschüttung von Histamin und zu einer erhöhten Darmtätigkeit. Außerdem ist auch eine antidiuretische Wirkung des Nicotins bekannt. Über die Wirkungen des Nicotins und die Ausschüttung von Dopamin wird eine Verstärkung des Konsumverhaltens ausgelöst,[37] die in einer Nicotinabhängigkeit resultieren kann. Entzugserscheinungen wie Reizbarkeit oder dysphorische Stimmungen können bis zu 72 Stunden andauern.[38] In gesunden Zellen aktiviert Nicotin die Proteinkinase B, die den Metabolismus, das Wachstum und das Absterben von Zellen kontrolliert. Dadurch wird die Überlebensfähigkeit der Zellen erhöht.
Nicotin befindet sich nicht auf der Dopingliste, obwohl es die Ausdauer verlängert.[39]
Nach den Kriterien einer Längsstudie kamen Tabakindustrie-affine Studien eher zu dem Ergebnis, Nicotin habe einen günstigen, sowie protektiven Einfluss auf eine Alzheimererkrankung, die anderen Publikationen hingegen nicht und weisen es als Risikofaktor aus.[40] In weiteren Studien wird dagegen auch eine positive Wirkung von Nicotin in Bezug auf Entstehung und Therapie der Erkrankung dokumentiert.[41] Der Konsum von Nicotin ist mit einer geringeren Erkrankungswahrscheinlichkeit für Morbus Parkinson assoziiert.[42] Bei Albino-Laborratten konnte eine schädliche Wirkung auf Embryonen während der Schwangerschaft durch ein Nikotinsalz (Nikotin-bi-tartrat) nachgewiesen werden, die sich epigenetisch in der nächsten und übernächsten Generation als Asthma manifestierte. Ob ein solcher Effekt beim Menschen besteht, ist unbekannt.[43] Nicotin und manche Metaboliten werden zur Behandlung von Morbus Parkinson,[44] und Depressionen bei Nichtrauchern untersucht.[45]
Pharmakokinetik und pharmakokinetische Interaktionen
Die Plasmahalbwertszeit von Nicotin beträgt 1–2 Stunden. 10 % des Nikotins werden unverändert über die Nieren ausgeschieden. Der Rest wird überwiegend durch CYP2A6 zu Cotinin metabolisiert, das mit deutlich längerer Plasmahalbwertszeit teils ausgeschieden, teils weiter metabolisiert wird.[46]
Polyzyklische aromatische Kohlenhydrate im Zigarettenrauch und Tabakteer induzieren die Aktivität des Zytochroms CYP1A2 sowie von CYP2B6, wodurch der Abbau von CYP1A2-Substraten beschleunigt verläuft. CYP1A2 ist am oxidativen Metabolismus einer Reihe von Arzneistoffen und Umwelttoxinen beteiligt und beschleunigt deren Abbau, sodass in Folge therapeutisch erwünschte Plasmaspiegel von Pharmaka nicht erreicht oder gehalten werden können. Unter anderem trifft dies auf einige Psychopharmaka und Antidepressiva zu. Da dieser Effekt nicht auf Nicotin zurückzuführen ist, wird er durch eine Nicotinersatzbehandlung nicht beeinflusst.[47] Nicotin wird im Körper zu Cotinin, Nicotin-N′-oxid, Nornicotin, Hydroxynicotin und Anbasein abgebaut.[44]
Andere Toxine, die an Acetylcholinrezeptoren wirken, sind Anatoxin A einiger Cyanobakterien, Coniin des Gefleckten Schierlings, Arecolin der Betelnüsse, Cytisin des Goldregens und Epibatidin der Baumsteigerfrösche.
Toxische Wirkung
Nicotin ist in geringen Dosen in erster Linie ein Stimulans. In mittlerer Dosierung führt es dagegen zu einer entspannenden Wirkung. Das Phänomen des dosisabhängigen Wirkungswechsels wurde als Nesbitt-Paradox beschrieben.[48] Erst in hoher Konzentration ist Nicotin sehr giftig für höhere Tiere, da es in hoher Dosierung die Ganglien des vegetativen Nervensystems blockiert. Nicotin ist der hauptsächlich für das Suchtpotenzial von Tabakgenuss verantwortliche Wirkstoff im Tabak.[49] Akute Überdosierungen sind mit Übelkeit und Erbrechen assoziiert.
In den Nieren steigt der Blutdruck unter Nicotineinwirkung, begleitet von einer geminderten glomerulären Filtrationsrate und geminderter lokaler Strömung von Blutplasma.[50] Bei Heranwachsenden kann Nicotin zu Veränderungen in der Entwicklung des Nucleus accumbens, des mittleren präfrontalen Cortex, der basolateralen Amygdala, des bed nucleus der stria terminalis und des Gyrus dentatus führen.[51]
Die Geschwindigkeit der Nicotinaufnahme über die menschliche Haut ist generell langsam und vom Lösungsmittel abhängig. Die reine Base (100 % Nicotin) wird extrem langsam mit einer Rate von 82 µg/cm² pro Stunde aufgenommen, d. h. wenn man auf 10 cm² Haut reines Nicotin aufbringt, nimmt man 0,8 mg pro Stunde auf (das entspricht etwa dem Rauchen einer halben Zigarette). Bei Applikation einer 20-prozentigen Lösung von Nicotin in einer alkoholischen Lösung auf 10 cm², liegt die Aufnahme bei 0,1 mg Nicotin pro Stunde. In verdünnter wässriger Lösung (20-prozentig) ist die Nicotinaufnahme mit 8,8 mg pro Stunde deutlich schneller.[52]
Lange Zeit galt die Annahme, bereits beim Verschlucken von 60 mg Nicotin bestünde für einen Erwachsenen Lebensgefahr. Diese Annahme beruhte auf den Forschungsergebnissen des Toxikologen und Pharmakologen Rudolf Kobert. Im Jahr 1906 veröffentlichte er das Lehrbuch der Intoxikationen, in dem er sich auf experimentelle Ergebnisse von 2 bis 4 mg stützte und daraus ableitete, dass die maximale tödliche orale Nicotindosis nicht höher als 60 mg sein könnte. Kobert führte seine Erhebungen zurück auf Selbstversuche des österreichischen Arztes Karl Damian von Schroff aus dem Jahr 1856. 2014 korrigierte der Pharmakologe Bernd Mayer von der Karl-Franzens-Universität in Graz den Wert auf über 500 mg.[53]
Im Fall von durch Kinder verschluckten Zigaretten hat eine amerikanische 4-Jahres-Studie mit 700 analysierten Fällen gezeigt, dass der Krankheitsverlauf beim Verschlucken von bis zu zwei Zigaretten immer leicht war.[54] Das Schweizerische Toxikologische Informationszentrum empfiehlt daher bei Kindern eine ärztliche Konsultation erst, wenn mehr als zwei Zigaretten verschluckt worden sind oder Vergiftungssymptome (wie Erbrechen, Hautrötungen, Blässe, Unruhe) auftreten.[55] Teilweise wird aber auch schon bei geringeren Mengen eine ärztliche Konsultation als zwingend angesehen.[56]
Auf der Verpackung einer Zigarettenschachtel dürfen keine Angaben mehr zu Nikotin- und Teergehalt gemacht werden, da sich diese Angaben als irreführend herausgestellt haben. Der Verbraucher könne zu der Annahme gelangen, seine getroffene Wahl sei im Vergleich gesünder. Die Packungen sind strenger Vorgabe gemäß mit bereitgestellten Warnhinweisen zu versehen. Die Obergrenzen für die durch den Rauch zugeführte Nikotinmenge ist auf 1 Milligramm, die Teermenge auf 10 Milligramm sowie die CO-Menge auf 10 Milligramm pro Zigarette durch die EU-Richtlinie 2014/40 begrenzt.[57] Der Tabak einer Zigarette enthält im Durchschnitt etwa 12 Milligramm Nicotin.
Auf Vorschlag der niederländischen Chemikalienbehörde wurde 2015 die chemikalienrechtliche Einstufung von Nicotin überprüft. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) änderte am 10. September 2015 die Einstufung für Nicotin wie folgt: Sowohl oral, als auch dermal und inhalativ erfolgt die Einstufung in die Kategorie Akute Toxizität 2, die Warnhinweise werden erweitert auf H300, H310 und H330 (Lebensgefahr bei Verschlucken, Hautkontakt und Einatmen) sowie H411 (Aquatisch Chronisch 2).[58] Diese Einstufung des RAC wurde anschließend von der EU-Kommission in geltendes Recht umgesetzt, das seit dem 1. Mai 2020[59] von Unternehmen und Behörden berücksichtigt werden muss.
Karzinogene Wirkung
Nicotin steht nicht auf der Liste karzinogener Substanzen der Internationalen Agentur für Krebsforschung der Weltgesundheitsorganisation.[60]
Krebsbegünstigende Wirkung
In der US-Fachzeitschrift Journal of Clinical Investigation wurde berichtet, dass Nicotin im Rahmen einer Chemotherapie die Fähigkeit des Körpers blockiert, Zellen mit beschädigtem Erbmaterial zu zerstören. Derartige Zellen müssen aber gerade bei einer solchen Therapie vom Körper möglichst schnell abgebaut werden, weil sich sonst die bereits im Körper befindlichen Krebsgeschwulste weniger gehindert weitervermehren.[61][62] In gesunden Zellen aktiviert Nicotin die Proteinkinase B. Dadurch wird die Überlebensfähigkeit der Zellen erhöht, was prinzipiell günstig, aber schädlich ist, falls diese später einmal zu Krebszellen mutieren.[63] Darüber hinaus wurde berichtet, dass Nicotin die Bildung neuer Blutgefäße (Angiogenese) fördert und dadurch auch etwaige vorhandene Krebsgeschwulste besser mit Nährstoffen versorgt werden und schneller wachsen können.[64]
Abhängigkeitspotenzial
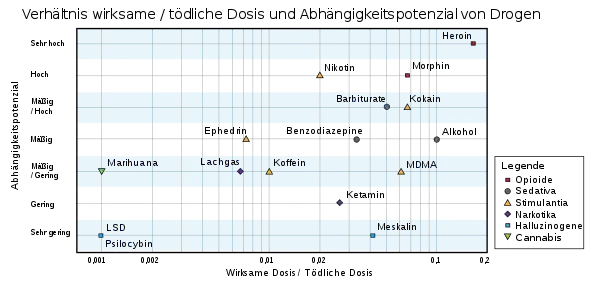
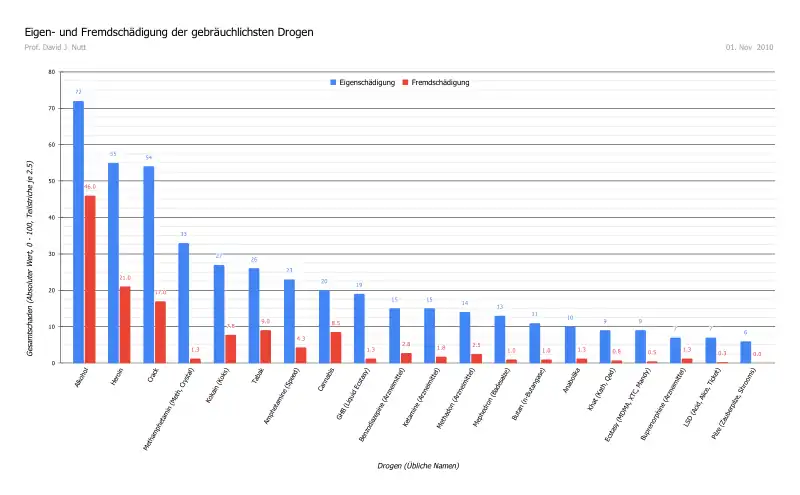
Nicotin ist hauptsächlich mitverantwortlich für die Abhängigkeit von Tabakerzeugnissen.[68] Die Suchtwirkung des Nicotins wird durch im Tabakrauch enthaltene Monoaminooxidase-Hemmer verstärkt.[69] Vergleiche von Tierstudien und Studien über menschlichen Drogenkonsum zeigen auf, dass pures Nicotin nur wenig, Tabakzigarettenrauch ein sehr hohes Suchtpotenzial aufweist.[70][71][72] Lewin verweist in Phantastica schon 1924 auf diesen Umstand.[73] Nicotin hat in Verbindung mit anderen Stoffen im Tabakrauch ein extrem hohes Abhängigkeitspotenzial und kann sehr schnell zu einem abhängigen Verhalten führen.[74] Laut einem im Jahr 2007 veröffentlichten Papier von David Nutt u. a. liegt das Abhängigkeitspotenzial von Tabakrauch zwischen Alkohol und Kokain. Genauer gesagt, liegt das physische Abhängigkeitspotenzial bei dem von Alkohol bzw. Barbituraten und das psychische Abhängigkeitspotenzial bei dem von Kokain.[75] Ein Vergleich mit der Sucht nach Opiaten wie Heroin ist nicht angezeigt, weil diese weitaus komplizierter zu behandeln ist und die Entzugserscheinungen schwerwiegender sind. Es reichen wenige Zigaretten oder wenige Tage mit kleinem Zigarettenkonsum bis zum Eintritt der körperlichen Abhängigkeit. Das Abhängigkeitspotenzial von oral aufgenommenem Nicotin ist deutlich geringer, Pflaster haben fast kein Abhängigkeitspotenzial.[76]
Zusammenhang mit Gebrauch anderer Substanzen
In Tierversuchen kann relativ einfach festgestellt werden, ob der Konsum einer Substanz die spätere Attraktivität einer anderen Substanz erhöht. Bei Menschen, wo derartige direkte Experimente nicht möglich sind, kann jedoch in Längsschnittstudien untersucht werden, ob die Wahrscheinlichkeit des Gebrauchs einer Substanz mit dem früheren Gebrauch von anderen Substanzen in Beziehung steht.
Bei Mäusen erhöhte Nicotin die Wahrscheinlichkeit von späterem Konsum von Kokain, und die Experimente ließen konkrete Schlüsse zu auf die zugrunde liegenden molekularbiologischen Veränderung im Gehirn.[77] Die biologische Prägung bei Mäusen entsprach somit den epidemiologischen Beobachtungen, dass Nicotin-Konsum beim Menschen gekoppelt ist an eine später erhöhte Wahrscheinlichkeit von Cannabis- und Kokain-Gebrauch.[78]
Bei Ratten erhöhte eine ethanolische Cannabislösung die spätere Selbstverabreichung eines Nicotinsalzes in Folgeexperimenten.[79] Eine Studie über den Drogengebrauch von ca. 14.500 Schülern der 12. Klasse zeigte, dass Alkoholkonsum mit einer erhöhten Wahrscheinlichkeit für den späteren Gebrauch von Tabak, Cannabis sowie anderen illegalen Substanzen verbunden war.[80]
Verwendung
Medizinische Verwendung
Nicotin wird in der Raucherentwöhnungstherapie in Form von Pflastern, Sprays oder Kaugummis verwendet.[81] Das zugeführte Nicotin reduziert dabei die Entzugssymptome bei Rauchverzicht; viele der durch den Tabakrauch entstehenden Risiken werden durch reines Nicotin vermieden.[82]
Eine Metaanalyse von 103 randomisierten, Placebo-kontrollierten Studien ergab, dass die Rückfallwahrscheinlichkeit bei Rauchern, die ohne Hilfsmittel mit dem Tabakkonsum aufhören, bei 97 Prozent innerhalb von sechs Monaten nach dem Rauchstopp liegt. Bis 2012 ging man davon aus, dass Nicotinersatzpräparate bei korrekter Dosierung und weiterer fachlicher Anleitung die Erfolgschancen um drei Prozent steigern können.[83] Eine neuere Studie von 2012 besagt, dass die Rückfallraten bei denen, die Nicotinersatzpräparate zum Aufhören verwendet haben, genau so hoch war wie derer, die ohne Hilfsmittel aufgehört haben.[84][85]
Ein aktualisiertes Review der Cochrane Collaboration hat im Oktober 2020 der Verwendung nicotinhaltiger elektronischer Zigaretten eine deutliche Überlegenheit gegenüber allen anderen Methoden für einen erfolgreichen Rauchstopp bescheinigt. Das trifft insbesondere auf Nicotinkaugummis und Pflaster zu. Ein noch deutlicherer Vorteil zeigte sich im Vergleich zu verhaltenstherapeutischen Unterstützungsmaßnahmen oder Versuchen, ganz ohne Unterstützung das Rauchen aufzugeben.[86]
Nicotinkaugummis haben üblicherweise einen Nicotingehalt von 2 mg für Raucher mit einem gemäßigten Tabakkonsum oder 4 mg bei starker Abhängigkeit. In Deutschland sind sie nur in Apotheken erhältlich. In der Schweiz sind alle Nicotinentwöhnungsmittel in der Abgabekategorie D, sie sind also in Apotheken und Drogerien erhältlich.
Hinsichtlich konjugierter Impfstoffe mit Nicotin zur Erzeugung von anti-Nicotin-Antikörpern gibt es entsprechende Studien.[87][88] Weiterhin werden Antagonisten des nicotinischen Acetylcholinrezeptors zur Entwöhnung untersucht.[89]
Anwendung im Pflanzenschutz
Reines Nicotin wurde früher im Pflanzenschutz als Pestizid gegen saugende oder beißende Insekten (unter anderem Blattläuse) eingesetzt. Für Pflanzen ist der Stoff gut verträglich und zudem biologisch gut abbaubar. Aufgrund der lange aufrechterhaltenen falschen Angabe zur hohen Toxizität besteht für Nicotin jedoch seit den 1970er Jahren ein Anwendungsverbot. Synthetisch hergestellte Insektizide auf Basis von Organophosphaten wie beispielsweise E605 wurden als Ersatz verwendet. Andere natürliche Nicotinoide und synthetische Neonicotinoide werden als Insektizide vor allem für die kommerzielle Anwendung entwickelt.[9][90]
Anwendung in der E-Zigarette
Nicotin findet ebenfalls als optionaler Bestandteil Anwendung als Genussmittel in der E-Zigarette.
Handelsnamen
Nicopatch (A), Nicorette (D, A, CH), Nicotinell (D, A, CH), Nicotrol (A), Nikaloz (A), Nikofrenon (D), NiQuitin (D, A)
Literatur
Weblinks
Einzelnachweise
- Eintrag zu Nikotin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- A. C. Moffat (Hrsg.): Clarke’s Isolation and Identification of Drugs. 2. Auflage. The Pharmaceutical Press, London 1986, ISBN 0-85369-166-5, S. 807–808.
- Eintrag zu Nicotin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. April 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-386.
- Eintrag zu Nicotine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 54-11-5 bzw. Nikotin), abgerufen am 28. August 2020.
- Eintrag zu Nicotine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 28. August 2020.
- Doris Schwarzmann-Schafhauser: Nikotin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1053.
- Izuru Yamamoto, John E. Casida (Hrsg.): Nicotinoid insecticides and the nicotinic acetylcholine receptor. Springer, 1999.
- Eintrag zu Neonicotinoide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. September 2013.
- Dietrich Hoffmann, Ilse Hoffmann: Chemistry and Toxicology. (PDF; 454 kB). In: Smoking and Tobacco Control Monograph No. 9 – Cigars: Health Effects and Trends. Kapitel 3, National Cancer Institute, 1998.
- H. P Rang u. a.: Rang and Dale’s Pharmacology. 6. Auflage. Elsevier, 2007, ISBN 978-0-7020-4074-0, S. 598.
- Robert L. Metcalf: Insect Control. In: Ullmann's Encyclopedia of Industrial Chemistry. 7. Auflage. Wiley 2007, S. 9.
- Eckart Eich: Ornithine-Derived Alkaloids. In: Solanaceae and Convolvulaceae: Secondary Metabolites – Biosynthesis, Chemotaxonomy, Biological and Economical Significance (A Handbook). Springer Verlag, 2008, ISBN 978-3-540-74540-2, S. 33–188.
- The Nicotine Content of Common Vegetables. In: The New England Journal of Medicine. Band 329, August 1993, S. 437, doi:10.1056/NEJM199308053290619.
- Rainer Tölle, Gerhard Buchkremer: Zigarettenrauchen: Epidemiologie, Psychologie, Pharmakologie und Therapie. 2. Auflage, Springer, 2013. ISBN 978-3-642-74044-2. S. 45.
- Rainer Tölle, Gerhard Buchkremer: Zigarettenrauchen: Epidemiologie, Psychologie, Pharmakologie und Therapie. 2. Auflage, Springer, 2013. ISBN 978-3-642-74044-2. S. 36.
- Alfred Lichtenschopf: Standards der Tabakentwöhnung: Konsensus der Österreichischen Gesellschaft für Pneumologie – Update 2010. Springer-Verlag, 2012, ISBN 978-3-7091-0979-3, S. 55.
- Zur Wirkung des Schnupftabaks, doi:10.1007/BF01865916.
- Tobacco (leaf tobacco). Transportation Information Service, abgerufen am 13. August 2017.
- A. Pinner, R. Wolffenstein: Ueber Nicotin. In: Berichte der deutschen chemischen Gesellschaft. 24, 1891, S. 61–67, doi:10.1002/cber.18910240108.
- A. Pinner, R. Wolffenstein: Ueber Nicotin. In: Berichte der deutschen chemischen Gesellschaft. 24, 1891, S. 1373–1377, doi:10.1002/cber.189102401242.
- A. Pinner, R. Wolffenstein: Ueber Nicotin. In: Berichte der deutschen chemischen Gesellschaft. 25, 1892, S. 1428–1433, doi:10.1002/cber.189202501214.
- Paul M. Dewick: Medicinal Natural Products: A Biosynthetic Approach. 2. Edition. Wiley-Blackwell, 2001, S. 313.
- Xuewen Wang, Jeffrey L. Bennetzen: Current status and prospects for the study of Nicotiana genomics, genetics, and nicotine biosynthesis genes. In: Molecular Genetics and Genomics. 290, 2015, S. 11, doi:10.1007/s00438-015-0989-7. PMID 25582664.
- M. Iwai, T. Ogawa, H. Hattori, K. Zaitsu, A. Ishii, O. Suzuki, H. Seno: Simple and rapid assay method for simultaneous quantification of urinary nicotine and cotinine using micro-extraction by packed sorbent and gas chromatography-mass spectrometry. In: Nagoya J Med Sci. 75(3-4), Aug 2013, S. 255–261. PMID 24640182.
- K. B. Scheidweiler, D. M. Shakleya, M. A. Huestis: Simultaneous quantification of nicotine, cotinine, trans-3'-hydroxycotinine, norcotinine and mecamylamine in human urine by liquid chromatography-tandem mass spectrometry. In: Clin Chim Acta. 413(11-12), 14. Jun 2012, S. 978–984. PMID 22394455.
- A. Lopes, N. Silva, M. R. Bronze, J. Ferreira, J. Morais: Analysis of cocaine and nicotine metabolites in wastewater by liquid chromatography-tandem mass spectrometry. Cross abuse index patterns on a major community. In: Sci Total Environ. 487, 15. Jul 2014, S. 673–680. PMID 24200094.
- N. Liachenko, A. Boulamery, N. Simon: Nicotine and metabolites determination in human plasma by ultra performance liquid chromatography-tandem mass spectrometry: a simple approach for solving contamination problem and clinical application. In: Fundam Clin Pharmacol. 29(5), Okt 2015, S. 499–509. PMID 26118829.
- C. Müller, F. Vetter, E. Richter, F. Bracher: Determination of caffeine, myosmine, and nicotine in chocolate by headspace solid-phase microextraction coupled with gas chromatography-tandem mass spectrometry. In: J Food Sci. 79(2), Feb 2014, S. T251–T255. PMID 24446916.
- Offermanns S.: Tabakrauch, In: Pharmakologie und Toxikologie. Springer-Lehrbuch (2016), S. 925–929; doi: 10.1007/978-3-662-46689-6_72 Springer, Berlin, Heidelberg; ISBN 978-3-662-46688-9.
- K.D. Brunnemann, D. Hoffmann: The pH of tobacco smoke, Food and Cosmetics Toxicology, Vol. 12, Issue 1, 1974, S. 115–124, doi:10.1016/0015-6264(74)90327-7.
- Aschenbrenner, Stahl: Handbuch des Tabakhandels, 6. Aufl. 1950, Vlg. Oldenburger Verlagshaus, S. 516 f.
- J. Le Houezec: Role of nicotine pharmacokinetics in nicotine addiction and nicotine replacement therapy: a review. In: Int J Tuberc Lung Dis. 7, 2003, S. 811–819. PMID 12971663.
- M. Sabha, J. E. Tanus-Santos, J. C. Toledo, M. Cittadino, J. C. Rocha, H. Moreno: Transdermal nicotine mimics the smoking-induced endothelial dysfunction. In: Clinical Pharmacology and Therapeutics. Band 68, Nr. 2, August 2000, S. 167–174, doi:10.1067/mcp.2000.108851, PMID 10976548.
- F. Scott Hall, Andre Der-Avakian, Thomas J. Gould, Athina Markou, Mohammed Shoaib, Jared W. Young: Negative affective states and cognitive impairments in nicotine dependence. In: Neuroscience & Biobehavioral Reviews. 2015, doi:10.1016/j.neubiorev.2015.06.004. PMID 26054790.
- Sybren F. de Kloet, Huibert D. Mansvelder, Taco J. De Vries: Cholinergic modulation of dopamine pathways through nicotinic acetylcholine receptors. In: Biochemical Pharmacology. 2015, doi:10.1016/j.bcp.2015.07.014. PMID 26208783.
- Otto-Michael Lesch, Henriette Walter: Alkohol und Tabak: Medizinische und Soziologische Aspekte von Gebrauch, Missbrauch und Abhängigkeit. Springer-Verlag, 2009, ISBN 978-3-211-48634-4, S. 144.
- T. Mündel, D. A. Jones: Effect of transdermal nicotine administration on exercise endurance in men. In: Experimental Physiology. Band 91, Nr. 4, Juli 2006, S. 705–713, doi:10.1113/expphysiol.2006.033373, PMID 16627574.
- J. K. Cataldo, J. J. Prochaska, S. A. Glantz: Cigarette smoking is a risk factor for Alzheimer’s Disease: an analysis controlling for tobacco industry affiliation. In: Journal of Alzheimer’s disease: JAD. Band 19, Nummer 2, 2010, S. 465–480, doi:10.3233/JAD-2010-1240. PMID 20110594, PMC 2906761 (freier Volltext).
- M. Mehta, A. Adem, M. S. Kahlon, M. N. Sabbagh: The nicotinic acetylcholine receptor: smoking and Alzheimer’s disease revisited. In: Frontiers in Bioscience. 2012, E4, S. 169–180. PMID 22201862, doi:10.2741/367.
- Maryka Quik, Xiomara A. Perez, Tanuja Bordia: Nicotine as a potential neuroprotective agent for Parkinson’s disease. In: Movement Disorders. 27, 2012, S. 947, doi:10.1002/mds.25028. PMID 22693036. PMC 3685410 (freier Volltext).
- Virender K Rehan, Jie Liu u. a.: Perinatal nicotine exposure induces asthma in second generation offspring. In: BMC Medicine. 10, 2012, S. 129, doi:10.1186/1741-7015-10-129.
- George E. Barreto, Alexander Iarkov, Valentina Echeverria Moran: Beneficial effects of nicotine, cotinine and its metabolites as potential agents for Parkinson's disease. In: Frontiers in Aging Neuroscience. 6, 2015, doi:10.3389/fnagi.2014.00340. PMID 25620929. PMC 4288130 (freier Volltext).
- YS Mineur, MR Picciotto: Nicotine receptors and depression: revisiting and revising the cholinergic hypothesis. In: Trends Pharmacol. Sci. Band 31, Nr. 12, Dezember 2010, S. 580–586, doi:10.1016/j.tips.2010.09.004, PMID 20965579, PMC 2991594 (freier Volltext).
- Offermanns S. "Tabakrauch". In: Pharmakologie und Toxikologie, Springer-Lehrbuch (2016), S. 925-929; doi: 10.1007/978-3-662-46689-6_72 Springer, Berlin, Heidelberg; ISBN 978-3-662-46688-9.
- Niklaus Löffel: "Arzneimittelinteraktionen mit Tabakrauch" In: pharma-kritik, Jahrgang 35, PK915, Online-Artikel, doi:10.37667/pk.2013.915.
- A. C. Parrott: Nesbitt’s Paradox resolved? Stress and arousal modulation during cigarette smoking. In: Addiction. Band 93, Nr. 1, Januar 1998, S. 27–39, doi:10.1046/j.1360-0443.1998.931274.x, PMID 9624709.
- F. Pistillo, F. Clementi, M. Zoli, C. Gotti: Nicotinic, glutamatergic and dopaminergic synaptic transmission and plasticity in the mesocorticolimbic system: focus on nicotine effects. In: Prog Neurobiol. (2015), Band 124, S. 1–27. doi:10.1016/j.pneurobio.2014.10.002. PMID 25447802.
- Gaurav Jain, Edgar A. Jaimes: Nicotine signaling and progression of chronic kidney disease in smokers. In: Biochemical Pharmacology. 86, 2013, S. 1215, doi:10.1016/j.bcp.2013.07.014. PMID 23892062. PMC 3838879 (freier Volltext).
- Robert F. Smith, Craig G. McDonald, Hadley C. Bergstrom, Daniel G. Ehlinger, Jennifer M. Brielmaier: Adolescent nicotine induces persisting changes in development of neural connectivity. In: Neuroscience & Biobehavioral Reviews. 55, 2015, S. 432, doi:10.1016/j.neubiorev.2015.05.019. PMID 26048001.
- S. Zorin u. a.: In Vitro Test of Nicotine’s Permeability through Human Skin. Risk Evaluation and Safety Aspects. (PDF; 194 kB). In: Ann Occup Hyg. 43, 1999, S. 405–413.
- B. Mayer: How much nicotine kills a human? Tracing back the generally accepted lethal dose to dubious self-experiments in the nineteenth century. In: Archives of Toxicology. Band 88, Nummer 1, Januar 2014, S. 5–7, doi:10.1007/s00204-013-1127-0. PMID 24091634. PMC 3880486 (freier Volltext).
- D. McGee, T. Brabson, J. McCarthy, M. Picciotti: Four-year review of cigarette ingestions in children. In: Pediatric Emergency Care. Band 11, Nr. 1, 1995, S. 13–16, doi:10.1097/00006565-199502000-00004.
- Zigaretten für Kleinkinder gefährlich? Schweizerisches Toxikologisches Informationszentrum.
- Häufige Vergiftungen durch Nikotin. (PDF; 41 kB). Gemeinsames GiftInformationszentrum.
- Richtlinie 2014/40/EU des europäischen Parlamentes und des Rates vom 3. April 2014 zur Angleichung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten über die Herstellung, die Aufmachung und den Verkauf von Tabakerzeugnissen und verwandten Erzeugnissen und zur Aufhebung der Richtlinie 2001/37/EG
- RAC Opinion proposing harmonised classification and labeling at EU level of Nicotine. 10. September 2015, abgerufen am 30. Oktober 2015.
- Verordnung (EU) 2018/1480
- Agents Classified by the IARC Monographs, Volumes 1–107. (PDF; 815 kB). abgerufen am 27. Mai 2013.
- Nikotin stoppt Chemotherapie. 3. April 2006, abgerufen am 8. September 2019. wissenschaft.de.
- Piyali Dasgupta, Rebecca Kinkade, Bharat Joshi, Christina DeCook, Eric Haura, Srikumar Chellappan: Nicotine inhibits apoptosis induced by chemotherapeutic drugs by up-regulating XIAP and surviving. In: PNAS. 103, 2006, S. 6332–6337, doi:10.1073/pnas.0509313103.
- Wolfram Parzefall, Manfred Neuberger, Rolf Schulte-Hermann: Die Karzinogene des Tabakrauchs. (PDF; 29 kB). abgerufen am 27. Mai 2013.
- C. Schaal, S. P. Chellappan: Nicotine-Mediated Cell Proliferation and Tumor Progression in Smoking-Related Cancers. In: Molecular Cancer Research. 12, 2014, S. 14, doi:10.1158/1541-7786.MCR-13-0541. PMID 24398389. PMC 3915512 (freier Volltext).
- David J Nutt, Leslie A King, Lawrence D Phillips: Drug harms in the UK: a multicriteria decision analysis. In: The Lancet. 376, 2010, S. 1558–1565, doi:10.1016/S0140-6736(10)61462-6.
- Drug Toxicity. Rober Gable, abgerufen am 14. Dezember 2015.
- R. S. Gable: Acute toxicity of drugs versus regulatory status. In: J. M. Fish (Hrsg.): Drugs and Society: U.S. Public Policy. Rowman & Littlefield Publishers, Lanham, MD 2006, S. 149–162.
- Karl Fagerström: Determinants of Tobacco Use and Renaming the FTND to the Fagerström Test for Cigarette Dependence. In: Nicotine & Tobacco Research. 14, 2012, S. 75–78.
- Anne-Sophie Villégier u. a.: Monoamine Oxidase Inhibitors Allow Locomotor and Rewarding Responses to Nicotine. In: Neuropsychopharmacology. 31, 2006, S. 1704–1713.
- James D. Belluzzi u. a.: Acetaldehyde Enhances Acquisition of Nicotine Self-Administration in Adolescent Rats. In: Neuropsychopharmacology. 30, 2005, S. 705–712.
- J. E. Rose, W. A. Corrigall: Nicotine self-administration in animals and humans: similarities and differences. In: Psychopharmacology. 130, 1997, S. 28–40. PMID 9089846.
- SCENIHR: Fragen zu Tabakzusatzstoffen: Ist die Entwicklung von Nicotinsucht dosisabhängig? (2010), abgerufen am 29. Juli 2013.
- L. Lewin: Phantastica. Die betäubenden und erregenden Genussmittel. 1924, Vlg. Georg Stilke Berlin, S. 334 Fussnote 1.
„Es gibt auch Versuchsreihen, in denen die Gewöhnung vermisst wurde, und auch nach zehn oder Hundert Einspritzungen von Nikotin die gleichen Erscheinungen mit gleicher Stärke und mit dem gleichen Verlauf sich wiederholten.“ - Surgeon General (US): How Tobacco Smoke Causes Disease: The Biology and Behavioral Basis for Smoking-Attributable Disease: A Report of the Surgeon General, Nicotine Addiction: Past and Present. 2010, abgerufen 29. Juli 2013.
- D. Nutt u. a.: Development of a rational scale to assess the harm of drugs of potential misuse. (PDF download via Researchgate; 127 kB) 2007, abgerufen am 2. Juli 2020.
- Harm reduction on nicotin addiction - Helping people who can’t quit. (Memento vom 29. April 2016 im Internet Archive) (PDF; 1,9 MB). A report by the Tobacco Advisory Group of the Royal College of Physicians, Oktober 2007, S. 98–99.
- E. R. Kandel, D. B. Kandel: Shattuck Lecture: A molecular basis for nicotine as a gateway drug. In: The New England Journal of Medicine. Band 371, Nummer 10, September 2014, S. 932–943, doi:10.1056/NEJMsa1405092. PMID 25184865, PMC 4353486 (freier Volltext).
- K. M. Keyes, A. Hamilton, D. B. Kandel: Birth Cohorts Analysis of Adolescent Cigarette Smoking and Subsequent Marijuana and Cocaine Use. In: American Journal of Public Health. [elektronische Veröffentlichung vor dem Druck] April 2016, doi:10.2105/AJPH.2016.303128. PMID 27077359.
- L. V. Panlilio, C. Zanettini, C. Barnes, M. Solinas, S. R. Goldberg: Prior exposure to THC increases the addictive effects of nicotine in rats. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 38, Nummer 7, Juni 2013, S. 1198–1208, doi:10.1038/npp.2013.16. PMID 23314220, PMC 3656362 (freier Volltext).
- T. Kirby, A. E. Barry: Alcohol as a gateway drug: a study of US 12th graders. In: The Journal of school health. Band 82, Nummer 8, August 2012, S. 371–379, doi:10.1111/j.1746-1561.2012.00712.x. PMID 22712674, PDF (abgerufen am 3. Mai 2016).
- Arzneimittelkommission der deutschen Ärzteschaft: Empfehlungen zur Therapie der Tabakabhängigkeit („Raucherentwöhnung“) (PDF), Arzneiverordnung in der Praxis, 2. Auflage, Band 37, Sonderheft 2, November 2010.
- A. Molyneux: Nicotine replacement therapy. In: The BMJ. 2004, Band 328, Nr. 7437, S. 454–456. PMID 14976103, doi:10.1136/bmj.328.7437.454.
- Stead u. a.: Nicotine replacement therapy for smoking cessation. Cochrane Tobacco Addiction Group, 16. Juli 2008, doi:10.1002/14651858.CD000146.pub3.
- Nikotinersatz und andere Medikamente zur Raucherentwöhnung. DKFZ, abgerufen 6. März 2013.
- H. R. Alpert, G. N. Connolly, L. Biener: A prospective cohort study challenging the effectiveness of population-based medical intervention for smoking cessation. In: Tobacco Control. Band 22, Nummer 1, Januar 2013, S. 32–37, doi:10.1136/tobaccocontrol-2011-050129. PMID 22234781.
- Cochrane Deutschland: Cochrane Review zeigt Nutzen von E-Zigaretten für den Rauchstopp, 14. Oktober 2020.
- E. H. Cerny, T. Cerny: Vaccines against nicotine. In: Hum Vaccin. 2009, Band 5(4), S. 200–205. PMID 19276649.
- P. R. Pentel, M. G. LeSage: New directions in nicotine vaccine design and use. In: Adv Pharmacol. Band 69, 2014, S. 553–580. doi:10.1016/B978-0-12-420118-7.00014-7. PMID 24484987; PMC 4047682 (freier Volltext).
- P. A. Crooks, M. T. Bardo, L. P. Dwoskin: Nicotinic receptor antagonists as treatments for nicotine abuse. In: Adv Pharmacol. Band 69, 2014, S. 513–551. doi:10.1016/B978-0-12-420118-7.00013-5. PMID 24484986; PMC 4110698 (freier Volltext).
- Steven R. Sims: Insecticide Compositions And Process. U.S. Patent Application 13/078,641.