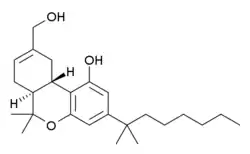
Dexanabinol
Dexanabinol (HU-211) ist ein synthetisches Cannabinoid, welches nicht an CB1- und CB2-Rezeptoren bindet. Es handelt sich um eine Forschungschemikalie, für die zurzeit keine Marktzulassung besteht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dexanabinol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C25H38O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 386,57 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemie
Dexanabinol ist das Enantiomer von HU-210, einem sehr potenten Cannabinoid. Strukturell gesehen ist es das Spiegelbild des Seitenketten-Homologon des THC-Metaboliten 11-Hydroxy-Δ9-tetrahydrocannabinol.
Die ursprüngliche Synthese von HU-211 basiert auf einer säure-katalysierten Kondensation von (+)-Myrtenol und 1,1-Dimethylheptylresorcinol (3,5-Dihydroxy-1-(1,1-dimethylheptyl)benzol).[2]
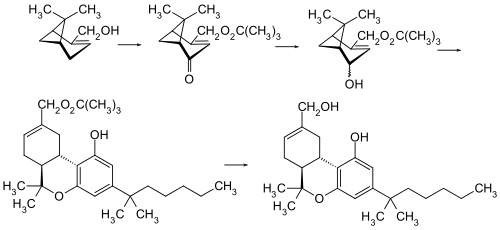
Es wurde in der Arbeitsgruppe von Raphael Mechoulam an der Hebräischen Universität in Jerusalem entwickelt.[3] HU-211 bindet nicht an bekannte Cannabinoid-Rezeptoren, aber an NMDA-Rezeptor-Kanäle und wurde deshalb als potentielles Medikament für Schädel-Hirn-Trauma getestet, war aber in klinischen Studien nicht effektiver als Placebo.[4]
Literatur
- K. Razdan: The Total Synthesis of Cannabinoids. In: John Apsimon (Hrsg.): The Total Synthesis of Natural Products. Wiley Interscience, 1981, ISBN 978-0-471-05460-3, S. 245.
Weblinks
- Material Safety Data Sheet HU-211 (PDF; 19 kB)
- HU-211 als Produkt bei Cayman Chemical
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Januar 2020.
- R. Mechoulam, N. Lander, A. Breuer, J. Zahalka: Synthesis of the Individual, Pharmacologically Distinct, Enantiomers of a Tetrahydrocannabinol Derivative. In: Tetrahedron: Asymmetry, 1990, 5, S. 315–318.
- R Zeltser, Z Seltzer, A Eisen, JJ Feigenbaum, R Mechoulam: Suppression of neuropathic pain behavior in rats by a non-psychotropic synthetic cannabinoid with NMDA receptor-blocking properties. In: Pain. 47, Nr. 1, Oktober 1991, S. 95–103. PMID 1663228.
- AI Maas, G Murray, H Henney et al.: Efficacy and safety of dexanabinol in severe traumatic brain injury: results of a phase III randomised, placebo-controlled, clinical trial. In: The Lancet Neurology. 5, Nr. 1, Januar 2006, S. 38–45. doi:10.1016/S1474-4422(05)70253-2. PMID 16361021.