Immuncheckpoint-Inhibitor
Ein Immuncheckpoint-Inhibitor (auch Immun-Checkpoint-Inhibitor) ist ein Molekül, das einen Immuncheckpoint hemmt.[1] In der Onkologie werden entzündungshemmende Immuncheckpoints blockiert. Diese Moleküle werden immuntherapeutisch genutzt und sind derzeit ausschließlich monoklonale Antikörper.[2][3]
Eigenschaften
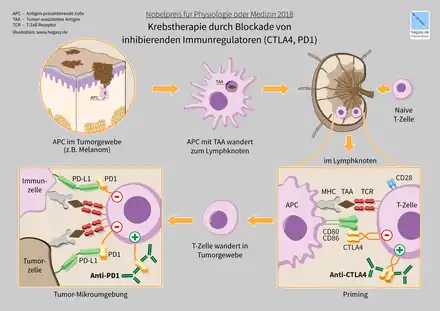
Das Immunsystem verfügt über sowohl kostimulatorische (aktivierende) als auch inhibitorische (hemmende) Signalwege. Diese Regelmechanismen beeinflussen die Stärke und Intensität einer Immunantwort. Im Normalfall dienen diese Mechanismen u. a. der Vermeidung von Autoimmunreaktionen. Jene Signalwege mit hemmender Wirkung werden als co-inhibitorische Immuncheckpoint bezeichnet und bewirken ein Herabregulieren der T-Zell-Aktivierung oder der T-Zell-Effektorfunktion.[1] Die Immuncheckpoints mit entzündungsfördernder Wirkung werden als co-stimulatorische Immuncheckpoints bezeichnet.[1]
Behandlung von Malignomen mit Immuncheckpoint-Inhibitoren
In Bezug auf Tumorerkrankungen ist bekannt, dass Tumorzellen sich dieser Immuncheckpoints bedienen können, um der Erkennung durch das Immunsystem zu entkommen (Immunevasion).[4] Dieses immunsuppressive Milieu mancher Tumoren wird durch die Produktion von hemmenden Zytokinen, die Rekrutierung von immunsuppressiven Immunzellen und die Hochregulation von koinhibitorischen Rezeptoren, den negativ regulierenden Immuncheckpoints, erzeugt. Dieses Wissen führte zur Entwicklung von Checkpointinhibitoren, die durch Unterbrechung einer Rezeptor-Liganden-Bindung immunsupprimierende Signale „abschalten“. Auf diese Weise kann das Immunsystem des Organismus die entarteten Krebszellen erkennen und bekämpfen.
Die Behandlung mit Checkpoint-Inhibitoren hat die Onkologie in den letzten Jahren revolutioniert.[5] Metastasierte Tumoren, wie das Melanom, dessen Verlauf bisher wenig beeinflusst werden konnte, wurden behandelbar. Bei anderen Tumoren, wie dem NSCLC (nicht kleinzelliges Bronchialkarzinom), konnte eine Behandlung mit Checkpoint-Inhibitoren eine nebenwirkungsreiche Chemotherapie ersetzen und zum Teil übertreffen. Allerdings können Checkpoint-Inhibitor auch erhebliche Nebenwirkungen aufweisen.[6] Durch das teilweise Ausschalten der „Freund-Feind-Erkennung“ von Killerzellen kann es zu lebensbedrohlichen Autoaggressionserkrankungen z. B. der Lunge, der Leber oder der Nieren kommen. Es laufen seit Beginn der 2010-Jahre zahlreiche Studien zur Behandlung mit Checkpoint-Inhibitoren.[7] Daher kann sich die Wirksamkeitsevidenz und der Zulassungsstatus der Präparate kurzfristig ändern. Folgende Medikamente werden angewendet oder getestet:[8]
| Wirkung | Pharmakon | Handelsname | Hersteller | Malignome |
|---|---|---|---|---|
| CTLA-4-Inhibitor | Ipilimumab | Yervoy | Bristol-Myers Squibb | Melanom, Nierenzellkarzinom[9] |
| Tremelimumab | noch nicht zugelassen | Medimmune (Astra Zeneca) | Testung bei diversen Entitäten[10] | |
| PD-1-Antikörper | Nivolumab | Opdivo | Bristol-Myers Squibb | malignes Melanom, NSCLC, Nierenzellkarzinom, Hodgkin-Lymphom, Leberzellkarzinom, HNO-Plattenepithelkarzinom, Urothelkarzinom, Kolorektales Karzinom |
| Pembrolizumab | Keytruda | Merck Sharp & Dohme | malignes Melanom, NSCLC, Nierenzellkarzinom, Hodgkin-Lymphom, HNO-Plattenepithelkarzinom, Urothelkarzinom | |
| Cemiplimab | Libtayo | Sanofi/Regeneron | Metastasiertes oder lokal fortgeschrittenes Plattenepithelkarzinom der Haut[11] | |
| Spartalizumab | noch nicht zugelassen | Novartis | Metastasiertes Melanom[12] | |
| PD-L1-Antikörper | Atezolizumab | Tecentriq | Roche | NSCLC, SCLC, Nierenzellkarzinom, Urothelkarzinom, Mammakarzinom |
| Durvalumab | Imfinzi | Astra Zeneca | Urothelkarzinom, NSCLC | |
| Avelumab | Bavencio | Merck KGaA | Urothelkarzinom, Merkelzellkarzinom |
Die in der Tabelle aufgezählten Tumoren wurden erfolgreich getestet. Das bedeutet aber nicht, dass sie bei allen Fällen wirksam sind und eine Zulassung besteht. Letzteres kann in den Artikeln der einzelnen Präparate nachgelesen werden.
Immuncheckpoint-Inhibitoren sind z. B. Antikörper gegen CTLA-4 (Ipilimumab), PD-1 (Nivolumab) und PD-L1 (Atezolizumab, Durvalumab und Avelumab).[13][14][15] Nach einer Infusion des Antikörpers erfolgt die Bindung des Antikörpers an diese als Immuncheckpoint wirkenden Proteine. Dadurch werden die Zellen, welche eines dieser Proteine auf der Zelloberfläche tragen und den Antikörper binden, vorübergehend (bzw. solange der therapeutische Antikörper im Körper zirkuliert) durch Immunzellen angegriffen und durch Makrophagen aus dem Körper entfernt (temporäre Zelldepletion). Diese Vorgänge führen zu einer Verstärkung der Immunantwort gegen den Tumor, so dass dessen Strategie der Immunevasion entgegengewirkt wird. Daher werden Immuncheckpoint-Inhibitoren im Rahmen der Krebsimmuntherapie verwendet,[16] darunter auch in Kombination mit Krebsimpfstoffen.[17]
Der PD-L1-Antikörper Avelumab wurde in Kombination mit dem VEGF-Inhibitor Axitinib bei fortgeschrittenen Nierenzellkarzinomen in der JAVELIN-Renal-101-Studie, einer randomisierten Phase-III-Studie, mit dem Tyrosinkinase-Inhibitor Sunitinib verglichen. Dabei konnte mit Avelumab und Axitinib ein signifikant längeres rezidivfreies Überleben erzielt werden. Bei Patienten mit PD-L1-positiven Tumoren betrug das mediane rezidivfreie Überleben 13,8 Monate mit Avelumab und Axitinib und 7,2 Monate mit Sunitinib. Selbst unter Einbeziehung der PD-L1-negativen Tumorfälle wurden gleich gute Ergebnisse erzielt.[18]
Gegen diese immunreaktionsmindernden Moleküle wurden therapeutische monoklonale Antikörper (zunächst der anti-CTLA-4-Antikörper Ipilimumab und dann die anti-PD-1-Antikörper Nivolumab und Pembrolizumab) entwickelt und zunächst in Studien zum metastasierten malignen Melanom evaluiert.[19] Die Behandlung mit diesen Antikörpern zeigte eine im Vergleich zu den üblichen Therapien nicht beobachtete klinische Wirkung und auch ein differentes, durch Autoimmunphänomene charakterisiertes Nebenwirkungsprofil.[20][21]
Nobelpreis für die Entdeckung von Immuncheckpoints
Im Jahr 2018 erhielten James Patrick Allison und Tasuku Honjo den Nobelpreis für Physiologie oder Medizin. Allison und seine Arbeitsgruppe an der University of California, Berkeley, entdeckten CTLA-4 und stellten fest, dass dieses Protein die Immunantwort abschwächte.[22] An einem Mausmodell konnte Allison zeigen, dass dieser Mechanismus sich für die Krebsbekämpfung nutzbar machen ließ.[23] Tasuku Honjo hat mit seiner Arbeitsgruppe entdeckt, dass PD-1 dämpfend auf die Immunantwort wirkt.[24] Auf der Grundlage dieser Forschungen konnten eine Reihe von wirksamen Medikamenten in der Krebsbehandlung entwickelt werden. Honjo erkannte, dass auch bei Autoimmunerkrankungen, Allergien und einer Transplantatabstoßung eine Dämpfung der Immunreaktion nützlich sein könnte.[25]
Anwendungen
Immuncheckpoint-Inhibitoren werden derzeit bei der Behandlung von Melanomen[26], nicht-kleinzelligen Lungenkarzinomen[27][28][29] und klarzelligen Nierenzellkarzinomen[30] und Plattenepithelkarzinomen[31] eingesetzt.
Literatur
- Patrick Terheyden, Angela Krackhardt, Thomas Eigentler: Systemtherapie des Melanoms. Einsatz von Immuncheckpoint-Inhibitoren und Hemmung von intrazellulärer Signaltransduktion. In: Deutsches Ärzteblatt. Band 116, Heft 29 f., (22. Juli) 2019, S. 497–504.
Einzelnachweise
- S. Ceeraz, E. C. Nowak, C. M. Burns, R. J. Noelle: Immune checkpoint receptors in regulating immune reactivity in rheumatic disease. In: Arthritis research & therapy. Band 16, Nummer 5, 2014, S. 469. PMID 25606596, PMC 4289356 (freier Volltext).
- DocCheck Medical Services GmbH: Checkpoint-Inhibitor. Abgerufen am 2. Juni 2019.
- Immun-Checkpoint-Inhibitoren - Altmeyers Enzyklopädie - Fachbereich Dermatologie. 18. April 2018, abgerufen am 2. Juni 2019.
- Krebsinformationsdienst, Deutsches Krebsforschungszentrum: PD-1-Inhibitoren: Immuntherapie gegen Krebs. Abgerufen am 2. Juni 2019.
- Ausgabe 02 / 2017. Abgerufen am 2. Juni 2019.
- „Ein komplett neuer Ansatz in der Krebstherapie“. Abgerufen am 2. Juni 2019.
- Avoxa-Mediengruppe Deutscher Apotheker GmbH: Checkpoint-Inhibitoren: Immuntherapie gegen Krebs. Abgerufen am 2. Juni 2019.
- Checkpoint-Inhibitoren • ARZNEI-NEWS.de. Abgerufen am 2. Juni 2019.
- Robert J. Motzer, Nizar M. Tannir, David F. McDermott, Osvaldo Arén Frontera, Bohuslav Melichar: Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. In: New England Journal of Medicine. Band 378, Nr. 14, 5. April 2018, ISSN 0028-4793, S. 1277–1290, doi:10.1056/NEJMoa1712126, PMID 29562145, PMC 5972549 (freier Volltext) – (nejm.org [abgerufen am 11. Mai 2019]).
- Pipeline - AstraZeneca. Abgerufen am 15. August 2019 (englisch).
- Annette Mende: Der dritte PD-1-Inhibitor. In: Pharmazeutische Zeitung. 4. September 2019, abgerufen am 8. November 2019.
- Dr. Frank Antwerpes: Spartalizumab. DocCheck Flexikon, abgerufen am 8. November 2019.
- K. Shih, H. T. Arkenau, J. R. Infante: Clinical impact of checkpoint inhibitors as novel cancer therapies. In: Drugs. Band 74, Nummer 17, November 2014, S. 1993–2013, doi:10.1007/s40265-014-0305-6. PMID 25344022, PMC 4224737 (freier Volltext).
- A. Ito, S. Kondo, K. Tada, S. Kitano: Clinical Development of Immune Checkpoint Inhibitors. In: BioMed research international. Band 2015, S. 605478, doi:10.1155/2015/605478. PMID 26161407, PMC 4486755 (freier Volltext).
- M. K. Callahan, M. A. Postow, J. D. Wolchok: Targeting T Cell Co-receptors for Cancer Therapy. In: Immunity. Band 44, Nummer 5, Mai 2016, S. 1069–1078, doi:10.1016/j.immuni.2016.04.023. PMID 27192570.
- K. R. Rajani, R. G. Vile: Harnessing the Power of Onco-Immunotherapy with Checkpoint Inhibitors. In: Viruses. Band 7, Nummer 11, 2015, S. 5889–5901, doi:10.3390/v7112914. PMID 26580645.
- J. Kleponis, R. Skelton, L. Zheng: Fueling the engine and releasing the break: combinational therapy of cancer vaccines and immune checkpoint inhibitors. In: Cancer biology & medicine. Band 12, Nummer 3, September 2015, S. 201–208, doi:10.7497/j.issn.2095-3941.2015.0046. PMID 26487965, PMC 4607816 (freier Volltext).
- Robert J Motzer, Konstantin Penkov, John Haanen, Brian Rini, Laurence Albiges: Avelumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. In: New England Journal of Medicine. Band 380, Nr. 12, 21. März 2019, ISSN 0028-4793, S. 1103–1115, doi:10.1056/NEJMoa1816047 (nejm.org [abgerufen am 26. März 2019]).
- I. Márquez-Rodas, P. Cerezuela, A. Soria, A. Berrocal, A. Riso, M. González-Cao, S. Martín-Algarra: Immune checkpoint inhibitors: therapeutic advances in melanoma. In: Annals of translational medicine. Band 3, Nummer 18, Oktober 2015, S. 267, doi:10.3978/j.issn.2305-5839.2015.10.27. PMID 26605313, PMC 4630549 (freier Volltext).
- B. A. Teply, E. J. Lipson: Identification and management of toxicities from immune checkpoint-blocking drugs. In: Oncology. Band 28 Suppl 3, November 2014, S. 30–38. PMID 25384885.
- J. Villadolid, A. Amin: Immune checkpoint inhibitors in clinical practice: update on management of immune-related toxicities. In: Translational lung cancer research. Band 4, Nummer 5, Oktober 2015, S. 560–575. doi:10.3978/j.issn.2218-6751.2015.06.06. PMID 26629425. PMC 4630514 (freier Volltext).
- A A Hurwitz, D R Leach, A van Elsas, S E Townsend, J P Allison: Manipulation of T cell activation in the anti-tumor immune Response. In: E Mihich, C Croce (eds.): The Biology of Tumors. Plenum Press, New York, S. 2013–2019.
- Arthur A Hurwitz, Barbara A Foster, Eugene D Kwon, Tan Truong, Eugene M Choi, Norman M Greenberg, Maurice B Burg, James P Allison: Combination Immunotherapy of Primary Prostate Cancer in a Transgenic Mouse Model Using CTLA-4 Blockade1. In: CANCER RESEARCH. Band 60, 2000, S. 2444–2448.
- Y Ishida, Y Agata, K Shibahara, T Honjo: Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. In: EMBO J. Band 11, 1992, S. 3887.
- T Okazaki, T Honjo: PD-1 and PD-1 ligands: from discovery to clinical application. In: International Immunology. Band 19, Nr. 7, 22. Juni 2007, ISSN 0953-8178, S. 813–824, doi:10.1093/intimm/dxm057 (oup.com [abgerufen am 5. April 2019]).
- F. S. Hodi u. a.: Improved survival with ipilimumab in patients with metastatic melanoma. In: N Engl J Med. 363, 2010, S. 711–723. doi:10.1056/NEJMoa1003466. PMID 20525992; PMC 3549297 (freier Volltext)
- J. Brahmer u. a.: Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. In: N Engl J Med. 373, 2015, S. 123–135. doi:10.1056/NEJMoa1504627.
- H. Borghaei u. a.: Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. In: N Engl J Med. 373, 2015, S. 1627–1639. doi:10.1056/NEJMoa1507643.
- E. B. Garon u. a.: Pembrolizumab for the treatment of non-small-cell lung cancer. In: N Engl J Med. 372, 2015, S. 2018–2028. doi:10.1056/NEJMoa1501824.
- R. J. Motzer, B. Escudier, D. F. McDermott, S. George, H. J. Hammers, S. Srinivas, S. S. Tykodi, J. A. Sosman, G. Procopio, E. R. Plimack, D. Castellano, T. K. Choueiri, H. Gurney, F. Donskov, P. Bono, J. Wagstaff, T. C. Gauler, T. Ueda, Y. Tomita, F. A. Schutz, C. Kollmannsberger, J. Larkin, A. Ravaud, J. S. Simon, L. A. Xu, I. M. Waxman, P. Sharma: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. In: The New England Journal of Medicine. Band 373, Nummer 19, November 2015, S. 1803–1813, doi:10.1056/NEJMoa1510665. PMID 26406148.
- European Commission Approves Bristol-Myers Squibb’s Opdivo (nivolumab) for Squamous Cell Cancer of the Head and Neck in Adults Progressing On or After Platinum-based Therapy PM BSM vom 28. April 2017, abgerufen am 11. Mai 2017.