Rheumatoide Arthritis
Die rheumatoide Arthritis (auch chronische Polyarthritis, abgekürzt cP, oder (veraltet) primär chronische Polyarthritis und chronischer Gelenkrheumatismus genannt) ist eine langwierige andauernde rheumatische Erkrankung und die häufigste entzündliche Erkrankung der Gelenke, bei der es auch zur Beteiligung innerer Organe kommen kann. Abgekürzt wird die Krankheit mit RA (rheumatoide Arthritis), cP (chronische Polyarthritis) bzw. pcP (primär chronische Polyarthritis, veraltet).
| Klassifikation nach ICD-10 | |
|---|---|
| M05 | Seropositive chronische Polyarthritis |
| M06 | Sonstige chronische Polyarthritis |
| ICD-10 online (WHO-Version 2019) | |
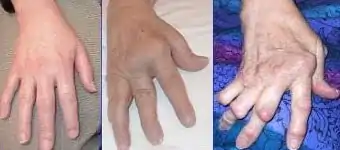
Der Krankheitsbeginn ist oft schleichend, kann aber auch plötzlich eintreten, mit Schmerzen in den kleinen Finger- oder Zehengelenken. Es können auch andere Gelenke betroffen sein, insbesondere Hand-, Knie-, Schulter, Fuß-, Hüftgelenke. Typischerweise werden bevorzugt die Handwurzelknochen, die Fingergrundgelenke (Metacarpophalangealgelenke) und die Fingermittelgelenke (proximale Interphalangealgelenke, PIP) befallen. Die Fingerend- und Zehenendgelenke (distale Interphalangealgelenke, DIP) sind im Gegensatz zur Psoriasisarthritis nicht betroffen. Die betroffenen Gelenke schwellen an und sind überwärmt. Eine Rötung der betroffenen Gelenke kann hinzukommen. Eine symmetrische (= beidseits auftretende) Synovitis der stammfernen Gelenke ist typisch, aber nicht zwingend. Morgens sind diese Symptome zumeist am stärksten ausgeprägt; es handelt sich dabei um die symptomatische Morgensteife. Im Krankheitsverlauf werden immer mehr Gelenke befallen.
Meist verläuft die Krankheit schubweise; ein Schub dauert typischerweise zwischen einigen Wochen und Monaten an. Zwischen den einzelnen Schüben lassen die Beschwerden nach. Eine Besserung des Gesundheitszustandes ist nicht zwingend auf die Therapie zurückzuführen.
Sonderformen der rheumatoiden Arthritis sind das Felty-Syndrom (schwere Verlaufsform der RA mit Hepatosplenomegalie und Neutropenie), das Caplan-Syndrom (RA und Silikose), die Alters-RA (LORA – late onset rheumatoid arthritis, Beginn nach dem 60. Lj.) und das RS3PE-Syndrom (vorübergehende seronegative symmetrische Synovitis mit eindrückbarem Ödem)[1] sowie (als schwere systemische Verlaufsform der kindlichen Polyarthritis) mit hoher entzündlicher Aktivität und extraartikulären Organmanifestationen das Still-Syndrom.[2]
Epidemiologie (Häufigkeit, Geschlechts- und Altersverteilung)
Beschrieben wurden der chronischen Polyarthritis entsprechende Krankheitsbilder 1802 von William Heberden, 1800 von Augustin Jakob Landrè-Beauvais (1772–1840) und 1852 von Jean-Martin Charcot sowie den Begriff „rheumatoide Arthritis“ prägend 1876 von Alfred B. Garrod.[3] Abgesehen von der entzündlich aktivierten Arthrose ist die rheumatoide Arthritis die häufigste entzündliche Gelenkerkrankung. Weltweit sind etwa 0,5–1 % der Bevölkerung betroffen. In Deutschland schätzt man die Zahl der Erkrankungen auf 800.000, wobei Frauen rund dreimal so häufig betroffen sind wie Männer. An der rheumatoiden Arthritis können Menschen aller Altersgruppen erkranken. Häufig ist ein Auftreten zwischen 35 und 45 Jahren. Es können jedoch auch Kinder betroffen sein; dies nennt man dann eine juvenile idiopathische Arthritis. Die Krankheitshäufigkeit nimmt mit steigendem Alter zu. Als Gipfel der Neuerkrankungsrate wird bei Frauen das Alter zwischen 55 und 64 Jahren, bei Männern das Alter zwischen 65 und 75 Jahren gesehen.[4]
Ursache
Die Ursachen der Erkrankung sind bislang weitgehend ungeklärt. Es wird eine autoimmune Ursache angenommen, bei der körpereigene Substanzen, z. B. der Gelenkknorpel, von Zellen des Immunsystems angegriffen werden. Dabei muss zwischen dem Auslöser der störenden Immunreaktion und weiteren Faktoren unterschieden werden, die diese Reaktion im Immunsystem etablieren und aufrechterhalten. Früher wurden auch psychosomatische Einflüsse angenommen. Diese Erkrankung gehörte zu den Holy Seven des Psychosomatikers Alexander.
Auslösende Faktoren
Krankheitsauslösend können, so eine wissenschaftliche Hypothese, Viren und Bakterien sein, ähnlich wie es bei der Pathogenese des rheumatischen Fiebers bereits beschrieben wurde.[5] Neuerdings wird auch der Zusammenhang zwischen einer Parodontitis-Erkrankung und dem Entstehen einer rheumatoiden Arthritis diskutiert. Zudem wurde ein möglicher Zusammenhang mit dem Auftreten von Prevotella-Bakterien im Darm entdeckt. Diese können auch in der Mundhöhle gefunden werden.[6][7] Möglicherweise sind Autoantikörper und autoreaktive T-Zellen gegen das ribosomale Protein RPL23A Auslöser für Arthritis.[8]
Beitragende Faktoren
Ein genetischer Einfluss wurde unter anderem durch Zwillingsstudien mehrfach nachgewiesen.[9][10][11] Eine bestimmte Form der RA ist demnach mit bestimmten MHC- bzw. HLA-Allelen assoziiert.
Bei einer rheumatoiden Arthritis ist außerdem die Funktion von regulatorischen T-Zellen geschwächt. Diese hängt direkt von der Aktivität von FOXP3 ab, und damit vom Level an TNF-α.[12]
Pathogenese
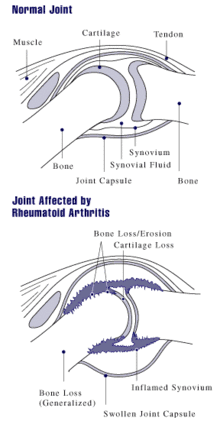
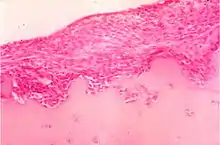
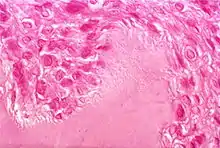
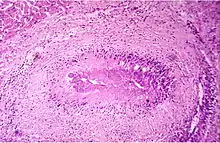
Ursächlich für das Krankheitsbild sind humorale und zelluläre Immunprozesse.[13] Das klinische Bild der rheumatoiden Arthritis ist das Ergebnis struktureller Prozesse, die sich im Gelenk- und gelenknahen Gewebe abspielen. Als Vollbild der Erkrankung zeigt sich ein Komplex aus immunologischer Gelenkentzündung, onkologischer Gelenkdestruktion und extraartikulären, u. U. sogar tödlichen primär nekrotisierenden Prozessen.[14] Die seit weit über hundert Jahren tradierte Vorstellung einer rein entzündlichen Erkrankung beruht auf wechselnd bewerteten klinisch-immunologischen Phänomenen und soll im folgenden Absatz dargestellt werden, wird aber durch neuere Forschungsergebnisse nicht gestützt:
Es wird beschrieben, dass fehlgesteuerte Immunzellen in das betroffene Gelenk einwandern und dort entzündungsfördernde Botenstoffe produzieren – sogenannte Zytokine –, mit deren Hilfe Immunzellen miteinander kommunizieren. An der Zellmembran der Zielzelle befinden sich Rezeptoren, an welche die Zytokinmoleküle nach dem Schlüssel-Schloss-Prinzip andocken und dort die entsprechenden Reaktionen auslösen können. Bei den Erkrankten ist der Theorie nach dieses Gleichgewicht zwischen den Zytokinen gestört. Insbesondere Interleukin-1 (IL-1), IL-6 und der Tumornekrosefaktor-alfa (TNF-α) seien übermäßig vorhanden und für den zerstörerischen Entzündungsprozess im Knorpelgewebe und die Aktivierung knochenabbauender Zellen, der Osteoklasten[15], verantwortlich. Durch die Wirkung der Zytokine entstehe an der Gelenkinnenhaut (Synovialis) ein geschwulstartiges Gewebe, der Pannus, welcher nach einer gewissen Zeit Knorpel, Knochen und auch andere Strukturen des betroffenen Gelenks zerstöre.
Mittlerweile ist an Mäusen nachgewiesen worden, dass für die RA typische Fibroblasten der Synovia von befallenen Gelenken über den Blutkreislauf in bisher gesunde Gelenke auswandern können. Dies könnte das typische Ausbreitungsmuster der Erkrankung erklären.[16] Der Entzündungsprozess wird jedoch nach Untersuchungen des Zentrums für Rheuma-Pathologie, Mainz, als im Verhältnis zu anderen, ebenfalls immunologisch ausgelösten entzündlichen Gelenkerkrankungen gering eingeschätzt. Obwohl in dieser meist der Grund für die starke Zerstörung des Gelenks gesehen wird, wurde niemals ein Beweis für die Destruktion von Knochen und Knorpel durch eine immunologische Entzündung erbracht.
Die Gelenkzerstörung bei rheumatoider Arthritis ist vielmehr das Werk eines spezifischen onkologischen Prozesses, der sich schubweise aus der pluripotenten synovialen Zellmatrix entwickelt.[17][18] Die aggressiven homogenen Zellverbände, die in Knorpel und Knochen eindringen, bestehen aus dicht gelagerten großen polygonalen Zellen. Der große helle Zellkern enthält 1 bis 2 Nucleolen. Diese Zellen exprimieren eine Reihe hochpotenter proteolytischer Enzyme, die sie zur schnellen Zerstörung des Gelenks durch Degradierung von Knorpel und Knochen befähigen. Der gefäßfreie Prozess ist kurzlebig, die aggressiven Zellverbände kollabieren innerhalb weniger Tage und werden von Entzündungszellen und Makrophagen resorbiert. Entzündliche Faktoren sind am Zerstörungsprozess nicht beteiligt. Der Prozess hinterlässt jedoch den bekannten, oft fälschlich der Entzündung zugeschriebenen Pannus. Diese aggressive Phase kann sich am selben Gelenk wiederholen und den Zerstörungsprozess fortsetzen. Dieser für die rheumatoide Arthritis spezifische Prozess wurde vom Deutschen Krebsforschungszentrum als „tumor-like proliferation“ klassifiziert.
Eine weitere potenziell tödliche Komponente der rheumatoiden Arthritis ohne entzündliche Störung ist das akute Absterben von Geweben infolge einer lokalen Freisetzung von Kollagenasen. Es sind gelenkferne Prozesse, die durch eine zentrale Nekrose und eine dichte radiäre Zellpalisade gekennzeichnet sind. Sie zerstören gefäßarme, kollagene Strukturen. In Sehnen führen sie zur Sehnenruptur, im Auge befallen sie die Sklera, was zum Verlust des Auges führt. Sie können die Wandung von Arterien zerstören und damit zum Absterben von Gliedmaßen führen. Dies sind Prozesse, die sich der klinischen Beobachtung weitgehend entziehen und deswegen oftmals anderen Erkrankungen zugeschrieben werden (z. B. Herzinfarkt).[14]
Diagnostik
Die Diagnostik erfolgt durch Labor, Klinik und bildgebende Verfahren.
- Labor: Es wird nach Rheumafaktoren (RF-Antikörper) im Blut bzw. Serum gesucht, die Blutsenkungsgeschwindigkeit (BSG) und das C-reaktive Protein (CRP) getestet. Rheumafaktoren (RF) sind hierbei jedoch nicht beweisend, sondern nur hinweisend, man kann auch bei anderen Erkrankungen Rheumafaktoren nachweisen. Fälle von seronegativer Arthritis sind ebenso bekannt wie Fälle, in denen Betroffene einen so niedrigen RF aufweisen, dass er zur Diagnostik nicht ausreicht. Untersuchungen haben jedoch gezeigt, dass ein seropositiver RF- oder ACPA-Status auf einen schweren erosiven Verlauf der Erkrankung mit einer raschen fortschreitenden Gelenkzerstörung hindeutet.[19][20]
- In neuerer Zeit haben die Testsysteme zum serologischen Nachweis der so genannten ACPAs (Anti-Citrullinated Protein/Peptide Antibodies, Antikörper gegen citrullinierte Protein-/Peptid-Antigene) die klassische Serodiagnostik über die Rheumafaktoren verbessert. Prominenteste Vertreter der ACPA-Testsysteme sind der CCP-Assay und der Nachweis von Autoantikörpern gegen mutiertes citrulliniertes Vimentin (Anti-MCV-ELISA).[21] Beide erreichen Sensitivitäten von nahezu 80 % und Spezifitäten von nahezu 98 %.
- Klinik: Zählung und Lokalisation schmerzhafter, geschwollener und überwärmter Gelenke, Patientenselbsteinschätzung (z. B. DAS28, Disease Activity Score 28)
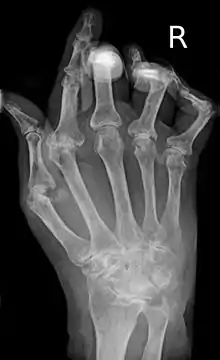
- Bildgebende Verfahren: Zu Beginn und im Verlauf sind Röntgen- oder MRT-Untersuchungen erforderlich, um Schädigungen der Knochen (Erosionen) abschätzen zu können. Typische radiologische Befunde, vor allem im Bereich der Hände, sind gelenknahe Entkalkungen, subchondrale (bzw. gelenknahe[22]) Osteoporose, Destruktionen des umliegenden Knochens, Ankylosen und Gelenkfehlstellungen (Knopflochdeformität, Schwanenhalsdeformität, Ulnardeviation).
- Mit der Weichteil- und Knochenszintigraphie kann das Verteilungsmuster der Entzündungsaktivität der verschiedenen Gelenke recht gut dargestellt werden.
Stadieneinteilung
Am Stadium der Erkrankung[23] orientiert sich deren Behandlung.
- Stadium I: geringe Schwellungen ohne Beeinträchtigungen bei alltäglichen Anforderungen
- Stadium II: konstante Synovitiden, keine Gelenkdeformierungen
- Stadium III: Gelenkdeformierungen, Muskelatrophien, Tendinitiden (Rheumaknoten)
- Stadium IV: ausgeprägte Gelenkdeformierungen, Gelenkinstabilität, Ankylosen sowie hochgradige Funktionskapazitätseinschränkung, Rollstuhlabhängigkeit oder Bettlägerigkeit
Klassifikationskriterien
Der US-amerikanische Rheumatologen-Fachverband ACR (American College of Rheumatology) und der Fachverband der europäischen Rheumatologen EULAR (European League Against Rheumatism) haben mit den gemeinsamen 2010 ACR / EULAR Kriterien zur Klassifikation der rheumatoiden Arthritis eine neue Grundlage für eine internationale Standardisierung der Klassifikation der Erkrankung veröffentlicht.[24][25][26] Mit dieser Arbeit wurden die vorhergegangenen ACR-Klassifikationskriterien von 1987 faktisch außer Kraft gesetzt.
Besonders die Autoimmundiagnostik und die Serologie haben mit den neuen Kriterien mehr Gewicht in der RA-Diagnostik erhalten (RA-Frühdiagnostik). Nach den neuen ACR/ EULAR-Kriterien trägt ein hochpositiver Rheumafaktor- oder ein hochpositiver ACPA-Titer (ACPA: anti-citrullinated protein antibody, deutsch: Antikörper gegen citrullinierte Peptide/Proteine) bereits die Hälfte der Punktzahl bei (3 Punkte von 6), die einen Betroffenen als RA-Patienten einstuft. In den ACR-Kriterien von 1987 tauchten lediglich die diagnostisch eher unspezifischen Rheumafaktoren auf.
Die radiologischen Veränderungen der Gelenke, in den Klassifikationskriterien von 1987 noch als entscheidend angesehen, verlieren als Symptom der etablierten RA („späte“ RA) zugunsten der RA-Frühdiagnostik an Bedeutung.
2010-ACR/EULAR-Klassifikationskriterien für die rheumatoide Arthritis
Die 2010-ACR/EULAR-Kriterien zur Klassifikation der rheumatoiden Arthritis erzeugen einen Punktewert zwischen 0 und 10. Jeder Patient mit einem Punktewert von 6 oder mehr wird eindeutig als RA-Patient klassifiziert. Vier Bereiche werden bei der Befundung abgedeckt:
- die Gelenkbeteiligung (je nach Art und Zahl der betroffenen Gelenke bis zu 5 Punkte)
- serologische Parameter (neben den Rheumafaktoren nun auch ACPA – je nach Antikörper-Titerhöhe bis zu 3 Punkte),
- die Akutphasereaktion (1 Punkt für erhöhte BSG- oder CRP-Werte)
- die Dauer der Arthritis (1 Punkt für Beschwerden, die sechs Wochen oder länger bestehen)
Dabei bleibt die Diagnosestellung weiterhin dem Rheumatologen überlassen. Für Hausärzte, für hausärztlich tätige Internisten oder für die Orthopäden (alle „Nicht-Rheumatologen“) bleiben nach wie vor die jeweiligen Verdachtskriterien für die rheumatoide Arthritis gültig. Für die Ärzte in Deutschland sind das die RA-Verdachtskriterien der Deutschen Gesellschaft für Rheumatologie (DGRh):
- zwei oder mehr geschwollene Gelenke[27]
- länger bestehende[28] Morgensteifigkeit von mehr als einer Stunde
- erhöhte Blutsenkungsgeschwindigkeit (BSG) oder CRP-Werte weisen auf eine rheumatoide Arthritis hin
- der Nachweis von Rheumafaktoren oder Autoantikörpern gegen CCP (das sind bestimmte ACPA) kann den Verdacht auf rheumatoide Arthritis erhärten. – Aber: Ein negativer Befund schließt die Diagnose RA nicht aus.
Die Krankheitsaktivität bei Diagnose und zur Therapiesteuerung wird häufig über den DAS28 ermittelt.
Extraartikuläre Manifestation der rheumatoiden Arthritis
Neben der Gelenkmanifestation können bei der rheumatoiden Arthritis auch andere Organe und Systeme betroffen sein.
Interstitielle Lungenfibrose
Bei Patienten mit rheumatoider Arthritis kann in bis zu 60 % im hochauflösenden CT eine interstitielle Lungenerkrankung festgestellt werden.[29] In 10 % der Fälle ist die Lungenveränderung symptomatisch. Auch die Sterblichkeit ist bei gleichzeitiger rheumatoider Arthritis und interstitieller Lungenfibrose erhöht.[30] Im Englischen wird die Bezeichnung RA-ILD (Rheumatoid arthritis – Associated Idiopathic Lung Disease) verwendet.
Durch Bildung von Exsudaten kann es bei der rheumatoiden Arthritis auch zum Pleuraerguss kommen. Der im Rahmen einer Pleurapunktion gemessene pH-Wert der Pleuraflüssigkeit zeigt dann eine Azidose.[31]
Herzbeteiligung
Verschiedene kardiale Strukturen können bei einer RA verändert sein.[32] Eine Metaanalyse gibt folgende Häufigkeiten an:[33]
- Perikarderguss: OR = 10,7
- Herzklappenknoten: OR = 12,5
- Trikuspidalinsuffizienz: OR = 5,3
- Aortenstenose: OR = 5,2
- Mitralinsuffizienz: OR = 3,4
- Aorteninsuffizienz: OR = 1,7
- Herzklappenveränderungen: OR = 4,3
- Mitralklappenverdickung oder -verkalkung: OR = 5,0
- Aortenklappenverdickung oder -verkalkung: OR = 4,4
- Klappenverdickung oder -verkalkung: OR = 4,8
- Mitralklappenprolaps: OR = 2,2
- Vorhofflimmern: adjustierte IRR: 1,41
- QT-Verlängerung: kumulative Inzidenz: 48 %
OR ist ein statistisches Maß für die Häufigkeitssteigerung gegenüber Patienten ohne rA. Der Perikarderguss kann echokardiographisch nachgewiesen werden und ist klinisch meistens nicht relevant.[32] Die genannte Klappenveränderungen sind ebenfalls meistens asymptomatisch. Eine Einschränkungen der kardialen Pumpfunktion und eine klinisch manifeste Herzinsuffizienz ist bei Patienten mit rA häufiger.[34]
Therapie
Medikamentöse Behandlung
Bei der im Vordergrund der Behandlung stehenden medikamentösen Therapie rheumatischer Erkrankungen werden traditionell vier Hauptgruppen von Medikamenten unterschieden:
- Analgetika (Schmerzmittel)
- Nichtsteroidale Antirheumatika (NSAR)
- Glucocorticoide
- Basistherapeutika (Langwirksame Antirheumatika (LWAR), krankheitskontrollierende Medikamente (Disease modifying anti-rheumatic drugs, DMARD))
Die verschiedenen Medikamentengruppen haben unterschiedliche Wirkungen und therapeutische Zielsetzungen. Ihre Anwendung erfolgt deshalb oft gleichzeitig, z. B. gibt man häufig neben Basistherapeutika zusätzlich Cortison oder cortisonfreie Entzündungshemmer.
Moderne Konzepte der Rheumabehandlung zeichnen sich dadurch aus, dass verschiedene Methoden kombiniert werden. Der Erfolg der Behandlung hängt wesentlich davon ab, für die unterschiedlichen Krankheitsbilder und -situationen die jeweils individuell richtige Behandlungskombination zusammenzustellen. Sehr häufig wird dabei allein oder in Kombination das Basistherapeutikum MTX (Methotrexat) eingesetzt, das aufgrund von Wirksamkeit und Verträglichkeit quasi der „Goldstandard“ der Basistherapie ist.[35] Weitere sogenannte konventionelle Basistherapeutika sind Leflunomid, Sulfasalazin, Chloroquin und Hydroxychloroquin (ursprünglich als Anti-Malaria-Medikamente entwickelt), Cyclosporin A, Azathioprin und Goldverbindungen, wie beispielsweise Auranofin. Goldverbindungen gelten allerdings als Basistherapeutika der zweiten Wahl.[36]
Neuere Therapeutika sind Antikörper, lösliche Rezeptoren oder Antagonisten, die gegen proinflammatorische Zytokine wie IL-1, IL-6 oder TNF-alpha gerichtet sind und auch Biologika (biologicals) genannt werden. Gegen TNF-alpha gerichtet sind die TNF-alpha-Hemmer Adalimumab, Certolizumab, Etanercept, Golimumab und Infliximab. Der IL-1-Rezeptor-Antagonist heißt Anakinra. Die B-Zell-Therapie mit Rituximab (monoklonaler CD20-Antikörper) ist seit Juli 2006 europaweit zugelassen. Rituximab wird nach Versagen des initialen TNF-alpha-Hemmers eingesetzt. Bei unzureichendem Ansprechen und/oder Unverträglichkeit eines TNF-alpha-Hemmers wird von den EULAR-Leitlinien eine Umstellung auf einen weiteren TNF-alpha-Hemmer oder Biologika mit anderem Wirkmechanismus wie z. B. Rituximab empfohlen.[37] Seit Mai 2007 ist eine Substanz zugelassen, die die T-Zell-Ko-Stimulation moduliert. Es handelt sich um das vollständig humane Fusionsprotein CTLA4Ig (Abatacept). Abatacept wird derzeit nach Versagen mindestens eines TNF-alpha-Antagonisten eingesetzt.[38] Seit Januar 2009 ist der humanisierte Antikörper Tocilizumab europaweit zugelassen, der speziell Interleukin-6-Rezeptoren hemmt. Weitere Wirkstoffe befinden sich in der klinischen Erforschung in Phase II und Phase III-Studien. Für Patienten mit moderater bis schwerer rheumatoider Arthritis ist der orale Januskinase(JAK)-Hemmer Tofacitinib (Handelsname: Xeljanz; Hersteller: Pfizer) seit Mai 2017 EU-weit zugelassen.[39][40]
Eine Studie zeigte, dass die wesentlich günstigere Tripletherapie mit Methotrexat, Sulfasalazin und Hydroxychloroquin gleichwertige Behandlungsergebnisse erzielt wie die Kombination von Methotrexat mit einem Biologikum.[41]
Operative Therapie der rheumatischen Arthritis
..jpg.webp)
Als Zweig der Orthopädie hat sich die Rheumachirurgie etabliert. Die sie anwendenden Ärzte haben sich darauf spezialisiert, die schweren und bisweilen schwersten Gelenkveränderungen, die im Laufe einer rheumatischen Erkrankung entstehen können, operativ zu behandeln.
Synovialektomie
Die Synovialis – die Schleimhaut der Gelenkkapsel – produziert die Synovialflüssigkeit und ist der eigentliche Ort des Krankheitsgeschehens. Eine operative Gelenkinnenhautentfernung wurde erstmals gegen Ende des 19. Jahrhunderts durchgeführt.[42] Die Synovialis im frühen Stadium zu entfernen, kann den gesamten Verlauf günstig beeinflussen. Abhängig von den anatomischen Gegebenheiten des betroffenen Gelenkes gelingt das oft nicht vollständig, aber eine deutliche Reduktion des erkrankten Gewebes hat meist einen lindernden Effekt. Synovialgewebe ist auch in den Sehnenscheiden vorhanden. Normalerweise sorgt es dort für die Ernährung und Schmierung der Sehnen. Bei rheumatischen Erkrankungen bilden sich, besonders in den Strecksehnenfächern des Handrückens, starke Schwellungen, so genannte synovialitische Kissen, aus. Die krankhaft veränderte Synovia greift diese Sehnen an, die Sehnen können zerreißen. Die frühe Synovialektomie wirkt sich bremsend auf den Krankheitsprozess aus.
Im späteren Verlauf, wenn es zu Zerstörungen von Gelenken gekommen ist, reichen solche relativ kleinen Eingriffe nicht mehr aus. Abhängig von der Lokalisation, dem Typ und der Funktion des Gelenkes kommen verschiedene Verfahren zum Einsatz.
Gelenkresektion
Das zerstörte Gelenk wird ersatzlos entfernt. Die Nachbehandlung mit Gips und Schienen hat zum Ziel, eine funktionell zufrieden stellende Narbenbildung zu ermöglichen. Oft werden diese Verfahren an den Zehengrundgelenken eingesetzt.
Arthrodese (Gelenkversteifung)
Das erkrankte Gelenk wird entfernt, die Knochenstümpfe werden in einer für die Funktion günstigen Stellung aufeinander fixiert. Nach der Verheilung ist das ehemalige Gelenk zwar vollständig eingesteift, dafür aber weitgehend schmerzfrei. Bei Rheumakranken werden Arthrodesen bevorzugt am Daumen, den Handwurzelgelenken, den Fingerendgelenken (sog. DIP-Gelenke), dem oberen und unteren Sprunggelenk, der Fußwurzel und dem Großzehengrund- und -endgelenk sowie den Zehenmittel- und -endgelenken durchgeführt.
Arthroplastik
Ein Teil des Gelenkes wird reseziert, der entstandene Defekt mit körpereigenem Gewebe aufgefüllt. Meistens wird hierzu eine eingerollte Sehne verwendet. Sinnvoll kann dieses Vorgehen im Bereich der Handwurzel sein.
Endoprothesen
Wie bei verschleißbedingten Arthrosen wird versucht, den Einbau eines künstlichen Gelenkes so lange wie möglich hinauszuzögern. Daher hat die frühzeitige Erkennung und konsequente stadiengerechte medikamentöse Therapie (siehe Basistherapie), Radio- oder Chemosynoviorthese (seltener auch Synovialektomie) einen sehr wichtigen Stellenwert. Bei zunehmender Gelenkknorpelzerstörung, Bewegungs- sowie Ruheschmerzen wird auch bei rheumatischen Erkrankungen die Entscheidung für eine Gelenkprothese getroffen. Das Ziel liegt hierbei in einer Schmerzreduktion, Verbesserung der Gelenkbeweglichkeit sowie der Gelenkstabilität. Eine Besonderheit der Prothesenoperation beim Rheumatiker ist die konsequente Mitentfernung der rheumatisch-entzündlich veränderten inneren Gelenkschleimhaut (Synovia).
Typische Regionen, die bei Rheumakranken mit einem Kunstgelenk ersetzt werden können, sind die großen Gelenke (Schultergelenk, Hüftgelenk, Kniegelenk, oberes Sprunggelenk, Ellenbogengelenk) und einige kleine Gelenke (Fingergrund- und Fingermittelgelenk, Großzehengrundgelenk). Gerade bei Rheumatikern sollte mit der sogenannten Endoprothesenoperation nicht zu lange gewartet werden, um der entzündlichen Zerstörung von stabilisierenden Kapsel-Bandstrukturen oder der Entwicklung von Knochendefekten zuvorzukommen.
In der Endoprothetik (Einbau von Kunstgelenken) unterscheidet man zementfreie von zementierten Gelenken. Am Knie grenzt man zusätzlich aufsteigend nach dem Grad der erzwungenen Gelenkführung „ungekoppelte“ von „teilgekoppelten“ sowie „vollständig gekoppelten“ Prothesen ab. Die verwendeten Prothesenmaterialien und Designs unterscheiden sich nicht von denen, wie sie bei der herkömmlichen Arthrose verwendet werden. Eine Besonderheit stellt jedoch der künstliche Ersatz von Fingergrund- (sog. MCP-Gelenke) und -mittelgelenken (sog. PIP-Gelenke) dar. Hier werden am häufigsten silikonhaltige elastische „Gelenkstäbe“ implantiert.
Grundsätzlich unterscheidet sich die operative Durchführung eines Kunstgelenkes beim Rheumatiker nicht von der beim Arthrosepatienten. Aufgrund von immunmodulierenden Medikamenten (z. B. Kortison, Biologika u. a.), der verminderten Körperabwehr infolge der chronischen Erkrankung und anderer Faktoren ist die Anzahl an Frühinfekten nach einer Prothesenoperation sowie die Lockerungsrate gegenüber anderen Arthrosepatienten geringfügig erhöht. Dennoch stellt der künstliche Gelenkersatz gerade bei Rheumapatienten eine sehr große Bereicherung der Behandlungsoptionen mit einem deutlichen Anstieg an Lebensqualität dar.
Radiosynoviorthese
Eine Alternative zur operativen Behandlung stellt die Radiosynoviorthese (RSO) dar. Die Wirksamkeit bei der rheumatoiden Arthritis ist durch Studien mit hohem Evidenzgrad gesichert. Die Indikation zur RSO ist gegeben, wenn nach sechsmonatiger Basistherapie auch durch intraartikuläre Injektion von cortisonhaltigen Lösungen der Krankheitsprozess nicht zu beherrschen ist. Die Erfolge der RSO sind umso besser, je früher sie im Krankheitsgeschehen eingesetzt wird. Als absolute Kontraindikationen gelten Schwangerschaft und Stillzeit, als relative Kontraindikationen die Behandlung bei Kindern und Jugendlichen. Die verwendeten Nuklide (vor allem 90Y, 186Re und 169Er) richten sich nach der Größe des zu behandelnden Gelenks. Es handelt sich um reine oder zumindest vorwiegende Betastrahler.[43]
Fasten und vegetarische Diät
Eine Analyse der verfügbaren klinischen Studien, bezüglich einer möglichen positiven Beeinflussung der RA durch Fasten gefolgt von einer vegetarischen Diät, ergab eine statistisch und klinisch relevante positive Beeinflussung des Langzeit-Krankheitsverlaufs durch eine solche Ernährungstherapie.[44] Auch zeigte sich, dass es bei erneuter Umstellung zur früheren Diät zum Wiederauftreten von Krankheitssymptomen kommen kann.[45] Eine Fastenkur sollte, wie die meisten Ernährungstherapien, mit dem behandelnden Arzt bzw. Therapeuten abgesprochen werden. Auch Eliminationsdiäten, bei denen versucht wird, mögliche allergie- bzw. krankheitsauslösende Faktoren aus der Ernährung auszuschließen, könnten nützlich sein. Gute Ergebnisse wurden auch mit veganer Rohkost in Verbindung mit Lactobazillen-Supplementen erhalten.[46] Die Ergebnisse berufen sich auf Studien mit kleiner Teilnehmerzahl.
Eine Meta-Analyse aus dem Jahr 2021 kommt zu dem Schluss, dass entzündungshemmende Ernährungsformen (mediterrane, vegetarische und vegane Ernährung sowie ketogene Diät) signifikant zur Schmerzlinderung beitragen können.[47]
Siehe auch
Literatur
Leitlinien
- S3-Leitlinie Management der frühen rheumatoiden Arthritis der Deutschen Gesellschaft für Rheumatologie (DGRh). In: AWMF online (Stand 2011)
- S1-Leitlinie Empfehlungen und Algorithmus zur medikamentösen Therapie der rheumatoiden Arthritis der Deutschen Gesellschaft für Rheumatologie (DGRh). In: AWMF online (Stand 2012)
Übersichtsarbeiten
- D. L. Scott, F. Wolfe, T. W. Huizinga: Rheumatoid arthritis. In: The Lancet. Band 376, Nummer 9746, September 2010, S. 1094–1108. doi:10.1016/S0140-6736(10)60826-4. PMID 20870100.
- I. B. McInnes, G. Schett: The pathogenesis of rheumatoid arthritis. In: The New England journal of medicine. Band 365, Nummer 23, Dezember 2011, S. 2205–2219. doi:10.1056/NEJMra1004965. PMID 22150039.
- Sonstiges
- Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 731–733 (Chronische Polyarthritis (CP), rheumatoide Arthritis) und 735 f. (Chronische Polyarthritis (cP)).
- ältere Literatur
- Ludwig Heilmeyer, Wolfgang Müller: Die rheumatischen Erkrankungen. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 309–351, hier: S. 321–333.
Weblinks
Einzelnachweise
- Gerd Herold und Mitarbeiter: Innere Medizin 2020. Selbstverlag, Köln 2020, ISBN 978-3-9814660-9-6, S. 661.
- Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. 2003, S. 733.
- Wolfgang Miehle: Gelenk- und Wirbelsäulenrheuma. Eular Verlag, Basel 1987, ISBN 3-7177-0133-9, S. 35.
- Rheumatoide Arthritis. In: www.internisten-im-netz.de. Abgerufen am 19. Januar 2016.
- L. Guilherme, J. Kalil: Rheumatic fever and rheumatic heart disease: cellular mechanisms leading autoimmune reactivity and disease. In: J. Clin. Immunol. 30, 2010, S. 17–23, PMID 19802690 (Review).
- D. Mathis: A gut feeling about arthritis. In: eLife. 2, 2013, S. e01608–e01608, doi:10.7554/eLife.01608.
- Julia Downes, Floyd E. Dewhirst, Anne C. R. Tanner und William G. Wade: Description of Alloprevotella rava gen. nov., sp. nov., isolated from the human oral cavity, and reclassification of Prevotella tannerae Moore et al. 1994 as Alloprevotella tannerae gen. nov., comb. nov.. In: International Journal of Systematic and Evolutionary Microbiology. 63, Nr. 4, 2012, S. 1214–1218. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Y. Ito, M. Hashimoto, K. Hirota, N. Ohkura, H. Morikawa, H. Nishikawa, A. Tanaka, M. Furu, H. Ito, T. Fujii, T. Nomura, S. Yamazaki, A. Morita, D. A. Vignali, J. W. Kappler, S. Matsuda, T. Mimori, N. Sakaguchi, S. Sakaguchi: Detection of T cell responses to a ubiquitous cellular protein in autoimmune disease. In: Science. Band 346, Nummer 6207, Oktober 2014, S. 363–368, ISSN 1095-9203. doi:10.1126/science.1259077. PMID 25324392.
- K Hemminki, X Li, J Sundquist, K Sundquist: Familial associacions of rheumatoid arthritis with autoimmune diseases and related conditions. In: Arthritis Rheum. 2009;60(3):661-8. Februar.
- L Padyukov, C Silva, P Stolt, L Alfredsson, L Klareskog for the Epidemiological Investigation of Rheumatoid Arthritis Study Group: A Gene-Environment Interaction Between Smoking and Shared Epitope Genes in HLA-DR Provides a High Risk of Seropositive Rheumatoid Arthritis. In: Arthritis Rheum 2004;50(10):3085-92. Februar.
- L Padyukov, C Silva, P Stolt, L Alfredsson, L Klareskog: A gene-environment interaction between smoking and shared epitope genes in HLA-DR provides a high risk of seropositive rheumatoid arthritis. In: Arthritis Rheum 2004;50:3085-92. Februar.
- H. Nie, Y. Zheng u. a.: Phosphorylation of FOXP3 controls regulatory T cell function and is inhibited by TNF-α in rheumatoid arthritis. In: Nature Medicine. Band 19, Nummer 3, März 2013, S. 322–328, ISSN 1546-170X. doi:10.1038/nm.3085. PMID 23396208.
- Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 731.
- H. G. Fassbender: Pathology and Pathobiology of Rheumatic Diseases. Heidelberg, Springer 2002. ISBN 978-3-540-62942-9.
- Rheumatoide Arthritis. (PDF) In: Journal für Mineralstoffwechsel. Abgerufen am 27. Oktober 2017.
- S. Lefèvre, A. Knedla, C. Tennie, A. Kampmann, C. Wunrau, R. Dinser, A. Korb, E. M. Schnäker, I. H. Tarner, P. D. Robbins, C. H. Evans, H. Stürz, J. Steinmeyer, S. Gay, J. Schölmerich, T. Pap, U. Müller-Ladner, E. Neumann: Synovial fibroblasts spread rheumatoid arthritis to unaffected joints. In: Nat. Med., 15, 2009, S. 1414–1420, PMID 19898488.
- H. G. Fassbender: Rheumatoide Arthritis. In: Spezielle pathologische Anatomie. Band 18: Pathologie der Gelenk und Weichteiltumoren, ed. W. Doerr, G. Seifert. Springer, Berlin/Heidelberg 1984, S. 191–229.
- H. G. Fassbender: Normal and pathological synovial tissue with emphasis on rheumatoid arthritis In: Rheumatology and Immunology. 2nd Ed. (ed. A.S. Cohen and J.C. Bennett). Grüne & Stratton, Orlando NY 1986, ISBN 978-0-8089-1809-7, S. 36–42.
- WJ van Venrooij et al.: Anticitrullinated protein/peptide antibody and its role in the diagnosis and prognosis of early rheumatoid arthritis. In: Neth J Med, 2002, 60, S. 383–388
- KP Machold et al.: Very recent onset rheumatoid arthritis: clinical and serological patient characteristics
- Egerer K, Feist E, Burmester G: The Serological Diagnosis of Rheumatoid Arthritis – Antibodies to citrullinated Antigens. In: Dtsch Arztebl Int 2009; 106(10): 159-63. Februar. doi:10.3238/arztebl.2009.0159.
- Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 731.
- Vgl. Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 732.
- rme: Neue Rheumaklassifikation soll Frühdiagnose erleichtern. In: aerzteblatt.de. 11. August 2010, abgerufen am 31. Januar 2015.
- 2010 Rheumatoid Arthritis Classification Criteria (PDF) In: Arthritis & Rheumatism, Band 62, Nummer 9, September 2010, S. 2569–2581
- The 2010 ACR-EULAR classification criteria for rheumatoid arthritis.
- Vgl. auch Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 731 (Gelenkschwellung an > 3von 14 möglichen Gelenkregionen, seit wenigstens 6 Wochen vorhanden, und wenigstens eine Schwellung im Bereich der Hand, sowie symmetrischer Befall).
- Franz Hrska, Wolfgang Graninger, Michael Frass: Systemerkrankungen. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, (November) 2003, S. 719–740, hier: S. 731 (Morgensteifigkeit von wenigsten einer Stunde, seit wenigstens 6 Wochen vorhanden).
- Pierre-Antoine Juge, Joyce S. Lee, Esther Ebstein, Hiroshi Furukawa, Evgenia Dobrinskikh: MUC5B Promoter Variant and Rheumatoid Arthritis with Interstitial Lung Disease. In: New England Journal of Medicine. Band 379, Nr. 23, 6. Dezember 2018, ISSN 0028-4793, S. 2209–2219, doi:10.1056/NEJMoa1801562 (nejm.org [abgerufen am 16. Februar 2019]).
- Amy L. Olson, Jeffrey J. Swigris, David B. Sprunger, Aryeh Fischer, Evans R. Fernandez-Perez: Rheumatoid Arthritis–Interstitial Lung Disease–associated Mortality. In: American Journal of Respiratory and Critical Care Medicine. Band 183, Nr. 3, 2011, ISSN 1073-449X, S. 372–378, doi:10.1164/rccm.201004-0622OC, PMID 20851924, PMC 5450769 (freier Volltext).
- Berthold Jany, Tobias Welte: Pleuraerguss des Erwachsenen – Ursachen, Diagnostik und Therapie. In: Deutsches Ärzteblatt, Band 116, Nr. 21, (Mai) 2019, S. 377–385, hier: S. 379 f. und 382 f.
- Jürgen Braun, Klaus Krüger, Bernhard Manger, Matthias Schneider, Christof Specker: Cardiovascular Comorbidity in Inflammatory Rheumatological Conditions. In: Deutsches Aerzteblatt Online. 24. März 2017, ISSN 1866-0452, doi:10.3238/arztebl.2017.0197, PMID 28407841, PMC 5397890 (freier Volltext) – (aerzteblatt.de [abgerufen am 10. April 2021]).
- Salvatore Corrao, Silvia Messina, Giovanni Pistone, Luigi Calvo, Rosario Scaglione: Heart involvement in Rheumatoid Arthritis: Systematic review and meta-analysis. In: International Journal of Cardiology. Band 167, Nr. 5, September 2013, S. 2031–2038, doi:10.1016/j.ijcard.2012.05.057 (elsevier.com [abgerufen am 10. April 2021]).
- Elena Myasoedova, Cynthia S. Crowson, Paulo J. Nicola, Hilal Maradit-Kremers, John M. Davis: The Influence of Rheumatoid Arthritis Disease Characteristics on Heart Failure. In: The Journal of Rheumatology. Band 38, Nr. 8, August 2011, ISSN 0315-162X, S. 1601–1606, doi:10.3899/jrheum.100979, PMID 21572155, PMC 3337549 (freier Volltext) – (jrheum.org [abgerufen am 10. April 2021]).
- J. Kay, Westhovens, R.: Methotrexate: the gold standard without standardisation. In: Ann Rheum Dis. 68, Nr. 787, 2009, S. 1081–1082. PMID 19525405.
- S1-Leitlinie der Deutschen Gesellschaft für Rheumatologie:Medikamentöse Therapie der rheumatoiden Arthritis>awmf.org
- Smolen JS et al.: EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. In: Ann Rheum Dis 2010; 69: 964–975.
- K. Krüger, M. Gaubitz: Empfehlungen zum Einsatz von Abatacept bei Patienten mit rheumatoider Arthritis. (Memento des Originals vom 5. August 2013 im Internet Archive; PDF) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Kommission Pharmakotherapie der DGRh, 2008; abgerufen am 27. September 2015.
- Zusammenfassung für die Öffentlichkeit. (PDF; 147 kB) EPAR der EMA; abgerufen am 14. Juni 2018
- Rheumatoide Arthritis: Oraler JAK-Inhibitor bremst auch die Gelenkzerstörung. Abgerufen am 13. Juni 2018.
- James R. O Dell, Ted R. Mikuls, Thomas H. Taylor, Vandana Ahluwalia, Mary Brophy, Stuart R. Warren, Robert A. Lew, Amy C. Cannella, Gary Kunkel, Ciaran S. Phibbs, Aslam H. Anis, Sarah Leatherman, Edward Keystone: Therapies for Active Rheumatoid Arthritis after Methotrexate Failure. In: New England Journal of Medicine. 2013, S. 130611150115007, doi:10.1056/NEJMoa1303006.
- Wolfgang Miehle: Gelenk- und Wirbelsäulenrheuma. Eular Verlag, Basel 1987, ISBN 3-7177-0133-9, S. 12.
- G. Mödder. Radiosynoviorthese. In: T. Kuwert, F. Grünwald, U. Haberkorn, Thomas Krause (Hrsg.): Nuklearmedizin. 5. Auflage. Thieme, Stuttgart / New York 2008, ISBN 978-3-13-118504-4.
- H Müller et al.: Fasting followed by vegetarian diet in patients with rheumatoid arthritis: a systematic review. In: Scandinavian Journal of Rheumatology, 2001; 30: 1-10 (doi:10.1080/030097401750065256).
- L Vitetta et al.: Dietary recommendations for patients with rheumatoid arthritis: a review. In: Nutrition and Dietary Supplements, 2012, 4, S. 1–15.
- MT Nenonen et al.: Uncooked, lactobacilli-rich, vegan food and rheumatoid arthritis. In: Br J Rheumatol., 1998, 37(3), S. 274–281.
- Katja A. Schönenberger, Anne-Catherine Schüpfer, Viktoria L. Gloy, Paul Hasler, Zeno Stanga: Effect of Anti-Inflammatory Diets on Pain in Rheumatoid Arthritis: A Systematic Review and Meta-Analysis. In: Nutrients. Band 13, Nr. 12, 24. November 2021, ISSN 2072-6643, S. 4221, doi:10.3390/nu13124221, PMID 34959772 (nih.gov [abgerufen am 29. Dezember 2021]).
