Pyranosen
Als Pyranosen werden Lactole von Monosacchariden bezeichnet, die einen Sechsring aus fünf Kohlenstoff- und einem Sauerstoff-Atom sowie an einem der C-Atome, die den ringbildenden Sauerstoff binden, eine Hydroxygruppe enthalten; es liegt also ein Halbacetal (oder Halbketal) vor.[1] Der Ring entsteht in bestimmten Monosacchariden durch Halbketal- oder Halbacetalbildung zwischen einer Carbonylgruppe und einer OH-Gruppe, etwa bei der Glucose (Traubenzucker).
| Tetrahydropyrane (Pyrane) | |||
| Name | Tetrahydropyran | α-D-(+)-Glucopyranose | |
| Strukturformel | 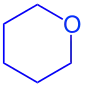 |  | |
| Bemerkung | Tetrahydropyran-Ring (blau) | Tetrahydropyran-Ring blau markiert | |
Die Sechsringform ist stabiler als der Fünfring, da hier die Ringspannung am geringsten ist. Alle Monosaccharide mit mindestens fünf Kohlenstoffatomen liegen in wässriger Lösung im Gleichgewicht zwischen offenkettiger und cyclischen Formen (α-Form und β-Form, je der Stellung der glycosidischen Hydroxygruppe) vor und unterliegen der Mutarotation.[1] Auch höhermolekulare Kohlenhydrate (Di-, Oligo- und Polysaccharide) bauen sich aus ringförmigen Monomeren auf.
Der Name Pyranose leitet sich von dem heterocyclischen Molekül Pyran ab, das ebenfalls aus einem Sechsring mit einer Sauerstoffbrücke besteht, jedoch zwei C=C-Doppelbindungen aufweist. Genauer passt die Analogie zum Tetrahydropyran, siehe Abbildung.
Bei der Ringbildung können verschiedene Isomere entstehen. Beispiel einer Pyranoseform ist die α-D-Glucopyranose, eine Aldohexose in Ringform.
Nomenklatur von Pyranosen
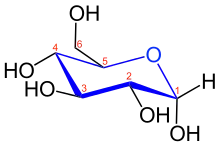
Um einer Pyranose eine Konformation zuordnen zu können, analysiert man – ähnlich wie beim Cyclohexan – die möglichen Konformationen, wie Sessel-, Boot-, Halbsessel- oder Twistform. Die Atome des Sechsringes (Tetrahydropyranring) werden derart nummeriert, dass dem anomeren Kohlenstoffatom (ursprüngliches Kohlenstoffatom der Carbonylgruppe der Aldose bzw. Ketose) stets die Position 1 zugewiesen wird. Die Position der Hydroxygruppen ergibt sich dann aus dem Lokanten des Kohlenstoffatoms an das dieses in der acyclischen Form gebunden ist. Weitere Konventionen sind in der wissenschaftlichen Literatur[2] beschrieben.
| α-Pyranose und β-Pyranose ausgewählter D-Aldosen |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
_V.3.png.webp) |
Siehe auch
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, ISBN 3-342-00280-8, S. 638–641.
- Furhop, J. H.; Endisch, C.: Molecular and Supramolecular Chemistry of Natural Products and Their Model Compounds. CRC Press, 2000, ISBN 0-8247-8201-1.
- Eberhard Breitmaier, Günther Jung: Organische Chemie, 7. Auflage, Thieme Verlag, 2012, S. 864–865, ISBN 978-3-13-541507-9.