Aldosereduktase
Aldosereduktase (AR) (Gen: AKR1B1) ist ein Enzym, welches die Reduktion von verschiedenen Aldehyden und Ketonen (einschließlich Monosaccharide) katalysiert. Besonders ist die Aldosereduktase dafür bekannt, Glukose zu Sorbit umwandeln. Dies ist der erste Schritt im Polyolweg, der von Zellen benutzt wird, um ohne ATP-Verbrauch Fructose aus Glucose herzustellen. Die wichtigste Aufgabe von AR ist wahrscheinlich, giftige Aldehyde zu reduzieren, die im Stoffwechsel entstehen. Jedes Lebewesen benutzt AR. Die Nebennieren des Menschen produzieren am meisten AR, es ist jedoch in allen Gewebetypen aktiv.[1][2]
| Aldosereduktase | ||
|---|---|---|
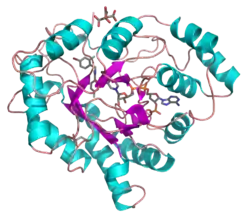
| ||
| Bändermodell der humanen Aldosereduktase, mit NADP, Citrat und einem Inhibitor als Stäbchen, nach PDB 1US0 | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 315 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Bezeichner | ||
| Gen-Name | AKR1B1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.21, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | Alditol + NAD(P)+ | |
| Produkte | Aldose + NAD(P)H/H+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Bei Diabetes mellitus oder Galactosämie entsteht durch die AR viel Sorbit, das sich aufgrund der Langsamkeit der Sorbitdehydrogenase in den Zellen ansammelt und insbesondere in den Nieren, Augen und Nerven Schäden durch den hohen osmotischen Druck verursacht. Um Folgeschäden von Diabetes zu lindern, versucht man daher, Arzneistoffe zu finden, die die AR hemmen. Ein erster Vermarktungsversuch mit Tolrestat musste 1997 wegen schwerer Lebertoxizität wieder zurückgenommen werden. Die bestuntersuchten möglichen Arzneistoffe sind momentan Epalrestat und Ranirestat. Epalrestat hat in Japan die Zulassung erhalten.[2][3][4][5]
Neben der Funktion im Zuckermetabolismus und bei der Entgiftung von Aldehyden spielt AR noch eine Rolle bei der Signaltransduktion während entzündlicher Prozesse.[6]
Reaktionen

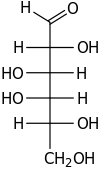 + NADPH + H+
+ NADPH + H+
-hexane-1%252C2%252C3%252C4%252C5%252C6-hexaol_200.svg.png.webp) + NADP+
+ NADP+
D-Galactose wird durch die Aldosereduktase mit NADPH als Cofaktor zu Galaktit umgesetzt.[7]
Weblinks
Einzelnachweise
- UniProt P15121.
- Aldosereduktase. In: Online Mendelian Inheritance in Man. (englisch).
- MA Ramirez, NL Borja: Epalrestat: an aldose reductase inhibitor for the treatment of diabetic neuropathy. In: Pharmacotherapy. 28, Nr. 5, Mai 2008, S. 646–655. doi:10.1592/phco.28.5.646. PMID 18447661.
- N Giannoukakis: Ranirestat as a therapeutic aldose reductase inhibitor for diabetic complications. In: Expert Opin Investig Drugs. 17, Nr. 4, April 2008, S. 575–581. doi:10.1517/13543784.17.4.575. PMID 18363521.
- O El-Kabbani, A Podjarny: Selectivity determinants of the aldose and aldehyde reductase inhibitor-binding sites. In: Cell. Mol. Life Sci.. 64, Nr. 15, August 2007, S. 1970–1978. doi:10.1007/s00018-007-6514-3. PMID 17497245.
- A. Corso, M. Cappiello, U. Mura: From a Dull Enzyme to Something Else: Facts and Perspectives Regarding Aldose Reductase. In: Current Medicinal Chemistry. Band 15, Nr. 15, 2008, S. 1452–1461, doi:10.2174/092986708784638870, PMID 18537622.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.: Stryer Biochemie. Springer-Verlag, 2014, ISBN 978-3-8274-2988-9, S. 476 (eingeschränkte Vorschau in der Google-Buchsuche).