Hexokinase
Die Hexokinasen sind Enzyme aus dem Kohlenhydratstoffwechsel, die Hexosen (Zucker mit sechs Kohlenstoffatomen) phosphorylieren und damit jeweils in ein Hexose-Phosphat überführen, etwa Glucose in Glucose-6-phosphat. Hexokinasen gehören zu den Phosphotransferasen (EC 2.7[1]).
| Hexokinase | ||
|---|---|---|
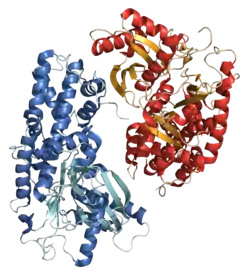
| ||
| Hexokinase aus der Hefe Kluyveromyces lactis | ||
| Andere Namen |
HK | |
| Masse/Länge Primärstruktur | 50 kDa in Prokaryoten, 100 kDa in Eukaryoten | |
| Isoformen | 4 in Säugern | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.1.1, Kinase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | Hexose + ATP | |
| Produkte | Hexose-6-Phosphat + ADP | |
Eigenschaften
Als Kinasen führen die Hexokinasen zu einer Phosphorylierung von Hexosen, meistens entsteht aus Glucose Glucose-6-phosphat unter Verwendung von Adenosintriphosphat. Das Glucose-6-Phosphat wird anschließend im Zuge der Glykolyse oder des Pentosephosphatwegs verstoffwechselt.
Typen von Hexokinasen
Hexokinasen kommen in allen Reichen der Lebewesen vor und gehören zu den ATPasen mit actin fold. Hexokinasen kommen oftmals in mehreren Isoformen vor. In Säugetieren kommen vier Isoformen der Hexokinase vor (I, II, III und IV, oder A, B, C und D). Die Glucokinase in Säugetieren ist eine Isoform der Hexokinase in der Leber (Hexokinase IV), die jedoch nur Glucose phosphoryliert. Während bakterielle Hexokinasen eine Molmasse um 50 kDa besitzen, sind eukaryotische Hexokinasen um 100 kDa und aus zwei einander ähnlichen Teilen aufgebaut, die vermutlich evolutionär durch Genduplikation aus einer Vorläufer-Hexokinase entstanden sind. Nur in der Hexokinase II sind beide Teile enzymatisch aktiv.
In einigen Tumoren werden Hexokinasen überexprimiert.[2]
| Typ | Beschreibung | Gen | Phänotypen |
|---|---|---|---|
| I (A) | kommt in allen Geweben von Säugetieren vor und gilt als „Haushaltsenzym“, das von den meisten physiologischen, hormonellen und metabolischen Veränderungen nicht betroffen ist | HK1 | Morbus Charcot-Marie-Tooth Typ 4G,[3] |
| II (B) | stellt bei vielen Zelltypen die hauptsächliche regulierte Isoform dar und ist bei vielen Krebsarten erhöht. Es ist die Hexokinase, die in Muskel und Herz vorkommt. Hexokinase II befindet sich auch an der äußeren Mitochondrienmembran, sodass ein direkter Zugang zu ATP möglich ist.[6] | HK2 | hochexprimiert in mehreren Krebsarten, einschließlich Brustkrebs und Dickdarmkrebs[7][8][9] |
| III (C) | ist in physiologischen Konzentrationen durch Glucose substrathemmend | HK3 | überexprimiert im malignen follikulären Schilddrüsenknoten |
| IV (D) | kommt in Leber, Bauchspeicheldrüse, Hypothalamus, Dünndarm und möglicherweise in bestimmten anderen neuroendokrinen Zellen vor und spielt eine wichtige regulatorische Rolle im Kohlenhydratstoffwechsel. In den Beta-Zellen der Pankreasinseln dient es als Glucosesensor zur Steuerung der Insulinfreisetzung und in ähnlicher Weise zur Steuerung der Glukagonfreisetzung in den Alpha-Zellen. In Hepatozyten der Leber reagiert die Glucokinase auf Änderungen des Umgebungsglucosespiegels durch Erhöhen oder Verringern der Glykogensynthese. | GCK | Maturity Onset Diabetes of the Young Typ 2, |
Mechanismus
Bindung der Glucose
Aus röntgenkristallographischen Untersuchungen der Hexokinase aus Hefe hat man gezeigt, dass die Bindung von Glucose am aktiven Zentrum eine starke Konformationsänderung des Enzyms induziert. Die Hexokinase besteht aus zwei Lappen und bei Bindung der Glucose bewegen sich die Lappen aufeinander zu. Dabei dreht sich ein Lappen um zwölf Grad relativ zum anderen, was zu Bewegungen des Polypeptidrückgrats von 0,8 nm führt. Die durch Induced Fit hervorgerufene Schließung des Spaltes in der Hexokinase sorgt für die Umhüllung der Glucose, außer der Hydroxygruppe am C6-Atom, auf der anschließend eine Phosphorylgruppe vom ATP übertragen wird. Die durch die Glucose induzierten Strukturveränderungen haben zwei Vorteile:
- Die Umgebung der Glucose wird unpolarer, was die Reaktion mit der hydrophilen Hydroxygruppe der Glucose und der terminalen Phosphatgruppe des ATP begünstigt.
- Die Hexokinase drängt Wasser aus dem aktiven Zentrum heraus und sorgt dafür, dass Wasser nicht die γ-Phosphatgruppe des ATP angreift. Falls es doch zur Hydrolyse von ATP kommen sollte, entstünden ADP und Pi.
Die Hexokinase ist nur dann aktiv, wenn Mg2+-Ionen (oder andere zweiwertige Metallionen wie Mn2+) vorhanden sind.[10]
Reaktion am aktiven Zentrum
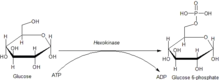
Die Hexokinase führt einen willkürlichen „bi-bi“-Reaktionsmechanismus aus, bei dem das Enzym vor der Reaktion einen ternären Komplex (Proteinkomplex aus drei verschiedenen Molekülen, die miteinander in Verbindung stehen) mit Glucose und Mg2+–ATP bildet. Dabei führt die Hydroxygruppe am C6-Atom der Glucose einen nukleophilen Angriff auf die γ-Phosphatgruppe von ATP aus und bildet als Abgangsgruppe das ADP. Dieser Mechanismus ist auch als SN2-Mechanismus bekannt. Als Produkt entsteht Glucose-6-phosphat. Die Komplexierung des Mg2+-Ions mit ATP dient vermutlich dafür, dass durch die Abschmirmung der negativen Ladungen der Sauerstoffatome der nukleophile Angriff am Phosphoratom erleichtert wird. Die genaue(n) Position(en) des Mg2+-Ions im Komplex mit ATP während der Reaktion konnte(n) noch nicht endgültig ermittelt werden.[11]
Regulation
Glucose-6-phosphat ist ein potenter Inhibitor der Hexokinasen 1–3 mit einer Inhibitionskonstante (Ki) von 10–30 mM. Es existieren zwei Modelle, welche die inhibitorische Wirkung von Glucose-6-phosphat darstellen:[12]
- Glucose-6-phosphat bindet sich als allosterischer Inhibitor fest an die N-terminale Domäne, um so die geschlossene Konformation der N-terminalen Domäne zu stabilisieren. Die geschlossene N-terminale Domäne stabilisiert vermutlich die flexible Unterdomäne der C-terminalen Hälfte des Enzyms (wo sich auch das aktive Zentrum befindet), und zwar so, dass die Bindung zu ATP unterbunden wird.
- Glucose-6-phosphat wirkt als kompetitiver Inhibitor, der mit ATP um die C-terminale Domäne als Bindungsstelle konkurriert.
Bei Hexokinase 1 kann die Hemmung durch Glucose-6-phosphat durch physiologische Konzentrationen an Pi wieder aufgehoben werden.[13] Fang et al. (1998) beschrieben zwei mögliche Mechanismen zur Aufhebung der Hemmung durch Pi:
- Pi konkurriert mit Glucose-6-phosphat um die allosterische Bindungsstelle in der N-terminalen Hälfte des Enzyms.
- Pi bindet sich an die N-terminale Hälfte des Enzyms und verdrängt somit Glucose-6-phosphat aus dem aktiven Zentrum in der C-terminalen Hälfte über einen indirekten Mechanismus.
In beiden Fällen wird durch Bindung an der N-terminalen Domäne durch Pi die Katalyse in der C-terminalen Region durch einen allosterischen Mechanismus reguliert. Fang et al. zeigten ebenfalls, dass die regulatorische Bindungsstelle für Pi sich in der N-terminalen Domäne befindet, die auch die niederaffine Bindungsstelle für Glucose-6-phosphat enthält.[14]
Glucokinase wird nicht durch Glucose-6-phosphat gehemmt.[15] Dies ermöglicht eine fortgesetzte Signalausgabe (z. B. um die Insulinfreisetzung auszulösen) unter signifikanten Mengen an G6P.[16]
Stoffwechsel
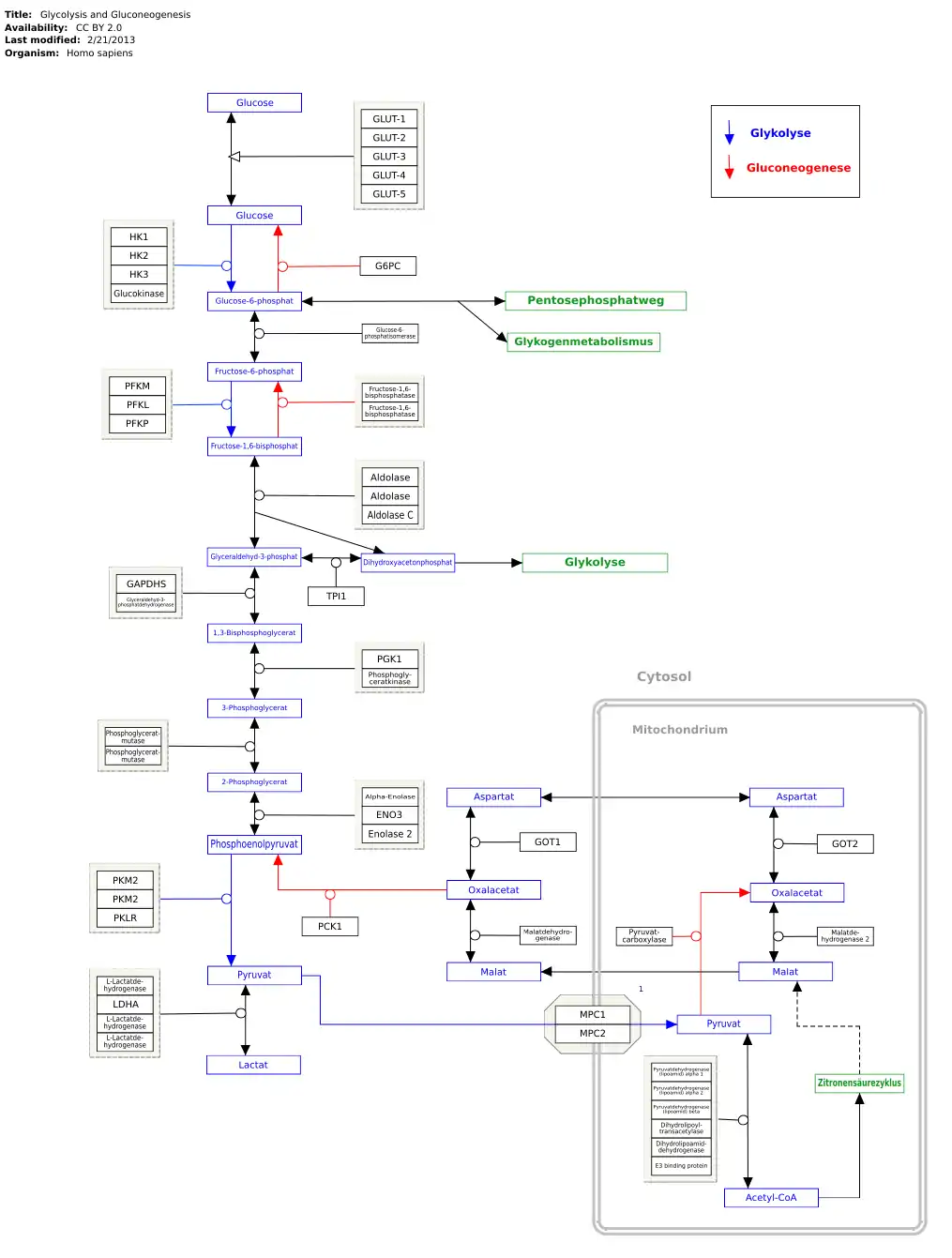
Gene, Proteine und Metaboliten sind zu den jeweiligen Artikeln verlinkt. Der Stoffwechselweg kann bei WikiPathways bearbeitet werden:
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0-8153-4106-2.
Einzelnachweise
- The following ENZYME entries belong to class 2.7.-.- (englisch) SIB Swiss Institute of Bioinformatics. Abgerufen am 29. Oktober 2019.
- T. A. Smith: Mammalian hexokinases and their abnormal expression in cancer. In: British journal of biomedical science. Band 57, Nummer 2, 2000, ISSN 0967-4845, S. 170–178, PMID 10912295.
- CMT4G. In: Online Mendelian Inheritance in Man. (englisch)
- L. S. Sullivan, D. C. Koboldt, S. J. Bowne, S. Lang, S. H. Blanton, E. Cadena, C. E. Avery, R. A. Lewis, K. Webb-Jones, D. H. Wheaton, D. G. Birch, R. Coussa, H. Ren, I. Lopez, C. Chakarova, R. K. Koenekoop, C. A. Garcia, R. S. Fulton, R. K. Wilson, G. M. Weinstock, S. P. Daiger: A dominant mutation in hexokinase 1 (HK1) causes retinitis pigmentosa. In: Investigative ophthalmology & visual science. Band 55, Nummer 11, September 2014, S. 7147–7158, doi:10.1167/iovs.14-15419, PMID 25190649, PMC 4224580 (freier Volltext).
- F. Wang, Y. Wang, B. Zhang, L. Zhao, V. Lyubasyuk, K. Wang, M. Xu, Y. Li, F. Wu, C. Wen, P. S. Bernstein, D. Lin, S. Zhu, H. Wang, K. Zhang, R. Chen: A missense mutation in HK1 leads to autosomal dominant retinitis pigmentosa. In: Investigative ophthalmology & visual science. Band 55, Nummer 11, Oktober 2014, S. 7159–7164, doi:10.1167/iovs.14-15520, PMID 25316723, PMC 4224578 (freier Volltext).
- UniProt P35354#subcellular_location
- A. Schindler, E. Foley: Hexokinase 1 blocks apoptotic signals at the mitochondria. In: Cellular signalling. Band 25, Nummer 12, Dezember 2013, S. 2685–2692, doi:10.1016/j.cellsig.2013.08.035, PMID 24018046.
- D. Palmieri, D. Fitzgerald, S. M. Shreeve, E. Hua, J. L. Bronder, R. J. Weil, S. Davis, A. M. Stark, M. J. Merino, R. Kurek, H. M. Mehdorn, G. Davis, S. M. Steinberg, P. S. Meltzer, K. Aldape, P. S. Steeg: Analyses of resected human brain metastases of breast cancer reveal the association between up-regulation of hexokinase 2 and poor prognosis. In: Molecular cancer research : MCR. Band 7, Nummer 9, September 2009, S. 1438–1445, doi:10.1158/1541-7786.MCR-09-0234, PMID 19723875, PMC 2746883 (freier Volltext).
- Q. Peng, J. Zhou, Q. Zhou, F. Pan, D. Zhong, H. Liang: Silencing hexokinase II gene sensitizes human colon cancer cells to 5-fluorouracil. In: Hepato-gastroenterology. Band 56, Nummer 90, 2009 Mar-Apr, S. 355–360, PMID 19579598.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto jr.: Stryer Biochemie. Springer-Verlag, 2014, ISBN 978-3-8274-2988-9, S. 460 (eingeschränkte Vorschau in der Google-Buchsuche).
- Donald Voet, Judith G. Voet: Biochemistry. 4. Auflage. John Wiley & Sons, 2010, ISBN 978-0-470-91745-9, S. 597 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. E. Aleshin, C. Zeng, G. P. Bourenkov, H. D. Bartunik, H. J. Fromm, R. B. Honzatko: The mechanism of regulation of hexokinase: new insights from the crystal structure of recombinant human brain hexokinase complexed with glucose and glucose-6-phosphate. In: Structure. Band 6, Nummer 1, Januar 1998, S. 39–50, doi:10.1016/s0969-2126(98)00006-9, PMID 9493266.
- D. L. Purich, H. J. Fromm, F. B. Rudolph: The hexokinases: kinetic, physical, and regulatory properties. In: Advances in enzymology and related areas of molecular biology. Band 39, 1973, S. 249–326, doi:10.1002/9780470122846.ch4, PMID 4583639 (Review).
- Tsuei-Yun Fang, Olga Alechina, Alexander E. Aleshin, Herbert J. Fromm, Richard B. Honzatko: Identification of a Phosphate Regulatory Site and a Low Affinity Binding Site for Glucose 6-Phosphate in the N-terminal Half of Human Brain Hexokinase. In: Journal of Biological Chemistry. 273, 1998, S. 19548, doi:10.1074/jbc.273.31.19548.
- G. I. Bell, A. Cuesta-Munoz, F. M. Matschinsky: Glucokinase. In: Encyclopedia of Molecular Medicine. John Wiley & Sons, Hoboken 2002, ISBN 978-0-471-37494-7.
- F. M. Matschinsky: Banting Lecture 1995. A lesson in metabolic regulation inspired by the glucokinase glucose sensor paradigm. In: Diabetes. Band 45, Nummer 2, Februar 1996, S. 223–241, doi:10.2337/diab.45.2.223, PMID 8549869 (Review).