Cofaktor (Biochemie)
Ein Cofaktor (auch Kofaktor) ist in der Biochemie eine Nicht-Protein-Komponente, die neben dem Protein-Anteil eines bestimmten Enzyms für dessen katalytische Aktivität unerlässlich ist.[1]
Der Überbegriff Cofaktor umfasst neben anorganischen Komponenten wie Metall-Ionen verschiedene organische Moleküle, die nicht aus Aminosäuren aufgebaut sind und bei Enzymaktivität verändert werden. Letztere Gruppe wird unter dem Übergriff Coenzym (Koenzym) zusammengefasst. Bei nicht kovalenter Bindung wird häufig von Cosubstrat (Kosubstrat) gesprochen, während bei fester, dauerhafterer Bindung der Begriff prosthetische Gruppe Anwendung findet. Eine genaue Abgrenzung der Begriffe ist jedoch nicht immer gegeben, sodass bei verschiedenen Autoren unterschiedliche Definitionen und Klassifizierungen anzutreffen sind. Cofaktoren lassen sich somit wie folgt grob einteilen:
| Coenzym | Prosthetische Gruppe | Ein organisches Molekül, das mit hoher Affinität oder kovalent an ein Enzym gebunden ist; die prosthetische Gruppe kann also nicht dissoziieren. |
|---|---|---|
| Cosubstrat | Ein niedermolekulares organisches Molekül, das nicht-kovalent an ein Enzym bindet und nach der Katalyse wieder dissoziiert. Es nimmt während der Reaktion chemische Gruppen, Protonen oder Elektronen auf oder gibt diese ab, wodurch sich seine Reaktivität verändert.[2] Ein Coenzym geht als Cosubstrat – wie auch eine prosthetische Gruppe – verändert aus der Reaktion hervor[3] und muss daher wieder in den Vorzustand überführt werden, jedoch geschieht das meist nicht am Enzym. | |
| Metall-Ion | Ein Metall-Ion, das an ein Enzym gebunden und für die Katalyse erforderlich ist, ist ebenfalls ein Cofaktor. Das entsprechende Enzym wird Metalloenzym genannt. | |
Ein Enzymkomplex mit gebundenem Cofaktor wird Holoenzym genannt, ohne Cofaktor Apoenzym. Nicht zu den Cofaktoren – und auch nicht zu den Substraten – zählen Verbindungen, die ubiquitär vorkommen, wie das Wasser, wenngleich sie häufig an Reaktionen beteiligt sind.
Prosthetische Gruppen
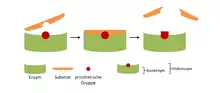
Als prosthetische Gruppe (Kunstwort nach altgriechisch προστίθημι ‚voranstellen‘) wird eine an ein Protein fest (meist kovalent) gebundene Nicht-Protein-Komponente mit katalytischer Wirkung bezeichnet. Da sie oft verändert aus der Katalyse hervorgeht, muss sie am Enzym regeneriert werden.
Beispiele
- Biotin in Carboxylasen
- Häme im Hämoglobin, im Cytochrom c, in der Cytochrom c Oxidase
- Flavine in Flavoproteinen
- Moco (Molybdän-Cofaktor) in Molybdoenzymen (z. B. Xanthinoxidase)
- FeMo (Molybdän-Eisen-Cofaktor, MoFe-Protein) in der Nitrogenase
- Vitamin B6 (Pyridoxalphosphat) als prosthetische Gruppe von Aminotransferasen sowie der humanen Histidindecarboxylase
Coenzyme, Cosubstrate
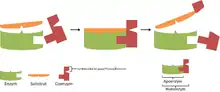
Ein Cosubstrat oder Coenzym ist ein niedermolekulares organisches Molekül, das sich nicht-kovalent an das Enzym bindet und nach der Katalyse wieder dissoziiert. Während der Reaktion nimmt es funktionelle Gruppen, Protonen, Elektronen oder Energie auf beziehungsweise gibt solche ab (siehe auch Donator-Akzeptor-Prinzip). Es geht also – wie die prosthetische Gruppe – verändert aus der Reaktion hervor und muss daher erneuert werden. Dies unterscheidet das Coenzym zum Beispiel auch von allosterischen Effektoren. Typischerweise geschieht seine Regeneration in einer nachgeschalteten Reaktion. Da sich das Coenzym eher wie ein Substrat denn wie ein Enzym verhält, wird es oft treffender als Cosubstrat bezeichnet.
Ein häufiges Cosubstrat enzymatisch katalysierter Reaktionen ist Adenosintriphosphat (ATP), von dem energiereiche Phosphatgruppen (mit Bildung von ADP bzw. AMP) auf andere Moleküle übertragen und diese aktiviert werden können. Einige andere Coenzyme sind Derivate von Vitaminen.
| Stoffname | Coenzymbezeichnung | Derivat von | Funktionstyp |
|---|---|---|---|
| Adenosintriphosphat (ATP) | – | – | liefert durch Abspaltung eines Phosphats Energie, überträgt Phosphat an das Substrat (Phosphatdonator) |
| Adenosindiphosphat (ADP) | – | – | nimmt Phosphat vom Substrat entgegen (Phosphatakzeptor) |
| Nicotinamidadenindinukleotid (NAD) | Coenzym I | – | NAD+: Elektronen- und Protonenakzeptor, Oxidationsmittel |
| NADH: Elektronen- und Protonendonator, Reduktionsmittel | |||
| Nicotinamidadenindinukleotidphosphat (NADP) | Coenzym II | – | NADP+: Elektronen- und Protonenakzeptor, Oxidationsmittel |
| NADPH: Elektronen- und Protonendonator, Reduktionsmittel | |||
| Flavin-Adenin-Dinukleotid (FAD) | – | Vitamin B2 | FAD: Elektronen- und Protonenakzeptor, Oxidationsmittel |
| FADH2: Elektronen- und Protonendonator, Reduktionsmittel | |||
| Pyridoxalphosphat | – | Vitamin B6 | |
| Tetrahydrofolsäure | Coenzym F | Vitamin B9 | Methylgruppendonator |
| Cobalamine | Coenzym B12 | Vitamin B12 | |
| Ascorbinsäure | – | Vitamin C | Reduktionsmittel |
| Coenzym A | Coenzym A | – | |
| Ubichinon-10 | Coenzym Q10 | – | |
| α-Liponsäure | – | – |
Komplette Liste der von der Enzymkommission der International Union of Biochemistry and Molecular Biology (IUBMB) anerkannten Koenzyme/Kofaktoren siehe in der Kategorie:Coenzym.
Pyridoxalphosphat
Pyridoxalphosphat, das aktivierte Pyridoxin (Vitamin B6), ist beispielsweise ein Coenzym im aktiven Zentrum von Transaminasen. Hier katalysiert es im ersten Schritt die Desaminierung von Aminosäuren zu alpha-Ketosäuren (mit Bildung des Pyridoxaminphosphats), im zweiten die Übertragung der Aminogruppe auf eine andere alpha-Ketosäure (sogenannter ping-pong-bi-bi-Mechanismus nach Wallace W. Cleland). In diesem Fall wird Pyridoxalphosphat am Enzym regeneriert. Es ist auch Coenzym von Decarboxylasen, mit denen Aminosäuren abgebaut werden.
Coenzym A
Ein weiteres Beispiel ist Coenzym A, das in freier sowie acetylierter Form an verschiedenen Schritten des Citratzyklus sowie am Fettsäurestoffwechsel beteiligt ist.
FAD, NAD, NADP
Bei verschiedenen Abbauschritten im Citratzyklus, aber auch in der Glykolyse dienen die Coenzyme Flavin-Adenin-Dinukleotid (FAD) und Nicotinamid-Adenin-Dinukleotid (NAD) als Elektronen- und Protonenakzeptoren oder -donatoren. Sie vermitteln so den Elektronen-Transfer von einem Edukt zum anderen. Eine vergleichbare Rolle übernimmt Nicotinamid-Adenin-Dinukleotid-Phosphat (NADP) in umgekehrter Richtung bei Aufbauprozessen, etwa der Biosynthese von Fettsäuren. FAD kann in manchen Enzymen kovalent verknüpft sein, wobei davon ausgegangen wird, dass dies bei etwa 10 % aller Flavoproteine der Fall ist[4]. Ein Beispiel hierfür wäre die Succinat-Dehydrogenase[5].
Ubichinon
Ein anderes Beispiel ist der Elektronencarrier Ubichinon, das Coenzym Q im Prozess aerober Energiebereitstellung, oxidative Phosphorylierung genannt. Es vermittelt durch Aufnahme und Abgabe von Elektronen bzw. Protonen deren Übertragung zwischen den membrangebundenen Proteinkomplexen I, II und III der Atmungskette in den Mitochondrien.
Metallionen
Ionen von Metallen wie Eisen (Fe), Magnesium (Mg), Mangan (Mn), Cobalt (Co), Kupfer (Cu), Zink (Zn) oder Molybdän (Mo) sind häufig Cofaktoren verschiedener Enzyme. In dieser Rolle werden sie zu essentiellen Spurenelementen der Nahrung, mit denen sich ein Organismus versorgt. Ein Enzym, dessen aktive Form Metallionen enthält, wird Metalloenzym genannt. Ein Metallatom kann zur Stabilisierung der Proteinstruktur beitragen, im aktiven Zentrum dient es der Katalyse einer bestimmten Reaktion. Ist es für die Enzymfunktion entscheidend, so kann das Fehlen des Metalls zu einem limitierenden Faktor werden.
Die Anwesenheit eines Zink-Kations deutet häufig auf dessen Funktion als Lewis-Säure hin, z. B. in Peptidasen oder Zinkfingerproteinen. Aus der Anwesenheit eines bestimmten Metallions lässt sich jedoch nur ungefähr auf die Funktion des Enzyms schließen. Zum einen können verschiedene Enzyme den gleichen Cofaktor benötigen. Zum anderen können Metalloenzyme mit ähnlicher Funktion in anderen Spezies ein anderes Metallion verwenden. Der Grund hierfür ist meist die unterschiedliche Verfügbarkeit der jeweiligen Metalle im Lebensraum der Organismen. Das Bakterium Borrelia burgdorferi beispielsweise kann ohne Eisen auskommen, da es stattdessen Mangan als Cofaktor verwendet.[6] Ein anderes Beispiel ist der Einsatz von Kupfer statt Eisen bei der Sauerstoffaktivierung.
Von Metalloproteinen spricht man, wenn beispielsweise Erdalkalimetalle wie Calcium und Magnesium wohl auf die Struktur und die Faltung von Proteinen Einfluss nehmen, nicht aber zu einer katalytischen Wirkung beitragen.
Beispiele
- Urease enthält Nickel.
- Glutamatcysteinligase kann Mangan, Magnesium oder Kupfer enthalten.
- Acireducton-Synthase in Klebsiella pneumoniae: mit Eisen oder Magnesium ist das Reaktionsprodukt 4-Methylthio-2-ketobutyrat; mit Nickel ist es 3-(Methylthio)propionat.[7]
- Phenylalaninhydroxylase enthält Eisen.
- Leucylaminopeptidase kann Zink, Kobalt, Magnesium oder Mangan enthalten.
- Lipoxygenase enthält ebenfalls Eisen.
- Superoxiddismutase enthält Mangan.
- Xanthinoxidase enthält Molybdän und Eisen.
- Cytochrom-c-Oxidase enthält Kupfer und Eisen.
- Carboanhydrase enthält Zink.
Enzymhemmung
Stoffe, die dem Cofaktor in dessen Bindungseigenschaften ähneln und ebenfalls mit dem Enzym komplexieren können, sind kompetitive Inhibitoren; sie hemmen das Enzym, indem sie um die Bindungsstelle für den Cofaktor konkurrieren.
Siehe auch
Literatur
- Eintrag im GLOSSARY OF TERMS USED IN BIOINORGANIC CHEMISTRY. IUPAC Empfehlungen von 1997.
- W. Kaim, B. Schwederski: Bioanorganische Chemie. (= Teubner Studienbücher Chemie). Stuttgart 2004, ISBN 3-519-23505-6.
Einzelnachweise
- Eintrag zu Cofactors. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01128 – Version: 2.3.1.
- Eintrag zu Coenzyme. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01126 – Version: 2.3.1.
- Georg Löffler, Petro E. Petrides, Peter C. Heinrich: Biochemie und Pathobiochemie. 8. Auflage.
- Dominic P. H. M. Heuts, Nigel S. Scrutton, William S. McIntire, Marco W. Fraaije: What’s in a covalent bond?: On the role and formation of covalently bound flavin cofactors. In: FEBS Journal. Band 276, Nr. 13, 11. Juni 2009, S. 3405–3427, doi:10.1111/j.1742-4658.2009.07053.x (wiley.com [abgerufen am 23. September 2019]).
- Martin Mewies, William S. McIntire, Nigel S. Scrutton: Covalent attachment of flavin adenine dinucleotide (FAD) and flavin mononucleotide (FMN) to enzymes: The current state of affairs. In: Protein Science. Band 7, Nr. 1, Januar 1998, S. 7–21, doi:10.1002/pro.5560070102, PMID 9514256, PMC 2143808 (freier Volltext).
- J. E. Posey, F. C. Gherardini: Lack of a role for iron in the Lyme disease pathogen. In: Science. Band 288, Nr. 5471, Juni 2000, S. 1651–1653, PMID 10834845.
- T. Ju, R. B. Goldsmith u. a.: One protein, two enzymes revisited: a structural entropy switch interconverts the two isoforms of acireductone dioxygenase. In: Journal of molecular biology. Band 363, Nummer 4, November 2006, S. 823–834, doi:10.1016/j.jmb.2006.08.060. PMID 16989860, PMC 1808343 (freier Volltext).